Наконец, было показано, что энтодерма также вовлекается в индукцию внутреннего уха у птиц (Ladher et al., 2005). Удаление энтодермы приводит к потере эпителиального утолщения со стороны удаления, а также к потере экспрессии
. В этом случае очевидно, что роль энтодермы косвенная, за счет действия энтодермы на мезодерму, которая затем индуцирует непосредственно развитие уха. Итак, эти данные указывают на то, что и мезодерма и задний мозг участвуют в развитии отических плакод, хотя их специфические роли, по-видимому, варьируют от вида к виду.
Члены семейства fibroblast growth factors, как было установлено, играют критическую роль в индукции внутреннего уха у некоторых видов. Их экспрессия в развивающемся заднем мозге по соседству с презумптивной отической тканью или в подлежащей мезодерме подтверждает роль членов семейства FGF как возможного индуктора уха. Передача сигналов FGF, как было показано, необходима для индукции отической плакоды у рыб, кур и мышей. У рыбок данио воздействие ингибитора FGF рецептора SU5402 приводит к полной потере отических пузырьков, а также к потере экспрессии некоторых ушных маркеров,
pax2a и dlx3b (Leger and Brand, 2002, Maroon et al., 2002). У эмбрионов кур будущая ушная эктодерма неспособна экспрессировать
Pax2 и EphA4, если культивируется в присутствии SU5402 (Martin and Groves, 2006). У рыб
fgf3 и fgf8 участвуют в качестве главных кандидатов на роль FGF-зависимой передачи индуктивных сигналов уха. Оба экспрессируются вблизи пре-отического домена во время индукции плакоды (Reifers et al., 1998, Furthauer et al., 2001, Phillips et al., 2001, Maroon et al., 2002). Потеря
fgf3 или fgf8 у morpholino-обработанных или мутантных рыб ассоциирует с уменьшением домена экспрессии
pax2a и dlx3b, а также с маленькими пузырьками. Когда затронуты оба
fgf3 и fgf8, то отические пузырьки не образуются (Phillips et al., 2001, Leger and Brand, 2002, Maroon et al., 2002, Liu et al., 2003). У мышей FGF3 и FGF10 рассматриваются как потенциальные индукторы, при этом
FGF3 экспрессируется в ромбомерах 5 и 6 заднего мозга. а FGF10 в мезодерме, подлежащей под презумптивной плакодой (Mahmood et al., 1995, McKay et al., 1996, Wright and Mansour, 2003).
FGF10 мутантные мыши дают очень маленькие отические пузырьки (Ohuchi et al., 2000), тогда как
FGF3 формируют отические плакоды, хотя позднее дифференциация уха очень аномальна (Mansour et al., 1993). Мутанты по
FGF3 и FGF10 неспособны формировать отические пузырьки или формируют микропузырьки, а
Pax2 отсутствует в ушной ткани, тогода как экспрессия
Pax8 и Gbx2 снижена (Alvarez et al.,
2003, Wright and Mansour, 2003). FGF8 также участвует в индукции плакод у эмбрионов кур и мышей, хотя его роль, по-видимому, непрямая. Он экспрессируется в краниальной энтодерме и необходим для мезодермальной экспрессии FGF19 у эмбрионов кур и FGF10 у мышей (Ladher et al., 2005). Исследования описанные выше, выявляют центральную роль передачи сигналов FGF в индукции отических плакод у всех исследованных видов, хотя характеристики и источники индуцирующих FGFs варьируют от вида к виду. Важно отметить, что некоторые аспекты индукции отических плакод являются FGF-независимыми. Напр., у рыбок данио индукция
foxi1, dlx4 и sox9b не затрагивается у мутантов, лишенных и fgf3 и fgf8 (Solomon et al., 2004). В самом деле, foxi1, как было предположено, действует как фактор компетентности у рыб, позволяя эктодерме отвечать на передачу сигналов FGF, но не сам отвечает на FGFs (Hans et al., 2004, Hans et al., 2007), хотя Phillips and colleagues показали, что эктопическая экспрессия
fgf8 индуцирует эктопические домены экспрессии
foxi1 (Phillips et al., 2004). Кроме того, dlx3b рыбок данио , как сообщалось, FGF-независим в некоторых исследованиях, но не в др. (Leger and Brand, 2002, Maroon et al., 2002, Liu et al., 2003, Solomon et al., 2004). Факторы, ответственные за экспрессию
foxi1, dlx3b, dlx4b и sox9a неизвестны, хотя недавно было предположено, что передача сигналов BMP может служить кандидатом на роль индуктора
foxi1 и dlx3b (Hans et al., 2007). Доказательства FGF-независимых путей индукции отических плакод получены в работе с эмбрионами кур, где индукция двух отических маркеров, Dlx3 и BMP7, не затрагивалась воздействием ингибитора рецепторов FGF SU5402 (Martin and Groves, 2006). Эктопическая экспозиция разных членов семейства FGF также подтверждает их роль в индукции отических плакод. FGF кусочки, имплантированные в заднюю часть эктодермы эмбрионов
Xenopus или рядом с отической тканью у эмбрионов кур д. индуцировать эктопические отические пузырьки (Lombardo et al., 1998, Lombardo and Slack, 1998, Adamska et al., 2001). Сходные результаты наблюдались у эмбрионов кур, когда FGF3 эктопически экспрессировали в не-отической ткани (Vendrell et al., 2000). Хотя результаты, полученные на лягушках и курах подтверждают индуктивные свойства FGF, они ничего не говорят, действует ли FGF3 прямо или опосредованно. Возможно, что передача сигналов FGF д. индуцировать др. молекулы в соседней ткани, которые сами по себе д.быть ответственны за формирование эктопического отического эпителия. Напр., FGF19 индуцирует Pax2 в компетентной эктодерме только, если эктодерма ко-культивируется с нервной тканью или когда FGF19 применяется в сочетании с Wnt8c (Ladher et al., 2000). Авт. описывают модель индукции плакод, в которой FGF19 д.
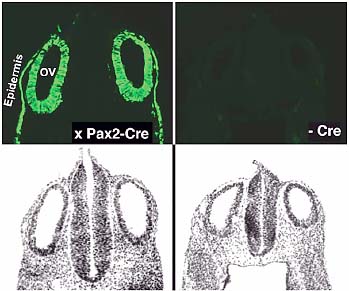 Fig. 4. Pax2+ cells give rise to both otic placode and epidermis. Pax2-
Cre mice are crossed with reporter mice that express GFP in a Cre-
inducible fashion. All Pax2-expressing cells and their descendants will
express GFP in embryos derived from such crosses (left). GFP-positive
cells are observed not only in the otic vesicle (OV), but also in the
epidermis at E9.5, while no cells are GFP-positive in reporter mice alone
(right).
Fig. 4. Pax2+ cells give rise to both otic placode and epidermis. Pax2-
Cre mice are crossed with reporter mice that express GFP in a Cre-
inducible fashion. All Pax2-expressing cells and their descendants will
express GFP in embryos derived from such crosses (left). GFP-positive
cells are observed not only in the otic vesicle (OV), but also in the
epidermis at E9.5, while no cells are GFP-positive in reporter mice alone
(right).
сначала индуцировать экспрессию
Wnt8c в нейральной эктодерме, а затем индуцировать некоторые аспекты индукции отических плакод вместе с Wnt8c. Недавнее исследование на эмбрионах кур показало, что кусочки компетентной эктодермы отвечают относительно быстро на воздействие FGF2 (Martin and Groves, 2006). Ряд отических маркеров, Pax2, Pax8, EphA4, Dlx3, активируется самое раннее спустя 6 ч после воздействия и индукция происходит без индукции нейральных или мезодермальных маркеров, подтверждая, что FGF скорее всего действует непосредственно, индуцируя отическую эктодерму. Интересно, что отический маркер BMP7 никогда не индуцируется при любой концентрации FGF, что снова демонстрирует существование FGF-независимых путей отической индукции.
From pre-placode to placode: testing a two step model
of otic placode induction
В предыдущем разделе были представлены доказательства существования общего преплакодного домена и было высказано предположение, что локальные индуцирующие сигналы действуют в ограниченных областях преплакодного домена, чтобы индуцировать специфические краниальные плакоды. В случае отических плакод передача сигналов FGF от заднего мозга и краниальной параксиальной мезодермы, лежащей под презумптивной плакодой, является строгим кандидатом на роль отического индуктора. Индукция краниальных плакод происходит в две ступени - индукция преплакодной области является обязательным условием для последующей индукции специфических плакод. Имеются косвенные доказательства такой двухступенчатой модели отической индукции. Напр., краниальная эктодерма, взятая из преплакодной области, быстро экспрессирует отические маркеры, если культивируется с FGF2, тогда как эктодерма того же самого уровня, но лежащая латеральнее преплакодного региона остается нечувствительной к FGF2 (Martin and Groves, 2006). Более того, передняя часть молодого эпибласта, не экспрессирующая преплакодных генов легко формирует отоцист, если трансплантируется в презумптивную отическую область, но не может экспрессировать отические маркеры, если культивируется в присутствии FGF2 (Groves and Bronner-Fraser, 2000; Martin and Groves, 2006; Figures 2 and 3).
Недавние эксперименты проверяли гипотезу, что приобретение преплакодных характеристик необходимо для последующей индукции отических плакод с помощью передачи сигналов FGF. Исходная ткань эпибласта способна позитивно регулировать преплакодные гены (такие как члены семейств
Eya и Dlx) между 4 и 8 ч после трансплантации в преплакодную область эмбрионов кур. Важно. что если такие транплантаты удаляются до экспрессии ими преплакодных генов, то они не отвечают на FGF сигналы, тогда как те же самые трансплантаты отвечают с готовностью, если сталкиваются с FGF после того как они начали экспрессировать преплакодные гены (Martin and Groves, 2006; Fig. 3). Т.о.,
компетентность отвечать на передачу сигналов FGF коррелирует с экспрессией преплакодных генов в отической индукции. Существует множество отличающихся путей, в которых преплакодные характеристики д. обеспечивать компетентность отвечать на сигналы FGF в презумптивной отической эктодерме. Многие из этих генов, как известно, экспрессируются в преплакодном домене, являются транскрипционными факторами из семейств
Dlx, Six, Eya, Dach и Foxi (Streit, 2004, Groves, 2005) и возможно, что некоторые из этих генов действуют индивидуально или сочетанно как "competence factors", как это было предположено для foxi, dlx3b и dlx4b у рыбок данио (Hans et al., 2004, Hans et al., 2007). Неясно, действуют ли эти факторы компетентности иерархически ниже передачи сигналов FGF или же они сами по себе облегчают передачу сигналов FGF, что происходит, напр., путем позитивной регуляции сигнального пути FGF. У
Xenopus, избыточная экспрессия
Six1 вызывает экспансию преплакодного поля, тогда как потеря функции Six1 ведет к уменьшению этого домена (Brugmann et al., 2004). Остается определить, могут ли эти результаты быть обобщены для др. видов и являются ли эти или др. пока не идентифицированные факторы достаточны для обеспечения компетентности отвечать на передачу сигналов FGF.
Revising the two-step model: insights from fate map-
ping
Простая двухступенчатая модель индукции плакод, описанная выше, предусматривает, что клетки соседние к нервной трубке, получают сигналы, которые активируют преплакодные гены как необходимое условие для индукции специфических плакод с помощью локальных индуцирующих сигналов. Однако, из исследований по картированию судеб ясно, что предшественники разных краниальных плакод могут быть перемешаны до своей дифференцировки. Напр., Kozlowski и др. установили, что при 50% epiboly у рыбок данио имеются области, соседние с презумптивным отическим регионом, которые дают не только отический пузырек, но и др. сенсорные области, такие как хрусталик, обонятельный эпителий и тройничный ганглий (Kozlowski et al., 1997). Во втором наборе исследований, Streit
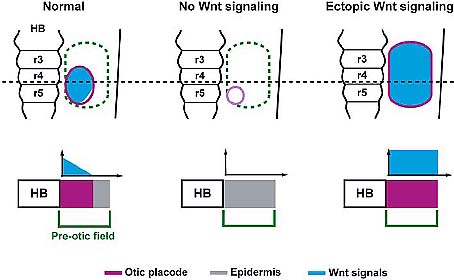 Fig. 5. Wnt signals mediate a placode-epidermis fate decision. In normal mice (left), the canonical Wnt signaling pathway is activated (light blue) in the Pax2 + pre-otic field by Wnts from the hindbrain (HB). Cells receiving high levels of Wnt signals differentiate as otic placode (magenta), while those receiving lower or no Wnt signals differentiate as epidermis (grey). In the absence of Wnt signaling in the pre-otic field (center), epidermis is expanded at the expense of the otic placode. When -catenin is stabilized in the pre-otic field (right), it activates Wnt-responsive genes in the entire pre-otic field, thus expanding the otic placode at the expense of epidermis. Modified from Ohyama et al., (2006).
Fig. 5. Wnt signals mediate a placode-epidermis fate decision. In normal mice (left), the canonical Wnt signaling pathway is activated (light blue) in the Pax2 + pre-otic field by Wnts from the hindbrain (HB). Cells receiving high levels of Wnt signals differentiate as otic placode (magenta), while those receiving lower or no Wnt signals differentiate as epidermis (grey). In the absence of Wnt signaling in the pre-otic field (center), epidermis is expanded at the expense of the otic placode. When -catenin is stabilized in the pre-otic field (right), it activates Wnt-responsive genes in the entire pre-otic field, thus expanding the otic placode at the expense of epidermis. Modified from Ohyama et al., (2006).
меченные клетки в области презумптивной отической эктодермы эмбрионов кур на ст. поздней гаструлы и ранней пост-гаструлы, было установлено, что отическая плакода возникает из более широкой области эпибласта и что её предшественники перемешаны с клетками, дающими эпидермис, epibranchial плакоды, клетки ЦНС и нервного гребня (Streit, 2002). Др. исследования подтвердили сходное перемешивание клеток предшественников для хрусталиковых и обонятельных плакод (Whitlock and Westerfield, 2000, Bhattacharyya et al.,
2004).
Хотя эти исследования по картированию судеб предоставили убедительные доказательства перемешанности предшественников разных плакод, они не предоставили информации о том, когда индивидуальные предшественники вычленяются для определенной судьбы. Недавно картирование судеб показало, что такой отбор может происходить даже после экспрессии ранних плакодных генов. Напр., хотя Pax2 обычно является одним из самых ранних маркеров отических плакод, исследования на эмбрионов кур и мышей показали, что Pax2-экспрессирующие клетки могут становиться эпидермальными, а также воспринимать судьбу отической плакоды. В Streit's клональном анализе у кур, клетки в области из домена экспрессии Pax2 на ст. ранней головной складки в основном дают как отические плакоды, так и не-плакодную эктодерму, а домен Pax2+ грубо подразделяется на плакодную и неплакодную территории (see Fig. 3D and E in Streit, 2002). Для дальнейшего тестирования судеб Pax2-экспрессирующих клеток, генетически метили Pax2+ эктодерму у мышей и отслеживали производных этих клеток, используя Cre-loxP рекомбинационную систему. Когда Pax2-Cre трансгенные мыши скрещивались с loxP репортерными мышами, то Pax2+ клетки постоянно метились продуктом репортерного гена за счет необратимой Cre-loxP рекомбинации. У потомков от таких скрещиваний reporter-позитивные клетки локализовались как в отических плакодах, так и в эпидермисе (Ohyama and Groves, 2004b), указывая тем самым, что Pax2-экспрессирующие клетки еще не детерминированы относительно отической судьбы, и могут давать также эпидермис.
Как можно согласовать эти результаты с ранее описанными наблюдениями роли передачи сигналов FGF в индукции отических плакод? Несколько линий доказательств указывают на то, что передача сигналов FGF необходима и достаточна для индукции ранних отических маркерных генов, таких как
Pax2 (Phillips et al., 2001, Leger and Brand, 2002, Maroon et al., 2002, Ladher et al., 2005, Martin and Groves, 2006). В свете наших исследовании по картированию судеб становится ясно, что передача сигналов FGF индуцирует область
Pax2-экспрессирующих клеток, которая дают отическую плакоду, но которая может дифференцироваться и как эпидермис. Мы описали этот домен, маркированный генами ранних отических маркеров, таких как
Pax2 и Pax8, как 'pre-otic field', отличающееся от отической плакоды. Т.о., наша двухступенчатая модель теперь нуждается в третьей ступени, на которой передача сигналов FGF необходима для индукции Pax2
+ пре-отического поля, и дополнительные сигналы необходимы для подразделения пре-отического поля на отическую плакоду и эпидермис.
Wnt signaling and the induction of the otic placode
Ladher с коллегами предоставили первые доказательства участия передачи сигналов Wnt в индукции отической плакоды. Они культивировали презумптивную отическую эктодерму кур с кусочками, смоченными FGF19 или Wnt8c. Они наблюдали более строгую индукцию генов отических маркеров, таких как Pax2 при воздействии FGF19 и Wnt8c, чем только FGF19. Они предположили, что Wnt8c индуцируется в заднем мозге с помощью происходящего из мезодермы FGF19 и что он синергично индуцирует отические гены с FGF19 (Ladher et al., 2000). некоторые наблюдения поставили под вопрос эту гипотезу - напр., Wnt8 экспрессируется в головном мозге некоторых видов после того, как
Pax2 и Pax8 индуцируются в презумптивной отической эктодерме (Hume and Dodd, 1993, Bouillet et al., 1996, Lekven et al., 2001). Более того, исследования с помощью Phillips и др. на рыбках данио показали, что после деплеции передачи сигналов Wnt8 с помощью morpholino нокдауна или Wnt антагониста dickkopf (Dkk1), отоцист всё ещё формируется, хотя его размер меньше (Phillips et al., 2004). Возможно, однако, что др. молекулы Wnt компенсируют потерю функции Wnt8, а экспрессия Dkk1 в этих экспериментах не полностью блокирует передачу сигналов Wnt. Несмотря на эти противоречивые наблюдения, тем не менее ясно, что презумптивная отическая эктодерма подвергается действию сигналов Wnt. TCF/Lef-lacZ трансгенные репортерные мыши, которые обнаруживают активность канонического сигнального пути Wnt (Mohamed et al., 2004), обнаруживают репортерную активность в субнаборе пре-отического поля, с клетками ближайшими к нервной трубке, обладающими высокими уровнями репортерной активности, а более латеральная эктодерма обладала меньшей или не обнаруживала репортерной активности (Ohyama et al., 2006). Чтобы протестировать, модулирует ли передача сигналов Wnt выбор судьбы плакода-эпидермис, β-catenin, нижестоящая молекула, необходимая для канонического сигнального Wnt пути, была функционально инактивирована или активирована в пре-отическом поле, используя Pax2-Cre мышей (Ohyama et al., 2006). у β-catenin условных нокаутных мышей отическая плакода существенно уменьшалась в размере. Напротив, условная стабилизация β-catenin вызывала экспансию плакода-подобного утолщения за счет неплакодной эктодермы (Fig. 5). Эти результаты строго указывают, что каноническая передача сигналов Wnt играет критическую роль в обеспечении выбора судьбы плакода-эпидермис внутри пре-отического поля, с клетками, получающими мало или не получающими сигналы Wnt, дифференцирующимися в эпидермис. Кстати имеются косвенные доказательства роли специфических членов семейства Wnt в этом выборе судьбы плакоды или эпидермиса. У мышей
Wnt6 экспрессируется на задней поверхности эктодермы на ст. E7.5 (T.O. and C. Jayasena, unpublished observations).
Wnt8a экспрессируется в ромбомере 4 на E8.0 (Bouillet et al., 1996) и чуть позднее
Wnt1 и Wnt3a начинают экспрессироваться в дорсальных частях нервных складок (Gavin et al., 1990). Экспрессия др. компонентов сигнального Wnt пути в преотическом поле не была изучена детально. Однако, один из Wnt
рецепторов, frizzled-8 и нижестоящий транскрипционный фактор Tcf3, по-видимому, экспрессируются в передней части эктодермы на ст. E7.5 (Lu et al., 2004, Merrill et al., 2004). Путь Wnt8-Tcf3 обеспечивает формирование оси тела (Popperl et al., 1997, Merrill et al., 2004) и вряд ли
Lef1 или Tcf1, Tcf3 действует как рецептор (Merrill et al., 2001). Т.о., сходные механизмы могут модулировать выбор судеб плакода-эпидермис в пре-отической области.
How do the Wnt and FGF signaling pathways interact to generate the otic placode?
Некоторые исследования подтвердили потенциальное взаимодействие между путями Wnt и FGF. Напр., куриный
Sox2, который экспрессируется в эпибласте (Avilion et al., 2003), имеет энхансер задней части нервной пластинки, который синергично активируется с помощью FGFs и
Wnts. Энхансерная область
Sox2 содержит сайт связывания Lef1 и FGF-чувствительные элементы, а с помощью репортера было показано, что Wnt-зависимая активация существенно усиливается в присутствии FGFs, тогда как FGF сам по себе активирует энхансер на низком уровне (Takemoto et al., 2006). Более того, несколько линий доказательств показали, что усиление фосфорилирования GSK3 с помощью передачи сигналов FGF (возможно посредством Akt) усиливает стабилизацию β-catenin (Hashimoto et al., 2002, Holnthoner et al., 2002, Israsena et al., 2004, Dailey et al., 2005). Эти результаты подтверждают, что передача сигналов Wnt может только влиять на выбор судьбы между плакодной и эпидермальной в присутствие передаси сигналов FGF. Возможно также, что др. недиффундирующие сигналы, такие как передача сигналов NotchЮ являются важными для предопределения границы между плакодой и эпидермисом. Martinez-Arias и др. предложили модель, согласно которой передача сигналов Wnt действует как фильтр транскрипционного шума (Arias and Hayward, 2006). Они также показали, что Notch модулирует передачу сигналов Wnt путем регуляции активности β-catenin (Hayward et al., 2005, Hayward et al., 2006). Более того, в эпидермисе мышей Notch лиганд Jagged1, как было показано, нацелен на β-catenin (Estrach et al., 2006). Т.о., взаимодействие между Wnt и др. сигналами может быть необходимо для предопределения соответствующего размера отической плакоды. Возможно также, чт передача сигналов FGF и Wnt действуют независимо во время индукции отических плакод. Напр., наши исследования показали, что активация передачи сигналов Wnt репрессирует специфичный для эпидермиса транскрипционный фактор Foxi2, тогда как потеря передачи сигналов Wnt вызывает экспансию экспрессии Foxi2 (Ohyama et al., 2006). Передача сигналов Wnt может, следовательно, действовать как пермиссивный фактор, который предопределяет размер отической плакоды путем репрессии Foxi2, обеспечивая тем самым свободу действий для FGF, чтобы индуцировать отические гены в Foxi2-негативном домене.
From ectoderm to otic placode: three steps and more?
Исследования, описанные выше, начинают предлагать более детальное описание того, как исходная эктодерма индуцируется, чтобы сформировать специфические черепно-лицевые плакоды. Во-первых, эктодерма понуждается к экспрессии преплакодных генов в ответ на сигналы от передней части мезодермы (включая кардиальную мезодерму), которые включают FGFs вместе с BMP и Wnt антагонистами (Litsiou et al., 2005; see article by Streit and colleagues in this issue). Во-вторых, подтверждено, что все преплакодные клетки временно специфицируются, приобретая хрусталиковые характеристики (Bailey et al., 2006), с последующими сигналами, ограничивающими хрусталиковые качественные особенности только небольшой областью преплакодного домена. Эти две ступени делают эктодерму компетентной отвечать на сигналы, индуцирующие плакоды - напр., преплакодные характеристики необходимы для эктодермы. чтобы отвечать на FGFs и индуцировать маркеры пре-отического поля, такие как Pax2 (Martin and Groves, 2006). Эта индукция компетентной преплакодной области скорее всего также необходима для индукции и др. плакод - напр., реакцией на FGF является индукция носовой плакоды (Bhattacharyya et al., 2004) , а происходящие из нервной трубки факторы участвуют в индукции плакоды тройничного нерва (Baker et al., 1999). Наконец, Pax2+ пре-отическое поле расщепляется на эпидермис и предетерминированную ткань отической плакоды благодаря действию передачи сигналов Wnt (Ohyama et al., 2006). Нерешенной проблемой остается, как сходные сигналы, развертывающиеся в разное время во время индукции плакод дают разные результаты. Напр., передача сигналов FGF является критической для индукции преплакодных генов (Litsiou et al., 2005), но она позднее также необходима для индукции носовой плакоды (Bhattacharyya et al., 2004), пре-отического поля (Martin and Groves, 2006) и epibranchial плакод у рыбок данио (Nechiporuk et al., 2005, Nechiporuk et al., 2007, Nikaido et al., 2007, Sun et al., 2007). Тем не менее использование молекулярной биологии и генетики преображает исследования индукции отических плакод и позволяет дать детальное молекулярное описание генеза одного из сложнейших сенсорных органов тела.
Сайт создан в системе
uCoz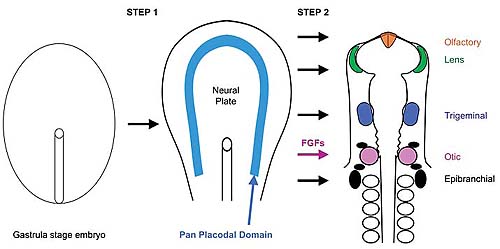
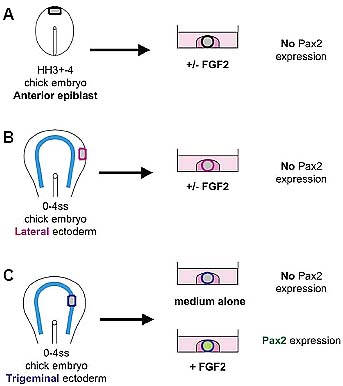 Fig. 2. Only the ectoderm within the pre-placodal region can induce
Pax2 in response to FGF2. (A) Anterior epiblast from HH stage 3+-4 chick embryos is unable to induce Pax2 when cultured in presence of FGF2. (B) Lateral ectoderm (outside the pre-placodal domain) from 0-4ss chick
embryos does not express Pax2 when treated with FGF2. (C) Presumptive
trigeminal ectoderm (within the pre-placodal domain) from 0-4ss chick
embryo expresses Pax2 only when cultured in the presence of FGF2.
Fig. 2. Only the ectoderm within the pre-placodal region can induce
Pax2 in response to FGF2. (A) Anterior epiblast from HH stage 3+-4 chick embryos is unable to induce Pax2 when cultured in presence of FGF2. (B) Lateral ectoderm (outside the pre-placodal domain) from 0-4ss chick
embryos does not express Pax2 when treated with FGF2. (C) Presumptive
trigeminal ectoderm (within the pre-placodal domain) from 0-4ss chick
embryo expresses Pax2 only when cultured in the presence of FGF2. 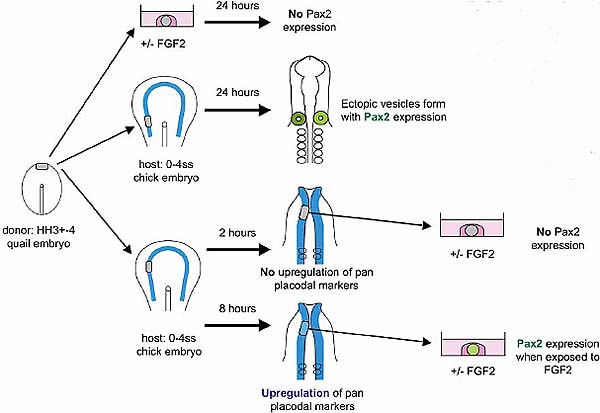
 Fig. 4. Pax2+ cells give rise to both otic placode and epidermis. Pax2-
Cre mice are crossed with reporter mice that express GFP in a Cre-
inducible fashion. All Pax2-expressing cells and their descendants will
express GFP in embryos derived from such crosses (left). GFP-positive
cells are observed not only in the otic vesicle (OV), but also in the
epidermis at E9.5, while no cells are GFP-positive in reporter mice alone
(right).
Fig. 4. Pax2+ cells give rise to both otic placode and epidermis. Pax2-
Cre mice are crossed with reporter mice that express GFP in a Cre-
inducible fashion. All Pax2-expressing cells and their descendants will
express GFP in embryos derived from such crosses (left). GFP-positive
cells are observed not only in the otic vesicle (OV), but also in the
epidermis at E9.5, while no cells are GFP-positive in reporter mice alone
(right).  Fig. 5. Wnt signals mediate a placode-epidermis fate decision. In normal mice (left), the canonical Wnt signaling pathway is activated (light blue) in the Pax2 + pre-otic field by Wnts from the hindbrain (HB). Cells receiving high levels of Wnt signals differentiate as otic placode (magenta), while those receiving lower or no Wnt signals differentiate as epidermis (grey). In the absence of Wnt signaling in the pre-otic field (center), epidermis is expanded at the expense of the otic placode. When -catenin is stabilized in the pre-otic field (right), it activates Wnt-responsive genes in the entire pre-otic field, thus expanding the otic placode at the expense of epidermis. Modified from Ohyama et al., (2006).
Fig. 5. Wnt signals mediate a placode-epidermis fate decision. In normal mice (left), the canonical Wnt signaling pathway is activated (light blue) in the Pax2 + pre-otic field by Wnts from the hindbrain (HB). Cells receiving high levels of Wnt signals differentiate as otic placode (magenta), while those receiving lower or no Wnt signals differentiate as epidermis (grey). In the absence of Wnt signaling in the pre-otic field (center), epidermis is expanded at the expense of the otic placode. When -catenin is stabilized in the pre-otic field (right), it activates Wnt-responsive genes in the entire pre-otic field, thus expanding the otic placode at the expense of epidermis. Modified from Ohyama et al., (2006).