Во время развития внутреннего уха сенсорные нейроны и волосковые клетки происходят из отических предшественников, в которых активируются пронейральные гены. Пока мало известно о том, как и когда приобретается пронейральная компетентность в отической плакоде.
После образования отической плакоды, отическая ткань инвагинирует и инициируется автономная программа развития. Наиболее очевидными изменениями, помимо постоянной модуляции формы, происходит прогрессивная генерация специализированных клеток в точно определенных местах. После инвагинации плакоды некоторые эпителиальные клетки приобретают характеристики нейробластов, теряют связанность и вычленяются в мезенхимное пространство, где они остаются в виде группы, формирующей cochleo-vestibular ганглий (D'Amico-Martel, 1982, Hemond and Morest, 1991, Adam et al. , 1998). Эти нейробласты претерпевают серию временных амплифицирующих раундов делений (Alsina et al., 2003, Camarero et al., 2003), затем вступают в дифференцировку, вытягивают свои аксоны и иннервируют эпителиальные области вблизи места, где они были генерированы (Fritzsch et al., 2002). В последнюю декаду были идентифицированы многие гены, участвующие в процессе нейросенсорного развития как у беспозвоночных, так и позвоночных (Ghysen and Richelle, 1979, Torres and Giraldez, 1998, Baker and Bronner-Fraser, 2001). Сегодня ясно, что ранние ступени спецификации клеточных судеб в разных сенсорных органах контролируются пронейральными генами, которые были впервые идентифицированы у мутантов Drosophila, лишенных способности формировать наружные сенсорные органы и щетинки (Ghysen and Richelle, 1979). Пронейральные гены кодируют транскрипционные факторы basic Helix-Loop-Helix (bHLH) класса. которые соединяются с общими последовательностями ДНК, наз. E-box последовательностью (Bertrand et al., 2002). У Drosophila, два главных семейства пронейральных генов контролируют нейральное развитие ПНС, achaete-scute (asc) и atonal (ato) семейства генов (Simpson, 1990). Гены asc
у Drosophila специфицируют наружные сенсорные органы, тогда как ген ato специфицирует фоторецепторы и chordotonal органы, среди них специализированный Johnstonґs орган (Ghysen and Dambly-Chaudiere, 1989, Treisman, 2004). Последний располагается на антенне мух, и по-видимому, является гомологом органа слуха у Drosophila, учитывая его способность звуками возбуждать потенциалы (rev. Caldwell and Eberl, 2002, Boekhoff-Falk, 2005;Eberl and Boekhoff-Falk in this issue). У позвоночных, в дополнение к achaete-scute homologues (ash) и atonal homologues (atoh), др. новое родственное пронейральное семейство кодирует в геноме: E proteins, Olig, NeuroD, Neurogenin и Nscl семейства белков (Bertrand et al., 2002), некоторые из них рекрутируются для периферических сенсорных онтогенетических программ у имеющих череп. Предполагается, что появление новых пронейральных генов у позвоночных позволяет изначальным функциям механотрансдукции и распространения электрических сигналов осуществляться с помощью одиночных клеток, чтобы они были разделены и осуществлялись двумя разными клетками: волосковые клетки специфицируются с помощью atoh, а нейроны, специфицируются с помощью Neurogenin (Neurog, Ngn) (see Fritzsch and Beisel, 2001).
Спецификация волосковых клеток отстает от спецификации нейрональных клеток приблизительно на два дня у амниот. Немногие разбросанные клетки, экспрессирующие
Atoh1 выявляются в просенсорных участках в отических пузырьках кур на ст. E3.5 (Pujades et al., 2006) и сенсорном эпителии E11-E12 эмбрионов мышей (Shailam et al., 1999; Matei et al., 2005). Напротив, у рыбок данио сенсорные и нейрональные предшественники специфицируются почти в одно и то же время (Andermann et al., 2002). Низкая экспрессия
atoh1b у рыбок данио предшествует появлению индивидуальных atoh1a-позитивных волосковых клеток в широком сенсорном поле эквивалентных клеток. Инициальное развитие этого домена, регулируемое с помощью передачи сигналов Notch, сходно у
Drosophila, что подтверждает классическую пронейральную роль
atoh1b у рыбок данио (Millimaki et al., 2007). У млекопитающих эта роль менее ясна из-за появления Atoh1 главным образом в пост-митотических клетках и ограничивается клетками, которые которые д. дифференцироваться в волосковые клетки (Chen et al., 2002), хотя у мышей экспрессия может обнаруживаться до появления предопределенных сенсорных участков с помощью RT-PCR (Matei et al., 2005). У амниот события детерминации нервных и волосковых клеток разделены во времени с существенными морфогенетическими изменениями во время этого периода. Поэтому пока не решено, происходит ли Neurog1 и Atoh1 пронейральная активация в общем пронейросенсорном домене или в сегрегированном, или частично перекрывающихся нейральном и сенсорном доменах. Анализ клонов установил, что macula utriculae содержит предшественников с общим нейро-сенсорным клоном у кур, а мутантные
Neurog1 мыши обнаруживают также потерю волосковых клеток, указывая тем самым, что по крайней мере, в некоторых областях существуют общие предшественники для клеток обоих клонов (Satoh and Fekete, 2005). Однако, как
Neurog1, так и
Atoh1 гены экспрессируются широко почти на не обнаруживаемых уровнях и усиливают свою экспрессию в детерминированных клетках, анализ распределения белков Sox предоставляет лучший индикатор детерминированных пронейросенсорных территорий. В нервном развитии
Sox гены экспрессируются раньше пронейральных генов, а
Sox2 мутанты обнаруживают тяжелые дефекты в развитии сенсорных органов, лишены также экспрессии
Atoh1 (Kiernan et al. , 2005). Sox3 и Sox2 белки присутствуют в передней вентральной части отического бокала, но позднее, исключительно Sox2 картируется в сенсорных участках (Neves et al.,2007).
Inducing neural competence in the otic placode
Во время раннего развития эмбрионов пути передач сигналов Fibroblast Growth Factor (FGF), Wingless/int-2 (WNT) и Bone Morphogenetic Protein (BMP) многократно конвергируют, чтобы индуцировать эктодермальную ткань в нейральную судьбу, как это продемонстрировано на примере индукции нервной пластинки и нервного гребня. Текущее представление об этом процессе заключается в том, что передача сигналов FGF и/или WNT необходима, что ингибировать передачу сигналов BMP, самого раннего описанного пути, чтобы потенциировать эпидермальную судьбу в противоположность нейральной (Stern, 2005). Два ключевых исследования положили начало пониманию, как пути передачи сигналов FGF и BMP конвергируют внутриклеточно во время раннего эмбриогенеза. Во-первых, описано прямое фосфорилирование с помощью MAPK smad1, чтобы ингибировать передачу сигналов BMP (Pera et al. , 2003) и во-вторых, установлено, что Sip1, Smad-interacting protein 1, регулируется с помощью Churchill, гена, изолированного после нейральной индукции, обусловленной FGF (Sheng et al., 2003). Взаимоотношения между передачей сигналов FGF и пронейральной активацией установлены в исследовании появления каудальной части ЦНС, где Cash4 активируется с помощью FGF (Henrique et al. , 1997). Однако, в большинстве случаев переключение на пронейральные гены задерживается, чтобы нейральная индукция и её активация обеспечивались бы рано индуцируемыми pan-нейральными генами (Sox, ENRI, Zic), которые затем регулируют пронейральную активность.
Sox белки из семейства HMG-box транскрипционных факторов, родственны SRY, тестисы детерминирующему фактору млекопитающих. На базе сходства последовательностей как ДНК-связывающего домена, так и др., специфичных для группы законсервированных мотивов, Sox были подразделены, по крайней мере, на 7 подгрупп (A-G). В ходе эволюции экспрессия SoxB1 генов (Sox1, Sox2 и
Sox3), непосредственно коррелирует сначала с эктодермальными клетками, которые компетентны приобретать нейральную судьбы, а затем с детерминацией клеток в нейральную судьбу (Rex et al., 1997, Pevny and Placzek, 2005). Drosophila SoxNeuro, предполагаемый ортолог белков Sox1-3 позвоночных, является одним из самых ранних транскрипционных факторов, экспрессирующихся pan-нейроэктодермально (Cremazy et al. , 2000) и он действует выше и параллельно с achaete-scute генами. Интересно, что у Drosophila, SoxNeuro участвует в развитии только ЦНС, но не ПНС, это указывает на то, что привлечение белков Sox к развитию плакод является новшеством у craniates, чтобы быстро увеличивать эктодермальные зачатки (Fritzsch et al. , 2006b). Прямые доказательства вовлечения генов SoxB1 в нейральную детерминацию получены в исследованиях in vitro стволовых клеток, на которых было показано, что ген Sox1 может индуцировать нейральную судьбу в компетентных нейроэктодермальных клетках (Pevny et al., 1998). Согласующимся с SOXB1 факторами наделением эктодермальных клеток нейральным потенциалом, является модифицирование экспрессии с помощью нейральных индуцирующих сигналов (Streit et al. , 2000). Более того, строгие доказательства связи между нейральными индуцирующими сигналами и активацией Sox получены благодаря идентификации чувствительных к FGF и Wnt связывающих доменов в одной и той же энхансерной области локуса Sox2 (Takemoto et al., 2006).
Индукция преплакодной области, из которой возникают краниальные плакоды, обеспечивается с помощью тех же самых сигнальных путей. В этом случае активация FGF пути, вместе с WNT и BMP антагонистами специфицирует преплакодное поле (Ahrens and Schlosser, 2005, Litsiou et al. , 2005). После образование преплакодной области вторая волна индукции в определенных местах дает серию субдоменов. Хотя в конце у амниот формируются 6 плакод
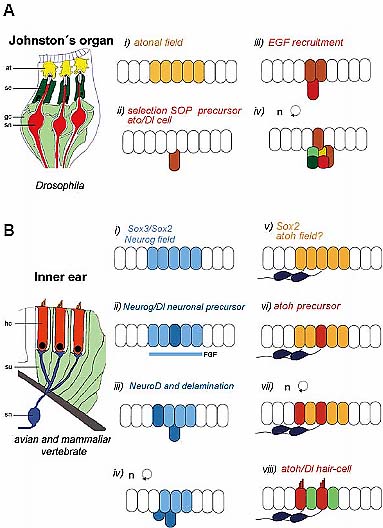 Fig. 1. Steps of proneural gene activation in vertebrate and invertebrate sensory organs. (A) Schematic drawing of three chordotonal sensilla of Drosophila (modified from Yager, 1999) and sequential steps of insect sensory development. i) a neurosensory field is specified by atonal proneural gene, ii) a SOP is singled out by the N-Dl pathway, iii) EGF recruits secondary precursors and iv) sensory neuron and accessory cells are generated. at, attachment cell; sc, scolopale cell; gl, glial cell; sn, sensory neuron. (B) Sensory patch of the vertebrate inner ear (Fettiplace and Hackney, 2006) and outline of major steps of sensory development. i) A proneural field is specified by Neurogenin, ii) neuronal precursors are singled out by the N-Dl pathway, iii) NeuroD is switched on, v) neuroblasts delaminate and differentiate, vi) atoh starts to be expressed in a prosensory field, vii) sensory precursors are singled out, viii) hair-cells and supporting cells are determined by the activity of Notch pathway. sn, sensory neuron; hc, hair cell; su, supporting cell.
Fig. 1. Steps of proneural gene activation in vertebrate and invertebrate sensory organs. (A) Schematic drawing of three chordotonal sensilla of Drosophila (modified from Yager, 1999) and sequential steps of insect sensory development. i) a neurosensory field is specified by atonal proneural gene, ii) a SOP is singled out by the N-Dl pathway, iii) EGF recruits secondary precursors and iv) sensory neuron and accessory cells are generated. at, attachment cell; sc, scolopale cell; gl, glial cell; sn, sensory neuron. (B) Sensory patch of the vertebrate inner ear (Fettiplace and Hackney, 2006) and outline of major steps of sensory development. i) A proneural field is specified by Neurogenin, ii) neuronal precursors are singled out by the N-Dl pathway, iii) NeuroD is switched on, v) neuroblasts delaminate and differentiate, vi) atoh starts to be expressed in a prosensory field, vii) sensory precursors are singled out, viii) hair-cells and supporting cells are determined by the activity of Notch pathway. sn, sensory neuron; hc, hair cell; su, supporting cell.
(adenohypophyseal, lens, olfactory, trigeminal, epibranchial and otic), идентифицирована промежуточная ступень развития плакод в виде появления трех широких доменов экспрессии генов семейства Pax: переднего Pax6 позитивного домена, второго Pax3-позитивного домена, соседнего границей между средним и задним мозгом, и каудальной области, экспрессирующей
Pax2 (Bhattacharyya and Bronner-Fraser, 2004). В Pax6 домене предшественники аденогипофиза, хрусталиковых и обонятельных плакод перемешаны и затем рассортировываются в разные регионы (Bhattacharyya et al. , 2004). Домен Pax3 и Pax2 содержит предшественников тройничной и epibranchial/otic плакод соотв. (Baker and Bronner-Fraser, 2000, Schlosser and Ahrens, 2004). В конце, индивидуальные плакоды могут быть идентифицированы по комбинации Pax, Six/Eya , Foxi и Sox транскрипционных факторов. Six белки обычно экспрессируются в инициальном преплакодном поле, чтобы дать позднее индивидуальные плакоды. У некоторых видов позвоночных экспрессия
Sox2 и Sox3 в эктодерме возникает двумя волнами; первоначально они экспрессируются на низких уровнях в преплакодной области, затем временно выключаются в презумптивных плакодных доменах и наконец их экспрессия возобновляется, когда индивидуальные плакоды специфицируются и экспрессируют Pax гены (Abu-Elmagd et al. , 2001, Schlosser and Ahrens, 2004, Sun et al., 2007). Напр., в поле хрусталиков экспрессия
Sox2 усиливается, как только хрусталик начинает контактировать с оптическим пузырьком (Kamachi et al. , 1998). Все краниальные плакоды, нейрогенные и не-нейрогенные, за исключением тройничной плакоды, экспрессируют SoxB1 транскрипционные факторы. У
Xenopus экспрессия
Neurog1 инициируется во всей преплакодной эктодерме, но постепенно выключается в хрусталиках, указывая, что все плакоды фактически обладают инициальной нейральной склонностью (Schlosser and Ahrens, 2004).
У кур отические пронейральные территории, экспрессирующие Neurog1, появляются в виде треугольников в передней половине плоских отических плакод. Первоначально пронейральный домен является передне-медиальным аспектом отических плакод, чтобы превратиться после инвагинации в передне-медиальную и вентральную позицию отического пузырька (Alsina et al. ,2004). Прежде чем отические плакоды становятся морфологически видимыми, Sox3 экспрессируется в широкой полосе, которая соответствует отической и epibranchial территории, чтобы ограничиться потом пронейральной областью отических плакод (Sun et al. , 2007; G.A and B.A, unpublished observations). Возникают два главных вопроса при анализе функции Sox во время отического развития. Во-первых, является ли процесс индукции плакод, по умолчанию, связанным с пронейральной индукцией или напротив происходят последовательные индуктивные события, ведущие сначала к плакодной, а затем к нейральной судьбе? Во-вторых, приобретается ли нейральная компетентность только в субдомене отически предетерминированных клеток или необходима репрессия нейральной судьбы в не-нейральной компетентной области? Мы предлагаем несколько моделей того, как пронейральный домен может быть заложен (Figure 2) с помощью экспрессии Sox3, как самого раннего маркера нейральной индукции, и Pax2, как маркера плакодной индукции.
Model A: Single induction and repression of neural fate
Эта модель предполагает, что компетентность к нейральной судьбе обеспечивается за счет приобретения плакодных характеристик (Figure 2A).
Тот факт, что передача сигналов FGF необходима как для otic/epibranchial
индукции, так и для экспрессии генов Sox1-3 в otic/epibranchial поле у рыбок данио (Sun et al. , 2007)указывает на то, что оба события могут быть фактически частью одного и того же процесса. Кроме того, Sox2 способен регулировать экспрессию типичного плакодного маркера, такого как Pax6 в хрусталиковых и носовых плакодах (Donner et al., 2007), а у Medaka эктопическая экспрессия Sox3 индуцирует эктопические отические и хрусталиковые плакоды, экспрессирующие Pax2 и Pax6 соотв. (Koster et al. , 2000) . В задней части преплакодной области экспрессия Six1 и Sox3 скоррелирована в высокой степени, но не в передней части преплакодного поля Xenopus (Schlosser and Ahrens, 2004). Снова в otic-epibranchial
поле, Pax2 и Sox3 ко-экспрессируются у рыбок данио и кур, хотя у последних появление экспрессии Sox3 задерживается относительно Pax2 (Groves and Bronner-Fraser, 2000, Abu-Elmagd et al. , 2001, Sun et al. , 2007). Наконец, экспрессия Sox2-3 и экспрессия плакодных маркеров, таких как Pax и Six строго параллельны. Однако, несмотря на некоторые данные, согласно которым можно предположить, что плакодная и нейральная судьбы сцеплены, имеется мало функциональных доказательств, подтверждающих эту модель. В этой модели, как и в model c, пронейральная судьба д. ингибироваться в задних частях отических территорий после широкой плакодной индукции.
Model B: Successive inductions and restricted neural induction
Данная модель постулирует, что плакодная и нейральная индукция являются последовательными событиями (Figure 2B). Трансплантационные эксперименты на разных аксиальных уровнях, осуществленные Noden and Van De Water, (1986) показали, что эктодерма презумптивных отических плакод может эктопически генерировать отические пузырьки без способности формировать нейроны. Также Groves and Bronner-Fraser (2000) наблюдали, что передняя часть эпибласта перепела, трансплантированная в презумптивную отическую область хозяина на ст. 3-10 сомитов может начать экспрессировать Pax2 и Sox3, тогда как трансплантации, осуществленные на ст. 11-21 сомитов, экспрессируют только Sox3, но не Pax2, указывая тем самым, что Pax2-индуцирующие сигналы теряются прежде Sox3-индуцирующих сигналов. Т.о., в зависимости от продолжительности воздействия сигналов, появление некоторых молекулярных маркеров, таких как Pax2 и Sox3, может быть разобщено. Ингибирование передачи сигналов FGF у рыбок данио указывает на то, что индукция Sox3 и Pax2 нуждается в передаче сигналов FGF в otic-epibranchial области, но не взаимозависимым способом (Groves and Bronner-Fraser, 2000, Nikaido et al., 2007, Sun et al., 2007). В согласии с этим мнением мультиступенчатый индуктивный процесс полного отического развития, хорошо известно, что индукция отических плакод нуждается сначала в индукции преплакодной эктодермы для получения второй волны индукции (Litsiou et al., 2005, Martin and Groves, 2006).
Эта модель предполагает также ограниченный источник нейральных индукторов в передней части отического поля. Пока потребность в передаче сигналов FGF в основном ассоциировалась с отической индукцией, но как недавно было сообщено, процесс возможно также затрагивает и epibranchial индукцию (Hans et al., 2007, Nikaido et al., 2007, Sun et al., 2007,
Nechiporuk et al. , 2007). Несколько FGFs экспрессируются в окружающих тканях во время отической и Sox3 индукции. Сегодня считается, что FGF8 из энтодермы, FGF19/FGF10 из мезодермы и FGF3/FGF8/FGF10 из заднего мозга участвуют последовательно, а иногда и синергично, чтобы индуцировать уже подготовленную эктодерму к формированию внутреннего уха (rev. Groves, 2005; Groves, Schimmang in this issue). FGF молекулы (22 у млекопитающих) регулируют широкое разнообразие функций, таких как клеточные судьбы, формирование паттерна, пролиферация, дифференцировка, жизнеспособность и морфогенез. Во время развития внутреннего уха FGF регулируют также некоторые из более поздних событий, такие как формирование паттерна и рост (Wright and
Mansour, 2003). Одиночные мутанты FGF3 или гены, формирующие паттерн заднего мозга, подобные kreisler, у которых уровни FGF3 в задней части заднего мозга редуцированы/потеряны, обнаруживают дефекты формирования отического паттерна, такие как экспансия улитки или отсутствие эндолимфатического протока (Mansour et al. , 1993, McKay et al., 1996, Choo et al., 2006). У рыбок данио мутантных по valentino (ортолог kreisler) обнаруживается экспансия передней части отического домена и избыточная продукция волосковых клеток, возможно из-за экспансии кзади экспрессии FGF3 в заднем мозге (Kwak et al. , 2002). Сходным образом, vHNF1
мутантные эмбрионы также обнаруживают anteriorization заднего мозга,снова обнаруживая экспансию нейрогенного и сенсорного доменов за счет задних и дорсальных маркеров (Lecaudey et al. , 2007). Некоторые из этих эффектов могут быть также обусловлены за счет WNT молекул, которые действуют синергично с FGFs, способствуя нейральным характеристикам. Однако, следует учитывать, что некоторые из фенотипов внутреннего уха, затрагивающие экспансию и/или редукцию нейрональной или сенсорной территорий, были проанализированы на ст. отического пузырька, когда происходит основной морфогенез и клеточный рост, с некоторыми из этих путей , участвующими также в вышеупомянутых процессах. Итак, большинство из FGFs и WNT молекул локально экспрессируются вокруг презумптивного отического поля в различные периоды времени, следовательно, разумно поверить, что i) тип, ii) время и iii) пространство активации этих сигналов может дифференциально регулировать плакодную и отическую нейральную индукцию. У кур FGF2 способен индуцировать обширное множество, но не все ранние отические маркеры (т.e. Pax2, EphA4, Nkx5.1, SOHo1, но не BMP7, Dlx5), тогда как FGF8 обладает некоторыми, но не незначительными индуцирующими свойствами (Adamska et al.,2001, Martin and Groves, 2006). Итак, на данный момент, детальное исследование роли различных FGFs по активации специфических ранних отических генов необходимо для выяснения полной картины.
Model C: Successive inductions and repression of neural
fate Эта модель предсказывает последовательную индукцию, как и в model b,
но неограниченные нейральные индуцирующие сигналы активируют Sox гены в широком otic/epibranchial поле. Широкая пронейральная компетентность постепенно ограничивается передней частью отической области с помощью ингибирующего сигнала от задней области (Figure 2C). Кстати, Tbx1, транскрипционный фактор, принадлежащий к T-box семейству генов, является единственным фактором, который четко демонстрирует ингибирование функции нейрогенеза в задней части внутреннего уха (Vitelli et al., 2003, Raft et al., 2004, Xu et al., 2007). У мышей Tbx1 экспрессируется в фарингеальных дугах, головной мезенхиме, вторичном поле сердца, задней части отоциста и склеротоме (Chapman et al., 1996). Гомозиготные мутанты по гену Tbx1 у мышей обусловливают врожденные дефекты, происходящие из фарингеальной системы. В отоцисте также наблюдаются серьёзные дефекты, они маленькие и сенсорные органы не образуются (Vitelli et al. , 2003). Интересно, что Tbx1 экспрессируется в не-нейральной области отического пузырька, комплементарно NeuroD позитивному домену. Потеря гена Tbx1 вызывает экспансию и удвоение нейральной области, тогда как нейральная детерминация супрессируется в отоцистах с избыточной функцией Tbx1, указывая тем самым, что его функция заключается в ингибировании нейрональной судьбы (Raft et al. , 2004). В дальнейшем это было подтвержено и картированием судеб; Tbx1 позитивные клетки характеризовали популяцию клеток, которые давали большую часть отоциста, за исключением областей нейрогенной и эндолимфатического протока (Xu et al., 2007). У кур выявлены два комплементарных домена на ст. раннего отического бокала: пронейральная область, экспрессирующая LFng, FGF10/FGF3, Delta1 и Hes5, и не-нейральная область, экспрессирующая Lmx1, Irx1, Tbx1, Hairy1 и Serrate1 (Alsina et al., 2004, Abellу et al., 2007).
Hairy другой bHLH ген у Drosophila экспрессируется в широкой области, в которой пронейральная функция репрессирована (Orenic et al. , 1993). Конечности взрослых Drosophila melanogaster покрыты щетинками в виде периодических паттернов. Было показано, что hairy контролирует паттерн формирования сенсорных органов путем репрессии achaete-scute (Orenic et al., 1993). На границе между средним и задним мозгом у рыбок данио, в обонятельных плакодах мышей и в inter-proneural полосках у Xenopus, Hairy and Enhancer of Split гомологи (Hes/Her) репрессируют нейральные судьбы (Cau et al., 2000, Geling et al., 2003, Bae et al., 2005). У эмбрионов кур в отическом бокале Hairy1 (Hes1 у млекопитающих) экспрессируется ограниченно в не-нейральном домене, раскрывая свою предполагаемую роль в репрессии пронейральной судьбы в задней области (Abellу et al. , 2007).
Во всех трех моделях пронейральная функция скорее всего усиливается с помощью локальных отических FGF сигналов, Напр., экспрессия
FGF3, FGF10 и FGF8 отличается в пронейральной территории у разных видов, с описанными нейрогенными функциями для некоторых из них.
Notch signaling during early otic development
Principles of the Notch signaling pathway
Путь передачи сигналов Notch участвует почти в каждом онтогенетическом решении и процессах и вместе с с семействами белков FGF, WNT, TGF и HH составляет один из 5 основных путей, необходимых для развития metazoan. Впервые Notch рецептор идентифицирован у
Drosophila melanogaster. Суть сигнального пути состоит из Notch рецептора с крупным внеклеточным доменом с 36 тандемными epidermal growth factor (EGF)-подобными повторами и тремя богатых цистеином Notch/LIN-12 повторов. 6 тандемных ankyrin повторов, богатый глютамином домен (opa) и последовательности PEST найдены во внутриклеточном домене
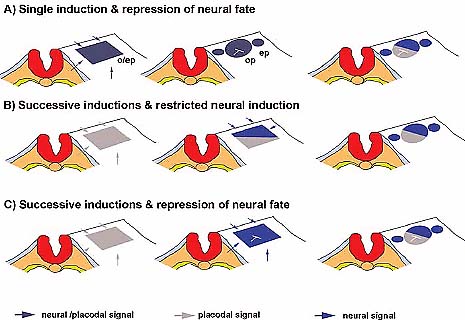 Fig. 2. Proposed models for neural induction in the otic/epibranchial field. Dorsal views of the cranial ectoderm at the level of the hindbrain. o/ep, otic-epibranchial placode; ep, epibranchial
placode; op, otic placode.
Fig. 2. Proposed models for neural induction in the otic/epibranchial field. Dorsal views of the cranial ectoderm at the level of the hindbrain. o/ep, otic-epibranchial placode; ep, epibranchial
placode; op, otic placode.
(rev. Artavanis-Tsakonas et al., 1999). Лиганды, которые соединяются с Notch рецептором, являются двумя пронизывающими один раз мембрану белками, Delta и Serrate (Jagged у млекопитающих). В результате активации рецептора, Notch происходит серия протеолитических расщеплений, которые высвобождают внутриклеточный домен Notch рецептора (NICD) в цитоплазму. Затем NICD транслоцируется в ядро, рекрутирует транскрипционный фактор Suppressor of Hairless [Su(H)] (CBF1/RJBk у млекопитающих, LAG-1 у
C. elegans) и
mastermind ко-факторный белок, чтобы сформировать комплекс, который активирует нижестоящие гены мишени;
Enhancer of split (E(spl) гены у
Drosophila и
HES или HESR у позвоночных выступают в качестве основных генов мишеней. Эта общая картина передачи сигналов Notch не более чем эскиз пути, сильно усложнившегося после выделения многочисленных модуляторов пути Notch (Artavanis-Tsakonas et al. , 1999, Schweisguth, 2004, Louvi and Artavanis-Tsakonas, 2006).
Путь Notch регулирует длинный список различных биологических процессов: решения клеточных судеб, пролиферация, апоптоз, клеточная дифференцировка, формирование паттерна и асимметричные деления. Notch функции могут отличаться в результате модуляции количества рецепторов или лигандов на клеточной поверхности, путем петель обратной связи, которые потенциируют или выключают сигнал, или с помощью ткане-специфичных ко-факторов (Schweisguth, 2004). Наиболее заметная роль пути Notch заключается в его способности влиять на соседние клетки, так что одна клетка принимает одно состояние, а соседняя клетки воспринимает антагонистическое состояние. Notch играет важную роль в нейрогенезе, при котором Delta-позитивные клетки способствуют принятию нейрональной судьбы, а
TABLE 1
ORTHOLOGUES OF NOTCH PATHWAY COMPONENTS
 List of Notch pathway genes across species. Genes in brackets indicate alternative nomenclatures found in the literature. Data extracted mainly from ENSEMBL database, Sieger et al., 2004 and Landford and Kelley 2005. Super index lettering indicate presence (+), absence (-) or not determined (nd) expression in the developing inner ear.
List of Notch pathway genes across species. Genes in brackets indicate alternative nomenclatures found in the literature. Data extracted mainly from ENSEMBL database, Sieger et al., 2004 and Landford and Kelley 2005. Super index lettering indicate presence (+), absence (-) or not determined (nd) expression in the developing inner ear.
Notch-активированные клетки репрессируют нейрональную судьбу (rev. Lewis, 1998). Этот феномен, в котором активность Notch генерирует петлю негативной обратной связи путем репрессии своего лиганда, обозначается как латеральное торможение (lateral inhibition). В целом в этих случаях Notch активированные клетки остаются в виде недифференцированных клеток предшественников и репрессируют активность пронейральных генов, тогда как Delta-позитивные клетки вступают в дифференцировку. Однако, недавние данные указывают на то, что путь Notch может обеспечивать дифференцировку. В Таблице 1 представлены ортологи у мышей, кур и рыбок данио членов пути Notch дрозофилы.
Путь Notch также обладает способностью сегрегировать клоны специфических клеток из полей онтогенетически эквивалентных клеток; в целом в этом механизме Notch оперирует путем индукции своих лигандов, обозначаемой как латеральная индукция. Во время нейрального развития у позвоночных было установлено, что он существенен для сегментации заднего мозга и и формирования zona limitans внутри талямуса (Lewis, 1998, Pasini and Wilkinson, 2002, Kiecker and Lumsden, 2005). Хотя точный механизм, с помощью которого соседние региональные домены приобретают разные характеристики у позвоночных, неясен, лежащая в его основе модель, полученная на
Drosophila предсказывает, что путь Notch дифференциально активируется с помощью отличающейся экспрессии лигандов Delta и Serrate и модулятора Fringe на соседних территориях.
Drosophila Fringe (Fng) и гомолог позвоночных Lunatic fng, Manic fng и Radical fng являются glycosyl-transferases, которые гликолизируют Notch EGF повторы, приводя в итоге к активации Notch рецепторов с помощью активации Delta в отличие от Serrate лиганда (Rampal et al., 2005).
Expression patterns and roles of Notch in the inner ear
По большей части роль Notch в развитии внутреннего уха затрагивает сенсорное развитие, т.к. дает ошеломляющий фенотип, связанные с продукцией волосковых клеток, когда предача сигналов Notch нарушена. Роль пути Notch в развитии внутреннего уха подтверждается длинным списком мутаций у мышей, дополненного генетическим анализом рыбок данио (Lewis, 1998, Eddison et
al. , 2000, Landford and Kelley, 2005). Коротко рассмотрим паттерны экспрессии Notch элементов и роли во время сенсорного развития, концентрируясь на ранней роли Notch в регуляции пронейрального домена, базируясь на исследованиях кур.
Notch function in sensory epithelia
Было установлено, что у мышей на ст E12, с помощью Notch1, Jag1 и
LFng экспрессия начинает концентрироваться во всём эпителии 6 сенсорных эпителиев (Morrison et al. , 1999). Одновременно, Dll1 (Dl1 у позвоночных не млекопитающих) экспрессируется в разбросанных клетках, преимущественно в будущих волосковых клетках вестибулярного эпителия (дифференцируется прежде слухового эпителия), Позднее на ст. E14-E15, Dll1 и Jagged2 (Jag2), по-видимому, экспрессируются также в эпителии ушной улитки, снова ограничиваясь клетками, которые станут волосковыми клетками (Morsli et al. , 1998, Morrison et al. , 1999), начиная с базального конца улитки и прогрессивно распространяясь к верхушке. Транскрипты Hes1 и Hes5 выявляются только с помощью RT-PCR на этой стадии (Shailam et al. , 1999, Lanford et al. , 2000). На ст. E15, экспрессия Hes5 выявляется с помощью гибридизации in situ в основании улитки, на на ст. E17, когда большинство клеток прекратило деления, экспрессия LFng, Jagged1 (Jag1) и экспрессия Hes5 ограничивается поддерживающими клетками в улитке, тогда как экспрессия Jag2 и Dll1 ограничивается волосковыми клетками (see revision in Landford and Kelley, 2005). Сходные паттерны экспрессии обнаружены и у др. видов, таких как куры, рыбки данио (Adam et al., 1998, Haddon et al., 1998, Eddison et al., 2000).
Дефектная передача сигналов Notch у рыбок данио или млекопитающих (мутанты по
Jag2, Hes5, Dll1, mind bomb) приводит к избыточной продукции волосковых клеток за счет поддерживающих клеток, указывая тем самым, что передача сигналов Notch регулирует спецификацию судеб сенсорных клеток с помощью механизма латеральной ингибиции (Haddon et al., 1998, Lanford et al., 1999, Zine et al., 2000, Kiernan et al., 2001). Т.о., Jag2/Dll1 лиганды приводят к активации пути Notch и Hes5 в соседних клетках, что блокирует детерминацию волосковых клеток. Сходные фенотипы добавочных волосковых клеток присутствуют у Foxg1 нулевых мышей, что подтверждает возможные взаимодействия Hes белков с forkhead box G1 белками, балансирующими клеточную пролиферацию и детерминацию клеточных судеб во внутреннем ухе (Pauley et al., 2006, Fritzsch et al., 2006a). С др. стороны,
Jag1 широко экспрессируется в всех просенсорных участках и разные мутации
Jag1 у мышей вызывают тотальную или частичную потерю сенсорного эпителия, указывая, что Jag1 необходим для спецификации просенсорных участков (Tsai et al., 2001, Daudet and Lewis, 2005, Brooker et al., 2006, Kiernan et al., 2006). Более того, Jag1 также необходим для поддержания клеток в состоянии сенсорных предшественников (Kiernan et al., 2006). Превалирующим мнением является то, что помимо регуляции спецификации волосковых клеток, передача сигналов Notch-Jag1 первоначально специфицирует сенсорный в сопоставлении к несенсорному эпителию внутри уха, устанавливая границу с помощью механизма латеральной индукции (Adam et al., 1998,
Lewis, 1998, Eddison et al., 2000, Landford and Kelley, 2005). Одна из возможных моделей подтверждает, что активность Notch в несенсорном эпителии, управляемая с помощью Jag1 связывания из сенсорного эпителия, репрессирует сенсорную судьбу. В соответствие этой гипотезе инактивация Notch у рыбок данио ведет к экспансии сенсорной судьбы и сходные результаты получены у условных мутантов Notch1 (Kiernan et al., 2001). Однако, как уже упоминалось условная делеция
Jag1 в отоцисте не фенокопирует результатов инактивации Notch1, а скорее подтверждает, что путь Notch активируется в сенсорном эпителии. Более того, у кур избыточная экспрессия NICD вызывает индукцию дополнительных сенсорных участков (Daudet and Lewis, 2005). Т.о., было предположено, что активность Notch необходима для сенсорного развития, во-первых, делая клетки компетентными, чтобы формировать просенсорные участки, наделяя их просенсорными характеристиками и затем ингибируя дифференцировку волосковых клеток и устанавливая мозаичный клеточный паттерн (Daudet and Lewis, 2005).
Notch function in the proneural domain
До появления сенсорных участков, когда устанавливается ранний пронейральный домен, большинство членов пути Notch уже экспрессируются в отической плакоде/бокале. У кур, Notch1 экспрессируется во всем отическом эпителии со ст. 11 сомитов и до ст. отоциста (Groves and Bronner-Fraser, 2000).
LFng экспрессируется по всему пронейральному домену, тогда как Dl1 обнаруживает соль-и-перец паттерн (Adam et al., 1998, Cole et al., 2000, Alsina et al., 2004). В том же самом домене,
Hes5 экспрессируется в клетках, соседних с Dl1-позитивными клетками как следствие процесса N-Dl латеральной ингибиции (Fig. 3) (Abellу et al., 2007).
Hes6 в нервной трубке экспрессируется как в предшественниках, так и дифференцированных нейронах
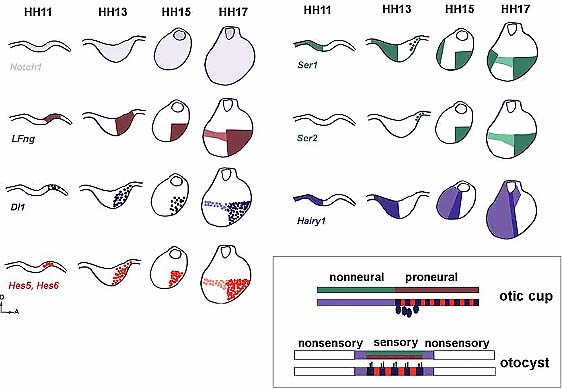 Fig. 3. Schematic lateral views of developing chick inner ears from otic placode (HH11) to otic vesicle stage (HH17) with expression profiles of members of the Notch pathway. Dotted pattern represents mRNA expression in scattered or clusters of cells. Dorsal up and anterior to the right.
Fig. 3. Schematic lateral views of developing chick inner ears from otic placode (HH11) to otic vesicle stage (HH17) with expression profiles of members of the Notch pathway. Dotted pattern represents mRNA expression in scattered or clusters of cells. Dorsal up and anterior to the right.
(Fior and Henrique, 2005), а у кур внутреннее ухо обнаруживает мозаичный паттерн в пронейральном домене (G.A and B.A unpublished observations). В сенсорных участках экспрессия
Hes6 очень сходна с
Atoh1 (Qian et al., 2006). Следовательно, домены экспрессии
LFng, Hes5, Dl1 и Hes6 расширяются со ст. отического бокала до позднего отоциста, т.к. существует общий программный механизм для селекции сначала нейрональных, а затем сенсорных клеток. Как и ожидалось, исходя из модели латеральной ингибиции, нарушение передачи сигналов Notch у
mind bomb мутантных рыбок данио или у кур с помощью ингибирования внутриклеточного расщепления Notch ведет к продукции избытка нейрональных предшественников во внутреннем ухе, сопровождаемом супрессией активации Hes5 (Haddon et al. , 1998, Abellу et al. , 2007). Итак, передача сигналов Notch необходима в отическом нейрогенезе, чтобы регулировать количества нейрально детерминированных клеток, которые вступают в нейрональную дифференцировку.
Интересно, что Ser1 (или Jag1) также экспрессируются уже на ранней ст. отического бокала, перед появлением просенсорных участков. В этом случае Ser1 проявляется широко в домене, комплементарном пронейральному домену. Позднее Ser1 также отличается в пронейральном домене вместе с Ser2 разбросанным способом экспрессии. Приблизительно на той же самой инициальной стадии
Hes1 также ограничивается не-нейральной областью, первоначально в виде широкой задней экспрессии, прогрессивно увеличиваясь в уровне в узкой латеральной полосе, соседствующей с пронейральным доменом. Итак, не-нейральная область сначала характеризуется с помощью домена с Notch, Jag1 и Hes1 и без LFng и Dl1 (Fig. 3). Ранняя комплементарность экспрессии Ser1/Hes1 и Dl1/LFng/Hes5 может отражать роль Notch в вычленении пронейрального домена из не-нейрального домена. Во время стабилизации пронейрального домена можно предположить, что активность Notch посредством связывания Ser1 в не-нейрональном домене может приводить к активации Hes1, чтобы ингибировать эту пронейральную активность. Однако, блокада активности Notch у эмбрионов кур до появления экспрессии
Hes1 не расширяет пронейральный домен, хотя Hes1 подавляется (Abellу et al., 2007). Это указывает на то, что или др. факторы, такие как Tbx1, могут репрессировать пронейральную судьбу или что активности Notch недостаточно для супрессии нейральной судьбы. Это согласуется с результатами у кур, согдасно которым активность Notch способствует выборе сенсорной судьбы скорее, чем её ингибированию. У мышей, NICD выявляется только в пронейральном домене на ст. отического пузырька (Xu et al. , 2007). Детальное картирование экспрессии NICD и Hes1 на ст. отической плакоды/бокала до ст. отического пузырька необходимо у млекопитающих и кур. Ранняя блокада Notch на ст. 6-9 сомитов не препятствует развитию пронейрального домена, но влияет на ограниченную экспрессию пронейральных генов, таких как
Lmx1 (Abellу et al. , 2007). В согласии с этой идеей в эмбриональных стволовых клетках активность Notch способствует нейральной компетентности, синхронизирует клетки с Sox1 и обеспечивает нейральными характеристиками за счет ингибирования не-нейральной судьбы
(Lowell et al., 2006).
Summary
The early development of the inner ear is tightly linked to the emergence of a proneural domain with neurogenic capacity expressing the proneural gene Neurogenin1. Preceding the establishment of the proneural domain, SoxB1 genes distinguish a broad otic and epibranchial field foreshadowing the neural competent domain. Several models have been proposed for how neural competence is acquired. Yet, lacking many functional
studies we envisage a multi-inductive process in which first, a placodal induction is followed by a neural induction. Restricted anterior proneural function would result of a combination of i) inhibitory factors acting in the posterior region plus ii) anterior enhancement of proneural activity by local otic FGFs. Notch activity in the proneural field is not required for the establishment of the proneural field but to maintain a pool of progenitors with proneural character.
Сайт создан в системе
uCoz Fig. 1. Steps of proneural gene activation in vertebrate and invertebrate sensory organs. (A) Schematic drawing of three chordotonal sensilla of Drosophila (modified from Yager, 1999) and sequential steps of insect sensory development. i) a neurosensory field is specified by atonal proneural gene, ii) a SOP is singled out by the N-Dl pathway, iii) EGF recruits secondary precursors and iv) sensory neuron and accessory cells are generated. at, attachment cell; sc, scolopale cell; gl, glial cell; sn, sensory neuron. (B) Sensory patch of the vertebrate inner ear (Fettiplace and Hackney, 2006) and outline of major steps of sensory development. i) A proneural field is specified by Neurogenin, ii) neuronal precursors are singled out by the N-Dl pathway, iii) NeuroD is switched on, v) neuroblasts delaminate and differentiate, vi) atoh starts to be expressed in a prosensory field, vii) sensory precursors are singled out, viii) hair-cells and supporting cells are determined by the activity of Notch pathway. sn, sensory neuron; hc, hair cell; su, supporting cell.
Fig. 1. Steps of proneural gene activation in vertebrate and invertebrate sensory organs. (A) Schematic drawing of three chordotonal sensilla of Drosophila (modified from Yager, 1999) and sequential steps of insect sensory development. i) a neurosensory field is specified by atonal proneural gene, ii) a SOP is singled out by the N-Dl pathway, iii) EGF recruits secondary precursors and iv) sensory neuron and accessory cells are generated. at, attachment cell; sc, scolopale cell; gl, glial cell; sn, sensory neuron. (B) Sensory patch of the vertebrate inner ear (Fettiplace and Hackney, 2006) and outline of major steps of sensory development. i) A proneural field is specified by Neurogenin, ii) neuronal precursors are singled out by the N-Dl pathway, iii) NeuroD is switched on, v) neuroblasts delaminate and differentiate, vi) atoh starts to be expressed in a prosensory field, vii) sensory precursors are singled out, viii) hair-cells and supporting cells are determined by the activity of Notch pathway. sn, sensory neuron; hc, hair cell; su, supporting cell.  Fig. 2. Proposed models for neural induction in the otic/epibranchial field. Dorsal views of the cranial ectoderm at the level of the hindbrain. o/ep, otic-epibranchial placode; ep, epibranchial
placode; op, otic placode.
Fig. 2. Proposed models for neural induction in the otic/epibranchial field. Dorsal views of the cranial ectoderm at the level of the hindbrain. o/ep, otic-epibranchial placode; ep, epibranchial
placode; op, otic placode.  List of Notch pathway genes across species. Genes in brackets indicate alternative nomenclatures found in the literature. Data extracted mainly from ENSEMBL database, Sieger et al., 2004 and Landford and Kelley 2005. Super index lettering indicate presence (+), absence (-) or not determined (nd) expression in the developing inner ear.
List of Notch pathway genes across species. Genes in brackets indicate alternative nomenclatures found in the literature. Data extracted mainly from ENSEMBL database, Sieger et al., 2004 and Landford and Kelley 2005. Super index lettering indicate presence (+), absence (-) or not determined (nd) expression in the developing inner ear. 