Последовательная фиксация отической AP оси, сопровождаемая появлением DV оси, по-видимому, является общим феноменом, хотя по времени отличается у разных видов. У саламандр, напр., AP ось оказывается фиксированной намного раньше, чем у эмбрионов кур, сразу же после того как нервный складки смыкаются и перед появлением отических плакод; DV оказывается фиксированной чуть позднее, когда отический пузырек оказывается закрытым (Harrison, 1936; Hall, 1939; Harrison,1945; Yntema, 1955).
Эксперименты по ротации подтвердили, что факторы, как внешние, так и внутренние необходимы для спецификации и фиксации (детерминации) отических осей. На ранних стадиях позиционирование относительно окружающих тканей может влиять на формирование осей, т.к. после фиксации ротации в ухе не могут преодолеть заложенный паттерн, подтверждая, что внутренне присущие факторы в ухе действуют, чтобы поддерживать информацию по формированию аксиального паттерна и ухо является или более не чувствительным к внешним сигналам или, что они затухают. Ткани вблизи отической эктодермы, которые могут передавать для неё сигналы, включают нервную трубку, хорду, покрывающую эктодерму, фарингеальную энтодерму, потоки мигрирующих клеток нервного гребня и др. периотичекую мезенхиму. Из них дорсальная часть нервной трубки и ткань срединной линии (хорда и донная пластинка) исследовали наиболее активно; они важны как источник внешней паттерн-формирующей информации. В свою очередь внешние сигналы интерпретируются, поддерживаются и размножаются с помощью внутренних факторов, экспрессируемых внутри самого отического эпителия.
Кандидатами на роль внешних сигнальных факторов из дорсальной части нервной трубки, донной пластинки и хорды включают семейства BMP, Fgf, Hh и Wnt; отметим, что они, возможно за исключением Hh для некоторых видов, экспрессируются также внутри отического эпителия, где они могут действовать как внутренне присущие факторы для поддержания и повышения качества формирования аксиального паттерна. Многие факторы, как внешние, так и внутренние по отношению к уху, участвуют в спецификации более чем одной оси и каждый фактор вряд ли действует независимо; некоторые исследования показывают, что существуют взаимодействия и обмены сигналами между разными сигнальными путями, чтобы сформировать паттерн уха. Мы установили, что AP ось отдельна, но DV и ML оси подвергаются воздействию совместно, т.к. они редко затрагиваются независимо.
Anteroposterior patterning
Role of the hindbrain in otic AP patterning
Отические плакоды развиваются в тесной взаимосвязи с ромбомерами (r) заднего мозга, каждый из которых экспрессирует уникальную комбинацию генов во время спецификации отических осей; поэтому кажется привлекательной идея, что ромбомеры награждают AP характеристиками соседнюю отическую ткань. У рыбок данио, напр., отические плакоды инициально возникают рядом с r4, но позднее оказываются расположенными по соседству с r5, с их передними и задними полюсами (и сайтами инициального образования волосковых клеток) оппозитно r4 и r6, соотв. (Kimmel et al., 1995; Riley et al., 1997; Ernest et al., 2000). У эмбрионов кур отический пузырек лежит по соседству с r5 и r6; где граница r5/6 находится на одной линии с границей отического AP компартмента, указывая тем самым, что r5- и r6-производные факторы м. соотв. обеспечивать А и Р качественные особенности в отической пузырьке (Brigande et al., 2000b) (see Fig. 5).
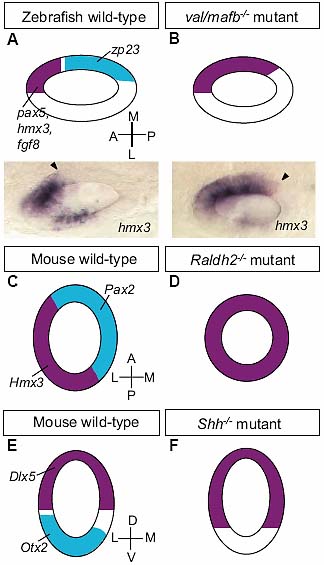 Fig. 3. Examples of mutant phenotypes affecting axial patterning at
the otic vesicle stage. (A,B) Disruption of the otic AP axis in the
zebrafish val/mafb mutant (dorsal views). Expression of anterior markers ( hmx3, pax5, fgf8; purple) extends posteriorly around the medial wall of the otic vesicle, while expression of a posterior marker ( zp23; light blue) is lost (adapted from data in Kwak et al., 2002). The photographs show the expression of hmx3 at 25 hpf; arrowheads mark the posterior boundary of expression. (C,D) Disruption of the otic ML axis in the mouse Raldh2-/- mutant (dorsal views). Expression of a medial marker ( Pax2;light blue) is lost, while expression of a lateral marker ( Hmx3; purple) is expanded throughout the otic epithelium (adapted from data in Niederreither et al ., 2000). (E,F) Disruption of the otic DV axis in the mouse Shh -/- mutant (transverse sections). Expression of the dorsal marker Dlx5 (purple) extends ventrally, while expression of the ventral marker Otx2 (light blue) is lost (adapted from data in Riccomagno et al., 2002). All drawings are schematic diagrams, not to scale; they show only a subset of the genes affected in each case.
Fig. 3. Examples of mutant phenotypes affecting axial patterning at
the otic vesicle stage. (A,B) Disruption of the otic AP axis in the
zebrafish val/mafb mutant (dorsal views). Expression of anterior markers ( hmx3, pax5, fgf8; purple) extends posteriorly around the medial wall of the otic vesicle, while expression of a posterior marker ( zp23; light blue) is lost (adapted from data in Kwak et al., 2002). The photographs show the expression of hmx3 at 25 hpf; arrowheads mark the posterior boundary of expression. (C,D) Disruption of the otic ML axis in the mouse Raldh2-/- mutant (dorsal views). Expression of a medial marker ( Pax2;light blue) is lost, while expression of a lateral marker ( Hmx3; purple) is expanded throughout the otic epithelium (adapted from data in Niederreither et al ., 2000). (E,F) Disruption of the otic DV axis in the mouse Shh -/- mutant (transverse sections). Expression of the dorsal marker Dlx5 (purple) extends ventrally, while expression of the ventral marker Otx2 (light blue) is lost (adapted from data in Riccomagno et al., 2002). All drawings are schematic diagrams, not to scale; they show only a subset of the genes affected in each case. Доказательства, полученные на рыбках подтверждают роль ромбомеров в формировании отического AP паттерна: в частности, было предположено, что r4 является источником сигналов, которые действуют anteriorise ухо. У гомозиготных
valentino (val/mafb) мутантных эмбрионов границы ромбомеров, теряемые позади r3/4 и r5 и r6 территорий замещаются неразделенным ромбомером, rX, с некоторыми характеристиками r4;соотв., домены экспрессии передних отических маркеров (pax5, hmx3 ) расширяются кзади по соседству с rX, тогда как экспрессия заднего маркера zp23 теряется (Kwak et al., 2002) (Fig. 3A, B). Сходная anteriorisation уха наблюдается у гомозиготных
tcf2 (vhnf1) мутантов рыбок данио, которые также имеют нарушение формирования паттерна ромбомеров и отсутствие экспрессии
val/mafb в заднем мозге (Hernandez et al., 2004; Lecaudey et
al ., 2007). У
tcf2 мутантных эмбрионов домены экспрессии передних отических маркеров (fgf8, pax5, hmx3) расширяются кзади или удваиваются в задней части отического пузырька, тогда как экспрессия
fst (follistatin), заднего отического маркера, часто отсутствует (Lecaudey et al., 2007). Отметим, что
tcf2 и val/mafb мутантные фенотипы, хотя и сходны, но не идентичны: дупликации (скорее, чем экспансии) передних маркеров не были описаны у
val/mafb мутантов и имеются также некоторые отличия в DV дефектах уха между двумя этими мутантами.
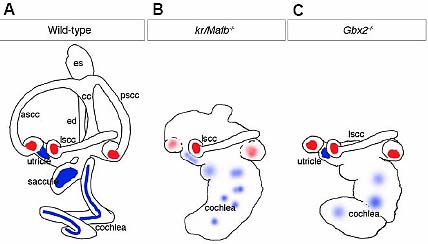 Fig. 4. Similarity of axial patterning defects between kr/Mafb-/- and Gbx2-/- mutant phenotypes in the mouse. (A) Wild-type mouse inner ear at E16. (B,C) Ear phenotypes in kr/Mafb -/- mutants (E15.5, Type II) (B) and Gbx2-/- mutants (E15.5, Type III) (C). Both mutants show a similar wide spectrum of defects; examples of relatively strong phenotypes are shown for each. The anterior and posterior semicircular canals, crus commune and endolymphatic duct are missing, and the cochlea is grossly distended (adapted from data in Lin et al ., 2005 and Choo et al ., 2006). Blue shading indicates maculae; red indicates cristae. Light shading indicates poorly differentiated sensory organs. The similarity of the two phenotypes, together with expression data ( Gbx2 expression is lost in the ears of kr/Mafb-/- mutants), strongly suggest that Gbx2 acts downstream of a kr/Mafb-dependent hindbrain signal. Abbreviations: ascc, lscc, pscc, anterior, lateral (horizontal) and posterior semicircular canals; cc, crus commune; ed, es, endolymphatic duct and sac.
Fig. 4. Similarity of axial patterning defects between kr/Mafb-/- and Gbx2-/- mutant phenotypes in the mouse. (A) Wild-type mouse inner ear at E16. (B,C) Ear phenotypes in kr/Mafb -/- mutants (E15.5, Type II) (B) and Gbx2-/- mutants (E15.5, Type III) (C). Both mutants show a similar wide spectrum of defects; examples of relatively strong phenotypes are shown for each. The anterior and posterior semicircular canals, crus commune and endolymphatic duct are missing, and the cochlea is grossly distended (adapted from data in Lin et al ., 2005 and Choo et al ., 2006). Blue shading indicates maculae; red indicates cristae. Light shading indicates poorly differentiated sensory organs. The similarity of the two phenotypes, together with expression data ( Gbx2 expression is lost in the ears of kr/Mafb-/- mutants), strongly suggest that Gbx2 acts downstream of a kr/Mafb-dependent hindbrain signal. Abbreviations: ascc, lscc, pscc, anterior, lateral (horizontal) and posterior semicircular canals; cc, crus commune; ed, es, endolymphatic duct and sac.
Т.к. очевидно, что некоторые эффекты
tcf2 мутации обусловлены потерей экспрессии
val/mafb, но некоторые аспекты, по-видимому, независимы. И
val/mafb и tcf2 (vhnf1) кодируют транскрипционные факторы, экспрессируемые в r5 и r6 заднего мозга и, следовательно, их влияние на ухо скорее всего косвенное, посредством транскрипционной регуляции одного или нескольких диффундирующих факторов. У
val/mafb мутантов эффекты могут быть обусловлены частично экспансией экспрессии
fgf3 в заднем мозге: обычно ограниченная r4, теперь она расширяется кзади от r3/4 границы и практически на всю длину соседней плакоды. Соотв. истощение передачи сигналов Fgf3 с помощью антисмысловых morpholino супрессирует
val/mafb ушной фенотип, редуцируя экспрессию
pax5 и hmx3 и приводя к экспансии экспрессии zp23 в передние регионы уха (Kwak et al., 2002). У
tcf2 мутантов экспансия кзади экспрессии
fgf3 в заднем мозге более драматична, чем у
val/mafb мутантов (Hernandez et al ., 2004) и поэтому могут быть приложимы сходные механизмы.
Хотя эти результаты предполагают, что r4-производный Fgf3 достаточен для приобретения передних характеристик в ухе рыбок данио, но имеется возражение: fgf3 экспрессируется также в передней части отического пузырька (Walshe and Mason, 2003), a нокдаун производного уха Fgf3 может вносить вклад в morpholino-обеспечиваемую супрессию дефектов у мутантов val/mafb. Кроме того, участвуют др. факторы: паттерны экспрессии wnt1 и wnt3a в дорсальной части заднего мозга также нарушены у tcf2 мутантов (Lecaudey et al., 2007), а экспрессия wnt1 нарушена по-разному в задних ромбомерах у val/mafb мутантов (Riley et al., 2004). Хотя не было ещё протестировано непосредственно, но возможно. что редукция экспрессии wnt вносит вклад в отический фенотип обоих мутантов; заметим, что продуцируемые задним мозгом Wnts, как известно, необходимы для формирования отического DV паттерна у мышей.
Было бы интересно проверить формирование отического AP паттерна на др. мутантах рыбок данио, фон которых нарушает гены, необходимы для установления экспрессии val/mafb или tcf2, таких как spg/pou2 мутанты (Burgess et al., 2002; Hauptmann et al., 2002) или вследствие обработки, чтобы разрушить путь передачи сигналов RA (Hernandez et al., 2004; Maves and Kimmel, 2005). Мутации в ряде др. генов также нарушают ромбомеры или границы между ними в задней части заднего мозга рыбок данио, включая членов семейств Hox, Irx, Meis и Pbx (Moens and Prince, 2002; Lecaudey et al., 2004), и очень возможно, что также будут оказывать соотв. эффекты на формирование отического паттерна.
У амниот роль ромбомеров в формировании отического AP паттерна менее ясна. Хотя ротации отической плакоды у эмбрионов кур подтверждают, что внешние факторы влияют на AP спецификацию, ротация самого заднего мозга указывает на то, что эта ткань менее важна у данного вида, чем у рыбок данио: реверсия оси AP r4-7 в заднем мозге эмбрионов кур на ст. E1.5 не влияет на формирование отического AP паттерна (Bok et al., 2005). Тем не менее нельзя исключить роли заднего мозга в формировании отического AP паттерна до ст. E1.5; некоторые гены семейства
Hmx , напр., уже экспрессируются в AP ограниченных отических доменов в это время (see Table 1). Возникают также различия в механизме передачи сигналов из заднего мозга в ухо между рыбками данио и мышами. Исследованы некоторые мутанты мышей, у которых паттерн ромбомеров заднего мозга нарушен, но не формирование AP паттерна в отическом пузырьке, включая
Egr2 (Krox20)-/- мутантов и
RARa-/-; RARb-/- двойных мутантов (see discussion in Brigande et al. , 2000a). Кроме того, т.к. транскрипционные взаимоотношения между Tcf2/vHNF1 и kr/Mafb (мышиные ортологи tcf2 и val/mafb, соотв.) в r5 и r6 заднего мозга законсервированы (Kim et al., 2005), то мутации в kr/Mafb приводят к редукции скорее, чем к экспансии, наблюдаемой у рыбок данио, экспрессии
Fgf3 в заднем мозге. В согласии с этим
Fgf3-/- мутантные мыши обладают сходными дефектами уха с теми. что у мутантов
kr/Mafb (Mansour et al., 1993; McKay et al., 1996). В отличие от
val/mafb фенотипа дефекты ушей у
kr/Mafb и Fgf3-/-мутантов прежде всего затрагивают DV ось скорее, чем AP ось уха.
Role of the midline in otic AP patterning
Важно исчерпывающее понимание того, как локальные источники индуктивных факторов из специфических ромбомеров заднего мозга могут повлиять на отический AP паттерн. Менее очевидно, почему ткани срединной линии (хорда и донная пластинка), которые не имеют явного формирования AP паттерна в области самого уха и, по-видимому, равно удаленные от всей отической AP оси, д. оказывать дифференциальные эффекты на A и P полюса отического пузырька. Несмотря на это данные нашей лаборатории указывают, что передача сигналов Hedgehog (Hh) из хорды и вентральной пластинки играют роль в развитии задних отических структур у рыбок данио (Hammond et al ., 2003). Гены Hh строго экспрессируются как в вентральной пластинке, так и хорде эмбрионов рыбок данио, тогда как гены, чьи продукты необходимы для передачи сигналов Hh (ptc, smo и gli), экспрессируются в отическом эпителии. Более того, ptc1 - мишень для сигналов Hh - экспрессируется Hh-зависимым образом в ухе, указывая тем самым, что эффект Hh на ухо является прямым. Когда передача сигналов Hh отсутствует или тяжело редуцирована, то задние отические структуры неспособны формироваться и ухо обнаруживает зеркальные удвоения передних регионов, подобно enantiomorphic ушам. обнаруженным Harrison (Fig. 2). Недавно очень сходные находки были сделаны на Xenopus, которым инъецировали мРНК, кодирующую Hh ингибитор Hip, что приводило к зеркальным удвоениям передних структур внутреннего уха (Waldman et al., 2007). Когда Hh активируется эктопически у рыбок данио с помощью инъекций shh или доминантно негативной PKA РНК, то обнаруживался противоположный фенотип: уши теряли передние отические структуры и обнаруживали зеркальные удвоения задних регионов (Hammond et al., 2003) (Fig. 2).
Все эти данные демонстрируют, что передача сигналов Hh необходима и достаточна для приобретения задних отических характеристик у рыбок данио и Xenopus. У рыбок данио ближайшим источником Hh для формирования паттерна уха является срединная линия и вовлекаются два ортолога Shh млекопитающих, shha и shhb (ранее twhh) (Hammond et al., 2003). У Xenopus источник передачи сигналов Hh не подтвержден, но ген Bhh экспрессируется в самом ухе (Ekker et al ., 1995). В ушах мышей, любые AP эффекты от нарушения передачи сигналов Hh значительно менее очевидны, чем у рыб. Вместо этого. потеря передачи сигналов Hh в первую очередь затрагивает формирование DV паттерна.
Отметим, что хотя и имеется некоторое сходство, но нарушение формирования AP паттерна, когда отсутствует передача сигналов Hh у рыбок данио совершенно отлично от того, что наблюдается у tcf2 или val/mafb мутантов: несмотря на удвоение сенсорных участков на более поздних стадиях, мы не наблюдали удвоений или расширения экспрессии передних маркеров fgf8 и pax5 в раннем отическом пузырьке. Это может указывать на то, что поддержание скорее, чем инициация формирования AP паттерна нарушается. когда теряется предача сигналов Hh. Существуют и др. различия: уши у мутантов пути Hh часто имеют дополнительный, эктопический гребешок (crista) (Hammond et al., 2003), в то время как у tcf2 мутантов, cristae редуцированы (Lecaudey et al., 2007). Кроме того, некоторые маркеры формирования DV паттерна остаются незатронутыми, когда отсутствует передача сигналов Hh у рыбок данио, в то время как мутация tcf2 нарушает и AP и DV отические оси (Lecaudey et al., 2007).
Роль передачи сигналов Hh из срединной линии для формирования отического AP паттерна представляет парадокс: как может линейный источник Hh влиять на A и P полюса пузырька по-разному? Позиция отического пузырька д. дать объяснение: хотя отическая плакода расположена параллельно срединной линии на ст. 24 hpf, задний полюс отического пузырька является ближайшим к источнику Hh срединной линии, чем передний (unpublished data). Соответственно, ptc1 становится ограниченным задними отическими регионами.
Однако, неясно может ли это соответствовать времени, когда необходим Hh для формирования отического паттерна. Альтернативные объяснения (ещё не были тестированы) включают возможность, что клетки, специфицированные с помощью передачи сигналов Hh мигрируют в задние регионы отического пузырька по мере развития уха.
Возможно также, что Hh противодействует или способствует действию др. более локальных факторов детерминации AP, таких как Fgf3 из r4, чтобы поддерживать отический AP паттерн (Fig. 6A).
Intrinsic factors for interpretation of AP patterning information
Итак, изменения в передаче внешних сигналов нарушают формирование паттерна отического пузырька, как показывают изменения морфологического паттерна и генной экспрессии в отическом эпителии. Если эти последние гены являются не более чем маркерами позиций в отическом пузырьке, но играют активную роль в интерпретации внешних сигналов, то следует ожидать, что их потеря будет оказывать сходные эффекты на формирование AP паттерна в ухе. Вызывают ли мутации или нокдауны внутренне присущих генов фенокопии всех или субнабора дефектов, обнаруживаемых при нарушениях внешних факторов, мы можем предположить, что такие гены скорее всего участвуют в рецепции и интерпретации этого сигнала.
Сегодня имеется довольно мало примеров, когда потеря функции генов, внутренне присущих отическому эпителию, вызывают дефекты формирования AP паттерна и ни один не известен, который бы в точности фенокопировал дефекты, наблюдаемые у мутантов заднего мозга рыбок данио или у мутантов срединной линии. У рыбок данио, напр., редукция экспрессии или функции pax5 (переднего маркера, расширяющегося в anteriorised ушах мутантов
val/mafb и tcf2) приводит к потере некоторых передних (utricular) волосковых клеток, но не к нарушению общего формирования AP паттерна (Kwak et al ., 2006). Это указывает на то, что Pax5 играет роль в
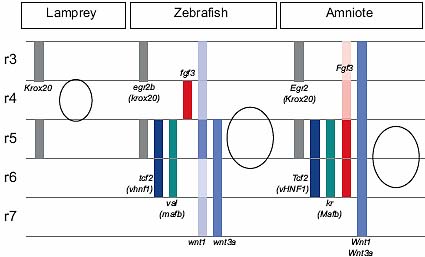 Fig. 5. Position of the otic vesicle with respect to hindbrain rhombomeres in different species. Schematic diagram to show the position of the otic vesicle with respect to rhombomere boundaries and gene expression patterns in lamprey, zebrafish and amniote (chick and mouse) embryos. Bands mark the position of expression of genes. Egr2/Krox20 marks the conserved position of r3 and r5 in each organism. Expression domains of tcf2/vhnf1 and kr/val/mafb are conserved in zebrafish and amniotes, while expression of wnt1, wnt3a and fgf3 differs. Expression data for these genes are not available for the lamprey. Adapted from data in references cited in the text.
Fig. 5. Position of the otic vesicle with respect to hindbrain rhombomeres in different species. Schematic diagram to show the position of the otic vesicle with respect to rhombomere boundaries and gene expression patterns in lamprey, zebrafish and amniote (chick and mouse) embryos. Bands mark the position of expression of genes. Egr2/Krox20 marks the conserved position of r3 and r5 in each organism. Expression domains of tcf2/vhnf1 and kr/val/mafb are conserved in zebrafish and amniotes, while expression of wnt1, wnt3a and fgf3 differs. Expression data for these genes are not available for the lamprey. Adapted from data in references cited in the text.
переднем развитии уха и особенно в продукции или жизнеспособности волосковых клеток в передней macula.
У мышей Tbx1 считается детерминантом формирования AP паттерна внутри отического пузырька (Raft et al., 2004), но неясно какие внутренние сигналы регулируют его экспрессию в отическом эпителии; его экспрессия не зависит от передачи сигналов Hh, напр. (Riccomagno et al., 2002). У
Tbx1-/- эмбрионов мышей экспрессия тех же самых передних отических маркеров (Ngn1, NeuroD, Lfng, Fgf3 ) расширяется кзади, экспрессия Otx1 (posteroventrolateral маркера) теряется, а рудимент VIIIth ганглия, который обычно оккупирует anteromedial позицию на нижней стороне отического пузырька, удваивается в задней части (Raft et al., 2004; Arnold et al., 2006). Альтернативная интерпретация, однако, предложена Xu et al. (2007), которые полагают, что дефекты формирования осевого паттерна обусловлены потерями ткани скорее, чем настоящей anteriorisation отоциста. Хотя он и экспрессируется и в отическом эпителии и окружающих тканях, но
Tbx1 определенно квалифицируется как внутренне присущий фактор для формирования отического паттерна: потребность в Tbx1 функции в отическом эпителии была продемонстрирована с использованием ткане-специфических подходов по условному нокауту (Arnold et al., 2006; Xu et al., 2007).
An AP organiser for the otic vesicle?
Существование фенотипов, с участием удвоений отической АР оси и присутствие локальных источников диффундирующих сигнальных молекул - как вблизи уха, так и внутри отического эпителия - напоминает др. системы органов, паттерн которых организуется с помощью организатора, было предположено, что организатор может также существовать для формирования паттерна AP оси в ухе (Leger and Brand, 2002). Хотя организатор для отической AP оси не был окончательно идентифицирован, но это идея заслуживает доверия. Классически организатор определятся операционно; он часто является источником морфогена, который устанавливает паттерн зависимым от концентрации способом. Для уха такой источник информации по формированию паттерна может быть или вне отической области (напр., r4 или границы ромбомеров) или может быть внутри самого отического эпителия, такой как домен экспрессии
fgf3 и fgf8 на передней или
fst на задней части отического пузырька рыбок данио. Hh безусловно действует как морфоген в др. системах, в которых встречаются фенотипы зеркального удвоения (Hammond et al., 2003), но для уха так как нет очевидного локального источника Hh или четкого локализованного ответа на его активность, то остается неясным,
обладает ли Hh организующей способностью и вообще необходим ли для установления или поддержания такого организатора. Дальнейшие эксперименты необходимы для идентификации любой ткани в ухе, которая может обладать организующими свойствами и для определения какие сигналы являются инструктивными и какие пермиссивными для установления отического АР паттерна.
Dorsoventral and mediolateral patterning
Role of the hindbrain in DV/ML patterning
Ромбомеры заднего мозга обладают определенными отличиями в генной экспрессии вдоль DV оси и поэтому помимо их роли в формировании отического АР паттерна, они могут также передавать сигналы, управляющие DV паттерном в соседних отической плакоде или пузырьке. Harrison предоставил ранние доказательства, что задний мозг необходим для приобретения дорсальных отических характеристик. В частности, трансплантации второго заднего мозга, вентральнее отических плакод у эмбрионов амфибий, индуцировали образование второго эндолимфатического протока (ED) - обычно дорсомедиальной структуры - из вентральной части уха (Harrison, 1945). У эмбрионов кур удаление или DV ротация r4-r7 нервной трубки показали, что сигналы от дорсальной части нервной трубки необходимы и достаточны для приобретения дорсальных отических характеристик у этого вида (Bok et al., 2005).
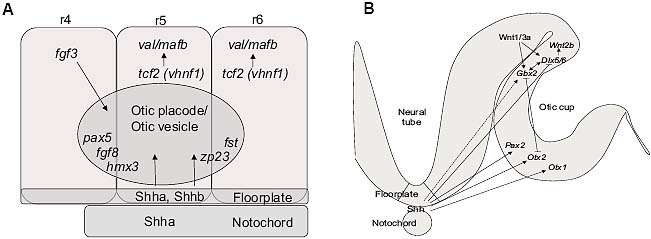 Fig. 6. Summary diagrams of axial patterning in the otic placode, cup and vesicle. (A) Schematic diagram of patterning influences for the zebrafish otic AP axis (not to scale). Fgf3 from r4 and Shh from the midline provide anterior and posterior signals, respectively. Contribution from Wnt genes is likely (see text and Fig. 5). Expression of fgf3 is excluded from r5 and r6 by the activity of tcf2/vhnf1 and val/mafb. A selection of genes expressed at the anterior ( hmx3, pax5, fgf8) and posterior ( fst, zp23) of the otic vesicle is indicated. (B) Schematic diagram of patterning influences for the DV and ML axes of an amniote otic cup (a combination of chick and mouse data). Shh from the midline and Wnts from the d orsal hindbrain provide ventral and dorsal signals, respectively. A selection of genes expressed in ventral ( Otx1, Otx2), medial ( Pax2) and dorsal ( Gbx2, Dlx5/6, Wnt2b) regions of the otic cup and vesicle is indicated. Arrows do not necessarily imply a direct interaction. The dotted line indic ates a role in maintenance, rather than establishment, of expression. Adapted from data in references cited in the text.
Fig. 6. Summary diagrams of axial patterning in the otic placode, cup and vesicle. (A) Schematic diagram of patterning influences for the zebrafish otic AP axis (not to scale). Fgf3 from r4 and Shh from the midline provide anterior and posterior signals, respectively. Contribution from Wnt genes is likely (see text and Fig. 5). Expression of fgf3 is excluded from r5 and r6 by the activity of tcf2/vhnf1 and val/mafb. A selection of genes expressed at the anterior ( hmx3, pax5, fgf8) and posterior ( fst, zp23) of the otic vesicle is indicated. (B) Schematic diagram of patterning influences for the DV and ML axes of an amniote otic cup (a combination of chick and mouse data). Shh from the midline and Wnts from the d orsal hindbrain provide ventral and dorsal signals, respectively. A selection of genes expressed in ventral ( Otx1, Otx2), medial ( Pax2) and dorsal ( Gbx2, Dlx5/6, Wnt2b) regions of the otic cup and vesicle is indicated. Arrows do not necessarily imply a direct interaction. The dotted line indic ates a role in maintenance, rather than establishment, of expression. Adapted from data in references cited in the text. Мутантные фенотипы у мышей также демонстрируют важность передачи сигналов из заднего мозга для формирования DV и ML паттерна в ухе. У мышей, гомозиготных по мутациям kr/Mafb (ортологу val/mafb рыбок данио ), спецификация r5 и r6 в заднем мозге отсутствует и дорсальные отические структуры не образуются (Deol,1964). Детальный анализ kr/Mafb эмбрионов выявил небольшие, кистозные, плохо дифференцированные ушные ткани: ED не образуется, передний и задний полукружные каналы и cristae часто отсутствуют, а улитка разрыхлена (Deol, 1964; Choo et al., 2006) (Fig. 4). Экспрессия дорсальных маркеров Gbx2, Dlx5 и Wnt2b теряется отическим пузырьком, тогда как экспрессия вентрального маркера Otx2 увеличивается, что может объяснить дефекты улитки (Choo et al., 2006). Задний мозг, следовательно, необходим те только для индукции дорсальных отических характеристик, но и также для репрессии вентральных отических характеристик. Сходным образом, дефекты заднего мозга и уха обнаруживаются у мутантных эмбрионов по Hoxa1 (Lufkin et al., 1991; Mark et al ., 1993). Отметим, что и kr/Mafb и Hoxa1 экспрессируются в заднем мозге, но не в самом отическом пузырьке; они т.о., скорее всего влияют на отический паттерн посредством регуляции экспрессии секретируемых сигнальных молекул.
Драматические альтерации ML паттерна обнаруживаются у мутантных Raldh2-/- мышей, у которых сегментация заднего мозга также тяжело нарушена. Здесь происходит полная lateralisation отического пузырька: экспрессия медиального маркера Pax2 теряется, хотя латеральный маркер Hmx3 экспрессируется по всему пузырьку (Niederreither et al ., 2000) (Fig. 3C, D). Отический пузырек очень маленький у мутантов, однако, вполне возможно, что медиальная ткань скорее отсутствует, чем адоптирует латеральные характеристики. Как и в случаях с kr/Mafb и Hoxa1, дефекты формирования отического паттерна скорее всего обусловлены потерей сигнала от заднего мозга, т.к. они присутствуют на стадии, когда Raldh2 экспрессируется в заднем мозге, но не в ухе. Для всех трех мутантов фактор, вносящий вклад в отический фенотип, также может иметь аномальную позицию в ухе по отношению к заднему мозгу: две ткани больше не находятся в тесном соприкосновении и поэтому ухо может просто оказаться слишком далеко от источника в заднем мозге, чтобы получить правильный сигнал (Deol, 1964; Lufkin et al ., 1991; Mark et al ., 1993; Brigande et al ., 2000b; Niederreither et al., 2000; Choo et al., 2006).
Сигнальные молекулы, происходящие из заднего мозга и участвующие в формировании паттерна DV и ML осей уха амниот, принадлежат к тем же самым семействам, что те, которые играют роль в формировании АР паттерна у рыб: Fgfs и Wnts. У мутантных мышей kr/Mafb в заднем мозге r5 и r6 замещены неразделенным ромбомером r4-подобными характеристиками и редуцированной экспрессией Fgf3 (McKay et al., 1996; Choo et al., 2006).Т.к. ушной фенотип Fgf3-/- эмбрионов напоминает тот, что у kr/Mafb мутантов (Mansour et al., 1993), дефекты уха, наблюдаемые у kr/Mafb как полагают частично обусловлены редукцией передачи сигналов Fgf3из заднего мозга (McKay et al., 1996). Ушной Fgf3-/- фенотип, однако, менее тяжелый, чем тот, что у kr/Mafb, это указывает на то, что могут участвовать дополнительные факторы. Сходным образом ушной фенотип Fgf10-/- очень легкий (Mansour et al., 1993). Заметим, однако, что Fgfs играют также роль в отической индукции; т.к. двойные мутантные Fgf3-/-; Fgf10-/- фенотипы обнаруживают существенную потерю отической ткани (Alvarez et al ., 2003; Wright and Mansour, 2003), то трудно отличить раннюю роль Fgfs в отической индукции от боле поздней (или сопутствующей) роли в формировании осевого паттерна.
У мышей передача сигналов Wnt от дорсальной части заднего мозга, по-видимому, является критическим фактором в установлении отического DV паттерна, действующим частично для ограничения ventralising эффектов передачи сигналов Shh от срединной линии (Riccomagno et al., 2005). Wnt сигналы (Wnt1 и Wnt3a), исходящие от дорсальной части заднего мозга действуют локально на дорсальную часть отического эпителия, но как полагают, оказывают влияние на всю DV ось уха, т.к. чувствительные к Wn клетки в дорсальной части отического пузырька вносят вклад в улитку, а также в дорсальные производные. Дополнительный фактор из дорсальной части заднего мозга также участвует в ограничении эффектов передачи сигналов Shh, исходящих от срединной линии: устранение дорсальной части заднего мозга приводит к экспансии чувствительных к Shh маркеров (
Pax2, Ngn1), которые оказываются не затронутыми у двойных мутантов
Wnt1-/-;Wnt3a-/- и эта экспансия не полностью устраняется за счет конституитивной активации Wnt пути (Riccomagno et al., 2005). У мутантов
tcf2 рыбок данио дефекты DV в формировании отического паттерна сходные с теми, что вдоль AP оси, также могут быть приписаны нарушению паттерна экспрессии
wnt1 и wnt3a в дорсальной части заднего мозга (Lecaudey et al ., 2007), хотя функциональное тестирование не проводилось.
Role of the midline in DV/ML patterning
Ткани эмбриональной срединной линии ( хорда и вентральная пластинка) идеально расположены, чтобы предоставлять сигналы, чтобы обеспечивать вентральный и медиальный паттерн отического пузырька. Устранение хорды или донной пластинки только, однако, не оказывает эффекта на формирование паттерна уха; присутствие любого из них достаточно для корректного формирования паттерна уха у эмбрионов кур (Bok et al ., 2005). Устранение и хорды и донной пластинки у эмбрионов кур по соседству с отическим пузырьком на ст. HH10-11 (E1.5, ст. placode/early otic cup), однако, приводит к потере вентральных отических производных (saccule и basilar papilla), демонстрируя, что вентральная часть срединной линии является критической для приобретения вентральных отических характеристик у этого организма. Сходным образом ротация нервной трубки и хорды на ст. E1.5 у эмбрионов кур, так что DV ось поворачивается относительно отического пузырька, ведет к приобретению вентральных характеристик дорсальными регионами. Anteroventral маркеры, включая Lfng, Six1 и NeuroD, начинают экспрессироваться anterodorsally, по соседству с ротированными хордой и донной пластинкой; вентральный маркер (Otx2) расширяется дорсально, а экспрессия дорсального маркера Gbx2 теряется. Удаление всего заднего мозга вместе с хордой из области r4-7 у эмбрионов кур приводит к развитию сильно дисморфичного отического пузырька, по-видимому, лишенного всех вентральных и дорсальных характеристик (Bok et al., 2005). Всё это указывает на то, что факторы, испускаемые из вентральной части срединной линии, кооперируют с теми, которые испускаются дорсальной частью заднего мозга и оба необходимы и достаточны для индукции вентральных и дорсальных характеристик, соотв.
Важным источником экспрессии Hh в вентральной части срединной линии, соседствующей с вентральным и медиальным регионами отческого пузырька, делающим Hh идеальным кандидатом для передачи информации по формированию ventromedial паттерна отическому пузырьку. Хотя у рыбок данио потеря передачи сигналов Hh, по-видимому, не вызывает явного воздействия на формирование DV паттерна (Hammond et al ., 2003), у амниот потеря передачи сигналов Hh приводит к драматическим DV дефектам (Liu et al., 2002; Riccomagno et al., 2002; Bok et al., 2005). Анализ Shh-/- эмбрионов мышей показал, что Hh из донной пластинки и хорды необходим для спецификации вентральных отических регионов: улитка, VIIIth ганглий и латеральный полукружный канал отсутствуют или редуцированы (Liu et al., 2002; Riccomagno et al., 2002). В согласии с потерей вентральных отических областей, отсутствует и экспрессия Otx2, Dlx5 (дорсальная) экспрессия расширяется вентрально, и Otx1, Fgf3, Lfng и Bmp4 домены сдвигается вентрально (Fig. 3E, F). Формирование дорсального и медиального паттерна также нарушается:Pax2 теряется из медиальных частей стенки отоциста на ст. E9.5, а Gbx2, который необходим для развития ED, подавляется, это коррелирует с неспособностью поддерживать рост ED. Эти находки подтверждаются работами на эмбрионах кур, где антителами, обусловленное ингибирование передачи сигналов Shh приводит к дефектам вентральных частей уха (Bok et al., 2005). Всё это подтверждает роль производного срединной линии Shh в формировании паттерна как DV, так и ML осей в ухе амниот.
Интерсно, что дорсальные вестибулярные дефекты у мутантов Shh-/- полностью устраняются с помощью мутации одной копии гена Gli3. В отсутствие активности Hh, Gli3 вызывает транскрипционный репрессор (Gli3R) на мишени для сигналов Hh. Авт. полагают, что дорсальная вестибулярная часть уха чувствительна к точной дозе активности Gli3R, т.к. вентральные структуры нуждаются в высокой активности Gli активирующих белков (Bok et al., 2007).
У мышей Shh не только необходим, но и достаточен для ventromedial отической спецификации. Трансгенные эмбрионы, у которых Shh эктопически экспрессируется во всем отическом пузырьке, обнаруживают экспансию вентральных и медиальных маркеров (VIIIth ганглион,
Pax2) и редукцию дорсальных (
Dlx5) и латеральных (
Hmx3) маркеров. Кохлеарный водопровод увеличивается, но не развивается корректно (Riccomagno et al ., 2002). Точно также передача сигналов из дорсальных частей заднего мозга действует, супрессируя вентрализующие эффекты Shh, чтобы установить дорсальные судьбы в ухе, найдены и реципрокные взаимоотношения: Shh действует, чтобы ограничить эффекты передачи сигналов Wnt в дорсальную часть отического пузырька (Riccomagno et al., 2005). У рыбок данио потеря передачи сигналов Hh, по-видимому, не вызывает серьезных дефектов формирования DV/ML паттерна, наши предварительные наблюдения подтверждают, что как и у амниот передача сигналов Hh д. удерживаться репрессированной для корректного приобретения дорсальных и латеральных судеб в ухе (KLH and TTW, unpublished data).
Intrinsic factors for interpretation of DV/ML patterning
Компоненты рецепции и трансдукции сигналов Fgf, Wnt и
Hh все экспрессируются в ухе. Fgfr2(III)b экспрессируется в dorsomedial части отического пузырька, соприкасающейся с задним мозгом и является рецептором как для продуцируемого задним мозгом, так и отическим пузырьком Fgf3 и Fgf10. Отический фенотип Fgfr2(III)b-/- мутантов по рецептору (Pirvola et al., 2000) напоминает таковой у kr/Mafb-/- эмбрионов и значительно более тяжелый по сравнению с высоко изменчивым фенотипом у Fgf3-/- (Mansour et al., 1993), указывая тем самым, что kr/Mafb может регулироваться более чем одним Fgf, или дополнительными факторами заднего мозга. Передача сигналов Wnt активно воспринимается в dorsomedial отической ткани, как показывает активация Wnt-чувствительного репортера Topgal (Riccomagno et
al ., 2005). Транскрипты семейств Ptc, Smo и Gli, кодирующих для Hh рецептор, трансдуцер и эффектор, соотв., экспрессируются в отическом эпителии и периотической мезенхиме как у рыбок данио, так и амниот (Riccomagno et al., 2002; Hammond et al., 2003; Ozaki et al., 2004; Bok et al., 2007). Более того, у мышей условная инактивация Smo в отическом пузырьке дает вентральные отические дефекты, демонстрируя тем самым, что вентральный отический эпителий непосредственно отвечает на передачу сигналов Shh (Brown et al., 2007).
У амниот имеются хорошие доказательства. показывающие, что мутации некоторых из генов, чьи паттерны отической экспрессии затрагиваются в ответ на нарушения в заднем мозге или передачу сигналов от срединной линии, приводят к дефектам формирования DV паттерна уха. Эти гены - которые включают Dlx, Gbx, Hmx, Otx и Six семейства - могут т.о. играть роль в интерпретации внешних сигналов. У Dlx5-/-;Dlx6-/- двойных мутантов, экспрессия Gbx2 в дорсальных регионах развивающегося уха теряется, экспрессия Pax2 расширяется на весь отический пузырек. В результате, все дорсальные (vestibular)структуры, включая эндолимфатический проток, utricle, saccule и полукружные каналы, не способны формироваться (Robledo and Lufkin, 2006). Сходный фенотип обнаруживается у двойных мутантов Hmx2-/-;Hmx3-/- (Wang et al., 2004); потеря только функции Dlx5, Hmx2 или Hmx3 также приводит к существенным дорсальным (vestibular) дефектам (Wang et al., 1998; Wang et al., 2001; Merlo et al., 2002). Они могут быть ключевыми генами по интерпретации сигналов от дорсальной части заднего мозга. Обобщение формирования DV паттерна у эмбрионов амниот см. Fig. 6B.
Отический фенотип Gbx2-/- мутантов очень сходен с тем, который обнаруживатеся у kr/Mafb мутантов, предоставляя неотразимые доказательства того, что Gbx2 является ключевым геном для интерпретации передаваемых их заднего мозга сигналов, зависимых от функции kr/Mafb (Lin et al., 2005; Choo et al ., 2006) (Fig. 4). У обоих мутантов имеется сходный спектр варьирующих фенотипов с пороками развития наиболее медиальных структур (ED, crus commune, передний и задний полукружные каналы и saccule), в то время как латеральный полукружный канал формируется нормально. Кроме того, вентральные отические производные - улитка и спиральный ганглий - неправильно формируются у обоих мутантов, даже когда Gbx2 не экспрессируется в вентральных отических доменах. Это может быть обусловлено, по крайней мере, частично взаимными репрессивными взаимодействиями между Gbx2 и Otx2 (Lin et al., 2005; Choo et al., 2006; Miyazaki et al., 2006). Gbx2 необходим для Wnt2b и медиальной экспрессии Dlx5/6, которая также теряется у мутантов kr/Mafb (Lin et al., 2005; Choo et al., 2006).
Otx гены экспрессируются в вентральной части отического эпителия и играют важную роль в развитии латерального (горизонтального) полукружного канала и вентральных отических производных. Потеря функции Otx1 как у мышей, так и рыб приводит к потере латерального полукружного канала и неполному расхождению пятен маточки и мешочка (utricular и saccular maculae) (Morsli et al., 1999; Fritzsch et al., 2001; Hammond and Whitfield, 2006). Otx2-/- мыши развиваются без головы, что делает невозможной проверку ушей у этих эмбрионов; однако, Otx1-/-;Otx2+/- мыши имеют более тяжелые дефекты улитки и мешочка (saccule), чем Otx1-/- мыши, указывая тем самым на важность Otx2 для развития этих структур (Morsli et al., 1999). Т.к. экспрессия Otx2 отсутствует в отических пузырьках мутантов Shh-/- (see above), то он может быть ключевым геном по интерпретации сигналов Shh от срединной линии мышей.
Было подчеркнуто сходство между
Shh-/- мутантным отическим фенотипом и таковым у мышей
Six1-/-, у которых наблюдается потеря вентральных маркеров и экспансия дорсальных маркеров, включая драматическое увеличение домена экспрессии
Wnt2b соответствующего эндолимфатическому протоку и мешочку (Zheng et al., 2003; Ozaki et al., 2004). Экспрессия
Six1 в отическом пузырьке, однако, не зависит от передачи сигналов Shh; скорее всего экспрессия чувствительных к Shh генов
Ptc и Gli1 в отическом пузырьке не нуждается в функции Six1 (Ozaki et al ., 2004). Поэтому вряд ли вентрализующая функция передачи сигналов Shh у мышей обеспечивается непосредственно с помощью Six1.
Conservation of otic axial patterning mechanisms
Многие маркеры формирования вентрального паттерна на ст. отического пузырька весьма законсервированы у рыбок данио и амниот (Table 1). Несмотря на это обнаруживается и неожиданность: сигналы. которые участвуют в формировании AP паттерна уха рыб (Fgfs, Wnts, Hh), по-видимому, вместо этого вносят вклад в формирование отического DV паттерна у эмбрионов амниот (see Fig. 6). Это может быть частично обусловлено просто различиями в анатомическом описании уха у двух групп. Всё ухо рыбок данио, которое не имеет улитки, соответствует тому, что обычно описывается как "dorsal" или вестибулярная область амниотического уха. У эмбрионов амниот водопровод улитки (cochlear duct) простирается вентрально и обычно рассматривается как вентральная структура; однако, водопровод улитки возникает из сайта, расположенного позади маточки, мешочка и места вычленения нейробластов, которые формируют cochleovestibular ганглий (Riccomagno et al., 2002). Сходным образом домен экспрессии Bmp4, который позднее маркирует basilar papilla в ухе эмбрионов кур, происходит из posteroventral региона на ст. HH24 (E4) отоциста (Oh et al., 1996) (Fig. 1D). Т.о., как и у рыбок данио saccule, улитка может рассматриваться как задняя структура, а также как вентральная, обнаруживая значительно больше сходства, чем отличий в формировании отического паттерна между рыбками данио и амниотами; отметим, что улитка, как полагают, развивается из мешочка (saccule) (Fritzsch et al., 2002).
Некоторые из мутантных фенотипов, однако, выявляют истинные аксиальные различия формирования паттерна уха у рыб и амниот, т.к. некоторые маркеры четко ведут себя по-разному на эквивалентных мутантных генетических фонах. Напр., у эмбрионов мышей Shh-/-, отическая экспрессия Pax2 подавляется, а домен экспрессии Bmp4 сдвигается вентрально, но эти гены не затрагиваются у эмбрионов рыбок данио, у которых теряется передача сигналов Hh (Riccomagno et al ., 2002; Hammond et al., 2003). Сравнение Mafb мутантов у мышей и рыб (kr и val, соотв.) выявляет различия в деталях экспрессии в заднем мозге Fgfs, и в последующих дефектах формирования отического паттерна. Кроме того, мало регион-специфических маркеров в отическом пузырьке экспрессируется дифференциально: pax5, напр., экспрессируется только у рыбок данио, но не в отическом пузырьке амниот, тогда как otx2, по-видимому, не экспрессируется в ушах рыб (Table 1).
Если информация из ромбомеров или границ между ромбомерами играет роль в формировании AP паттерна отического пузырька, то было бы интересно отметить. что существуют различия в позиционировании отического пузырька относительно эти х границ у разных видов позвоночных (Murakami et al ., 2004) (Fig. 5). У миног, бесчелюстных позвоночных, отические пузырьки возникают оппозитно r4; у рыбок данио первоначально также возникают напротив r4, но позднее позиционируются рядом с r5, тогда как у амниот ухо располагается даже еще более каудально, рядом с r5 и r6. Паттерны генной экспрессии в заднем мозге, однако, - за небольшим исключением, включая таковые для Fgfs - в основном законсервированы, так что отические пузырьки, оказываются рядом с разными молекулярными влияниями у разных видов. Было предположено, напр., что изменения в паттерне экспрессии Fgf3 в заднем мозге могут быть факторами, влияющими на эволюцию улитки (Kwak et al., 2002). Тем не менее несмотря на различия в позиционировании отического пузырька относительно ромбомеров, AP ограничение многих отических маркеров (напр.,
hmx3, tbx1) законсервированы у разных видов (Table 1), подтверждая находки, что у эмбрионов кур, по крайней мере, информация от заднего мозга не является критической для установления отического AP паттерна (see above).
Evolution of otic axial patterning
Уши взрослых бесчелюстных позвоночных (миксин и миног), по-видимому, в высшей степени симметричны вдоль AP оси и поэтому предполагается, что сложный ушной лабиринт у челюстных позвоночных развивается из более простой структуры с AP симметрией, имея одиночный сенсорный участок (Hagelin, 1974). Как следствие этой идеи было предположено, что мутантные фенотипы, с enantiomorphic удвоениями ушей могут быть атавизмами (Lеger and Brand, 2002). Недавно, однако, мы установили, что внутреннее ухо миног значительно более асимметрично во время эмбриональной стадии, чем у взрослых и что это напоминает развитие внутреннего уха у рыбок данио во многих аспектах. Морфологическая асимметрия по форме и расположению macula communis, также как и асимметрия паттернов полярности волосковых клеток, очевидны на поздних эмбриональных стадиях (stage 27-28). Молекулярные асимметрии, сходные с таковыми у рыбок данио, выявляются ещё раньше, в отическом пузырьке. В частности tbx1 и fst экспрессируются в отдельных задних доменах в отических пузырьках миног на ст. 24 и 25, как и у рыбок данио на ст. 24-30 hpf (Sauka-Spengler et al ., 2002; Hammond and Whitfield, 2006). Др. исследования рыбок данио показывают, что одиночное сенсорное пятно (macula) не обязательно указывает на AP симметрию: atoh1a1b морфанты, у которых сенсорный домен не подразделен, сохраняют определенную AP асимметрию (Millimaki et al., 2007), a otx1 морфанты, у которых пятно слито, также сохраняют AP асимметрию (Hammond and Whitfield, 2006).
Данные по миногам подтверждают, что отический пузырек с отчетливой AP
асимметрией всегда присутствует у общего предшественника миног и челюстных. Однако, нельзя исключить возможности. что общий родоначальник всех позвоночных действительно имел более простое AP симметричное внутреннее ухо. В частности, было бы интересно посмотреть, имеют ли эмбрионы миксин отические пузырьки, которые более AP симметричны, чем у миног, хотя неясно, можно ли их рассматривать как более родоначальным видом (Ota and Kuratani, 2006). Т.к. у морских глубоководных рыб практически ничего неизвестно о поведении нереста у миксин поэтому их эмбрионов почти невозможно получить; правда эмбрионы миксин недавно были получены в лаборатории (Ota et al., 2007; Ota and Kuratani, 2006).
Conclusions
Although several of the signalling components for the estab-
lishment of axial patterning in the otic vesicle have been identified
(summarised in Fig. 6), the details of their mechanism of action
are not simple and straightforward: synergy and antagonism
between different signalling pathways and cross-talk between
downstream effectors all contribute to the final pattern. The use of
the same signalling pathways—Fgfs, Wnts and Hh—for pattern-
ing of the zebrafish otic AP axis and the amniote otic DV axis in
part may simply reflect the different anatomical arrangement of
the ear, revealing similarities between the DV axis of amniotes
and the AP axis in the fish. It is clear that the axes are established
at very early stages of development: asymmetric gene expression
patterns are present in the otic placode as soon as it appears.
Although the AP poles of the placode are equipotential, there may
never be a symmetrical stage and so no requirement for a
symmetry-breaking event. Symmetric ear phenotypes are there-
fore unlikely to represent atavisms, just as chick limbs with
duplicated polarity do not mimic an ancestral condition. Areas that
require further attention include a study of how axial information—
as measured by asymmetric patterns of gene expression—is
coupled to early pathways of otic placode induction and to later
morphogenesis. This will require an understanding of how extrin-
sic signalling information is integrated in the developing otic placode and how regional patterning within the otic vesicle co-
ordinates changes in cytoskeletal, cell junction and extracellular
matrix components to effect the morphogenetic movements that
sculpt the extraordinary labyrinthine structure of the mature inner
ear.
Сайт создан в системе
uCoz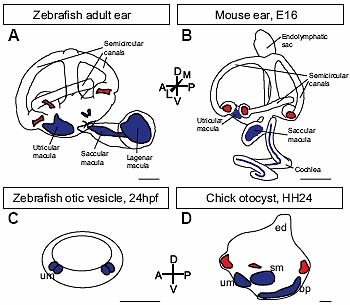 Fig. 1. Axes of the otic vesicle and adult inner ear in zebrafish and amniotes. (A,B) Diagram of a lateral view of the inner ear of an adult zebrafish (A) and E16 mouse (B), showing asymmetries about all three body axes. The positions of the maculae (blue) and cristae (red) are indicated. Scale bars, 500 µm. (C,D) Schematic diagram of a lateral view of the otic vesicle of a zebrafish at 24 hpf (C) and the chick at HH24 (E4) (D). Scale bars, 100 µm. There are already obvious morphological asymmetries at these stages: in zebrafish, the dorsal epithelium is hinner than the ventral epithelium; in amniotes, the endolymphatic duct protrudes from the dorsal side. In zebrafish, hair cells (blue) are differentiating in the presumptive utricular and saccular maculae at the anterior and posterior poles, respectively, of the otic vesicle. In the chick, the expression of Bmp4 marks the relative positions of all presumptive sensory areas (the mediolateral dimension is not shown) (adapted from data in Oh et al ., 1996). Although the shape of the otic vesicle is distorted during morphogenesis, the relative positions of the sensory patches about the body axes in the mature ear match those at otic vesicle stages. Abbreviations: bp, basilar papilla; ed, endolymphatic duct; sm, saccular macula; um, utricular macula.
Fig. 1. Axes of the otic vesicle and adult inner ear in zebrafish and amniotes. (A,B) Diagram of a lateral view of the inner ear of an adult zebrafish (A) and E16 mouse (B), showing asymmetries about all three body axes. The positions of the maculae (blue) and cristae (red) are indicated. Scale bars, 500 µm. (C,D) Schematic diagram of a lateral view of the otic vesicle of a zebrafish at 24 hpf (C) and the chick at HH24 (E4) (D). Scale bars, 100 µm. There are already obvious morphological asymmetries at these stages: in zebrafish, the dorsal epithelium is hinner than the ventral epithelium; in amniotes, the endolymphatic duct protrudes from the dorsal side. In zebrafish, hair cells (blue) are differentiating in the presumptive utricular and saccular maculae at the anterior and posterior poles, respectively, of the otic vesicle. In the chick, the expression of Bmp4 marks the relative positions of all presumptive sensory areas (the mediolateral dimension is not shown) (adapted from data in Oh et al ., 1996). Although the shape of the otic vesicle is distorted during morphogenesis, the relative positions of the sensory patches about the body axes in the mature ear match those at otic vesicle stages. Abbreviations: bp, basilar papilla; ed, endolymphatic duct; sm, saccular macula; um, utricular macula. 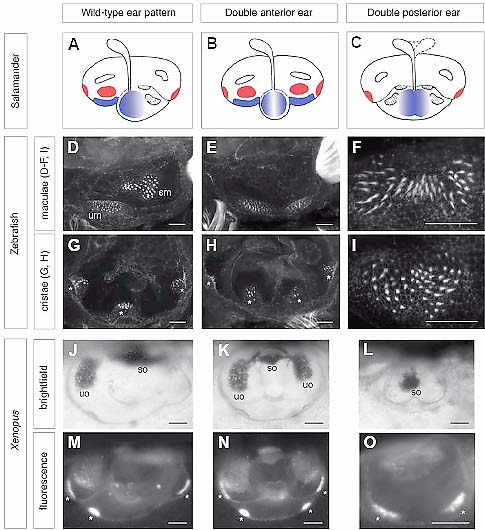 Fig. 2. Examples of axial duplications in the ears of amphibian and zebrafish embryos. (A-C) Diagrams of ear phenotypes obtained by rotations of the otic rudiment about the AP axis in the salamander (reproduced, with permission, from Harrison, 1945). (A) Wild-type ear pattern; (B) double anterior ear; (C) double posterior ear. The utricular and saccular maculae (blue) and cristae (red) are highlighted for clarity. (D-I) Confocal images of ear phenotypes following manipulation of Hh signalling in the zebrafish embryo. Ears are stained with FITC-phalloidin to mark the hair bundles of sensory hair cells in the maculae (D-F, I) or cristae (G, H). (D,G) Wild-type pattern (86 hpf); (E,H) double anterior pattern (86 hpf) obtained by incubation of the embryo from the 10 somite stage to 22 hpf in 50 µM cyclopamine to inhibit Hh signalling; (F,I) two examples of a double posterior pattern (mirror-image saccular macula) obtained by injection of shha mRNA into the embryo at the 1-cell stage (72 hpf) (reproduced with permission of the Company of Biologists from Hammond et al., 2003). (J-O) Ear phenotypes at tadpole stage (stage 48) obtained by partial otic placode or otic vesicle ablations in the Xenopus embryo at stages 24-27 (reprinted with permission of Wiley-Liss, Inc., a subsidiary of John Wiley & Sons, Inc., from Waldman et al., 2007). (J,M) Wild-type pattern; (K,N) double anterior ear obtained by ablation of the posterior half of the otic placode; (L,O) double posterior ear obtained by ablation of the anterior half of the otic placode. In all double anterior ears, the utricular macula is duplicated, and four cristae are present. In the double posterior ears, the utricular macula is missing, and the number of cristae is reduced. In all panels, the anterior of the embryo is to the left; (A-I) are lateral views, (J-O) are dorsal views. Abbreviations: sm, saccular macula; so, saccular otolith; um, utricular macula; uo, utricular otolith. Asterisks indicate the position of cristae. Scale bars: (D-I) 25 µm; (J-O) 100 µm.
Fig. 2. Examples of axial duplications in the ears of amphibian and zebrafish embryos. (A-C) Diagrams of ear phenotypes obtained by rotations of the otic rudiment about the AP axis in the salamander (reproduced, with permission, from Harrison, 1945). (A) Wild-type ear pattern; (B) double anterior ear; (C) double posterior ear. The utricular and saccular maculae (blue) and cristae (red) are highlighted for clarity. (D-I) Confocal images of ear phenotypes following manipulation of Hh signalling in the zebrafish embryo. Ears are stained with FITC-phalloidin to mark the hair bundles of sensory hair cells in the maculae (D-F, I) or cristae (G, H). (D,G) Wild-type pattern (86 hpf); (E,H) double anterior pattern (86 hpf) obtained by incubation of the embryo from the 10 somite stage to 22 hpf in 50 µM cyclopamine to inhibit Hh signalling; (F,I) two examples of a double posterior pattern (mirror-image saccular macula) obtained by injection of shha mRNA into the embryo at the 1-cell stage (72 hpf) (reproduced with permission of the Company of Biologists from Hammond et al., 2003). (J-O) Ear phenotypes at tadpole stage (stage 48) obtained by partial otic placode or otic vesicle ablations in the Xenopus embryo at stages 24-27 (reprinted with permission of Wiley-Liss, Inc., a subsidiary of John Wiley & Sons, Inc., from Waldman et al., 2007). (J,M) Wild-type pattern; (K,N) double anterior ear obtained by ablation of the posterior half of the otic placode; (L,O) double posterior ear obtained by ablation of the anterior half of the otic placode. In all double anterior ears, the utricular macula is duplicated, and four cristae are present. In the double posterior ears, the utricular macula is missing, and the number of cristae is reduced. In all panels, the anterior of the embryo is to the left; (A-I) are lateral views, (J-O) are dorsal views. Abbreviations: sm, saccular macula; so, saccular otolith; um, utricular macula; uo, utricular otolith. Asterisks indicate the position of cristae. Scale bars: (D-I) 25 µm; (J-O) 100 µm. 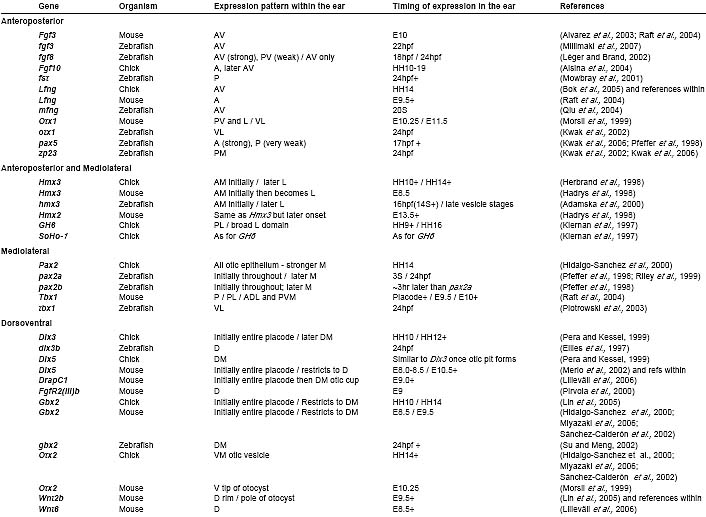
 Fig. 3. Examples of mutant phenotypes affecting axial patterning at
the otic vesicle stage. (A,B) Disruption of the otic AP axis in the
zebrafish val/mafb mutant (dorsal views). Expression of anterior markers ( hmx3, pax5, fgf8; purple) extends posteriorly around the medial wall of the otic vesicle, while expression of a posterior marker ( zp23; light blue) is lost (adapted from data in Kwak et al., 2002). The photographs show the expression of hmx3 at 25 hpf; arrowheads mark the posterior boundary of expression. (C,D) Disruption of the otic ML axis in the mouse Raldh2-/- mutant (dorsal views). Expression of a medial marker ( Pax2;light blue) is lost, while expression of a lateral marker ( Hmx3; purple) is expanded throughout the otic epithelium (adapted from data in Niederreither et al ., 2000). (E,F) Disruption of the otic DV axis in the mouse Shh -/- mutant (transverse sections). Expression of the dorsal marker Dlx5 (purple) extends ventrally, while expression of the ventral marker Otx2 (light blue) is lost (adapted from data in Riccomagno et al., 2002). All drawings are schematic diagrams, not to scale; they show only a subset of the genes affected in each case.
Fig. 3. Examples of mutant phenotypes affecting axial patterning at
the otic vesicle stage. (A,B) Disruption of the otic AP axis in the
zebrafish val/mafb mutant (dorsal views). Expression of anterior markers ( hmx3, pax5, fgf8; purple) extends posteriorly around the medial wall of the otic vesicle, while expression of a posterior marker ( zp23; light blue) is lost (adapted from data in Kwak et al., 2002). The photographs show the expression of hmx3 at 25 hpf; arrowheads mark the posterior boundary of expression. (C,D) Disruption of the otic ML axis in the mouse Raldh2-/- mutant (dorsal views). Expression of a medial marker ( Pax2;light blue) is lost, while expression of a lateral marker ( Hmx3; purple) is expanded throughout the otic epithelium (adapted from data in Niederreither et al ., 2000). (E,F) Disruption of the otic DV axis in the mouse Shh -/- mutant (transverse sections). Expression of the dorsal marker Dlx5 (purple) extends ventrally, while expression of the ventral marker Otx2 (light blue) is lost (adapted from data in Riccomagno et al., 2002). All drawings are schematic diagrams, not to scale; they show only a subset of the genes affected in each case.  Fig. 4. Similarity of axial patterning defects between kr/Mafb-/- and Gbx2-/- mutant phenotypes in the mouse. (A) Wild-type mouse inner ear at E16. (B,C) Ear phenotypes in kr/Mafb -/- mutants (E15.5, Type II) (B) and Gbx2-/- mutants (E15.5, Type III) (C). Both mutants show a similar wide spectrum of defects; examples of relatively strong phenotypes are shown for each. The anterior and posterior semicircular canals, crus commune and endolymphatic duct are missing, and the cochlea is grossly distended (adapted from data in Lin et al ., 2005 and Choo et al ., 2006). Blue shading indicates maculae; red indicates cristae. Light shading indicates poorly differentiated sensory organs. The similarity of the two phenotypes, together with expression data ( Gbx2 expression is lost in the ears of kr/Mafb-/- mutants), strongly suggest that Gbx2 acts downstream of a kr/Mafb-dependent hindbrain signal. Abbreviations: ascc, lscc, pscc, anterior, lateral (horizontal) and posterior semicircular canals; cc, crus commune; ed, es, endolymphatic duct and sac.
Fig. 4. Similarity of axial patterning defects between kr/Mafb-/- and Gbx2-/- mutant phenotypes in the mouse. (A) Wild-type mouse inner ear at E16. (B,C) Ear phenotypes in kr/Mafb -/- mutants (E15.5, Type II) (B) and Gbx2-/- mutants (E15.5, Type III) (C). Both mutants show a similar wide spectrum of defects; examples of relatively strong phenotypes are shown for each. The anterior and posterior semicircular canals, crus commune and endolymphatic duct are missing, and the cochlea is grossly distended (adapted from data in Lin et al ., 2005 and Choo et al ., 2006). Blue shading indicates maculae; red indicates cristae. Light shading indicates poorly differentiated sensory organs. The similarity of the two phenotypes, together with expression data ( Gbx2 expression is lost in the ears of kr/Mafb-/- mutants), strongly suggest that Gbx2 acts downstream of a kr/Mafb-dependent hindbrain signal. Abbreviations: ascc, lscc, pscc, anterior, lateral (horizontal) and posterior semicircular canals; cc, crus commune; ed, es, endolymphatic duct and sac.  Fig. 5. Position of the otic vesicle with respect to hindbrain rhombomeres in different species. Schematic diagram to show the position of the otic vesicle with respect to rhombomere boundaries and gene expression patterns in lamprey, zebrafish and amniote (chick and mouse) embryos. Bands mark the position of expression of genes. Egr2/Krox20 marks the conserved position of r3 and r5 in each organism. Expression domains of tcf2/vhnf1 and kr/val/mafb are conserved in zebrafish and amniotes, while expression of wnt1, wnt3a and fgf3 differs. Expression data for these genes are not available for the lamprey. Adapted from data in references cited in the text.
Fig. 5. Position of the otic vesicle with respect to hindbrain rhombomeres in different species. Schematic diagram to show the position of the otic vesicle with respect to rhombomere boundaries and gene expression patterns in lamprey, zebrafish and amniote (chick and mouse) embryos. Bands mark the position of expression of genes. Egr2/Krox20 marks the conserved position of r3 and r5 in each organism. Expression domains of tcf2/vhnf1 and kr/val/mafb are conserved in zebrafish and amniotes, while expression of wnt1, wnt3a and fgf3 differs. Expression data for these genes are not available for the lamprey. Adapted from data in references cited in the text. 