Места, где отические плакоды формируются вдоль оси тела, как полагают зависят от Fibroblast growth factors (Fgfs), испускаемых мезодермой, энтодермой и задним мозгом (Noramly и Grainger, 2002, Ladher et al., 2005). Анализ мышей с мутантным задним мозгом, таких как
указывают на то, что отсутствие передачи сигналов Fgf в заднем мозге само по себе не затрагивает формирования плакод, а скорее влияет на последующие морфогенетические события (Kiernan et al., 2002). Имеются некоторые указания на то, что врожденные пороки внутреннего уха у таких мутантов заднего мозга могут быть обусловлены дефектами в формировании осевого паттерна (Choo et al., 2006). У кур отическая осевая спецификация происходит после формирования плакод, тогда как этот процесс, по-видимому, происходит значительно раньше у саламандр (Harrison, 1936, Bok et al., 2005). Время осевой спецификации у мышей неясно. Спецификация antero-posterior (AP) оси внутреннего уха эмбрионов кур, по-видимому, происходит до закладки dorso-ventral (DV) оси (Wu et al., 1998), подобно нервной трубке и др. органам (Lumsden и Krumlauf, 1996).
Возможно, что инициация AP оси внутреннего уха начинается с экспрессии некоторых нейральных/сенсорных маркеров, таких как Fgf10, Lunatic fringe (Lfng), Delta1, Neurogenin1 (Ngn1) и NeuroD в передней области инвагинирующих отических плакоды/бокала, когда нейробласты вычленяются, чтобы сформировать cochleovestibular ганглий (Myat et al., 1996, Morsli et al., 1998, Cole et al., 2000,
Alsina et al., 2004). Однако, исследования по отическим трансплантациям у эмбрионов кур указывают на то, что AP ось внутреннего уха не фиксирована, когда эти нейросенсорные маркеры впервые обнаруживаются и процесс спецификации осуществляется постепенно примерно в течение 12 ч периода вплоть до того, когда отический бокал закрывается наполовину (Wu et al., 1998, Bok et al., 2005). Т.о., сигналы, обеспечивающие качественные особенности AP оси для отической плакоды скорее всего доступны до появления нейросенсорных маркеров и присутствуют постоянно вплоть до окончания процесса спецификации.
Развитие заднего мозга может быть той тканью, т.к. он организован во временные сегменты, ромбомеры. Каждый ромбомер экспрессирует уникальный профиль генов. Эта уникальная сегментация ромбомеров, как полагают, координирует места сенсорных ганглиев вдоль AP оси заднего мозга, а также выходные маршруты клеток нервного гребня, которые формируют паттерн головных и лицевых структур во время эмбриогенеза (Trainor и Krumlauf, 2000, Graham et al., 2004). Интересно, что передняя и задняя половина отического бокала соседствуют с ромбомерами 5 и 6 (r5 и r6) и и как полагают граница r5/6 может играть роль в формировании паттерна внутреннего уха (Brigande et al., 2000b). Более того, формирование границы r5/6 у эмбрионов кур происходит довольно рано ( ст.6 сомитов), еще до завершения индукции отических плакод (Fraser et al., 1990, Groves и Bronner-Fraser, 2000). Следовательно, паттерны дифференциальной генной экспрессии между r5 и r6 могут обеспечивать AP позиционную информацию для внутреннего уха. Однако, эта гипотеза не получает во многих случаях экспериментального подтверждения. Когда относительная позиция r5 и r6 меняется
in ovo до закладки AP оси во внутреннем узе кур, то осевой AP паттерн внутреннего уха не меняется (Bok et al., 2005), указывая тем самым, что AP ориентация r5 и r6 не играет существенной роли в обеспечении осевых AP характеристик внутреннего уха.
Т.к. ткань(и), ответственные за обеспечение осевых AP характеристик во внутреннем ухе, остаются неизвестными, но недавние исследования позволят предположить, что Tbx1 может быть ключевой нижестоящей мишенью для передачи внешних AP сигналов (Vitelli et al., 2003, Raft et al., 2004, Arnold et al., 2006). У мышей экспрессия
Tbx1 обнаруживается исключительно в задней половине отического бокала (Vitelli et al., 2003, Raft et al., 2004, Arnold et al., 2006). Интересно, что у
Tbx1 нулевых мутантов домены экспрессии генов, таких как
Ngn1, NeuroD1, Lfng и Fgf3 теряют свою обычную нормальную переднюю ограниченность в отоцисте и распространяются на более задние регионы. Напротив, домены экспрессии экспрессирующихся в задней части генов, таких как
Otx1, Otx2 и Goosecoid исчезают (Vitelli et al., 2003, Raft et al., 2004, Arnold et al., 2006). Более того, домены экспрессии Ngn1 и NeuroD1 существенно редуцируются в трансгенной линии мышей, несущей множественные копии TBX1 человека (Raft et al., 2004). Всё это указывает на то, что Tbx1 обычно функционирует, чтобы супрессировать или ограничить переднюю, нейросенсорную судьбу и что Tbx1 д. быть важным детерминантом AP осевых характеристик внутреннего уха. Базируясь на исследованиях условного нокаута
Tbx1, эта роль Tbx1 обеспечивается за счет его экспрессии в отическом эпителии скорее, чем экспрессии в окружающей мезенхиме (Arnold et al., 2006). Идентификация сигналов, которые регулируют экспрессию
Tbx1 в отическом эпителии важна для понимания аксиальной AP спецификации во внутреннем ухе.
Dorsoventral axis
Зрелое внутреннее ухо мышей и кур состоит из двух главных частей, дорсального вестибулярного компонента и вентрального слухового компонента (Figure 1). Базируясь на паттернах генной экспрессии, индукция DV оси также является ранним событием. Гены, ассоциированные с дорсальными вестибулярными структурами, такие как Dlx5, Dlx6, Hmx2, Hmx3 и Gbx2, или со структурами вентральных слуховых и нейросенсорных регионов, такие как Lfng, Ngn1, NeuroD1, Sox2 и Six1, экспрессируются асимметрично на ст. отического бокала у кур и мышей (Fekete and Wu, 2002). Тем не менее, трансплантационные эксперименты у кур демонстрируют, что DV ось внутреннего уха не специфицируется вплоть до окончания образования отоциста (Wu et al., 1998). Эти результаты указывают на то, что несмотря на то, что асимметрия паттернов генной экспрессии вдоль AP и DV осей возникает приблизительно в одно и то же время, детерминация DV оси происходит много позже, чем AP оси (Wu et al., 1998).
В отличие от AP оси DV аксиальная спецификация внутреннего уха в основном зависит от сигналов, исходящих от заднего мозга (Bok et al., 2005). Когда сегмент заднего мозга, соседствующий с внутренним ухом ротируется вдоль его DV оси in ovo, то гены обычно экспрессирующиеся в вентральной части отоциста, такие как Lfng, NeuroD1 и Six1 сдвигаются дорсально. С др. стороны, экспрессия дорсального отичеcкого гена, Gbx2, исчезает. Эти результаты указывают на то, что с помощью ротации DV оси заднего мозга ткани вентральной части заднего мозга достаточны для наделения вентральными судьбами дорсальной отической ткани (Bok et al.,2005). Т.о., способность вентральной части заднего мозга преодолевать др. потенциально дорсализующие сигналы от соседних тканей подчеркивает, что задний мозг предоставляет основную DV аксиальную информацию для внутреннего уха.
Секретируемые молекулы от заднего мозга, такие как Wnts из дорсальной части нервной трубки и Sonic hedgehog (Shh) от вентральной пластинки и хорды играют важные роли в установлении DV оси внутреннего уха (Liu et al., 2002, Riccomagno et al., 2002, Bok et al., 2005, Riccomagno et al., 2005). Эти секретируемые молекулы также участвуют в формировании DV паттерна нейронов в заднем мозге, а также др. параксиальных структур, таких как сомиты (Ikeya et al., 1997, Tajbakhsh и Sporle, 1998, Lee и Jessell, 1999, Ruiz i Altaba et al., 2003). Анализ внутреннего уха у двойных нокаутов Wnt1/Wnt3a показал, что передача сигналов Wnt ответственна за экспрессию субнабора дорсальных отических генов, таких как Dlx5, Dlx6 и Gbx2 (Riccomagno et al., 2005). Более того, эксперименты по удалению ткани, проведенные на культурах отических эксплантов, четко продемонстрировали, что Wnts, ответственные за экспрессию этих дорсальных отических генов, испускаются дорсальной частью заднего мозга (Riccomagno et al., 2005). Соотв., потеря доменов экспрессии Dlx5, Dlx6 и Gbx2 во внутреннем ухе двойных мутантов Wnt1/Wnt3a делает невозможным развитие каких-либо идентифицируемых вестибулярных структур (Riccomagno et al., 2005), подчеркивая, что передача сигналов Wnt необходима для спецификации дорсальных частей внутреннего уха.
Shh необходим для формирования вентрального паттерна внутреннего уха у кур и мышей (Liu et al., 2002, Riccomagno et al., 2002, Bok et al., 2005). У Shh-/- эмбрионов мыши уровни экспрессии генов в вентральных частях отоциста, таких как Otx1, Otx2, Lfng, Fgf3, Ngn1 и NeuroD1 снижены и приводят к полному отсутствию вентральных структур внутреннего уха (Riccomagno et al., 2002). У эмбрионов кур, инъекции гибридомных клеток, которые секретируют антитела, блокирующие биоактивность Shh, в вентральную срединную линию на ст. отического бокала также приводят к исчезновению вентральных структур внутреннего уха (Bok et al., 2005). Передача сигналов Shh обеспечивается с помощью семейства транскрипционных факторов Gli (Ingham и McMahon, 2001). Анализ некоторых линий мышей, несущих различные генетические комбинации мутантных аллелей, ассоциированных с путем передачи сигналов Shh/Gli указывает на то, что собственно баланс Gli3 репрессора и Gli2/Gli3 активаторов вдоль DV оси является критическим для обеспечения градированных уровней передачи сигналов Shh во внутреннем ухе (see below, Bok et al., 2007).
Каковы взаимоотношения между Wnts и Shh в развитии внутреннего уха? Оказывает их действие оппозитные др. др. эффекты во внутреннем ухе? передача сигналов Shh от вентральной части донной пластинки и хорды, по-видимому, ограничивает Wnt активности дорсально во внутреннем ухе, т.к.
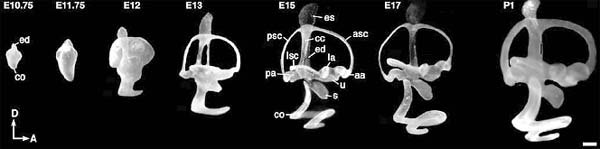 Fig. 1. Developmental series of the mouse внутреннего уха. Lateral views of paint-filled, membranous labyrinths of mice from embryonic days 10.75
(E10.75) to postnatal day 1 (P1). Abbreviations: aa, anterior ampulla; asc, anterior semicircular canal; cc, common crus; co, cochlear duct; ed,
endolymphatic duct; es, endolymphatic sac; la, lateral ampulla; lsc, lateral semicircular canal; pa, posterior ampulla; psc, posterior semicircular canal; s, saccule; u, utricle, D, dorsal; A, anterior. Scale bar, 200 µm. Adapted from Cantos et al., 2000.
Fig. 1. Developmental series of the mouse внутреннего уха. Lateral views of paint-filled, membranous labyrinths of mice from embryonic days 10.75
(E10.75) to postnatal day 1 (P1). Abbreviations: aa, anterior ampulla; asc, anterior semicircular canal; cc, common crus; co, cochlear duct; ed,
endolymphatic duct; es, endolymphatic sac; la, lateral ampulla; lsc, lateral semicircular canal; pa, posterior ampulla; psc, posterior semicircular canal; s, saccule; u, utricle, D, dorsal; A, anterior. Scale bar, 200 µm. Adapted from Cantos et al., 2000.
домены экспрессии генов, которые регулируются с помощью Wnts, таких как Dlx5 и Gbx2 расширяются вентрально у
Shh-/- эмбрионов (Riccomagno et al., 2002, Riccomagno et al., 2005). Однако, когда передача сигналов Wnt устраняется или активируется эктопически, то домены экспрессии генов, которые предположительно стоят ниже Shh, такие как
Gli1, Ngn1, Otx2 и Pax2 в вентральном отическом домене не меняются (Riccomagno et al., 2005), указывая тем самым, что вентральное ограничение передачи сигналов Shh не обеспечивается за счет Wnts.
Несколько линий доказательств указывает на то, что Wnts и Shh являются не только сигналами, участвующими в становлении DV во внутреннем ухе Отсутствие Wnts в заднем мозге затрагивает только некоторые из дорсальных отических генов, включая Dlx5, Dlx6 и Gbx2, mjгда как др. дорсальные гены, такие как Hmx3 и Wnt2b не затрагиваются, это указывает на то. что др. дорсальные сигналы ещё продолжают оперировать (Riccomagno et al.,
2005). Др. семейство секретируемых молекул, которое может служить в качестве сигнальных молекул для формирования паттерна внутреннего уха, это Bone morphogenetic proteins (Bmps), которые экспрессируются в верхней пластинке заднего мозга и дорсальной эктодерме (Lee и Jessell, 1999). Т.к.
Bmp и Shh ингибируют др. др. в нервной трубке, а ингибиторы BMPs, экспрессируемые в хорде, также модулируют функции Shh в вентральной части нервной трубки (Liem et al., 1995, Liem et al., 2000, Patten и Placzek, 2002), то возможно, что сходные оппозитные взаимодействия между Shh и Bmps происходят во внутреннем ухе. Сходная гипотеза множественных сигнальных путей для формирования DV паттерна из заднего мозга предложена для закладки центрального кохлеарного и вестибулярного ядер (Maklad и Fritzsch, 2003).
Six1, транскрипционный фактор, экспрессируемый в вентральной части отоциста, также необходим для формирования вентрального паттерна внутреннего уха (Zheng et al., 2003, Ozaki et al., 2004). Уровни экспрессии отических генов, включая
Otx1, Otx2, Fgf3, Fgf10 и Lfng существенно снижены, а домены экспрессии дорсальных отических генов, таких как
Dlx5, Hmx3, Gata3, Dach1 и Dach2 расширяются вентрально (Zheng et al., 2003, Ozaki et al., 2004). Интересно, что Six1 экспрессия не изменяется в Shh-нулевом внутреннем ухе, указывая тем самым, что Six1 не регулируется с помощью Shh во внутреннем ухе (Ozaki et al., 2004). Скорее
Eya1, чьё домен экспрессии перекрывается с
Six1 в отическом эпителии, участвует в регуляции Six1 (Xu et al., 1999). Сигналы, регулирующие экспрессию
Eya1 или Six1 в вентральной отической области неизвестны. Однако, когда DV ось заднего мозга ротируется, то обычный домен вентральной экспрессии
Six1 во внутреннем ухе сдвигается дорсально, указывая тем самым, что сигнал(ы), регулирующие экспрессию
Six1 внутреннего уха, исходят из вентральной части заднего мозга (Bok et al., 2005). Следовательно, эти результаты указывают на то, что имеется, по крайней мере, одна др. передача сигналов из заднего мозга, независимая от Shh, которая обеспечивает формирование вентрального паттерна внутреннего уха посредством регуляции Six1.
Mediolateral axis
Ткани и сигналы, обеспечивающие ML осевые характеристики внутреннего уха неясны. В зрелом внутреннем ухе эндолимфатический проток является медиальной структурой, а латеральный полукружный канал и ampulla являются латеральными структурами. Напротив, передний и задний полукружные каналы и канал улитки развиваются из комбинации медиальных и латеральных доменов (Figure 1) (Fekete and Wu, 2002). Ось ML может быть последней закладываемой осью, т.к. латеральный домен технически не существует вплоть до закрытия отического бокала. Однако, несколько линий доказательств подтверждают мнение, что медиальные характеристики приобретаются раньше. Во-первых, изменение ML оси развивающегося отоциста у кур ведет к тяжёлым порокам внутреннего уха без респецификации медиально или латерально экспрессируемых генов (Wu et al., 1998). Т.к. точное время спецификации ML оси неясно, но она происходит, по-видимому, в то же самое время, что и спецификации AP оси и обе они детерминируются прежде, чем фиксируется DV ось (Wu et al., 1998). Следовательно, несмотря на тот факт, что латеральная отическая область формируется последней, некоторые аспекты ML оси, по-видимому, появляются относительно рано.
Во-вторых, гены, которые активируются рано в отических плакодах, такие как Gbx2 и Pax2 ассоциируют с медиальной областью внутреннего уха на более поздних стадиях (Groves и Bronner-Fraser, 2000, Hidalgo-Sanchez et al., 2000, Burton et al., 2004, Lin et al., 2005). Такие паттерны экспрессии подразумевают ранннюю спецификацию медиальных характеристик. Напротив, контраргументом является то, что медиальные характеристики приобретаются только после ограничения доменов экспрессии Gbx2 и Pax2 от их широкого распределения во время стадии отических плакод.
В-третьих, мутанты заднего мозга. такие как
Hoxa1-/-,
Fgf3-/- и
kreisler, которые обнаруживают дефекты в r5 и r6 , а также в передаче сигналов Fgf, лишены дефинитивных медиальных структур, эндолимфатического протока в добавление к др. дефектам внутреннего уха (Deol, 1964, Mansour et al., 1993, Mark et al., 1993, Choo et al., 2006). Соотв., нокаут одного из FGF рецепторов, Fgfr2(IIIb), также приводит к отсутствию эндолимфатического протока, а также к др. дефектам (Mansour et al., 1993,
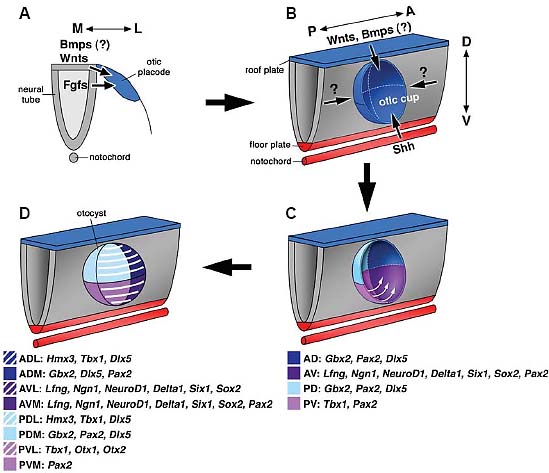 Fig. 2. A model on the timing of axial specification for mouse и chicken внутреннего ухаs. (A) Induction of the otic placode is dependent on signals
produced by surrounding tissues including Wnts, Fgfs и possibly Bmps from the hindbrain. The medial axis is likely the first axis to be specified in the otic epithelium since the newly induced otic genes such as Gbx2 и Pax2 are associated with the medial region of the внутреннего уха at later stages. (B,C) The invaginating otic placode receives AP и DV signals from the surrounding tissues, including Wnts и possibly Bmps from the dorsal hindbrain и Shh from the notochord и floor plate. Signal(s) that confer AP axial specification to the внутреннего уха is not known but most likely involve the induction of Tbx1 in the posterior half of the otic cup. Tbx1, in turn, may function to restrict the anterior neuro-sensory domain expressing Ngn1, NeuroD1 и Lfng. Cells located in the ventral posterior region of the otic cup migrate dorsally to form most of the lateral wall of the otocyst except the neurosensory domain in the antero-ventral region. (D) The newly formed lateral wall of the otocyst continues to receive existing AP и DV signals and further express regional-specific genes. Abbreviations: M, medial; L, lateral; A, anterior; P, posterior; D, dorsal; V, ventral.
Fig. 2. A model on the timing of axial specification for mouse и chicken внутреннего ухаs. (A) Induction of the otic placode is dependent on signals
produced by surrounding tissues including Wnts, Fgfs и possibly Bmps from the hindbrain. The medial axis is likely the first axis to be specified in the otic epithelium since the newly induced otic genes such as Gbx2 и Pax2 are associated with the medial region of the внутреннего уха at later stages. (B,C) The invaginating otic placode receives AP и DV signals from the surrounding tissues, including Wnts и possibly Bmps from the dorsal hindbrain и Shh from the notochord и floor plate. Signal(s) that confer AP axial specification to the внутреннего уха is not known but most likely involve the induction of Tbx1 in the posterior half of the otic cup. Tbx1, in turn, may function to restrict the anterior neuro-sensory domain expressing Ngn1, NeuroD1 и Lfng. Cells located in the ventral posterior region of the otic cup migrate dorsally to form most of the lateral wall of the otocyst except the neurosensory domain in the antero-ventral region. (D) The newly formed lateral wall of the otocyst continues to receive existing AP и DV signals and further express regional-specific genes. Abbreviations: M, medial; L, lateral; A, anterior; P, posterior; D, dorsal; V, ventral.
Pirvola et al., 2000). Следовательно, FGF3, как полагают, является важной сигнальной молекулой, происходящей из заднего мозга, участвующей в развитии внутреннего уха (McKay et al., 1996, Lin et al., 2005) и её ключевая роль может заключаться в спецификации медиальной оси.
Недавно детальный анализ мутантов kreisler подтвердил, что в противоположность потере эндолимфатического протока, латеральный полукружный канал и ampulla обычно сохраняются у мутантов kreisler (Choo et al., 2006). Кроме того во внутреннем ухе kreisler гены, экспрессируемые в дорсо-медиальной отической области, такие как Gbx2 и Wnt2b подавляются, тогда как домен экспрессии Otx2, гена, который обычно ограничен латеральной отической областью, расширяется медиально, указывая тем самым, что затрагиваются ML характеристики (Choo et al., 2006). Сходным образом дефекты формирование паттерна и изменения экспрессии генов наблюдаются также у мутантов Gbx2-/-. У эти х мутантов эндолимфатический проток затрагивается всегда, тогда как латеральный полукружный канал и ampulla обычно нормальны (Lin et al., 2005). Кроме того, домен дорсо-медиальной экспрессии Dlx5 отсутствует, а домен экспрессии латерального гена, Otx2, расширяется медиально, указывая тем самым, что ML характеристики также нарушаются в Gbx2-/- отоцистах (Lin et al., 2005). Исходя из этих результатов можно предположить, что активация Gbx2 в отическом эпителии является главным молекулярным событием, стоящим ниже передачи сигналов от заднего мозга. Остается проверить, являются ли др. мутантны заднего мозга, у которых отсутствует эндолимфатический проток, такие как нулевые мутанты Hoxa1 и Fgf3, также обнаруживают изменене6ия генной экспрессии, сходные с таковыми мутантов Gbx2-/- и kreisler.
Наконец, несмотря на тот факт, что передача сигналов Wnt исходит из дорсальной части заднего мозга, картирование судеб Wnt-чувствительных клеток в отическом бокале мышей показывает, что эти клетки вносят широкий вклад во внутреннее ухо, включая всю медиальную сторону (Riccomagno et al., 2005). Этот результат согласуется с находкой, что вентральные структуры внутреннего уха также тяжело нарушены у мутантов Wnt1-/-;Wnt3a-/- (Riccomagno et al., 2005). Отдельные работы по картированию судеб отического бокала эмбрионов курс использованием DiI показали, что большинство клеток латеральной стенки отоциста происходят из вентрального заднего края отического бокала (Brigande et al., 2000a). Всё это говорит о том, что возможно, что клетки отического бокала, первые смещающиеся вентрально и соответствуют всей медиальной стороне и затем мигрируют дорсо-латерально, чтобы сформировать латеральную стенку отоциста (Figure 2).
Исходя из всех представленных выше доказательств, становится понятным, что отические плакоды сначала приобретают медиальные характеристики благодаря сигналам Wnts и Fgfs, исходящим из заднего мозга, это ведет к активации генов, таких как
Pax2 и Gbx2. Затем AP ориентация, накладывается на инвагинирующую отическую плакоду благодаря спецификации нейросенсорного домена. В то же самое время вентральные отические клетки подвергаются воздействию Shh и др. неустановленных сигналов от вентральной части заднего мозга, которые придают вентральные характеристики медиальным судьбам и предопределяют DV различия. Комбинированные AP и DV осевые характеристики ограничивают нейросенсорный домен antero-ventral областью отического бокала. Затем детерминируется латеральная судьба, когда клетки, расположенные в ventro-posterior области отического бокала мигрируют дорсально, чтобы сформировать латеральную стенку отоциста. Вновь сформированная латеральная область затем продолжает получать dorsalizing и ventralizing сигналы от заднего мозга, это ведет к генерации каналов и канала улитки, соотв. (Figure 2).
The morphogenetic process
Большинство компонентов внутреннего уха состоит как из сенсорных. так и не-сенсорных регионов и морфогенез этих регионов скорее всего скоординирован во время развиатия. Одним из основных морфогенетических событий является подразделение предполагаемой нейросенсорной компетентной области на различные сенсорные участки после вычленения нейробластов (Figure 3). Основными сенсорными органами внутреннего уха позвоночных являются три гребешка (cristae), пятна (maculae) в utricle и saccule и слуховой сенсорный орган (орган Корти у млекопитающих и basilar papilla у кур). Молекулярные механизмы, лежащие в основе спецификации нейросенсорного домена, связаны с сигнальными путями Sox2, Six1 и Notch (Kelley, 2006). Отсутствие Sox2, Six1, или генов внутри сигнального пути Notch, таких как Jagged1 и Delta1, затрагивает образование ганглия, а также развитие сенсорных органов (Zheng et al., 2003, Ozaki et al., 2004, Kiernan et al., 2005, Brooker et al., 2006, Kiernan et al., 2006). Внутри доменов экспрессии Sox2 и Six1 субнабор клеток экспрессирует Bmp4, в то время как др. крупный субнабор клеток экспрессирует Lfng, модулятор Notch лиганд-рецептор взаимодействий (Neves et al., 2007, Wu unpublished results). Считается, что Bmp4-позитивные клетки дают три гребешка, тогда как Lfng-экспрессирующие клетки дают два maculae и орган Корти (Figure 3) (Morsli et al., 1998, Cole et al., 2000).
Формирование каждого сенсорного органа связано с развитием не-сенсорного компонента. Такое скоординированное развитие использует реципрокные взаимодействия между сенсорными и не-сенсорными тканями. Напр., Fgf10 экспрессируется в презумптивном сенсорном домене, тогда как его рецептор
FGFR-2(IIIb) экспрессируется в основном в не-сенсорном эпителии (Pirvola et al., 2000).
Fgf10 нокаутные мыши обнаруживают как сенсорные, так и несенсорные дефекты, а целенаправленные мутации FGFR-2(IIIb) также приводят к тяжелым врожденным порокам не-сенсорных компонентов, а также к неспособности формироваться сенсорному органу (Pirvola et al., 2000, Pauley et al., 2003). Эти результаты впервые подтвердили, что молекулярные взаимодействия между сенсорными и не-сенсорными компонентами внутреннего уха важны для их скоординированного и корректного образования. Сравнительно недавние исследования подтвердили, что cristae предопределяют образование ассоциированных с ними не-сенсорных компонентов, полукружных каналов.
Crista и semicircular canal formation
Три гребешка и ассоциированные с ними полукружные каналы отвечают за детекцию угловых движений головой. Эти структуры происходят из вертикального и горизонтального карманов развивающегося отоциста. Со временем эпителии, соответствующие центральной области каждого проспективного канала, внутри карманов приходят в соприкосновение, сливаются и резорбируются, приводя к образованию трубчатой формы каналов. В результате процесса резорбции вертикальный карман превращается в передний и задний каналы, соединенные вместе общей ножкой (common crus), а горизонтальный карман образует латеральный канал (Figure 1). Множество детерминантов влияет на образование этого вестибулярного аппарата, включая внешние сигналы из окружающих тканей, на формирование собственно карманов каналов и регулируемую резорбцию. Из внешних факторов, регулирующие образование crista и каналов, передача сигналов Wnt, исходящих из дорсальной части заднего мозга, важна для детерминации вестибулярной судьбы в дорсальной отической области путем регуляции субнабора дорсальных отических генов, таких как
Gbx2, Dlx5 и Dlx6 (Riccomagno et al., 2005). Внутреннее ухо одиночных
Gbx2, Dlx5 или двойных мутантных нокаутов
Dlx5/Dlx6 обнаруживает дефекты развития crista и каналов (Merlo et al., 2002, Lin et al., 2005, Robledo и Lufkin, 2006). Это согласуется с наблюдением, что отсутствует узнаваемый вестибулярный аппарат у
Wnt/Wnt3a двойных мутантных эмбрионов (Riccomagno et al., 2005). Напротив, Hmx семейство транскрипционных факторов, которые также участвуют в формировании каналов (Wang et al., 2001, Wang et al., 2004, Wang и Lufkin, 2005),по-видимому, не регулируются с помощью передачи сигналов Wnt, т.к. экспрессия Hmx3не нарушается в
Wnt1/Wnt3a мутантных отоцистах (Riccomagno et al., 2005). Т.о., очевидно, что два семейства гомеобокс содержащих транскрипционных факторов, необходимых для формирования каналов, Dlx и Hmx, регулируются независимо, возможно посредством разных внешних сигналов.
Crista и canal formation
Полукружные каналы происходят из дорсолатерального региона отоциста, где экспрессируются Dlx и Hmx семейства транскрипционных факторов. Хотя Dlx и Hmx в основном не экспрессируются в презумптивных cristae, они необходимы для формирования crista, возможно благодаря регуляции экспрессии собственно crista-специфических генов. Напр., домены экспрессии Bmp4, которые являются надежными маркерами презумптивных cristae, дезорганизуются или отсутствуют у мутантов Dlx и Hmx (Wang et al., 2001, Merlo
et al., 2002, Wang et al., 2004, Wang и Lufkin, 2005, Robledo and Lufkin, 2006). Экспрессия Bmp4 в презумптивных cristae законсервирована у многих видов, включая рыбок данио, лягушек, кур и мышей (Hemmati-Brivanlou и Thomsen, 1995, Wu и Oh, 1996, Morsli et al., 1998, Mowbray et al., 2001). Фенотипы внутреннего уха, возникающие в результате эктопической экспрессии BMP антагониста, Noggin, во внутреннем ухе кур показывают, что BMPs необходимы для собственно формирования как cristae, так и каналов (Chang et al., 1999, Gerlach et al., 2000). Эти результаты подтверждаются с помощью специфического нокаута во внутреннем ухе Bmp4 у мышей (unpublished results, Chang et al. ). Др. гены, которые экспрессируются в презумптивных cristae и , как было показано, необходимы для образования и crista и канала, это Sox2, Jagged1 и Fgf10 (Pauley et al., 2003, Kiernan et al., 2005, Brooker et al., 2006, Kiernan et al., 2006).
Несколько линий доказательств указывают на то, что образование cristae
и ассоциированных с ними каналов, связаны. Напр.,
Fgf10 экспрессируется в презумптивных cristae, т.к. нокаутные
Fgf10 внутренние уши обнаруживают дефектные cristae а также отсутствие всех трех каналов (Pauley et al., 2003), это указывает на то, что
Fgf10 экспрессируется в презумптивных cristae и необходим также для образования каналов (Pauley et al., 2003). Соотв., избыточность и потеря функции FGF в развивающемся внутреннем ухе кур показывают, что FGFs в сомом деле способствуют формированию канала (Chang et al., 2004a). Исследования по картированию судеб канальных карманов с использованием DiI, идентифицировали 'canal genesis zone' , которая располагается по соседству с презумптивными crista (Chang et al., 2004a). Клетки в зонах генезиса каналов дают большую часть клеток каналов, некоторые из клеток общуюю ножку (common crus). Образование зон генезиса каналов, по-видимому, связано с активацией экспрессии
Bmp2 посредством передачи сигналов Fgf, исходящих от соседних презумптивных cristae (Chang et al., 2004a). Неясно, как Sox2 (транскрипционный фактор) и Jagged1 (Notch лиганд) обеспечивают формирование каналов. Потребность в них для образования каналов может быть косвенной, за счет поддержания целостности сенсорной ткани и за счет добавления способствующих образованию каналов молекул, таких как Bmp4 и Fgf10.
Resorption и common crus formation
Общая ножка является структурой, которая образуется как результат процесса резорбции в вертикальном канальном кармане (Figure 1 и 4).
Следовательно, Fgf9 и Netrin1, которые участвуют в процессе нормальной резорбции внутри канальных карманов, необходимы также для образования общей ножки. У нокаутных мутантов
Fgf9 и Netrin1 эпителий в центральном регионе каждого проспективного канала неспособен приходить в соприкосновение, чтобы давать слитую пластинку, в результате отсутствует резорбция и неспособность образовать общую ножку (Salminen et al., 2000, Pirvola et al., 2004). Т.к. процесс резорбции регулирует образование общей ножки, то накапливающиеся данные указывают на то, что используются дополнительные механизмы. Эксперименты по неправильной экспрессии у эмбрионов кур подтверждают, что центральный
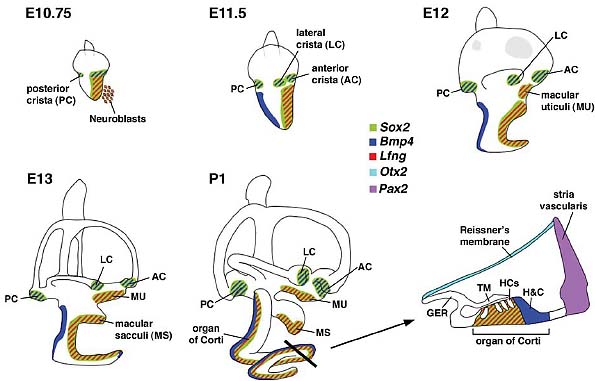 Fig. 3. Sensory organ formation in the mouse внутреннего уха. At E10.75, Bmp4 и Lfng are expressed in subsets of cells within the larger Sox2-positive, neurosensory domain of the otocyst. The Bmp4 expression domains, forming a Bmp4-positive anterior streak и a posterior focus, are associated with the three presumptive cristae. Lfng is expressed broadly in the anterior ventral region of the otocyst, associated with the macula utriculi, macula sacculi, organ of Corti и where neuroblasts delaminate. By E11.5, the presumptive anterior и lateral cristae are separate entities. Bmp4 is also expressed in the non-sensory region of the developing cochlear duct. By E12, the broad Lfng expression domain splits into two distinct regions: a dorsal, macula utriculi и a ventral domain that consists of the macula sacculi и organ of Corti, which become distinct entities by E13. Lfng is also expressed in the three cristae by E12 (not shown). A cross-section view of the organ of Corti at P1 shows that Sox2 и Lfng are down-regulated in sensory hair cells but strongly expressed in supporting cells. Abbreviations: GER, greater epithelial ridge; TM, tectorial membrane; HCs, hair cells; H&C, Hensen's и Claudius' cells.
Fig. 3. Sensory organ formation in the mouse внутреннего уха. At E10.75, Bmp4 и Lfng are expressed in subsets of cells within the larger Sox2-positive, neurosensory domain of the otocyst. The Bmp4 expression domains, forming a Bmp4-positive anterior streak и a posterior focus, are associated with the three presumptive cristae. Lfng is expressed broadly in the anterior ventral region of the otocyst, associated with the macula utriculi, macula sacculi, organ of Corti и where neuroblasts delaminate. By E11.5, the presumptive anterior и lateral cristae are separate entities. Bmp4 is also expressed in the non-sensory region of the developing cochlear duct. By E12, the broad Lfng expression domain splits into two distinct regions: a dorsal, macula utriculi и a ventral domain that consists of the macula sacculi и organ of Corti, which become distinct entities by E13. Lfng is also expressed in the three cristae by E12 (not shown). A cross-section view of the organ of Corti at P1 shows that Sox2 и Lfng are down-regulated in sensory hair cells but strongly expressed in supporting cells. Abbreviations: GER, greater epithelial ridge; TM, tectorial membrane; HCs, hair cells; H&C, Hensen's и Claudius' cells.
регион канального кармана , который превращается в общую ножку, нуждается в низких уровнях BMPs и FGFs (Chang et al., 1999, Chang et al., 2004a).
Preferential requirements for specific cristae и canals
Единственный известный ген, который исключительно экспрессируется в специфических crista или каналах является Otx1. Otx1 временно экспрессируется в презумптивной латеральных crista и канале и необходим для формирования этих структур (Morsli et al., 1999). Однако, фенотипический анализ этих мутантов показал, что многие гены дифференциально необходимы для трех cristae и каналов, даже если паттерны их экспрессии кажутся повсеместными. Напр., Fgf10 экспрессируется во всех трех cristae, но только задняя crista, а не передняя и латеральная затрагиваются, когда имеет место нокаут Fgf10 (Pauley et al., 2003). Кроме того, очевидно функциональное перекрывание между генами внутри одного и того же семейства, т.к.фенотипы внутреннего уха у Dlx5/Dlx6 и Hmx2/Hmx3 двойных мутантов значительно более тяжелые, чем таковые у Dlx5 и Hmx2 или Hmx3 одиночных мутантов (Wang et al., 2001, Merlo et al., 2002, Wang et al., 2004, Wang и Lufkin, 2005, Robledo and
Lufkin, 2006).
Недавние исследования
Shh-/- и
Gli3-/- внутреннего уха показали, что хотя Shh и Gli3 действуют в одном и том же сигнальном каскаде, их гены необходимы на разных стадиях формирования каналов (Bok et al., 2007). У обоих мутантов отсутствуют латеральные каналы. Однако, дефекты начал латерального канала разные, так что карман латерального канала неспособен развиваться в отсутствие Gli3, тогда как у мутантов
Shh-/- карман латерального канала выглядит нормальным, но неспособен развиваться в канал (Bok et al., 2007). Вообще-то наиболее интересным фенотипом вестибулярного канала характеризуются мутанты
Foxg1-/- (Pauley et al., 2006). У этих мутантов передний и латеральный cristae замещаются одиночным crista, который ассоциирует с передним и латеральным каналом. Неясно, представляет ли собой этот одиночный crista два презумптивных cristae, которые неспособны разделиться или разделение происходит нормально, но один из них вскоре после этого дегенерирует. Независимо от причины этого уродства, этот фенотип представляется дефектом раннего формирование паттерна во время образования crista.
Utricle и Saccule formation
Relationship between cochleovestibular ganglion и the macula of the utricle
Накапливаются доказательства, подтверждающие, что macula в utricle
обладает общим происхождением с нейронами CVG. Это впервые было продемонстрировано экспериментами по отслеживанию клеточных клонов у кур с использованием некомпетентного к репликации ретровируса (Satoh и Fekete, 2005).
Т.к. дисперсия клонально родственных клеток ограничена, когда epitope-
нагруженные вирусы высвобождаются на ст. отического бокала или отоциста,
то имеются четкие примеры клонального потомства, дающего сенсорные клетки внутри macula в utricle и нейроны вестибулярного и аудиторного ганглия. Кроме того, результаты исследований некоторых мутантных мышей подтверждают идею общего происхождения macula в utricle и CVG. Было предположено, что
Helix-loop-helix транскрипционный фактор, Ngn1, который экспрессируется в нейросенсорных клетках предшественниках в отическом эпителии и вычленяющихся нейронах, необходим для спецификации нейронов (Ma et al., 1998, Ma et al., 2000). У Ngn1 нокаутных мышей CVG отсутствует, но размер презумптивного macula utriculi исходно крупнее, чем в норме (Matei et al., 2005). Т.к. ряд сценариев может объяснить увеличение размеров презумптивного macula utriculi, то привлекательной гипотезой в свете модели общего происхождения является то, что в отсутствие Ngn1, проспективные нейробласты неспособны выходить из отического эпителия и вносят вклад вместо этого в сенсорный регион utricle. Неспособность macula utriculi сохранять свой увеличенный размер на более поздних стадиях у Ngn1 мутантов приписывается преждевременной дифференцировке сенсорных клеток (Matei et al., 2005).
Сигнальный путь Notch участвует в спецификации судеб нервных, волосковых клеток и поддерживающих клеток внутреннего уха (Fekete и Wu, 2002, Kelley, 2006). Отсутствие одного из лигандов для Notch рецепторов, Delta1, вызывает увеличение размера CVG, преимущественно из-за неспособности ингибировать нейральные судьбы за счет латеральной ингибиции (Brooker et al., 2006). Интересно, что у этих мутантов размер macula utriculi уменьшен. Это ожидаемый результат, если macula utriculi в самом деле обладает общим происхождением с CVG и поэтому в отсутствие Delta1 больше клеток детерминируется в направлении нейральных судеб. Кроме того, когда нейросенсорный домен расширяется как в случае мутантов
Tbx1-/-, то возникающее в результате macula utriculi крупнее, возможно благодаря расширению нейросенсорного домена на ранних стадиях (Raft et al., 2004). Всё это указывает на то, что субпопуляция клеток внутри нейросенсорного домена вычленяется, чтобы сформировать нейробласты под регуляцией Ngn1 и сигнального пути Notch. Затем клетки, которые остаются в нейросенсорном домене развиваются в сенсорные волосковые клетки и поддерживающие клетки macula utriculi.
Formation of the saccule
Мacula sacculi, как полагают происходит из некой Lfng-позитивной нейросенсорной области, которая дает macula utriculi, нейроны CVG и орган Корти (Morsli et al., 1998). Следовательно, macula в saccule также может иметь общее происхождение с нейрогенной областью. У мутантов
Delta1-/- размер macula sacculi маленький, сходен с таковым, наблюдаемым при маленьком macula utriculi, это подтверждает мнение, что происхождение macula sacculi и CVG так же может быть связанным (Brooker et al.,
2006). Напротив, т.к. гипотеза общего происхождения д. предсказывать сравнимое увеличение размера презумптивного мешочка (saccule) как и маточки (utricle) у мутантов
Ngn1-/-, но не обнаруживается презумптивное macula sacculi на ранних стадиях и только небольшой saccule присутствует на 18.5 день эмбриогенеза (Ma et al., 2000, Matei et al., 2005). Многие сценарии могут объяснять такие результаты. Повышенная клеточная гибель, наблюдаемая в презумптивной saccular области у мутантов
Ngn1-/- может объяснить инициальное отсутствие этого сенсорного участка (personal communication, Steven Raft). Кроме того, переключение клеточных судеб как результат отсутствия Ngn1 может вызывать задержку нормального разделения двух презумптивных maculae в результате чего и обнаруживается маленький saccule на более поздних стадиях (Ma et al., 2000, Matei et al., 2005).
Relationship between the utricle и saccule
У мышей, исходя из паттерна экспрессии Lfng, macula utriculi является самостоятельной единицей на эмбриональный день 12, тогда как macula sacculi не является самостоятельной структурой вплоть до 13-го дня эмбриогенеза (Figure 3) (Morsli et al., 1998). Мало известно о том, как каждый сенсорный участок отщепляется от др. в ходе развития внутреннего уха. Некоторые нокаутные мыши, такие как Hmx2, Hmx3, Otx1 и Otx2 обнаруживают неполное разделение двух maculae (Morsli et al., 1999, Fritzsch et al., 2001, Wang et al., 2004). Каждый из этих генов экспрессируется в не-сенсорной области utricle и saccule, указывая тем самым, что окружающая не-сенсорная ткань играет роль в выделении презумптивных сенсорных участков. Интересно, что нокдаун экспрессии otx1 у рыбок данио вызывает неспособность двух maculae разделяться, сходные фенотипы описаны для Otx1 нулевых мутантов. Морфология внутреннего уха этих otx1 knockdown эмбрионов рыбок данио также напоминает внутреннее ухо миног, которые не экспрессируют otx1 (Hammond и Whitfield, 2006). Было предположено, что приобретение экспрессии Otx1 является важным молекулярным отличительным признаком для бесчелюстных и
gnathostomes (Hammond и Whitfield, 2006).
К настоящему времени,
Gata3 является единственным известным геном gene, который преимущественно экспрессируется в utricle, но не в saccule (Karis et al., 2001). Однако, формирование и utricle и saccule затрагивается в
Gata3 нокаутном внутреннем ухе (Karis et al., 2001, Lillevali et al.,
2006). Дефекты и в utricle и saccule присутствуют и у некоторых др. нокаутных мышей, таких как Eya1, Six1 и Shh (Riccomagno et al., 2002, Ozaki et al., 2004, Lillevali et al., 2006, Zou et al., 2006). Известны также мутанты. у которых нарушается образование saccule, но utricle остается относительно нормальной.
Pax2 и Otx1 нулевые мутанты являются хорошим примером (Morsli et al., 1999, Burton et al., 2004). Однако, не известны мутанты, у которых интактный мешочек (saccule) формируется в отсутствие utricle, указывая тем самым, что utricle может диктовать или регулировать образование saccule.
Cochlear patterning
Улитка позвоночных является специализированным органом, ответственным за трансляцию звуков в головной мозг, конвертируя механическую энергию звука в электрическую энергию. Канал улитки у млекопитающих является закрученной структурой, напоминающей формой раковину улитки, тогда как у птиц канал улитки (basilar papilla) относительно прямой. У мышей канал улитки впервые инициируется в postero-lateral области отоциста и нисходит ventro-medially, формируя L-образный орган (половина витка) на 12-й день эмбриогенеза (Figure 1). Затем канал улитки продолжает увеличиваться и закручивается, так что у взрослых мышей структура состоит из одного и 3/4 витка. Как и у остальных млекопитающих канал улитки мышей основание наиболее чувствительны к звукам высокой частоты, а апикальная область к звукам низкой частоты (Davis, 2003).
Количество завитков канала улитки отличается у разных видов, Взаимоотношение между количеством витков канала и его функцией по проведению звуков неясно, хотя согласно недавней математической модели предполагается возможная взаимосвязь между радиусом спирали улитки и способностью воспринимать звуки низких частот (West, 1985, Manoussaki et al., 2006). Несомненно, что формирование паттерна этой структуры остается наиболее захватывающим вопросом развития внутреннего уха. Как сигнальные молекулы регулируют рост и формирование паттерна канала? Конвергентное расширение клеточных движений, которые происходят во время гаструляции могут также происходить и во время формирования кохлеарного канала (Chen et al., 2002, Keller, 2002, Mansour и Schoenwolf, 2005, Jones и Chen, 2007). Накапливаются доказательства, подтверждающие, что примордиальный домен органа Корти внутри канала улитки начинает утолщаться и расширяться, посредством интеркаляции клеток увеличиваясь радиально и расширяясь вдоль проксимо-дистальной оси канала улитки, приводя к конечному паттерну из 4-х радов волосковых клеток (McKenzie et al., 2004, Wang et al., 2005). Гены пути планарной клеточной полярности, такие как
Dishevelled, Vangl2 и Celsr1 , как полагают, участвуют в этом процессе (Wang et al., 2005, Jones и Chen, 2007).
Более того, недавний анализ различных компаундных мутантов внутреннего уха, ассоциированных с с сигнальным путем Shh, показал, что дистальный и проксимальный регионы канала улитки, которые характеризуются разными рангами воспринимаемых частот, формируют свой паттерн за счет разных молекулярных механизмов (Bok et al., 2007). Было показано, что дистальный регион улитки нуждается в сильной Gli активаторной функции, обеспечиваемой высокими уровнями передачи сигналов Shh, тогда как проксимальный регион канала улитки д. формироваться при относительно низком уровне Shh, который достаточен, чтобы устранять функцию Gli3 репрессора (Bok et al., 2007). На поперечных срезах канал улитки выглядит треугольным по форме и имеет три стенки: 1) днище, которое состоит из сенсорного компонента, Кортиевого органа и большого эпителиального гребня; 2)
тонкой медиальной стенки, состоящей из Reissner's мембраны; и 3)
латеральной стенки, которая состоит из сосудистой полоски (stria vascularis) (отвечающей за поддержание endocochlear потенциала в канале улитки) (Figure 3). Интересно, что мутации, затрагивающие нормальную клеточную дифференцировку и организацию любой из этих стенок канала улитки, приводят к аномальному формированию паттерна канала улитки. Напр., когда
Otx2, который экспрессируется в Reissner's мембране, подвергается нокауту, то формирование канала улитки аномально (Morsli et al., 1999). Кроме того,
Pax2, экспрессируемый в stria vascularis латеральной стенки канала улитки, также необходим для нормального роста канала улитки (Burton et al., 2004).
Sensory component in cochlear формирование паттерна
Некоторые гены, необходимые для собственно формирования паттерна Кортиевого органа, важны также для нормального роста канала улитки. Напр., у
Ysb или Lcc мутантов, у которых затрагивается экспрессия Sox2, и орган Корти и канал улитки уродливы (Kiernan et al., 2005). Кроме того, Jagged1, который экспрессируется в презумптивных сенсорных регионах и кодирует лиганд для сигнального пути Notch, также вызывает порок развития органа Корти и укорочение канала улитки, когда этот ген нокаутирован у мышей (Brooker et al., 2006, Kiernan et al., 2006). Сходным образом, Foxg1, транскрипционный фактор, экспрессируемый в Кортиевом органе и большом эпителиальном гребне, как было показано, необходим собственно для организации волосковых клеток, а также для нормального роста канала улитки (Pauley et al., 2006). Эти результаты подтверждают, что собственно формирование паттерна сенсорного компонента улитки, органа Корти, является важным для нормального роста канала улитки и подтверждают идею, что сенсорный компонент структуры внутреннего уха регулирует образование и его несенсорного компонента, подобно тому, что было описано для образования crista и полукружных каналов (Chang et al., 2004a).
Однако, не все гены, которые затрагивают собственно формирование органа Корти вызывают нарушения фенотипа канала улитки. Напр., Sprouty2, у мутантов
Spry2-/- морфология канала улитки нормальна несмотря на изменения клеточных судеб с клеток Deiters' на pillar клетки в кортиевом органе (Shim et al., 2005). Возможным объяснением этого, очевидного исключения, может служить относительно поздняя потребность в функции Spry2, возможно в то время, когда сенсорный компонент больше не нужен для морфогенеза канала улитки.
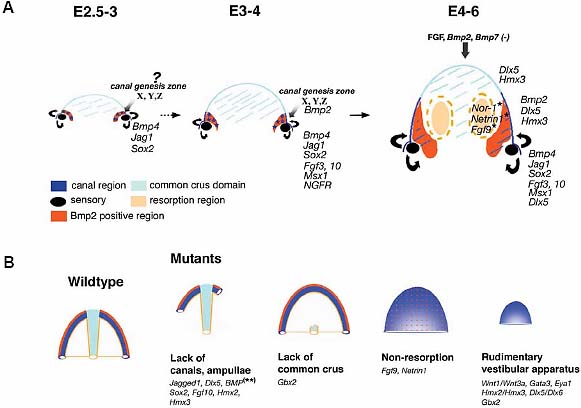 Fig. 4. A schematic diagram of semicircular canal и common crus formation. (A) Progression of chicken canal pouch development from E2.5 to E6. Signaling molecules such as Bmp4 и Fgfs are secreted from the presumptive cristae (black color) to induce canal genesis zones (blue stars that express Bmp2 и potentially other factors (X, Y и Z). Cells from these canal genesis zones (blue color) contribute to the majority of cells in the canals и some of the cells within the common crus (not shown). Two resorption domains (light yellow color) express Netrin1, Nor-1 и Fgf9 in the epithelia. The center region of the canal pouch (light blue color) that develops into the common crus does not express Bmp2 or Bmp7 и receives low levels of Fgf signaling. Hmx2, Hmx3 и Dlx5 are ubiquitously expressed in the canal pouch. (B) Examples of some typical canal phenotypes among various knockout mouse mutants. Genes responsible for causing each phenotype are in italic. Single asterisk represents data obtained from mouse
and double asterisks represent data from chicken.
Fig. 4. A schematic diagram of semicircular canal и common crus formation. (A) Progression of chicken canal pouch development from E2.5 to E6. Signaling molecules such as Bmp4 и Fgfs are secreted from the presumptive cristae (black color) to induce canal genesis zones (blue stars that express Bmp2 и potentially other factors (X, Y и Z). Cells from these canal genesis zones (blue color) contribute to the majority of cells in the canals и some of the cells within the common crus (not shown). Two resorption domains (light yellow color) express Netrin1, Nor-1 и Fgf9 in the epithelia. The center region of the canal pouch (light blue color) that develops into the common crus does not express Bmp2 or Bmp7 и receives low levels of Fgf signaling. Hmx2, Hmx3 и Dlx5 are ubiquitously expressed in the canal pouch. (B) Examples of some typical canal phenotypes among various knockout mouse mutants. Genes responsible for causing each phenotype are in italic. Single asterisk represents data obtained from mouse
and double asterisks represent data from chicken.
Даже в basilar papilla у кур, который не закручивается подобно каналу улитки млекопитающих, две структуры имеют сходное формирование паттерна в проксимальном регионе, как в возникающем из задней латеральной области развивающегося отоциста, так и в нисходящем в ventro-anterior направлении. Интересно, что формирование основного паттерна basilar papilla зависит от аксиальных AP характеристик нейросенсорного домена. Когда AP ось отоциста у эмбрионов кур меняется на обратную
in ovo в то время, когда AP ось нейросенсорного домена детерминируется, то AP ориентация канала улитки также изменятся на обратную, она возникает из antero-lateral области отоциста (Wu et al., 1998). Эти результаты указывают на то, что AP ориентация нейросенсорного домена отоциста диктует не только положение сенсорного компонента улитки, но и также глобальное формирование паттерна всего канала улитки.
Non-sensory component in cochlear patterning
Гены, кодирующие транскрипционные факторы, такие как Otx1 и Otx2, экспрессируются в отическом эпителии развивающейся улитки, но они не экспрессируются в презумптивном сенсорном домене и они, по-видимому, не нужны для формирования кортиевого органа (Morsli et al., 1999). Однако, целенаправленные делеции этих генов приводят к аномалиям роста и закручивания канала улитки, указывая тем самым на важность этих генов для собственно формирования паттерна канала улитки (Morsli et al., 1999, Cantos et al., 2000). Хотя не были изучены непосредственно во внутреннем ухе, но, как было установлено, Otx1 и Otx2 необходимы для нормальной клеточной пролиферации и регионализации в ходе развития головного мозга (Simeone et al., 2002).
PAX2, paired-box транскрипционный фактор, ассоциирован сrenal-coloboma синдромом у людей (Sanyanusin et al., 1995, Schimmenti et al., 1997). Умеренная нейросенсорная глухота была описана как один из дефектов, ассоциированный с этим синдромом (Schimmenti et al., 1997). Анализ внутреннего уха мутантов
Pax2-/- выявил раннюю потребность в Pax2 для роста канала улитки (Torres et al., 1996, Burton et al., 2004). Даже несмотря на то, что
Pax2 экспрессируется в сенсорных волосковых клетках и домен его экспрессии перекрывается с нейросенсорным доменом на ранней ст. отоциста, его экспрессия в развивающемся канале улитки обнаруживается в основном в в несенсорном домене у мышей (Burton et al., 2004). Изменения в профилях генной экспрессии в
Pax2-/- внутреннем ухе указывают на то, что рост и формирование паттерна улитки останавливаются на ранней стадии развития улитки возможно из-за снижения клеточной пролиферации и увеличения клеточной гибели в доменах, которые обычно экспрессируют
Pax2 в развивающейся улитке (Burton et al., 2004). Неясно, как эти фенотипы у
Pax2 нулевых эмбрионов связаны с глухотой при renal-coloboma синдроме, но было предположено, что транскрипционные факторы, экспрессируемые в развивающейся улитке, включая Pax2 и Otx1, могут играть критическую роль в собственно расширении, ориентации и закручивании канала улитки, за счет управления дифференциальной пролиферацией и ростом внутри различных регионов улитки (Burton et al., 2004).
Epithelial-mesenchymal interactions in cochlear patterning
Мезенхимные ткани, окружающие развивающееся внутреннее ухо, развиваются в отическую капсулу или костный лабиринт. Т.к. костный лабиринт в точности соответствует форме мембранозного лабиринта внутреннего уха, то д. существовать интимные межклеточные взаимодействия между отическим эпителием и окружающей его мезенхимой во время развития. Следовательно, любое нарушение собственно эпителиально-мезенхимных взаимодействий д. затрагивать формирование паттерна и морфогенез обоих лабиринтов. Анализ внутреннего уха у нокаутных мутантов
Brn-4/Pou3f4 предоставляет четкий пример важности подобных взаимодействий (Phippard et al., 1999).
Brn-4/Pou3f4 экспрессируется в мезенхимной ткани, окружающей развивающееся внутреннее ухо, но не в самом отическом эпителии. Однако, нокаутные
Brn-4/Pou3f4 мыши обнаруживают дефекты в морфогенезе внутреннего уха, включая уменьшение количества витков улитки (Phippard et al., 1999). Эти результаты демонстрируют, что изменения экспрессии генов в мезенхиме могут вызывать дефекты в эпителии внутреннего уха главным образом из-за аномальных эпителиально-мезенхимных взаимодействий.
Передача сигналов от отического эпителия также координирует собственно эпителиально-мезенхимное развитие. Напр., в то время как формирование канала улитки у
Fgf9 нулевых мутантов в основном нормально, отсутствие экспрессии
Fgf9 в Reissner's мембране, как полагают, вызывает дефекты в Scala vestibuli, наблюдаемые у этих мутантов (Pirvola et al., 2004).
Tbx1 экспрессируется как в отическом эпителии, так и периотической мезенхиме. Исследования ткане-специфических нокаутов показали, что Tbx1 в мезенхиме необходим для экспрессии
Brn-4/Pou3f4 (Arnold et al., 2006). В согласии с ролью Brn-4/Pou3f4 в развитии улитки, специфичная для мезенхимы делеция Tbx1 вызывает уродства канала улитки (Xu et al., 2007). Интересно, что экспрессия Tbx1 в периотической мезенхиме зависит от Shh (Riccomagno et al., 2002). Следовательно, молекулярный путь Shh-Tbx1-Brn-4 в периотической мезенхиме может участвовать в обеспечении формирования паттерна нормального канала улитки.
Genes not expressed in the cochlear epithelial и mesenchymal regions
Мутации некоторых генов, которые не экспрессируются в эпителиальной или мезенхимной областях карвивающегося канала улитки, также могут вызывать дефекты в формировании паттерна улитки. Один из таких примеров, Gbx2, чья экспрессия ограничена дорсо-медиальным аспектом отоциста. тогда внутреннее ухо мутантов
Gbx2-/- обнаруживает разные степени уродств улитки, а также вестибулярные дефекты, как осуждалось выше (Lin et al., 2005). Эти дефекты улитки у
Gbx2-/- могут быть связаны с аномальным медиальным расширением домена экспрессии
Otx2, чья обычная экспрессия в отоцисте является важной для развития улитки (Morsli
et al., 1999, Lin et al., 2005). Мутации генов. которые как полагают, стоят выше Gbx2, таких как
Mafb/kreisler и Hoxa1 также дают сходные фенотипы (Mansour et al., 1993, Mark et al., 1993, Choo et al., 2006). Как обсуждалось ранее, мы объясняем эти дефекты улитки аномальной ML спецификацией, которая косвенно затрагиывает формирование паттерна улитки.
Накоец, мутации, дающие в результате аномальную дифференцировку CVG, такие как
Ngn1-/- или
NeuroD1-/-, mfr;t lf.n укороченные каналы улитки (Liu et al., 2000, Ma et al., 2000, Kim et al., 2001, Matei et al., 2005), указывая тем самым. что сигналы от CVG также могут играть роль в развитии улитки. Итак, координация разнообразных внешних и внутренних факторов внутри и вокруг развивающегося внутреннего уха являются критическими для собственно развития закрученного канала улитки млекопитающих.
Conclusion
While we have categorized the phenotypes of many of the
known внутреннего уха mutants with respect to potential defects in axial
and/or positional specification, there are two categories of pheno-
types that are not well covered in this review. One category
includes mutants with rudimentary otocyst phenotypes such as
Fgfr-2(IIIb), Gata3 и Eya1 null mutants. The rudimentary state
of the внутреннего ухаs makes it difficult to identify axial defects, if any
exists. For example, in Gata3-/- внутреннего ухаs, while the neurosensory domain is abnormal, there appears to be additional cell
adhesion defects that cause the separation of the dorsal and
ventral domains of the otocyst (Lillevali et al., 2006). Another
category of внутреннего уха phenotypes that is beyond the scope of this
review are mutants with disrupted fluid homeostasis of the inner
ear. These внутреннего уха defects are often associated with engorge-
ment or shrinkage of the membranous labyrinth due to fluid
imbalance rather than problems in morphogenesis (Cowan et al.,
2000, Everett et al., 2001, Chang et al., 2004b, Dravis et al.,
2007). In summary, the continual discoveries of inductive signals
and their downstream cascades of molecule events for внутреннего уха
formation will decode the formation of this complex organ and
pave the way for design of strategies to improve hearing and
vestibular disorders.
Сайт создан в системе
uCoz
 Fig. 2. A model on the timing of axial specification for mouse и chicken внутреннего ухаs. (A) Induction of the otic placode is dependent on signals
produced by surrounding tissues including Wnts, Fgfs и possibly Bmps from the hindbrain. The medial axis is likely the first axis to be specified in the otic epithelium since the newly induced otic genes such as Gbx2 и Pax2 are associated with the medial region of the внутреннего уха at later stages. (B,C) The invaginating otic placode receives AP и DV signals from the surrounding tissues, including Wnts и possibly Bmps from the dorsal hindbrain и Shh from the notochord и floor plate. Signal(s) that confer AP axial specification to the внутреннего уха is not known but most likely involve the induction of Tbx1 in the posterior half of the otic cup. Tbx1, in turn, may function to restrict the anterior neuro-sensory domain expressing Ngn1, NeuroD1 и Lfng. Cells located in the ventral posterior region of the otic cup migrate dorsally to form most of the lateral wall of the otocyst except the neurosensory domain in the antero-ventral region. (D) The newly formed lateral wall of the otocyst continues to receive existing AP и DV signals and further express regional-specific genes. Abbreviations: M, medial; L, lateral; A, anterior; P, posterior; D, dorsal; V, ventral.
Fig. 2. A model on the timing of axial specification for mouse и chicken внутреннего ухаs. (A) Induction of the otic placode is dependent on signals
produced by surrounding tissues including Wnts, Fgfs и possibly Bmps from the hindbrain. The medial axis is likely the first axis to be specified in the otic epithelium since the newly induced otic genes such as Gbx2 и Pax2 are associated with the medial region of the внутреннего уха at later stages. (B,C) The invaginating otic placode receives AP и DV signals from the surrounding tissues, including Wnts и possibly Bmps from the dorsal hindbrain и Shh from the notochord и floor plate. Signal(s) that confer AP axial specification to the внутреннего уха is not known but most likely involve the induction of Tbx1 in the posterior half of the otic cup. Tbx1, in turn, may function to restrict the anterior neuro-sensory domain expressing Ngn1, NeuroD1 и Lfng. Cells located in the ventral posterior region of the otic cup migrate dorsally to form most of the lateral wall of the otocyst except the neurosensory domain in the antero-ventral region. (D) The newly formed lateral wall of the otocyst continues to receive existing AP и DV signals and further express regional-specific genes. Abbreviations: M, medial; L, lateral; A, anterior; P, posterior; D, dorsal; V, ventral.  Fig. 3. Sensory organ formation in the mouse внутреннего уха. At E10.75, Bmp4 и Lfng are expressed in subsets of cells within the larger Sox2-positive, neurosensory domain of the otocyst. The Bmp4 expression domains, forming a Bmp4-positive anterior streak и a posterior focus, are associated with the three presumptive cristae. Lfng is expressed broadly in the anterior ventral region of the otocyst, associated with the macula utriculi, macula sacculi, organ of Corti и where neuroblasts delaminate. By E11.5, the presumptive anterior и lateral cristae are separate entities. Bmp4 is also expressed in the non-sensory region of the developing cochlear duct. By E12, the broad Lfng expression domain splits into two distinct regions: a dorsal, macula utriculi и a ventral domain that consists of the macula sacculi и organ of Corti, which become distinct entities by E13. Lfng is also expressed in the three cristae by E12 (not shown). A cross-section view of the organ of Corti at P1 shows that Sox2 и Lfng are down-regulated in sensory hair cells but strongly expressed in supporting cells. Abbreviations: GER, greater epithelial ridge; TM, tectorial membrane; HCs, hair cells; H&C, Hensen's и Claudius' cells.
Fig. 3. Sensory organ formation in the mouse внутреннего уха. At E10.75, Bmp4 и Lfng are expressed in subsets of cells within the larger Sox2-positive, neurosensory domain of the otocyst. The Bmp4 expression domains, forming a Bmp4-positive anterior streak и a posterior focus, are associated with the three presumptive cristae. Lfng is expressed broadly in the anterior ventral region of the otocyst, associated with the macula utriculi, macula sacculi, organ of Corti и where neuroblasts delaminate. By E11.5, the presumptive anterior и lateral cristae are separate entities. Bmp4 is also expressed in the non-sensory region of the developing cochlear duct. By E12, the broad Lfng expression domain splits into two distinct regions: a dorsal, macula utriculi и a ventral domain that consists of the macula sacculi и organ of Corti, which become distinct entities by E13. Lfng is also expressed in the three cristae by E12 (not shown). A cross-section view of the organ of Corti at P1 shows that Sox2 и Lfng are down-regulated in sensory hair cells but strongly expressed in supporting cells. Abbreviations: GER, greater epithelial ridge; TM, tectorial membrane; HCs, hair cells; H&C, Hensen's и Claudius' cells.  Fig. 4. A schematic diagram of semicircular canal и common crus formation. (A) Progression of chicken canal pouch development from E2.5 to E6. Signaling molecules such as Bmp4 и Fgfs are secreted from the presumptive cristae (black color) to induce canal genesis zones (blue stars that express Bmp2 и potentially other factors (X, Y и Z). Cells from these canal genesis zones (blue color) contribute to the majority of cells in the canals и some of the cells within the common crus (not shown). Two resorption domains (light yellow color) express Netrin1, Nor-1 и Fgf9 in the epithelia. The center region of the canal pouch (light blue color) that develops into the common crus does not express Bmp2 or Bmp7 и receives low levels of Fgf signaling. Hmx2, Hmx3 и Dlx5 are ubiquitously expressed in the canal pouch. (B) Examples of some typical canal phenotypes among various knockout mouse mutants. Genes responsible for causing each phenotype are in italic. Single asterisk represents data obtained from mouse
and double asterisks represent data from chicken.
Fig. 4. A schematic diagram of semicircular canal и common crus formation. (A) Progression of chicken canal pouch development from E2.5 to E6. Signaling molecules such as Bmp4 и Fgfs are secreted from the presumptive cristae (black color) to induce canal genesis zones (blue stars that express Bmp2 и potentially other factors (X, Y и Z). Cells from these canal genesis zones (blue color) contribute to the majority of cells in the canals и some of the cells within the common crus (not shown). Two resorption domains (light yellow color) express Netrin1, Nor-1 и Fgf9 in the epithelia. The center region of the canal pouch (light blue color) that develops into the common crus does not express Bmp2 or Bmp7 и receives low levels of Fgf signaling. Hmx2, Hmx3 и Dlx5 are ubiquitously expressed in the canal pouch. (B) Examples of some typical canal phenotypes among various knockout mouse mutants. Genes responsible for causing each phenotype are in italic. Single asterisk represents data obtained from mouse
and double asterisks represent data from chicken.