экспрессируются рано и в широком домене и регулируют гены. специфические для нервного гребня и плакод. Они, следовательно, находятся на вершине иерархии, контролирующей спецификацию клеток, которые возникают из пограничной области и скорее всего являются внутриклеточными медиаторами путей передачи сигналов, которые формируют паттерн эктодермы и позицию плакодных территорий рядом с краниальной частью нервной пластинки.
Среди множества транскрипционных факторов, экспрессируемых в преплакодной области, только члены семейств
Six и Eya отмечают точно локализацию всех плакод, но теряются не-плакодной эктодермой. Они участвуют во множественных процессах во время формирования плакод и, следовательно, являются скорее всего кандидатами на роль по вычленению плакодных территорий на ранних стадиях развития
Six and Eya genes in sensory organ formation
Их важность в развитии сенсорных органов первоначально была установлена на Drosophila, где их гомологи sine oculis (so)
и eyes absent (eya) формируют не-линейную регуляторную сеть, которая вместе с dachshund (dac) контролирует развитие глаз и спецификацию фоторецепторных клеток (rev. Kumar and Moses, 2001; Donner and Maas, 2004; Pappu and Mardon, 2004; Rebay, et al., 2005). Потеря любого из этих генов приводит к дефектам или отсутствию глаз (Bonini, et al., 1993; Cheyette, et al., 1994;Mardon, et al., 1994; Quiring, et al., 1994; Serikaku and O'Tousa,
1994), тогда как их избыточная экспрессия ведет к формированию эктопических глаз в ограниченных позициях их имагинальных дисков (Halder, et al., 1995; Bonini, et al., 1997; Chen, et al., 1997; Pignoni, et al., 1997; Shen and Mardon, 1997; Weasner, et al., 2007). Так, eya и dac регулируют экспрессию др. др. и функцию нижестоящего Pax6 гомолога eyeless (ey): их экспрессия и способность индуцировать глаза зависит от присутствия функционального Ey (Halder, et al., 1998; Niimi, et al., 1999; Bui, et al., 2000; Punzo, et al., 2002; Pappu, et al., 2005; for review: Kumar and Moses, 2001; Pappu and Mardon, 2004).
У позвоночных, идентифицированы 6 Six генов (Six1-6), тогда как имеется только 4 гена Eya (Eya1-4) (rev. Kawakami,et al., 2000; Wawersik and Maas, 2000; Hanson, 2001; Rebay, et al., 2005). Из них Six1, Six4, Eya1 и Eya2 обнаруживаются в преплакодной области, тогда как комбинации разных членов семейств коэкспрессируются в зрелых плакодах (Mishima and Tomarev, 1998; Esteve and Bovolenta, 1999; Sahly, et al., 1999; Kobayashi, et al., 2000; Pandur and Moody, 2000; McLarren, et al., 2003;
Bessarab, et al., 2004; Schlosser and Ahrens, 2004; Litsiou, et al.,2005). из семейства генов Eya только Eya3 никогда не был обнаружен в какой-либо плакоде. Как и у мух они часто колокализуются с членами семейства генов Pax (напр., Pax6: lens, olfactory; Pax2: otic and
epibranchial; Pax3: trigeminal), хотя их регуляторные взаимоотношения , по-видимому, более сложны. Напр., в обонятельной эктодерме мышей инициальная экспрессия белков Six3, Eya1 и Dach1 является не зависимой от Pax6, тогда как из поддержание в плакоде нуждается в Pax6 (Purcell, et al., 2005). Сходным образом, в эктодерме презумптивного хрусталика Pax6 контролируется с помощью Six3, но как только сформируется плакода экспрессия Six3 зависит от активности Pax6 (Purcell, et al., 2005; Liu, et al., 2006). В ухе Pax2, Eya1 и Six1 экспрессируются в частично перекрывающихся доменах; экспрессия Eya1 и Six1 не зависит от Pax2, тогда как Six1 зависит от функции Eya1 (Zheng, et al., 2003; Burton, et al., 2004). В преплакоидной области Six и Eya транскрипты присутствуют до начала действия гена Pax и поэтому, скорее всего, действуют независимо. Важность генов Six и Eya для развития нормальных плакод была продемонстрирована с помощью потери функции у мышей, рыбок данио и людей. Eya1 и Six1 активно изучаются и играют роль в формировании большинства производных плкод, что отражает их широко распространенную экспрессию в преплакодной области. Сходным образом мутации в Eya4 и Six5 ассоциируют с дефектами в производных плакод (Klesert, et al., 2000; Wayne, et al., 2001; Zhang, et al., 2004), тогда как информация о Six2 и Eya2 очень бедна. Мыши, лишенные функции Eya2 получены, но фенотип их плакод не описан в деталях (Grifone, et al., 2007). Не описан также фенотип плакод для Six4 мутантных мышей (Ozaki, et al.,2001; Grifone, et al., 2005); одним из возможных объяснений может быть функциональное перекрывание между генами одного и того же семейства, которые обычно ко-экспрессируются. Подтверждают этого, Six1 и -4 двойные нокаутные мыши, обнаруживающие более тяжелый мышечный, почечный и тройничных ганглиев фенотип, чем у одиночных Six1 мутантов (Grifone, et al.,2005; Konishi, et al., 2006; Kobayashi, et al., 2007). Однако, неизвестно, верно ли это и для др. плакод. Мыши, гетерозиготные по Eya1, имеют фенотип, очень сходный с наследуемой формой глухоты у людей, с Branchio-Oto-Renal (BOR) синдромом, формой кондуктивной потери слуха, обусловленной дефектами развития среднего уха (Abdelhak, et al., 1997; Xu, et al., 1999). Мыши, полностью лишенные функции Eya1 имеют тяжелые дефекты внутреннего уха (Johnson, et al., 1999; Xu, et al., 1999; Li, et al.,2003; Zou, et al., 2004; Friedman, et al., 2005; Zou, et al., 2006): отическое развитие арестовывается на стадии пузырька, сенсорные участки остаются маленькими и между тем, как инициально формируемые cochlear-vestibular нейроны, позднее подвергаются апоптозу. Кроме того, тройничный ганглий редуцируется в размере, из epibranchial плакоды происходящие petrosal, geniculate и nodose ганглии, отсутствуют или сильно редуцированы и неспособны экспрессировать гены нейрональной детерминации. Мутанты dogeared рыбок данио (Eya1) также обнаруживают дефекты уха и развитие плакод латеральной линии нарушено, однако, краниальные ганглии в целом не затронуты (Kozlowski, et al., 2005; Whitfield, 2005).
Eya1 мутации у людей также ассоциируют с врожденными дефектами глаз (Azuma, et al., 2000), хотя они не были описаны у мышей. Наконец, мутации в eya-гомологичной области Eya4 ведут к глухоте с поздним началом у людей (Wayne, et al., 2001; Zhang, et al., 2004; Schonberger, et al., 2005). Подобно Eya1, Six1 участвует в нормальном развитии внутреннего уха, а мутации в Six1 человека вызывают синдром BOR подобно Eya1 мутациям (Ruf, et al., 2004). Мыши, лишенные функции Six1 обладают очень сходными фенотипами с мутантными мышами Eya1: отические пузырьки маленькие, отсутствует улитка и полукружные каналы и не формируется кохлеарно-вестибулярный ганглий (Laclef, et al., 2003; Li, et al.,2003; Zheng, et al., 2003; Ozaki, et al., 2004). Кроме того, из тройничной и epibranchial плакод происходящие нейроны редуцируются или отсутствуют, а развитие обонятельного эпителия нарушено. У рыбок данио Six1 способствует формированию волосковых клеток путем увеличения их пролиферации, в то же время ингибируя нейрогенез путем индукции апоптоза (Bricaud and Collazo, 2006). Наконец, мутации Six5 ведут к образованию катаракты в хрусталиках (Klesert, et al., 2000; Sarkar, et al., 2000; Bateman, et al., 2006) и ассоциируют с BOR синдромом у людей (Hoskins, et al., 2007).
Распространенные дефекты почти во всех производных плакод у
Six1 и/или
Eya1 мутантов указывает на законсервированную функцию этой сети во время формирования сенсорных плакод или на вовлечение на очень ранних стадиях развития, может быть вне-плакодной области. К сожалению, ни одно из выше приведенных исследований не исследовало этот вопрос. У
Xenopus функция
Six1 была отнесена к преплакодной стадии (Brugmann, et al., 2004), где он способствует экспрессии др. преплакодных генов, подобных
Eya1, репрессируя нейральную, нервного гребня и эпидермальную судьбы. Эти находки подчеркивают потенциально раннюю роль Six и Eya белков в формировании эктодермального паттерна преплакодной области и и в обеспечении общими преплакодными свойствами. Однако, необходимы дальнейшие исследования, чтобы выяснить их точную роль на этих ранних стадиях.
Molecular function and targets of the Six/Eya/Dach network
Six, Eya и Dach белки, как полагают, взаимодействуют физически и действуют как комплекс транскрипционных факторов, чтобы активировать нижестоящие гены мишени (rev. Relaix and Buckingham, 1999; Kawakami, et al., 2000; Wawersik and Maas, 2000; Hanson,2001; Silver and Rebay, 2005). Six гены кодируют гомеодоменовые ДНК связывающие белки (Seo, et al., 1999; Kawakami, et al., 2000), которые могут действовать как активаторы или репрессоры транскрипции в зависимости от рекрутирования соотв. кофакторов. Одной из групп таких кофакторов являются белки Dach (Mardon, et al., 1994; Hammond, et al., 1998; Davis, et al., 1999), ядерные факторы, которые вместе с др. репрессорами ингибируют транскрипцию генов мишеней. Кроме того, белки Dach сами по себе, по-видимому, соединяются с ДНК (Ikeda, et al., 2002) и модулируют передачу сигналов BMP путем взаимодействия с Smad4 (Wu, et al., 2003; Kida, et al., 2004). Eya белки представлены транскрипционными коактиваторами, которые рекрутируются на ДНК посредством своего взаимодействия с белками Six (Ohto, et al., 1999; Silver, et al.,2003). Недавно было показано, что белки Eya обладают каталитической активностью как протеин фосфатазы и эта активность, по-видимому, необходима для их функции в качестве активаторов (Li, et al., 2003; Rayapureddi, et al., 2003; Tootle, et al., 2003). Непосредственное связывание и в самом деле было показано для Eya и Dach , Six и Eya белков (Chen, et al., 1997; Pignoni, et al., 1997; Ohto, et al., 1999; Ikeda, et al., 2002; Li, et al., 2003; Silver, et al., 2003) а транслокация в ядро белка Eya зависит от его взаимодействия с членами семейства Six (Ohto, et al., 1999). Более того, Groucho репрессоры, как было показано связывают Six белки, в частности Six3 непосредственно и тем самым модулируют их активность (Kobayashi,et al., 2001; Zhu, et al., 2002).
Пока идентифицировано лишь немного непосредственных генов мишеней, среди них cMyc и CyclinA1 и -D1, все участвуют в контроле клеточного цикла (Coletta, et al., 2004; Yu, et al., 2006). В самом деле, Six1 и Eya2, по-видимому, способствуют туморогенезу за счет усиления пролиферации (Coletta, et al., 2004; Zhang, et al., 2005; Yu, et al., 2006), в то время как высокие уровни Eya2, по-видимому, запускают апоптоз (Clark, et al.,2002). В отическом пузырьке потеря Eya1 и Six1 ведет к редукции пролиферации, тогда как у Drosophila потеря so, dac или eya
первоначально приводит к избыточному росту, сопровождаемому клеточной гибелью (Bonini, et al.,1993; Pignoni, et al., 1997; Xu, et al., 1999; Li, et al., 2003; Ozaki, et al., 2004; Kozlowski, et al., 2005; Zou, et al., 2006). У рыбок данио Six1 играет противоположные роли в волосковых клетках и отических нейронах, которые возникают из общих сенсорных участков. Six1 индуцирует апоптоз в нейрональных предшественниках, но способствует пролиферации в сенсорных волосковых клетках (Bricaud and Collazo, 2006), регулируя тем самым баланс между обоими типами клеток. Т.о., Six/Eya/Dach сеть может контролировать количества предшественников плакод во время ранних чтадий развития, дифференциальную пролиферацию и апоптоз во время морфогенеза и количества предшественников для разных типов клеток внутри плакод.
Хотя данные на Drosphila показывают, что кассета Six/Eya/Dach может индуцировать изменения клеточных судеб, приводя к тому, что не глазные клетки принимают глазные судьбы, точные молекулярные механизмы того, как они оперируют во время этого процесса всё ещё неизвестны (Bonini, et al., 1997; Pignoni, et al., 1997; Shen and Mardon, 1997; Weasner, et al., 2007). Eyeless непосредственно регулируется с помощью sine oculis, однако, дальнейшие мишени не идентифицированы. У позвоночных функциональные Six и Eya необходимы для миогенеза (Heanue, et al., 1999; rev. Relaix and Buckingham, 1999), но доказательства, что они контролируют клеточную спецификацию, не затрагивая пролиферацию во время развития плакод, очень бедны. Как упоминалось выше, неправильная экспрессия Six1 способствует экспрессии преплакодных генов (Brugmann, et al.,2004), но сам по себе или в комбинации с Eya недостаточен для генерации зрелых плакод или, чтобы активировать Pax гены (Christophorou and Streit, unpublihsed). Т.к. только клетки внутри преплакодной области компетентны отвечать на сигналы, индуцирующие плакоды, то одной из потенциальных ролей генов Six и Eya может быть придание компетентности таким индуцирующим факторам.
Итак, имеются существенные доказательства критической роли сети Six/Eya/Dach в различных аспектах развития плакод, хотя во многих случаях точные молекулярные механизмы не идентифицированы. Характеристика непосредственных мишеней в разных клеточных контекстах будет важной ступенью в понимании их функции.
Signalling pathways inducing the neural plate border
and the preplacodal region
Образование преплакодной области начинается с серии событий, которые сначала предопределяют границу нервной пластинки и постепенно подразделяют границу на предшественников плакод и нервного гребня. Это достигается посредством взаимодействий с окружающими тканями нервной пластинкой, будущим эпидермисом и подлежащей головной мезодермой - которая секретирует факторы, способствующие или ослабляющие образование плакод. Т.о., разные сигнальные пути конвергируют с позицией плакодных территорий в головной эктодерме по соседству с нервной пластинкой.
FGF pathway
Несколько наблюдений указывают на FGFs как один из факторов, который инициирует образование пограничной области. У эмбрионов кур в необычном месте экспрессия FGF8 быстро индуцирует эктопическую экспрессию ряда генов, обычно ко-экспрессируемых на границе:
ERNI, Sox3, Dlx5 и Msx1 (Streit and Stern, 1999; Streit, et al., 2000; Litsiou, et al., 2005). Однако, FGF сам по себе недостаточен для генерации любого из типов клеток, которые возникают из пограничной области: нейрального гребня и плакод (Mayor, et al., 1997; LaBonne and Bronner-Fraser, 1998; Monsoro-Burq, et al., 2003; Ahrens and Schlosser, 2005; Litsiou, et al., 2005). Напротив, ингибирование FGF, с использованием антагониста SU5402 или доминантно негативных рецепторов, показывает, что активная передача сигналов через путь FGF необходима для, по крайней мере, некоторых пограничных генов (
Sox3, ERNI; Streit, et al., 2000) и для генерации производных пограничной области (Mayor, et al., 1997; LaBonne and Bronner-Fraser, 1998; Monsoro-Burq, et al.,2003; Ahrens and Schlosser, 2005; Litsiou, et al., 2005). Все эти находки говорят в пользу роли FGFs в обеспечении пограничными характеристиками эктодермальных клеток в качестве предварительного условия генерации клеток нервного гребня и плакод. Соотв. FGFs экспрессируются в головной мезодерме и туловищной параксиальной мезодерме, которая приходит, чтобы лечь в основу пограничной области и у
Xenopus по краю нервной пластинки (Niswander and Martin, 1992; Shamim and Mason, 1999; Streit and Stern, 1999; Ahrens and Schlosser,2005).
Кроме того, FGFs, по-видимому, играет роль в индукции преплакоды на слегка более поздней стадии. Передача сигналов FGF от окружающей ткани (головной мезодермы у эмбрионов кур,нервной пластинки у
Xenopus) необходима для индукции преплакодных маркеров, т.к. эктопическая экспрессия
FGF8 способствует экспрессии
Eya2, но не каких-либо др. специфичных для плакод генов (Brugmann, et al., 2004; Ahrens and Schlosser, 2005; Litsiou, et al., 2005). Т.о., FGFs играют двойную роль в поддержании формирования плакод: первоначально они способствуют экспрессии пограничных генов и позднее инициируют экспрессию субнабора преплакодных маркеров.
BMP pathway
Модуляция передачи сигналов BMP широко используется в формировании паттерна ранней эктодермы (Wilson, et al., 1997; Marchant, et al., 1998; Barth, et al., 1999; Tribulo, et al., 2003; for review Sasai and De Robertis, 1997; Aybar and Mayor, 2002; Stern, 2005). В самом деле, FoxiI зависит от передачи сигналов BMP у рыб и лягушек (Matsuo-Takasaki, et al., 2005; Phillips, et al., 2006). У рыбок данио экспрессия FoxiI редуцируется или теряется у BMP7 и BMP2a мутантов, тогда как она подавляется у Xenopus в присутствии антагониста BMP, Chordin. Напротив, избыточная экспрессия BMP4 вызывает экспансию FoxiI за счет нервной ткани. Сходным образом передача сигналов BMP необходима для экспрессии гена Dlx у эмбрионов кур, лягушек и рыб (Nguyen, et al., 1998; Feledy, et al., 1999; Pera, et al., 1999; Luo, et al., 2001), в то время как Msx1 является непосредственной мишенью для передачи сигналов BMP и обеспечивает их способность содействовать эпидермису (Suzuki, et al., 1997). Эти находки указывают на участие BMP активности, подобно передаче сигналов FGF в регуляции пограничных специфических генов.
Одна модель в основном базируется на экспериментах на
Xenopus она предполагает, что градиент активности BMP внутри эктодермы действует, чтобы предопределить разные клеточные судьбы (Sasai and De Robertis, 1997; Aybar and Mayor, 2002; Vonica and Brivanlou, 2006). В подтверждение этой идеи анимальные шапочки
Xenopus обрабатывали различными концентрациями антагонистов BMP, происходило формирование эпидермиса в присутствии высоких уровней активности BMP, тогда как клетки нервного гребня и преплакод генерировались при промежуточных уровнях, а нервная пластинки при низких уровнях (Wilson, et al., 1997; Tribulo, et al., 2003;
Brugmann, et al., 2004; Glavic, et al., 2004). Сходным образом, мутанты рыбок данио с пониженной активностью BMP (и т.о. с более отлогим градиентом) обнаруживают довольно крупную экспансию террирории нервного гребня, чем нервной пластинки (Nguyen, et al., 1998; Barth, et
al., 1999). Однако, территория плакод в основном замещалась,
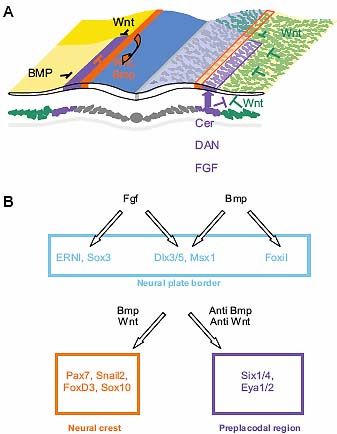 Fig. 3. Model for induction of the preplacodal region. (A) The diagram shows a cross section through a chick embryo at the 2-4 somite stage
viewed from anterior towards posterior (modified from Litsiou, et al.,
2005). Ectodermal signals that influence the position of the preplacodal
region are schematised on the left, whereas mesoderm derived signals
are shown on the right. The preplacodal region (purple) is surrounded by
inhibitory signals from the lateral (light yellow; BMP) and posterior
(yellow; Wnt) ectoderm, from the neural folds (orange; Wnt, BMP) and
from the lateral and posterior mesoderm (green; Wnt). FGF, Wnt antagonists
and BMP antagonists (purple) from the mesoderm underlying the
preplacodal region protect the overlying ectoderm from these inhibitory
signals and allow the formation of placode precursors. (B) Signals and
transcription factors in the border and preplacodal region. FGFs and
BMPs act upstream of border specific transcription factors. Once the
border is established, levels of BMP and Wnt signalling determine
whether border cells generate neural crest or placode cells.
Fig. 3. Model for induction of the preplacodal region. (A) The diagram shows a cross section through a chick embryo at the 2-4 somite stage
viewed from anterior towards posterior (modified from Litsiou, et al.,
2005). Ectodermal signals that influence the position of the preplacodal
region are schematised on the left, whereas mesoderm derived signals
are shown on the right. The preplacodal region (purple) is surrounded by
inhibitory signals from the lateral (light yellow; BMP) and posterior
(yellow; Wnt) ectoderm, from the neural folds (orange; Wnt, BMP) and
from the lateral and posterior mesoderm (green; Wnt). FGF, Wnt antagonists
and BMP antagonists (purple) from the mesoderm underlying the
preplacodal region protect the overlying ectoderm from these inhibitory
signals and allow the formation of placode precursors. (B) Signals and
transcription factors in the border and preplacodal region. FGFs and
BMPs act upstream of border specific transcription factors. Once the
border is established, levels of BMP and Wnt signalling determine
whether border cells generate neural crest or placode cells.
а не расширялась и разные плакоды затрагивались по-разному, что говорит против модели простого градиента (Neave, et al., 1997; Nguyen, et al., 1998). У эмбрионов кур главной областью, чувствительной к модуляции передачи сигналов BMP явился край самой нервной пластинки (Streit and Stern,1999). Здесь эктопическая экспрессия BMP антагонистов ведет к сдвигу границы в направлении не-нейральной эктодермы, тогда как эктопическая экспрессия BMP4 сужает нервную пластинку и сдвигает границу медиально. Напротив, модуляция BMP пути вдали от границы не оказывала какого-либо эффекта. Сходным образом, локальная редукция передачи сигналов BMP вблизи преплакодной области расширяет эту территорию у эмбрионов кур и
Xenopus, но недостаточна, чтобы индуцировать её эктопически в будущем эпидермисе (Glavic, et al., 2004; Ahrens and Schlosser, 2005; Litsiou, et al., 2005). Единственное возможное объяснение, примиряющее эти различия, что анимальная шапочка
Xenopus может содержать пограничную территорию и является поэтому чувствительной к изменениям активности BMP. Т.о., модуляция активности BMP и эксперименты по потере или избыточной функции для транскрипционных факторов, специфичных для пограничной области, обнаруживают сходный эффект: они сдвигают границу нервной пластинки. Следовательно, вполне возможно, что передача сигналов BMP осуществляется посредством медиаторов, таких как FoxiI, Dlx и Msx, чтобы косвенно изменять экспрессию преплакодных генов.
Wnt pathway
Как обсуждалось выше пути FGF и BMP модулируют экспрессию преплакодных генов: FGF8 активирует Eya2, в то время как ингибирование передачи сигналов BMP расширяет область преплакодных маркеров (Brugmann, et al., 2004; Ahrens and Schlosser, 2005; Litsiou, et al., 2005). Однако, даже комбинации FGF им антагонистов BMP недостаточно, чтобы индуцировать преплакодные характеристики в эктодерме вне эндогенной плакодной территории или в будущей эктодерме туловища (Brugmann, et al., 2004; Ahrens and Schlosser, 2005; Litsiou, et al., 2005). Подобно ингибированию BMP, эктопическая экспрессия антагонистов Wnt ведет к экспансии экспрессии преплакодных генов за счет будущего эпидермиса (Brugmann, et al., 2004; Litsiou, et al., 2005). Интересно, что
Six1, -4 и Eya2 также расширяют область своей экспрессии в эктодерме туловища, где обычно не происходит образование плакод. Напротив. активация канонической передачи сигналов Wnt репрессирует экспрессию преплакодных генов, указывая тем самым, что истощение Wnt делает возможной спецификацию предшественников плакод (Litsiou, et al., 2005). Более того, комбинация FGF с Wnt и BMP антагонистами индуцирует эктопическую преплакодную область в исходной эктодерме в отсутствие нервной и мезодермальной ткани, указывая тем самым, что эти факторы непосредственно обеспечивают плакодные характеристики (Litsiou, et al., 2005).
Т.о., временная и пространственная интеграция всех трех сигналов важна для генерации предшественников плакод. В отличие от предшественников плакод клетки нервного гребня нуждаются в канонической передаче сигналов Wnt (rev. Aybar and Mayor, 2002; Knecht and Bronner-Fraser, 2002). Эти находки указывают на то, что на граница нервной пластинки подвергается действию разных уровней активности Wnt, которые детерминируют будут ли клетки адоптировать судьбу плакод или нервного гребня. В самом деле, активация предачи сигналов Wnt расширяет область маркеров нервного гребня на территорию плакод, тогда как ингибирование оказывает противоположный эффект (Litsiou, et al., 2005). В этом контексте интересно, что на чуть более поздних стадиях, когда начинают формироваться отические плакоды, передача сигналов Wnt способствует формированию плакод: Pax2
+ клетки, которые активируют этот путь становятся отическими, тогда как те, что не делают этого развиваются в эпидермис (Ohyama, et al., 2006). Эти находки подчеркивают, что интерпретация одного и того же сигнального пути сильно зависит от контекста и предопределяется с помощью истории развития индивидуальных клеток.
A model for induction of the preplacodal region
Данные, суммированные выше подчеркивают, что индукция преплакодной области являются многоступенчатым процессом, который нуждается в интеграции различных сигналов, продуцируемых разными тканями. Согласно модели происходит интеграция тканевых взаимодействий и сигнальных путей (Fig. 3). В качестве первой ступени закладывается пограничная область на ст. ранней нейрулы между будущими нейральными и эпидермальными клетками. Гены, специфичные для этой области, находятся под контролем передачи сигналов FGF и/или BMP. BMP4 и -7 экспрессируются в не-нейральной эктодерме, а уровни транскриптов и активности phospho-smad наивысшие на краю нервной пластинки (Fainsod, et al., 1994; Streit, et al., 1998; Streit and Stern, 1999; Faure, et al., 2002), это в свою очередь ведет к позитивной регуляции некоторых пограничных генов (Dlx, Msx, FoxiI ). FGFs испускаются из организатора и мезодермы, лежащей под границей, чтобы поддерживать экспрессию Sox3 и ERNI и кооперировать с BMPs, способствуя экспрессии генов Dlx и Msx. Будучи установленной граница дает два разных типа клеток: нервного гребня и плакод. Транскрипты BMP4 и -7 концентрируются в формирующихся нервных складках (Fainsod, et al., 1994; Liem, et al., 1995), в которых начинают экспрессироваться Wnts; вместе они обеспечивают образования клеток нервного гребня. Будущая кардиальная мезодерма увеличивается кпереди и оказывается лежащей под территорией плакод (Kimmel and Warga, 1988; Keller and Tibbetts, 1989; Tam, et al., 1997; Redkar, et al., 2001; Hochgreb, et al., 2003).
Эта ткани экспрессирует FGF4, BMP антагониста DAN и Wnt ингибитор Cerberus (Ogita, et al., 2001), тогда как более латеральная и задняя мезодерма содержит высокие уровни Wnt8c (Hume and Dodd, 1993; Litsiou, et al., 2005). Wnt6 обнаружена в туловищной, но не в головной эктодерме (Garcia-Castro, et al., 2002; Schubert, et al., 2002). Т.о., преплакодная область окружена ингибирующими факторами со своих медиального, латерального и заднего краёв. Сигналы от кардиальной мезодермы защищают лежащую поверх эктодерму от этих ингибирующих влияний и позволяют адоптировать судьбу плакод.
Anterior-posterior patterning of the preplacodal region
Внутри преплакодной области предшественники для разных плакод перемешаны, хотя некоторое разделение индивидуальных популяций вдоль передне-задней оси уже выявляется. Предшественники для передних плакод (аденогипофиза, обонятельных, хрусталиковых) располагаются в ростральной части преплакодной области, тогда как предшественники для задних плакод (тройничной, эпибранхиальной, отической, латеральной линии) ограничены более каудально (D'Amico-Martel and Noden, 1983; Couly and Le Douarin, 1985; Couly and Le Douarin, 1988; Kozlowski, et al., 1997; Streit, 2002; Bhattacharyya, et al., 2004; Litsiou, et al., 2005). Такое приблизительное подразделение отражается по началу регионально ограниченной экспрессии транскрипционных факторов (и немногих др. генов), сразу же после индукции территорий плакод. По ходу развития преплакодная область становится молекулярно подразделенной на постепенно всё уменьшающиеся субдомены, так что ко времени, когда плакоды можно идентифицировать морфологически, каждая, по-видимому, обладает уникальным кодом транскрипционных факторов (Torres and Giraldez,
1998; Bailey and Streit, 2006; Schlosser, 2006). Эти изменения
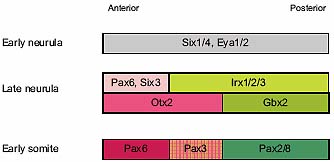 Fig. 4. Anterior-posterior patterning of the preplacodal region. At
early neurula stages preplacodal markers are expressed along the entire
length of the preplacodal region (anterior to the left, posterior to the right). Soon thereafter, regionalised gene expression is apparent: Pax6, Six3 and Otx2 are concentrated anteriorly, while Irx1-3 and Gbx2 are restricted posteriorly. At early somite stages Pax3 is upregualted in the ophthalmic part of the trigeminal region and Pax2 and -8 in the otic/epibranchial territory. Note: the relative boundaries of gene expression are inferred from data in the literature that show in situ hybridisation with a single gene (references see text). Double in situ hybridisation is required to confirm this model
Fig. 4. Anterior-posterior patterning of the preplacodal region. At
early neurula stages preplacodal markers are expressed along the entire
length of the preplacodal region (anterior to the left, posterior to the right). Soon thereafter, regionalised gene expression is apparent: Pax6, Six3 and Otx2 are concentrated anteriorly, while Irx1-3 and Gbx2 are restricted posteriorly. At early somite stages Pax3 is upregualted in the ophthalmic part of the trigeminal region and Pax2 and -8 in the otic/epibranchial territory. Note: the relative boundaries of gene expression are inferred from data in the literature that show in situ hybridisation with a single gene (references see text). Double in situ hybridisation is required to confirm this model
в экспрессии генов недавно рассмотрены в деталях на (Schlosser, 2006) и поэтому только некоторые из ранних аспектов будут рассмотрены ниже.
Transcription factors in anterior-posterior patterning
На ст. нейрулы ростральная преплакодная область начинает экспрессировать Otx2, Six3, Pitx3, Dmbx1 и Pax6, тогда как её каудальная часть характеризуется Irx1, -2, -3 и Gbx2 (Li, et al., 1994; Bally-Cuif, et al., 1995; Oliver, et al., 1995; Pannese, et al., 1995; Hirsch and Harris, 1997; Bellefroid, et al., 1998; Gomez-Skarmeta, et al.,1998; Shamim and Mason, 1998; Goriely, et al., 1999; Zhou, et al., 2000; Glavic, et al., 2002; Gogoi, et al., 2002; Matsumoto, et al., 2004; Dutta, et al., 2005; Zilinski, et al., 2005; Liu, et al., 2006; for review: Schlosser, 2006). Хотя эти паттерны, по-видимому, грубо комплементарны, но более тщательная проверка показывает, что разные транскрипты не принимают участие в одной и той же ростро-каудальной границе (Fig. 4). Скорее всего пары транскрипционных факторов имеют границы на разных уровнях: экспрессия Six3 граничит с Irx, тогда как Otx2 и Gbx2 граничат на более каудальных уровнях. Эти паттерны очень напоминают их экспрессию в нервной пластинке, где те же самые пары генов контролируют подразделение головного мозга на разные компартменты (for review: Martinez, 2001; Nakamura, 2001; Hidalgo-Sanchez, et al., 2005). Gbx2 и Otx2 участвуют в позиционировании границы между средним и задним мозгом (Broccoli, et al.,1999; Millet, et al., 1999; Katahira, et al., 2000; Acampora, et al., 2001; Li and Joyner, 2001), тогда как Six3 и Irx3 предопределяют границу переднего мозга, которая позднее соответствует zona limitans intrathalamica (Kobayashi, et al., 2002).
На ранней сомитной стадии члены семейства генов Pax начинаю экспрессироваться в более ограниченных доменах внутри преплакодной области (Bang, et al., 1997; Hirsch and Harris, 1997 Li, 1994 #195; Stark, et al., 1997; Heller and Brandli, 1999; Groves and Bronner-Fraser, 2000). Pax3 обнаруживается в офтальмической части плакоды тройничного нерва, Pax8 в отической плакоде, а Pax2 на эпибранхиальной, отической и боковой линии территории. Вместе гены Pax покрывают всю плакодную область в виде не перекрывающихся паттернов за исключением Pax2 и -8, которые ко-экспрессируются в будущей отической плакоде. Интересно, что в нервной пластинке Pax2 и -6 представляют собой др. пару транскрипционных факторов, которые позиционируют границу, в данном случае между будущим diencephalon и mesencephalon (Okafuji, et al., 1999; Schwarz, et al., 1999; Matsunaga, et al., 2000; Schwarz, et al., 2000). Как и в случаях с Six3/Irx3 и Otx2/Gbx2, в головном мозге Pax2 и -6 негативно прекресно регулируют др. др., приводя к возникновению острой молекулярной границы и разделению клеток разных судеб. Можно предположить, что одни и те же молекулярные механизмы, которые формируют паттерн головного мозга, оперируют также по созданию региональных характеристик плакод.
Потеря функции Otx2 приводит к тяжелым дефектам головы, включая головной мозг, обонятельные и хрусталиковые плакоды, а также паттерна зрительных пузырьков (Acampora, et al., 1995; for review: Acampora, et al., 2001). Однако, из-за тяжелых дефектов переднего и среднего мозга трудно оценить его непосредственную функцию в развитии плакод. Мыши, дефицитные по Gbx2 (Lin, et al., 2005) и Pax2 функции обнаруживают дефекты формирования паттерна в отических пузырьках (Torres, et al., 1996; Burton, et al., 2004), тогда как потеря Six3 или Pax6 затрагивают развитие хрусталиков и обонятельных плакод (Hogan, et al., 1988; Quinn, et al., 1996; Grindley, et al., 1997; Lagutin, et al., 2003; Liu, et al., 2006). У
Xenopus, Irx1 необходим для экспрессии раннего преплакодного маркера Six1 и генов, позднее специфичных для плакод, подобных
Sox2 и Pax2 (Glavic, et al., 2004). T.о., мутации в или потери любого из этих генов ведут к дефектам развития плакод, хотя их роль в формировании раннего паттерна преплакодной области остается неясной и это возможно связано с функциональным перекрыванием с др. членами того же семейства, которые экспрессируются в виде сходных паттернов (Schlosser, 2006).
Signalling pathways in anterior-posterior patterning
В нервной пластинке региональные характеристики первоначально закладываются посредством градированной активности Wnts, FGF и ретиноевой кислоты, каждый из которых обладает posteriorising активностью и контролирует некоторые из транскрипционных факторов, описанные выше (for review: Yamaguchi, 2001; Wilson and Houart, 2004; Kiecker and Lumsden, 2005; Rhinn, et al., 2006). Обеспечивают ли одни и те же сигнальные пути контроль формирования передне-заднего паттерна в преплакодной области? Эксперименты на
Xenopus показали, что формирование клеток нервного гребня, в самом деле, нуждается в активности Wnt и ретиноевой кислоты и что передние части нервных складок, которые обычно не генерируют клеток нервного гребня, делают это в присутствии этих факторов (Villanueva, et al., 2002). У кур и Xenopus экспрессия преплакодных маркеров может быть увеличена в туловищную эктодерму в присутствие антагонистов Wnt (Brugmann, et al., 2004; Litsiou, et al., 2005). Напротив, мутанты рыбок данио
masterblind и headless, у которых передача сигналов Wnt избыточно активирована, обнаруживают потерю передних плакод (хрусталиковой, обонятельной), но экспансию тройничных нейронов вблизи передней части нервной пластинки (Kim, et al., 2000; Heisenberg, et al., 2001). Т.о., дифференциальная активация пути Wnt вдоль ростро-каудальной оси влияет на формирование паттерна преплакодной области, указывая тем самым, что механизмы, которые обеспечивают региональные качественные особенности в нервной пластинке, могут действовать более глобально формируя паттерн всей эктодермы.
Cells in the preplacodal region share a common developmental programme
Плакоды формируют разнообразные структуры с разными функциональными свойствами и разнообразием типа клеток. Кроме того, они по-разному группируются вместе как семейство и рассматриваются как родственные структуры. Отражает ли такая группировка содержательную онтогенетическую концепцию и представляет ли собой преплакодная область 'basic placode state'? По крайней мере, два условия д. быть выполнены. Во-первых, на определенной временной точке вдоль их онтогенетической истории плакодные клетки д. приобретать уникальное состояние, которое отличает их от эктодермальных производных. Очевидно, что предшественники плакод оккупируют уникальную область эмбриональной эктодермы, ближайшую к краниальной нервной пластинке и они экспрессируют уникальный набор молекулярных маркеров. Более того, преплакодная область индуцируется с помощью специфической комбинации из тканей и сигналов. которые отличаются от сигналов, которые индуцируют нейральные, нервного гребня и эпидермальные предшественники. Во-вторых, и что более важно 'преплакодное состояние' д. быть уникальным свойством предшественников плакод и быть обязательным условием для превращения в зрелые плакоды.
Недавние эксперименты по отической индукции у эмбрионов кур предоставили строгие доказательства, что на самом дле эктодермальные клетки д. приобретать преплакодное состояние прежде чем они станут чувствительны к отическому индуктору FGF (Martin and Groves, 2006). Только клетки внутри преплакодной территории чувствительные к FGF, в то время как будущие эпидермальные клетки нет. Передняя часть эпибласта со стадии гаструлы эмбрионов кур обычно никогда не дает отических плакод, но является компетентной делать это при трансплантации в эктодерму, соседствующую с задним мозгом, где обычно и формируются отические плакоды. Сходным образом, эксперименты с передней частью эпибласта не обнаруживают экспрессии отических маркеров, если культивируют его в изоляции или когда обрабатывают FGF. Однако, если та же самая ткань впервые трансплантируется в преплакодную область на короткий период (~ 8 ч), то инициируется экспрессия генов, характерных для этой территории (Eya2, Dlx) и теперь после эксплантации отвечает на FGF экспрессией отических маркеров. Эти эксперименты подтверждают идею, что преплакодная область обладает уникальными свойствами и подтверждают, что приобретение преплакодных характеристик является важной ступенью в отической индукции и обязательным условием для формирования клетками зрелых плакод.
Но все ли предшественники плакод обладают общей онтогенетической историей? Недавние доказательства показывают, что очень маловероятно, что они исходно обладали общими характеристиками: в отличие от любой др. части эктодермы, вся преплакодная область специфицируется как хрусталики (Bailey, et al., 2006). Когда преплакодная область подразделяется на четыре порции вдоль передне-задней оси и культивируется в нейтральных условиях, то не обнаруживаются маркеры, специфичные для обонятельных, trigeminal или отических плакод - ткань не специфицируется. Однако, в том же самом эксперименте экспланты от всех частей преплакодной области, даже клетки, которые обычно никогда не вносят вклада в хрусталик,а в отические плакоды, формируют хрусталикоподобные структуры. Эти экспланты следуют той же самой последовательности и времени экспрессии генов, которые наблюдаются во время нормального развития хрусталика: они первоначально экспрессируют Pax6, сопровождаемый L-maf и Foxc1 и наконец, δ- и α-crystallin. Т.о., все плакодные клетки независимо от их конечной судьбы первоначально обладают характеристиками хрусталика, подтверждая, что индукция нормального развития плакод интимно связана с супрессией хрусталика. Хрусталики, по-видимому, сначала представляли собой простейшие производные плакод: они генерировали только два типа клеток, хрусталиковые волокна и хрусталиковые эпителиальные клетки. Лишь др. не-нейрогенные плакоды, передняя часть гипофиза, которая развивается в переденей части срединной линии, легко трансформируется в хрусталик в отсутствие sonic hedgehog от подлежащих аксиальных структур (Sbrogna, et al., 2003; Dutta, et al., 2005; Zilinski, et al., 2005). В противоположность хрусталикам и переденй части гипофиза все остальные плакоды дают сенсорные нейроны и/или сенсорные клетки. Т.о., супрессия хрусталиков д. сопровождаться приобретением нейрогенных свойств у нехрусталиковых плакод. Итак, эти результаты подтверждают концепцию общего исходного состояния для всех сенсорных плакод и значение преплакодной области в онтогенетической истории клеток плакод.
Каковы же сигналы, репрессирующие хрусталик? FGFs, по-видимому, являются основными игроками в инициации хрусталиковой репрессии: активация пути FGF ингибирует экспрессию презумптивного хрусталикового маркера Pax6 (Bailey, et al., 2006). FGFs (FGF3, FGF10, FGF19 в зависимости от видов) также играют важную роль в отической индукции (Ladher, et al., 2000; Vendrell, et al., 2000; Leger and Brand, 2002; Maroon, et al., 2002; Wright and Mansour, 2003) а спецификация хрусталиков устраняется в преплакодных эксплантах в присутствии FGF2, тогда как отический маркер Pax2 индуцируется (Bailey and Streit, unpublished). Напротив, воздействие FGF8 достаточно, чтобы индуцировать обонятельные характеристики в эктодерме, специфицированной давать хрусталик (Bailey, et al., 2006). Наконец, передача сигналов FGF (FGF3, -8) участвует в спецификации epibranchial плакод и в генерации аденогипофиза, плакоды, формирующейся в передней части срединной линии (Herzog, et al., 2004; Nechiporuk, et al., 2007; Nikaido, et al., 2007; Sun, et al., 2007). Т.о., FGFs играют ключевую роль в ограничении хрусталиковой судьбы и одновременно в индукции др. плакод. Остается нерешенным вопрос, как активация одного и того же сигнального пути в преплакодной области вызывает разные реакции, ведущие к образованию плакод с разными характеристиками.
Future perspectives
In summary, prior to the appearance of morphological placodes
induction of the preplacodal region is an essential process,
which imparts unique identity to all placode precursors. The
signalling pathways involved are similar to those implicated in
neural and neural crest induction, however, timing and levels
differ. Recent evidence argues that all placodes initially share a
common ground state as lens and thus possess a common
developmental history, before they diversify later. Surprisingly,
FGF signalling appears to play a role during the induction of
different placodes from this ground state. The future challenge is
to unravel how different pathways cooperate with FGF signalling
to impart placode identity and to establish networks of transcription
factors that control this process.
Сайт создан в системе
uCoz
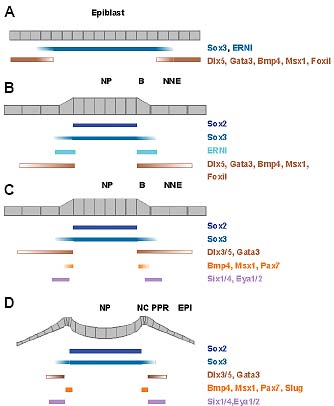 Fig. 2. Changes in gene expression from gastrula to early somite
stages. Diagrams show a cross section through chick embryos at
gastrula (A), head process (B), 1-2-somite (C) and 4-5-somite (D) stages.
(A) At gastrula stages, the epiblast is roughly subdivided into neural and
non-neural territories. (B)The neural plate can be identified morphologically
expressing definitive neural markers (Sox2), while preneural markers
(ERNI) become confined to the border, where non-neural markers
become upregulated (Dlx5, Gata3, BMP4, Msx1, FoxiI). (C) Preplacodal
markers begin to be expressed (Six1, Six4, Eya2); there is some overlap
between BMP4, Msx1 and Pax7, which are later confined to the neural
folds where neural crest cells arise. (D) Neural folds are morphologically
distinct and express neural crest cells markers (Slug, Pax7). There is no
overlap between neural crest and preplacodal genes. NP, neural plate; B,
border; NNE, non-neural ectoderm; NC, neural crest; PPR, preplacodal
region; EPI, future epidermis.
Fig. 2. Changes in gene expression from gastrula to early somite
stages. Diagrams show a cross section through chick embryos at
gastrula (A), head process (B), 1-2-somite (C) and 4-5-somite (D) stages.
(A) At gastrula stages, the epiblast is roughly subdivided into neural and
non-neural territories. (B)The neural plate can be identified morphologically
expressing definitive neural markers (Sox2), while preneural markers
(ERNI) become confined to the border, where non-neural markers
become upregulated (Dlx5, Gata3, BMP4, Msx1, FoxiI). (C) Preplacodal
markers begin to be expressed (Six1, Six4, Eya2); there is some overlap
between BMP4, Msx1 and Pax7, which are later confined to the neural
folds where neural crest cells arise. (D) Neural folds are morphologically
distinct and express neural crest cells markers (Slug, Pax7). There is no
overlap between neural crest and preplacodal genes. NP, neural plate; B,
border; NNE, non-neural ectoderm; NC, neural crest; PPR, preplacodal
region; EPI, future epidermis.  Fig. 3. Model for induction of the preplacodal region. (A) The diagram shows a cross section through a chick embryo at the 2-4 somite stage
viewed from anterior towards posterior (modified from Litsiou, et al.,
2005). Ectodermal signals that influence the position of the preplacodal
region are schematised on the left, whereas mesoderm derived signals
are shown on the right. The preplacodal region (purple) is surrounded by
inhibitory signals from the lateral (light yellow; BMP) and posterior
(yellow; Wnt) ectoderm, from the neural folds (orange; Wnt, BMP) and
from the lateral and posterior mesoderm (green; Wnt). FGF, Wnt antagonists
and BMP antagonists (purple) from the mesoderm underlying the
preplacodal region protect the overlying ectoderm from these inhibitory
signals and allow the formation of placode precursors. (B) Signals and
transcription factors in the border and preplacodal region. FGFs and
BMPs act upstream of border specific transcription factors. Once the
border is established, levels of BMP and Wnt signalling determine
whether border cells generate neural crest or placode cells.
Fig. 3. Model for induction of the preplacodal region. (A) The diagram shows a cross section through a chick embryo at the 2-4 somite stage
viewed from anterior towards posterior (modified from Litsiou, et al.,
2005). Ectodermal signals that influence the position of the preplacodal
region are schematised on the left, whereas mesoderm derived signals
are shown on the right. The preplacodal region (purple) is surrounded by
inhibitory signals from the lateral (light yellow; BMP) and posterior
(yellow; Wnt) ectoderm, from the neural folds (orange; Wnt, BMP) and
from the lateral and posterior mesoderm (green; Wnt). FGF, Wnt antagonists
and BMP antagonists (purple) from the mesoderm underlying the
preplacodal region protect the overlying ectoderm from these inhibitory
signals and allow the formation of placode precursors. (B) Signals and
transcription factors in the border and preplacodal region. FGFs and
BMPs act upstream of border specific transcription factors. Once the
border is established, levels of BMP and Wnt signalling determine
whether border cells generate neural crest or placode cells. Fig. 4. Anterior-posterior patterning of the preplacodal region. At
early neurula stages preplacodal markers are expressed along the entire
length of the preplacodal region (anterior to the left, posterior to the right). Soon thereafter, regionalised gene expression is apparent: Pax6, Six3 and Otx2 are concentrated anteriorly, while Irx1-3 and Gbx2 are restricted posteriorly. At early somite stages Pax3 is upregualted in the ophthalmic part of the trigeminal region and Pax2 and -8 in the otic/epibranchial territory. Note: the relative boundaries of gene expression are inferred from data in the literature that show in situ hybridisation with a single gene (references see text). Double in situ hybridisation is required to confirm this model
Fig. 4. Anterior-posterior patterning of the preplacodal region. At
early neurula stages preplacodal markers are expressed along the entire
length of the preplacodal region (anterior to the left, posterior to the right). Soon thereafter, regionalised gene expression is apparent: Pax6, Six3 and Otx2 are concentrated anteriorly, while Irx1-3 and Gbx2 are restricted posteriorly. At early somite stages Pax3 is upregualted in the ophthalmic part of the trigeminal region and Pax2 and -8 in the otic/epibranchial territory. Note: the relative boundaries of gene expression are inferred from data in the literature that show in situ hybridisation with a single gene (references see text). Double in situ hybridisation is required to confirm this model