Origin of Stem Cells in Organogenesis | |
|
The development of individual organs in animal embryos involves the formation of tissue-specific stem cells that sustain cell renewal of their own tissue for the lifetime of the organism. Although details of their origin are not always known, tissue-specific stem cells usually share the expression of key transcription factors with cells of the embryonic rudiment from which they arise, and are probably in a similar developmental state. On the other hand, the isolation of pluripotent stem cells from the postnatal organism has encouraged the formulation of models of embryonic and postnatal development that are at variance with the conventional ones. Possible explanations for the existence of such cells, and the issue of whether they also exist in vivo, are discussed.
|
Тело животных и человека состоит из различных популяций стволовых клеток, которые поддерживают оборот клеток в соотв. тканях. Откуда происходят эти клетки? Они д. возникать из эмбрионов - но ранние эмбрионы до стадии образования органов, не содержат стволовых клеток. Этот кажущийся парадокс возникает из-за обычного определения стволовых клеток как недифференцированных клеток, которые могут самообновляться бесконечно и могут давать, по крайней мере, один тип дифференцированного потомства. Это определение было предложено почти 30 лет тому назад Lajtha (1) в теоретической работе, в которой идентифицировано большинство из ключевых признаков поведения стволовых клеток, которые считаются важными и сегодня. Они включают различия между стволовыми клетками (которые самообновляются) и трансамплифицирующимися клетками (которые предназначены к дифференцировке после определенного количества делений); это появление асимметричных делений; необходимость. чтобы стволовые клетки самообновлялись в течение всей жизни организма; и существование ниш стволовых клеток [микроусловий, формируемых др. клетками, которые поддерживают стволовые клетки - концепция, предложенная Schofield (2)].
Эти свойства принадлежат стволовым клеткам взрослых млекопитающих, таким как эпидермис, гематопоэтическая система, или кишечный эпителий (3-7). Однако ранние эмбрионы не содержат стволовых клеток в этом смысле, т.к. все клетки эмбрионов позвоночных до начала органогенеза предопределены к изменению своего характера по ходу развития. Embryonic stem (ES) клетки, растущие в культуре обнаруживают неограниченное самообновление, но их нормальные предшественники внутри эмбриона нет, т.к. они вскоре превращаются в клетки трех зародышевых слоев: эктодермы. мезодермы и энтодермы. Напр., источник гематопоэтических стволовых клеток у эмбрионов мышей, изученный детально, и известно, что клетки, способные к долговременной репопуляции облученных животных, отсутствуют у ранних эмбрионов и появляются только примерно на 10.5 день развития (8).
Термин "клетки предшественники" означает, что клетка находится в переходном состоянии, предназначенном, в конечном итоге, стать дифференцированным типом. По этому определению все митотические клетки в раннем эмбрионе являются клетками-предшественниками, включая in vivo предшественники ES клеток, которые локализуются во внутренней клеточной массе эмбриона или эпибласте. Временно амплифицирующиеся клетки постнатальных тканей, в которых наблюдается высокий уровень оборота ["обновляемые ткани" (9)] также являются клетками предшественниками. Однако дифференцированные клетки, которые делятся медленно и просто воспроизводят самих себя-такие как панкреатические β-клетки или гепатоциты-не могут рассматриваться как клетки предшественники, т.к. не являются предшественниками кроме самих себя. Некоторые предпочитают определение "стволовые клетки" , что сопоставимо лишь с кратковременным существованием. Но такое определение неудобно из-за упразднения различий между стволовыми клетками и клетками предшественниками. Hierarchy in Development Образование ткане-специфических стволовых клеток является одним из аспектов органогенеза. Региональная спецификация эмбрионального развития осуществляется иерархически. Начиная с бластулы (или бластодермы или эпибласта, в зависимости от вида) формируется определенный тканевой рудимент или тип клеток за счет последовательных онтогенетических решений. Напр., предшественники β-клеток в поджелудочной железе млекопитающих подвергаются серии онтогенетических предопределений, чтобы стать дефинитивной энтодермой, энтодермой передней кишки, дорсальным или вентральным панкреатическим зачатком, эндокринными клетками предшественниками и наконец β клетками (10) (Fig. 1). На каждой ступени активируется или репрессируется определенная комбинация транскрипционных факторов в ответ на определенные внеклеточные сигналы (наз. "индуцирующими факторами" в эмбриональном контексте). Каждая ступень ведет к множественным путям, предоставляющими онтогенетический "выбор". Разные концентрации индуцирующего фактора д. вызывать активацию или репрессию генов, кодирующих разные транскрипционные факторы и, следовательно, к выбору разных онтогенетических путей. Повторение этого процесса и делает ранний эмбрион состоящий первоначально из простой массы сходных клеток в развитый автономный организм с очень сложным паттерном структур.
Поджелудочная железа возникает из двух энтодермальных зачатков у млекопитающих
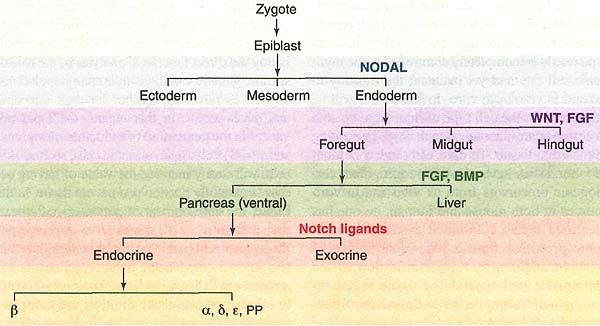 Fig. 1. The developmental hierarchy. This shows the normally accepted mode of formation of pancreatic P cells, involving six developmental steps, each controlled by one or more inducing factors. The inducing factors (NODAL, WNT, FGF, BMP, Notch ligands) are shown in color. The final step distinguishes the insulin-producing p cells from other types of endocrine cell also present in pancreatic islets (α, δ, ε, PP).
Fig. 1. The developmental hierarchy. This shows the normally accepted mode of formation of pancreatic P cells, involving six developmental steps, each controlled by one or more inducing factors. The inducing factors (NODAL, WNT, FGF, BMP, Notch ligands) are shown in color. The final step distinguishes the insulin-producing p cells from other types of endocrine cell also present in pancreatic islets (α, δ, ε, PP). (трех у птиц), которые обладают в чем-то отличающиеся комбинации транскрипционных факторов в начале образования, но становятся очень сходными, будучи дифференцированными (10). Следовательно, имеется более одного пути в терминах промежуточных онтогенетических состояний от оригинальных клеток предшественников к финальному дифференцированному фенотипу. Я полагаю, что состояние стволовых клеток возникает как финальное онтогенетическое решение, участвующее в создании определенного типа ткани. Следовательно, ткане-специфические стволовые клетки д. иметь состояние онтогенетической детерминации, сходное с эмбриональным рудиментом, который их продуцирует (11) (Fig. 2). Эта гипотеза ещё не подтверждена. В ряде исследований на мышах показано, что ключевые онтогенетические транскрипционные факторы существенны для формирования как специфического рудимента, так и поддержания возникающей в результате популяции стволовых клеток. Напр., Sox2 является транскрипционным фактором, который детерминирует свойства как эмбрионального нейроэпителия, так и постнатальные нейральные стволовые клетки (12, 13). Runx1 необходим как для инициального образования гематопоэтической ткани в дорсальной аорте, так и для поддержания гематопоэтических стволовых клеток у взрослых (14). Cdx2 необходим, чтобы специфицировать кишечник у эмбрионов, также как и поддерживать зоны стволовых клеток кишечника взрослых (15). p63 появляется когда эмбриональный эпителий становится стратифицированным и остается критическим для контроля свойств слущивающегося эпителия и стволовых клеток кератиноцитов (16, 17). Sox9 экспрессируется в специфической клеточной популяции эпидермальных плакод, которые формируют волосяные фолликулы у эмбрионов. Он также необходим для поддержания постнатальных стволовых клеток, которые располагаются в bulge области фолликула (18). В этом случае продемонстрировано (18,19) разное происхождение стволовых клеток волосяных фолликулов и межфолликулярных.] В передней части гипофиза, где nestin-позитивные клетки происходят независимо из соотв. эмбриональных предшественников и обладают иным профилем транскрипционных факторов (20). Опять же один и тот же дифференцированный тип клеток может возникать посредством более чем одного онтогенетического пути.
С помощью метода CreER-lox (21), 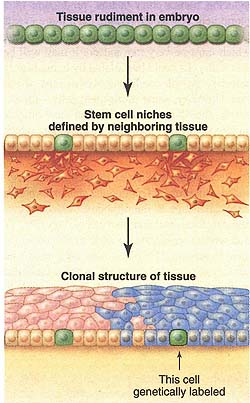 Fig. 2. Formation of stem cells in a tissue rudiment. In this hypothetical model, a few cells permanently retain their embryonic qualities because they lie in stem cell niches. Green represents cells in the embryonic tissue rudiment developmental state. Some of these are preserved as tissue-specific stem cells because of signals provided by neighboring mesenchymal cells (orange). These signals define stem cell niches. The rest differentiate to become a simple cuboidal epithelium, which later becomes a stratified epithelium maintained by production of cells from the stem cells. In such a tissue, labeling of a single stem cell (for example, by retroviral insertion) will label a domain of the tissue consisting of all the progeny of that stem cell.
Fig. 2. Formation of stem cells in a tissue rudiment. In this hypothetical model, a few cells permanently retain their embryonic qualities because they lie in stem cell niches. Green represents cells in the embryonic tissue rudiment developmental state. Some of these are preserved as tissue-specific stem cells because of signals provided by neighboring mesenchymal cells (orange). These signals define stem cell niches. The rest differentiate to become a simple cuboidal epithelium, which later becomes a stratified epithelium maintained by production of cells from the stem cells. In such a tissue, labeling of a single stem cell (for example, by retroviral insertion) will label a domain of the tissue consisting of all the progeny of that stem cell. который используется для конструкции трансгенных мышей, содержащих два компонента: ген, кодирующий активируемую гормоном DNA recombinase (CreER) , управляемую с помощью ткане-специфического промотора, и репортерный ген, экспрессия которого активируется с помощью Cre-обусловленной эксцизии ингибирующего сегмента ДНК. Когда синтетический эстроген tamoxifen дается мышам, то CreER становится активным и в клетках, в которых он присутствует, а вырезанный сегмент из репортерного трансгена, тем самым активирует продукцию репортерного белка и метит клетки и все их производные определенным образом (Fig. 3). Метятся только те клетки, которые обладают ткане-специфическим промотором, активным в момент воздействия tamoxifen, скорее чем до или после. Следует также учитывать, что некоторые ткани (такие как сердце, многие железы и соединительнотканные структуры) обнаруживают очень незначительное самообновление в постнатальной жизни (9), и в этом случае они могут вовсе не иметь популяции стволовых клеток. The Problem of Pluripotent Adult Stem Cells Некоторые биологи стволовых клеток открыто или неявно не принимают концепцию иерархического развития. Они придерживаются мнения, что все или большинство тканей тела постоянно возобновляются и что источником клеток является одна или более популяций плюрипотентных стволовых клеток- расположенных в костном мозге или где-то ещё-которые могут циркулировать по телу и превращаться во множественные типы клеток в зависимости от локального окружения (22), предполагается существование плюрипотентных стволовых клеток у взрослых по всему телу и предпочитается определять статус стволовых клеток по пластичности скорее, чем долговременным самообновлением. Сравнимые модели были предложены и др. авт. (23, 24), которые поддерживают идею, что ткане-специфические стволовые клетки д. "трансдифференцироваться " в др. тип ткани после трансплантации. Это экспериментально опровергнуто за исключением очень редких случаев (25), хотя некоторые очень удивительные события слияния клеток происходят после трансплантации костного мозга и могут участвовать в выраженной респецификации генной экспрессии с помощью ядер донорских клеток (26, 27).
Существуют многочисленные сообщения о плюрипотентных клетках, выделенных из постнатальных организмов. Такие клетки описываются как имеющие онтогенетический потенциал, более широкий, чем у ткане-специфических стволовых клеток и в некоторых случаях он приближается к таковому ES cells. Напр., mesenchymal adult progenitor cells (MAPCs) описываются как клетки, выделяемые из mesenchymal stem cells (MSCs) костного мозга мышей, крыс, человека, которые могут размножаться без предела и способны превращаться в большинство типов клеток тела (28). Marrow-isolated adult multilineage inducible (MIAMI) клетки являются популяцией из костного мозга человека, которые формируют нейроны и структуры подобные островкам панкреас, как и обычные мезенхимные производные (29). Pluripotent stem cells (PSCs) могут быть выделены из многих тканей мышей (30) и описывается их превращение в мышцы. жировую ткань и нейроны при определенных условиях. Tissue-committed stem cells (TCSCs) из костного мозга мышей и людей (31) как полагают, происходят от популяции предшественников плюрипотентных клеток, способных формировать большинство типов клеток. MSCs из жировой ткани человека (32) описываются как фибробластические клетки, которые обладают пластичность и, как писали, превращаться в широкий круг типов клеток in vitro, включая нейроны, кардиомиоциты, гепатоциты и панкреатические клетки. Skin-derived precursors (SKPs), изолированные из дермиса грызунов и человека растут как плавающие сферы в neurosphere среде (33). Описывается их дифференцировка в нейроны. глию, гладкие мышцы или адипоциты при соотв. культуральных условиях. В дополнение к плюрипотентным клеткам из постнатальных организмов имеется множество сообщений о сходных клетках, выделенных из плода, таких как плацента, пупчный канатик, амниотическая жидкость или ткани плода (34-38).
Однако в настоящее время нет убедительных доказательств, что такие клетки существуют in vivo. Если плюрипотентные клетки не существуют в нормальном постнатальном организме, тогда они д. возникать во время культивирования in vitro . Возможно. что они спонтанно подвергаются изменениям, сходным с теми, что наблюдаются во время образования induced pluripotent stem (iPS) клеток. Эти клетки, которые были репрограммированы в состояние, сходное с таковым ES клеток путем введения небольшого количества специфических транскрипционных факторов (42,43). При соотв. условиях избыточная экспрессия транскрипционных факторов, важных для контроля плюрипотентного состояния ES клеток (такие как Oct4, Sox2 и Nanog) могут репрограммировать дифференцированные клетки в плюрипотентные неизменно. Однако формирование колонии iPS редкое событие, с частотой между 10-2 and 10-6 в зависимости от стартующих клеток и определенных вносимых генов. Это предполагает, что необычная комбинация стохастических событий необходима в дополнение к избыточной экспрессии необходимых генов. В отсутствие избыточной экспрессии плюрипотентность индуцирующих транскрипционных факторов, продукция плюрипотентных клеток д. нуждаться в ещё большем количестве событий, происходящих спонтанно и одновременно, которые могут быть очень редкими. Возможно, что такие клетки могут быть выделены с использование высоко селективных условий роста свыше мес. культивирования. Однако некоторые плюрипотентные клетки -напр., SKPs-могут быть выделены более быстро и более воспроизводимо [e.g., (44)], это указывает на то, что они имеют определенного сорта копии in vivo. в
Из всего этого вытекает ортодоксальная модель современной биологии развития и развития стволовых клеток (Fig. 4). Плюрипотентные клетки могут быть неким типом клеток нервного гребня, т.к. нервный гребень является эмбриональной клеточной популяцией, которая, по-видимому, подвергается более стохастическому типу дифференцировки, чем др.эмбриональные клетки предшественники. Альтернативно, они могут быть типа "embryonic
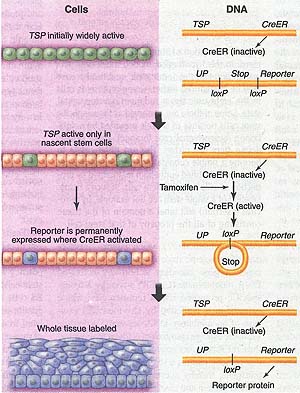 Fig. 3. The CreER labeling method (21). This requires the production of mice containing two transgenes, as shown in yellow. TSP represents a tissue-specific promoter, so the CreER protein is present in all cells where TSP is active (green). When the synthetic estrogen tamoxifen is given to the mice, the CreER becomes active and can excise DNA sequences lying between loxP sites. This has the effect of activating production of a reporter gene, which is driven by UP (a ubiquitous promoter). The reporter remains active in all progeny of the labeled cells. If stem cells are labeled, then this will result in the permanent labeling of the whole tissue that they maintain.
Fig. 3. The CreER labeling method (21). This requires the production of mice containing two transgenes, as shown in yellow. TSP represents a tissue-specific promoter, so the CreER protein is present in all cells where TSP is active (green). When the synthetic estrogen tamoxifen is given to the mice, the CreER becomes active and can excise DNA sequences lying between loxP sites. This has the effect of activating production of a reporter gene, which is driven by UP (a ubiquitous promoter). The reporter remains active in all progeny of the labeled cells. If stem cells are labeled, then this will result in the permanent labeling of the whole tissue that they maintain. remnant", представленными плюрипотентными клетками пережитками ранних эмбрионов. Спор, что некоторые плюрипотентные стволовые клетки взрослых в действительности являются клетками нервного гребня, не нов. В самом деле, несколько групп выделили "neural crest stem cells" из различных тканей: плодного sciatic нерва (45) и взрослого кишечника (46), сердца (47) и кожи (33, 48). Некоторые аспекты развития нервного гребня соответствуют модели на Fig. 1, особенно их инициальное образование и контроль дифференцировки с помощью индуцирующих факторов. Однако ранги дифференцируемых типов клеток, которые могут быть сформированы, очень широки и имеется определенный момент стохастичности в процессе дифференцировки, который не очевиден для др. частей эмбриона. Потенциал in vivo индивидуальных клеток нервного гребня изучался с помощью клонального мечения (49-51). Он показал, что имеется множество мультипотентных клеток в гребне перед миграцией. Во время миграции их количество и степень мультипотентности снижаются, хотя, по крайней мере, некоторая степень мультипотентности сохраняется некоторыми клетками в ходе этого процесса. Клетки нервного гребня становятся запрограммированными дифференцироваться в ответ на воздействие разнообразных индуцирующих факторов во время их миграции (52), но стохастическая природа реакций проявляется тем. что соседние клетки становятся детерминированными в разное время и могут давать разные вещи. в Имеются доказательства существования в качестве источника нервного гребня, по крайней мере, двух классов относящихся к делу клеток: SKPs и костномозговых MSCs. В голове эмбрионов мышей, SKPs могут быть помечены с помощью wnt1-Cre, маркера краниального гребня (53), и они также сохраняют экспрессию различных crest-типа генов. Они наиболее многочисленны у поздних эмбрионов и их количество падает постнатально. Кожа обычно содержит различные производные нервного гребня, включая меланоциты и Merkel клетки, так что не сюрприз, что некоторые предшественники этих типов клеток могут персистировать в постнатальный период. Изучение мечения, которое использует маркеры нервного гребня sox1-Cre и PO-Cre подтверждает, что, по крайней мере, некоторые из MSCs в костном мозге мышей происходят из нервного гребня (54). Опять же меченные клетки снижаются в частоте после рождения и, по-видимому, лишь немногие из MSCs в костном мозге старых животных происходят из нейрального гребня.
Концепция эмбриональных остатков имеет длинную историю и первоначально предлагалась как объяснение источника рака (55).
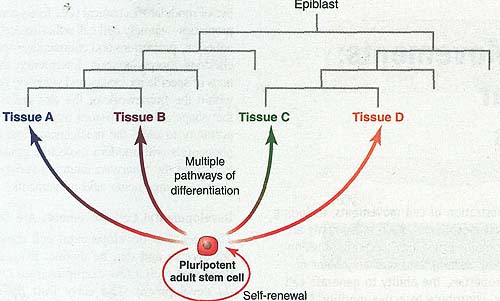 Fig. 4. The hypothetical postnatal pluripotent stem cell. The upper part represents the conventional account of development of four tissues; the lower part represents an entirely different view based on the existence of pluripotent adult stem cells. Not shown is the spatial pattern of the embryo, which is accounted for by the first model but not by the second.
Fig. 4. The hypothetical postnatal pluripotent stem cell. The upper part represents the conventional account of development of four tissues; the lower part represents an entirely different view based on the existence of pluripotent adult stem cells. Not shown is the spatial pattern of the embryo, which is accounted for by the first model but not by the second. Существует множество типов видимых эмбриональных остатков, которые могут быть обнаружены у некоторых индивидов, такие как остаточный карман Ратке, thyroglossal проток, urachus, хорда и т.д. (56). Более мелкие и менее заметные, кластеры клеток или персистирующие индивидуальные клетки могут быть даже более распространенными и не обязательно вызывают видимую патологию. Возможно. что некоторые клетки эпибласта могут оказаться за пределами достижения наиболее ранними индуцирующими сигналами и персистируют в ES-подобном состоянии. Они могут оказаться включенными в амнион или внеэмбриональную энтодерму, позднее могут обнаруживаться в кровотоке и будут превращаться в эмбриональные. Они появляются не у всех индивидов и могут быть очень редки, если вообще появляются. Их невозможно идентифицировать с помощью обычной микроскопии, но они могут быть изолированы при высокой степени отбора в тканевой культуре. Со временем такие клетки, по-видимому, теряют свой плюрипотентный характер или погибают. Это могло бы объяснить некоторые менее известные свойства постнатальных плюрипотентных стволовых клеток: они имеют тенденцию выделяться с трудом, более распространены у молодых животных и обнаруживают меньший потенциал, чем ES клетки. Одним из аргументов против этого мнения является анатомическое распределение опухолей зародышевых клеток (включая тератомы). Этого типа опухоли, как ожидается, возникают из неправильно расположенных плюрипотентных клеток. Однако они в основном обнаруживаются в гонадах и вдоль путей эмбриональной миграции примордиальных зародышевых клеток, чем гле либо ещё теле (57). Имеются также некоторые опухоли типа зародышевых клеток, возникающие в головном мозге (pineal и neurohypophyseal регионы), которые не могут быть легко объяснены происхождением из примордиальных зародышевых клеток (58).
Итак, хорошо охарактеризованные стволовые клетки в постнатальном организме являются тканеспецифическими стволовыми клетками. Они, как полагают, возникают в соотв. рудиментах во время эмбрионального развития как конечный продукт иерархии решений, контролируемых с помощью индуцирующих факторов. Но для полного понимания источника тканеспецифических стволовых клеток необходимы данные клонам клеток. Плюрипотентные стволовые клетки, выделяемые из постнатальных организмов могут не существовать in vivo, но если существуют, то они не обязательно участвуют в нормальном развитии или обновлении тканей.
|