Дополнительные эпителиально-мезенхимные взаимодействия необходимы для завершения морфогенеза и дифференцировки. Если скомбинированный с мышиным, куриным или ящериц эпидермисом мышиный дермис может индуцировать волосяные фолликулы, перья или плакоды чешуек, соотв., но эти плакоды не будут расти и дифференцироваться далее из-за отсутствия дермального сосочка. Эти результаты указывают на то, что второй сигнал, исходящий из эпидермиса, необходим для дифференцировки мезенхимных клеток в соответ. организующие центры (Hardy, 1992). Все эти исследования демонстрируют, что реципрокные индуктивные взаимодействия между мезенхимой и лежащим поверх эпителием существенны для индукции судьбы разных эпителиев. Секретируемые Wnt лиганды могут быть одним из первых сигналов, участвующих в этом общении.
Эпителиальный гомеостаз обычно поддерживается с помощью унипотентных клеток предшественников, которые обладают способностью дифференцироваться с один определенный клон клеток. Прямая демонстрация существования этих предшественников и их клонального потенциала базируется на клональных трансплантациях изолированных предшественников и экспериментах по отслеживанию генетических клонов.
Межфолликулярный эпидермис и сальные железы содержат однопотентные предшественники, которые могут поддерживать гомеостаз своей соотв. ткани. Гистологический анализ кожи мышей выявил, что эпидермис организован в стопки (stacks) клеток с гексогональной поверхностью, покрывающей примерно 10 базальных клеток (Potten, 1974). Эта структура, как было предположено, функционирует как эпидермальная пролиферативная единица, обладающая одно предположительно стволовой клеткой на единицу. Недавно это мнение было подтверждено экспериментально путем анализа отслеживания клонов или путем трансплантации нагруженных вирусом кератиноцитов в кожу спины Nude мышей (Ghazizaden, Taichman, 2001; Kolodka et al., 1998; Mackenzie, 1997) или путем индукции перманентной экспрессии GFP клонально в межфолликулярном эпидермисе и отслеживании судьбы маркированных клеток (Ro, Rannala, 2004). Стволовые клетки из культивируемого межфолликулярного эпидермиса человека были выделены на базе повышенной экспрессии интегринов (Jones, Watt, 1993). Недавний анализ картирования судеб выявил существование небольшой группы унипотентных сальных клеток предшественников, располагающихся в основании железы, которые экспрессировали репрессор транскрипции Blimp1 (Horsley et al., 2006).
В дополнение к этим унипотентным предшественникам, мультипотентные стволовые клетки располагаются в выпячиваниях (Cotsarelis et al., 1990; Oshima et al., 2001; Taylor et al., 2000). Мультипотентные стволовые клетки могут дифференцироваться во все клоны эпителиальных клеток, располагающихся в ткани. В коже они не только служат в качестве резервуара клеток для регенерации во время периодов нормального цикла роста волос, но и также в условиях гиперпролиферации сальных желез (Horsley et al., 2006) и при репарации межфолликулярного эпидермиса вследствие ранения (Ito et al., 2005; Levy et al., 2005; Taylor et al., 2000; Tumbar et al., 2004) (Рис. 2). Могут ли предшественники, находящиеся в межфолликулярном эпидермисе или сальных железах сходным образом становиться мультипотентными, вопрос будущего.
Мультипотентность стволовых клеток внутри впячиваний (bulge) впервые была подтверждена в трансплантационных экспериментах, в которых выделяли область выпячивания и трансплантировали иммунодефицитным мышам (Oshima et al., 2001). Трансплантированные клетки bulge оказались способными дифференцировать полный репертуар кожных эпителиальных клеток: межфолликулярный эпидермис, сальные железы и 8 клонов клеток, составляющих зрелый волосяной фолликул. Bulge клетки, очищенные с помощью fluorescence-activated cell sorting (FACS) на бази их предпочтительной экспрессии GFP трансгена, также дифференцировались в эти же клоны после трансплантации (Morris et al., 2004). Клональный анализ оказался существенным для демонстрации того. что bulge клетки являются мультипотентными стволовыми клетками а не просто смесью унипотентных предшественников. Это сопровождалось первым культивированием потомства, полученного из одиночной FACS-очищенной bugle клетки (Blanpain et al., 2004) или из трансплантатов микроиссеченной ткани (Claudinot et al., 2005).
Существование мультипотентных стволовых клеток в молочных железах следует из экспериментов. в которых фрагменты ткани молочной железы, содержащие клетки, обладающие случайно вставленным MMTV ретровирусом, были сначала трансплантированы в жировые подушки молочных желез, свободные от эпителия у неинфицированных реципиентных мышей и затем серийно трансплантировали клонально возникшие выросты. чтобы создать железы второй генерации (Kordon, Smith, 1998). C каждым раундом роста места вирусной интеграции картировали и показали их идентичность, это указывало на то. что целиком функциональная железа может быть получена от потомства одной эпителиальной стволовой клетки молочной железы, которая обладает свойством долговременного самообновления.
Две разные группы недавно продемонстрировали это впервые путем идентификации и очистки популяции клеток молочных желез (с маркерным профилем Lin-, α6 или β1High и CD24+), которые обогащены стволовыми клетками и затем с помощью трансплантационных экспериментов (Shackleton et al., 2006; Stingl et al., 2006). Путем мечения этих клеток lacZ трансгеном исследователи оказались способны непосредственно продемонстрировать, что индивидуальные стволовые клетки молочных желез способны генерировать функциональные молочные железы после трансплантации (Рис. 2). Как и bulge стволовые клетки, стволовые клетки молочных желез обладали повышенными количествами интегринов на поверхности, а также кератинов 5 и 14, которые являются характерными для стратифицированных и гляндулярных эпителиальных клеток, что располагаются вдоль базальной мембраны и которые обладают пролиферативным потенциалом. Они также выглядят как слабо делящиеся клетки, способные сохранять нуклеотидную метку в течение увеличенного pulse-chase, и они экспрессируют ряд генов, которые также позитивно регулируются в bulge стволовых клетках (Blanpain et al., 2004; Morris et al., 2004; Stingl et al., 2006; Tumbar et al., 2004).
Хотя кишечник, как полагают, обладает мультипотентными стволовыми клетками со способностью дифференцироваться в энтероциты, goblet, Paneth и нейроэндокринные клетки, пока биологические доказательства существования мутитипотентных кишечных стволовых клеток не столь убедительны как в др. эпителиях. Это прежде всего из-за бедности маркеров клеточной поверхности или промоторов, специфичных для кишечных стволовых клеток, которые бы позволили осуществить их выделение в их предполагаемом местопложении в криптах. Недавнее молекулярное профилирование предполагаемых стволовых клеток крипт с помощью лазерной микродиссекции выявило ряд новых маркеров, которые могут дать преимущества в этой области исследований (Giannakis et al., 2006).
В отсутствие чистых клеток крипт, чтобы протестировать их потенциал стволовых клеток, исследования ограничиваются в основном анализом отслеживания клонов. У химерных животных состав мозаичных поликлонов кишечных крипт наблюдается при рождении, но в течение двух недель крипты становятся в основном моноклональными и после этого эпителий индивидуальных крипт у взрослых мышей состоит из клеток одного родительского типа (Ponder et al., 1985; Schmidt et al., 1988). Переключение с поликлональных крипт при рождении на моноклональные крипты после разделения крипт у молодых животных заставляет предполагать, что некоторые стволовые и клетки предшественники располагались внутри инициальных крипт. Во взрослом кишечнике, однако, остаются только популяции клеток стволовых или предшественников на крипту.
Дополнительные исследования генетического картирования судеб подтверждают мнение, что унипотентные и мультипотентные предшественники сосуществуют в кишечном эпителии (Bjerkness, Cheng, 1999). Хотя кажется вполне возможным, что имеются мультипотентные стволовые клетки в кишечном эпителии, документальное подтверждение впереди, необходимы эксперименты по трансплантации изолированных стволовых клеток и/ или отслеживание генетических клонов с использованием промоторов. специфичных для стволовых клеток кишечника.
Wnt Signaling and Epithelial Stem Cells
Чтобы гарантировать поддержание в течение жизни гомеостаза ткани стволовые клетки д. обладать способностью к самообновлению и дифференцировке. Для этого, по крайней мере, одна дочерняя клетки д. сохранять свойства стволовой клетки после каждого клеточного деления. Передача сигналов Wnt/β-catenin контролирует спецификацию, поддержание и активацию стволовых клеток, а нарушение этого пути часто ведет к возникновению семейных и/или спорадических эпителиальных раков (Reya, Clevers, 2005). Законсервированный от червя до человека сигнальный путь Wnt/β-catenin является эволюционно родоначальным и управляет развитием и морфогенезом во многих отличающихся тканях (Logan, Nusse, 2004).
Wnt белки являются секретируемыми богатыми цистеином белками, которых около 20 у млекопитающих. Большая часть β-catenin в клетках располагает ся в местах межклеточных (слипчивых) соединений, где они связывают Е-cadherin одним концом и α-catenin другим. Напротив цитоплазматический пул β-catenin обычно фосфорилируется и направляется на обусловленную ubiquitin деградацию с помощью мультибелковой Axin поддержки, состоящей из adematous polyposis coli (APC) белка, β-catenin и GSK-3β kinase. Когда Wnt лиганд соединяется со своим Frizzled рецептором, то поддержка неспособна функционировать, это вызывает накопление β-catenin в цитоплазме. Когда член семейства Tcf/Lef ДНК связывающих белков присутствует, то стабилизированный цитоплазматический β-catenin может связывать его и действовать как транскрипционный кофактор, чтобы стимулировать транскрипцию своих генов мишеней. Несмотря на причинную связь активности генов мишеней с β-catenin/Tcf/Lef необходимо иметь в виду, что β-catenin может стабилизироваться с помощью не-Wnt механизмов (He, 2006).
Путь передачи сигналов β-catenin часто выполняет множественные роли в детерминации клонирования стволовых клеток в большинстве, если не во всех эпителиальных тканях (Рис. 3).
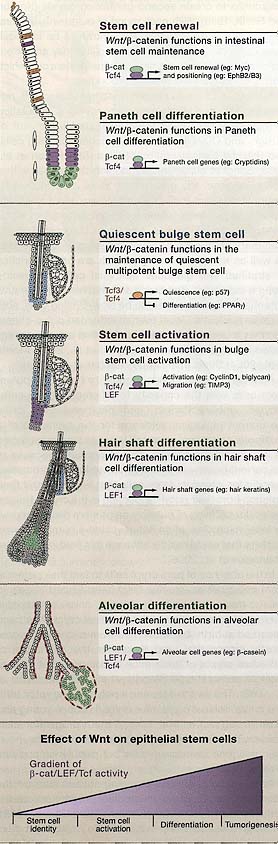 Figure 3. Wnt/β-Catenin Signaling Regulates Epithelial Stem Cells
(A) Model summarizing the functions of Wnt/p-catenin signaling in the intestine that regulate stem cell renewal and Paneth cell differentiation, p-catenin and Tcf4 appear to regulate c-Myc and EphB2/B3 during renewal, whereas these transcriptional complexes regulate Paneth cell genes during differentiation. (B) Model summarizing functions that have been suggested for Wnt signaling in stem cell maintenance, activation, and hair shaft differentiation in the follicle. Tcf3/4 regulate genes implicated in stem cell quiescence and differentiation, whereas p-catenin and Tcf/Lef complexes regulate genes likely involved in stem cell activation and migration, p-catenin and Lef1 complexes in precorneal cells regulate expression of hair shaft genes. (C) Model summarizing putative functions for Wnt signaling in the mammary gland in cancer development and alveolar differentiation. In combination with Tcf4 and Lef1, p-catenin regulates genes involved in alveolar differentiation. (D) General model depicting these different outcomes: stem cell self-renewal, activation, differentiation, or tumorigenesis, depending upon the level of effective Wnt signaling (that is, β-catenin/Lef/Tcf activity) that an epithelial stem cell receives.
Figure 3. Wnt/β-Catenin Signaling Regulates Epithelial Stem Cells
(A) Model summarizing the functions of Wnt/p-catenin signaling in the intestine that regulate stem cell renewal and Paneth cell differentiation, p-catenin and Tcf4 appear to regulate c-Myc and EphB2/B3 during renewal, whereas these transcriptional complexes regulate Paneth cell genes during differentiation. (B) Model summarizing functions that have been suggested for Wnt signaling in stem cell maintenance, activation, and hair shaft differentiation in the follicle. Tcf3/4 regulate genes implicated in stem cell quiescence and differentiation, whereas p-catenin and Tcf/Lef complexes regulate genes likely involved in stem cell activation and migration, p-catenin and Lef1 complexes in precorneal cells regulate expression of hair shaft genes. (C) Model summarizing putative functions for Wnt signaling in the mammary gland in cancer development and alveolar differentiation. In combination with Tcf4 and Lef1, p-catenin regulates genes involved in alveolar differentiation. (D) General model depicting these different outcomes: stem cell self-renewal, activation, differentiation, or tumorigenesis, depending upon the level of effective Wnt signaling (that is, β-catenin/Lef/Tcf activity) that an epithelial stem cell receives.
В кишечнике и молочных железах, Tcf4 преимущественно экспрессируется в компартменте стволовых клеток (Barker et al., 1999); в фолликулярной нише стволовых клеток. Tcf4 экспрессируется с содружестве с Tcf3 (Blanpain et al., 2004; Nguyen et al., 2006). Важность передачи сигналов Tcf/Lef1/β-catenin в спецификации и/или поддержании эпителиальных стволовых клеток подчеркивается исследованиями избыточной и недостаточной функции на мышах. Мыши, дефицитные по Lef1 не формируют волосяных фолликулов, молочных желез или зубов (van Genderen et al., 1994), тогда как отсутствие Tcf4 приводит у новорожденных к тому, что кишечный эпителий состоит целиком из дифференцированных, неделящихся клеток ворсинок (Korinek et al., 1998). Устранение
β-catenin также вызывает отсутствие фолликулярного морфогенеза у новорожденных (Huelsken et al.,2001) и постнатальную потерю ниши фолликулярных стволовых клеток (Lowry et al., 2005). Сходным образом избыточная экспрессия Dkk1, растворимого ингибитора Wnt лигандов, вызывает потерю кишечных крипт (Pinto et al., 2003) и неспособность развития фолликулярных фолликулов и молочных желез (Andl et al., 2002; Chu et al., 2004). Всё это указывает на специфическую роль передачи сигналов Wnt в развитии и/или поддержании эпителиальных стволовых клеток.
Стволовые клетки кишечных крипт, по-видимому, находятся в постоянном Wnt-активном пролиферативном состоянии и когда Tcf4 белок неспособен связывать β-catenin, то он экспрессируется в клетках рака толстой кишки, он супрессирует пролиферацию и способствует активации генов дифференцировки (van de Westering et al., 2002). Напротив, bulge стволовые клетки подвергаются воздействию в фазе покоя, во время которой они по-видимому, находятся в Wnt-ограниченных условиях (DasGupta, Fuchs, 1999). Во время перехода между фазой молчания и роста волосяного цикла экспрессия ядерного β-catenin и Lef1/β-catenin репортера может обнаруживаться в основании bulge, где начинает возникать новый волосяной фолликул (DasGupta, Fuchs, 1999; Lowery et al., 2005; Merrill et al., 2001). В соответствии с ролью передачи сигналов Wnt в активации стволовых клеток, трансгенные мыши, экспрессирующие стабилизированную форму β-catenin обнаруживают de novo образования волосяных фолликулов и увеличение плотности фолликулов (Gat et al., 1998)? а также преждевременное повторное вступление в регенеративную фазу роста волос (Lo Celso et al., 2004; Lowry et al., 2005; Van Matyer et al., 2003). Сходным образом в молочных железах, преждевременное образование зачатков происходит при целенаправленной активации β-catenin (Teuliere et al., 2005).
Некоторые Tcfs функционируют в стволовых клетках даже когда уровни цитоплазматического/ядерного β-catenin низки и/или отсутствуют. Недавно было установлено, что Tcf3 экспрессируется во взрослых фолликулярных стволовых клетках на всех стадиях цикла волос, а также в мультипотентных предшественниках эмбриональной кожи. Более того, когда экспрессия Tcf3 поддерживается постнатально, то все три клона кожной дифференцировки репрессируются (Nguyen et al., 2006), указывая тем самым, что Tcf3 может действовать, чтобы поддерживать стволовые клетки кожи в недифференцированном состоянии, а когда β-catenin стабилизирован, репрессия Tcf3 ослабляется и стволовые клетки активируются, чтобы пролиферировать и начинать дифференцировку в клоны волосяного фолликула.
Учитывая роль Tcf/β-catenin в активации стволовых клеток не кажется неожиданным обнаружение, что мутации, вызывающие постоянную стабилизацию β-catenin, ассоциированы с разнообразными эпителиальными раками у людей. Такие мутации впервые были открыты в аденокарциномах толстого кишечника (Reya, Clevers, 2005) и и затем были идентифицированы в pilomatricomas, которые являются опухолями клеток волосяного стержня (Chan et al., 1999; Gat et al., 1998) и в аденокарциномах молочных желез (Teuliere et al., 2005; Tsukamoto et al., 1988). Интересные свойства эпителиальных опухолей генерируются избытком передачи сигналов Wnt, которые часто проявляются в повышенной частоте клеток со свойствами стволовых и клеток предшественников в противоположность опухолям мышей, экспрессирующих др. онкогены. В этой связи, путь Wnt является, по-видимому, специальным, если не уникальным в отношении свой способности влиять на трансформацию стволовых клеток и/или клеток предшественников.
Др. признаком раков, возникающим в результате избыточности передачи сигналов Wnt, является то, что они часто избирательно обладают одним специфическим клоном стволовых клеток. Это лучше всего объясняется тем фактом, что дополнительные сигналы Wnt участвуют на поздних ступенях дифференцировки этих избранных клонов стволовых клеток, напр., волосяного стержня (Merrill et al., 2001), кишечные Paneth клетки (van Es et al., 2005a) и лобуло-альвеолярная дифференцировка эпителия молочных желез (Teuliere et al., 2005; Tsukamoto et al., 1988). Отметим. что гены волосяных кератинов транскрипционно регулируются с помощью Lef1/β-catenin (Merrill et al., 2001), а экспрессия генов, специфичных для клеток Paneth, таких как cryptidin/defensins , теряются после делеци Tcf4 или Wnt рецептора Frizzled 5 (van Es et al., 2005a).
Чтобы понять, как передача сигналов β-catenin/Еса контролирует эпителиальные стволовые клетки, исследователи сфокусировались на идентификации генов, которые регулируются передачей сигналов Wnt. В последнее время транскрипционное профилирование используется для определения генов стоящих ниже передачи сигналов β-catenin в эпителиальных стволовых клетках (Batlle et al., 2002; Lowery et al., 2005; Nguyen et al., 2006; Silva-Vargas et al., 2005; van de Wetering et al., 2002). Среди интересных новых мишеней для Wnt явились ephrin рецепторы EphB2 и EphB3, которые экспрессируются в кишечных криптах в ответ на передачу сигналов Wnt (Batlle et al., 2002). Напротив, лиганд EphrinB1 экспрессируется в клетках выше крипт. Компаундные мутации EphB2 и EphB3 обусловливают неправильное расположение клеток вдоль оси крипта-ворсинка, указывая тем самым, что ephrins и их лиганды устанавливают границу между пролиферативным компартментом и компартментом дифференцировки. Помимо участия в собственно позиционировании клеток внутри кишечника EphBs, по-видимому, регулируют клеточную пролиферацию внутри крипт (Holmberg et al., 2006) и экспрессия EphB2 теряется во время прогрессирования от злокачественной аденомы к агрессивной карциному (Batlle et al., 2005). Ephrins и их рецепторы обнаруживают дифференциальную экспрессию и в др. эпителиях, но их значение ещё далеко от понимания.
В волосяных фолликулах стабилизация β-catenin стимулирует покоящиеся bulge стволовые клетки к пролиферации и регенерации волосяного фолликула. Посредством транскрипционного профилирования очищенных bulge стволовых клеток было установлено, что во время активации стволовых клеток транскрибируется ряд генов, ассоциированный с ходом клеточного цикла (Lowery et al., 2005). Когда уровни β-catenin трансгена увеличены в молчащих стволовых клетках, то транскрипция некоторых из таких генов повышается, показывая тем самым, как передача сигналов Wnt может способствовать активации стволовых клеток. Заметим, что передача сигналов Wnt в bulge стволовых клетках не активирует гены волосяных кератинов, которые индуцируются на более поздних стадиях дифференцировки волосяных фолликулов (Lowery et al., 2005). Т.о., как только стволовые клетки активируются и начинают прогрессировать в направлении определенной клональной дифференцировки, они , по-видимому, отвечают на сигналы разного средового окружения и активируют разные наборы генов мишеней для Wnt. Множественность транскрипционных партнеров для β-catenin, связанная со сложной регуляцией его стабильности, скорее всего и вносит вклад в эффект и потенциал активности β-catenin/Lef1/Tcf в клетках. Эти регуляторные механизмы передачи сигналов Wnt скорее всего и влияют на то, могут ли и когда стволовые клетки самообновляться, становиться активными, чтобы пролиферировать или запускать программу окончательной дифференцировки.
Notch Signaling and Epithelial Stem Cells
Тканевой гомеостаз и заживление ран нуждаются в эпителиальных стволовых клетках, чтобы выполнить различные программы терминальной дифференцировки. Чтобы осуществить это стволовые клетки д. быть инструктированы своим микроокружением к избирательной адаптации свойств определенного клеточного клона. Передача сигналов Wnt является не единственным путем сигнальной трансдукции, который инструктирует стволовые клетки. Подобно передаче сигналов Wnt передача сигналов передача сигналов Notch контролирует избирательную детерминацию клеточных судеб в различных тканях (Artavanis-Tsakonas et al., 1999). Законсервированный путь канонической передачи сигналов Notch регулирует решения о судьбах клеток путем действующих на малых расстояниях межклеточных взаимодействиях.
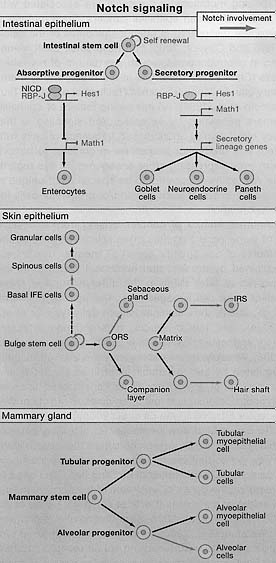 Figure 4. Notch Signaling Regulates Lineages Determination of Epithelial Stem Cells In canonical Notch signaling, upon binding to Notch ligands, Notch receptors are cleaved and the intracellular domain translocates to the nucleus to act in concert with an RBP-J transcription factor to regulate gene expression. The schematics illustrate the putative roles of Notch signaling in three different epithelial tissues. (Top) A role for Notch in intestinal stem cell self-renewal and differentiation. Notch/RBP-J restricts the fate of secretory lineages in the intestine (Goblet, Paneth, and enteroendocrine cells). In the absorptive progenitors, Notch activity leads to the expression of Hes1 and subsequent repression of Mathl, leading to enterocyte differentiation. In the absence of Notch signaling, Mathl expression is not repressed and allows secretory progenitors to differentiate into goblet, neuroendrocrine, and Paneth cells. (Middle) A role for Notch in stem cell maintenance and differentiation in the epidermis and hair follicle. Notch promotes spinous cell fate in the interfollicular epidermis (IFE) and regulates differentiation of the sebaceous gland, the hair shaft, and the inner root sheath cells of the hair follicle. (Bottom) A role for Notch signaling in alveolar differentiation in the mammary gland. Mammary stem cells form alveolar and ductal progenitors that each form a myoepithelial cell in addition to tubular and alveolar cells, respectively. Notch signaling regulates the differentiation of alveolar progenitors into alveolar cells.
Figure 4. Notch Signaling Regulates Lineages Determination of Epithelial Stem Cells In canonical Notch signaling, upon binding to Notch ligands, Notch receptors are cleaved and the intracellular domain translocates to the nucleus to act in concert with an RBP-J transcription factor to regulate gene expression. The schematics illustrate the putative roles of Notch signaling in three different epithelial tissues. (Top) A role for Notch in intestinal stem cell self-renewal and differentiation. Notch/RBP-J restricts the fate of secretory lineages in the intestine (Goblet, Paneth, and enteroendocrine cells). In the absorptive progenitors, Notch activity leads to the expression of Hes1 and subsequent repression of Mathl, leading to enterocyte differentiation. In the absence of Notch signaling, Mathl expression is not repressed and allows secretory progenitors to differentiate into goblet, neuroendrocrine, and Paneth cells. (Middle) A role for Notch in stem cell maintenance and differentiation in the epidermis and hair follicle. Notch promotes spinous cell fate in the interfollicular epidermis (IFE) and regulates differentiation of the sebaceous gland, the hair shaft, and the inner root sheath cells of the hair follicle. (Bottom) A role for Notch signaling in alveolar differentiation in the mammary gland. Mammary stem cells form alveolar and ductal progenitors that each form a myoepithelial cell in addition to tubular and alveolar cells, respectively. Notch signaling regulates the differentiation of alveolar progenitors into alveolar cells.
У млекопитающих имеется 4 Notch трансмембранных рецептора (Notch1-4). Notch лиганды также являются трансмембранными белками, представленными тремя различными подсемействами, каждое из которых имеет несколько членов. После взаимодействия с лигандом Notch рецепторы последовательно расщепляются с помощью металлопротеиназ и γ-secretases (presenillins 1 и 2). Будучи освобожденным внутриклеточный домен Notch (NICD) транслоцируется в ядро, где он может ассоциировать с ДНК-связывающим белком RBP-Об чтобы превратиться в активатора транскрипции. Наиболее охарактеризованными генами мишенями для Notch являются относящиеся к комплексу hairy enhancer of split (Hes), которые состоят из b-HLH транскрипционных факторов Hes (1-7) и Hey (1-3) (Iso et al., 2003). В кишечнике передача сигналов Notch регулирует детерминацию клеточных судеб в криптах, где преимущественно экспрессируются Notch1, некоторые Notch лиганды и Hes1, 6 и 7 (Schroder, Gossler, 2002). Первые доказательства, что передача сигналов Notch контролирует детерминацию судеб стволовых клеток внутри кишечного эпителия были получены при анализе нокаутных по Hes1 мышей и по одному из его репрессируемых генов мишеней, Math1 (Рис. 4). Мыши, дефицитные по Hes1, обладают повышенным количеством нейроэндокринных клеток, Paneth клеток и goblet клеток за счет кишечных энтроцитов (Jensen et al., 2000; Suzuki et al., 2005), тогда как нокаут по Math1 или мутации избыточной функции в Notch ведут к противоположному фенотипу (Fre et al., 2005; Stanger et al., 2005; Yang et al., 2001). Кроме того, ингибирование γ-secretase (Searfoss et al., 2003) или условный таргетинг RBP-J (van Es et al., 2005b) приводят к драматической экспансии популяции goblet клеток в кишечнике мышей. Передача сигналов Notch может контролировать также пролиферацию ТА клеток. Пролиферация клеток крипт серьезно нарушена после устранения RBP-J или вследствие ингибирования γ-secretase (van Es et al., 2005b), в то время как пролиферация усиливается при избыточной активности передачи сигналов Notch (Fre et al., 2005). При химическом блокировании γ-secretase кишечные опухоли у мутантных АРС мышей дифференцируются в goblet клетки, указывая на потенциал использования химических ингибиторов передачи сигналов Notch в качестве возможного терапевтического инструмента для лечения рака кишечника (van Es et al., 2005b). Всё это подтверждает модель, согласно которой передача сигналов Notch действует на кишечные стволовые клетки, чтобы поддерживать их пролиферативное состояние предшественников, а также ограничивать выбор судеб нейроэндокринных, goblet и Paneth клеток.
Сходная роль передачи сигналов Notch в обеспечении пролиферации и дифференцировки обнаружена в эпителии молочных желез. Избыточная экспрессия активной формы Notch4 ведет к туморогенезу молочных желез (Hu et al., 2006) и хотя устранение RBP-J не нарушает инициального морфогенеза молочных делез, дифференцировка альвеол тяжело нарушена во время беременности (Buono et al., 2006) (Рис. 4). Т.о., не стало бы сюрпризом, если бы Notch выступал в качестве опухолевого супрессора в роговице и эпидермисе, т.к. это подтверждается тем фактом, что потеря Notch1 во взрослом эпидермисе и роговице ведет к гиперутолщению эпителия, сопровождаемому экспансией базальных слоёв (Rangajan et al., 2001). Дополнительные подтверждения получены в исследованиях, показавших, что Notch1-дейицитная кожа обладает более высокой чувствительностью к развитию, индуцированных химически раковых опухолей (Nicolas et al., 2003).
На первый взгляд может показаться, что передача сигналов Notch способствует поддержанию и самообновлению некоторых эпителиальных стволовых клеток и ингибированию этих процессов в др. Однако, множественные Notch рецепторы экспрессируются в коже и если все канонические передачи сигналов Notch устранены в эмбриональном эпидермисе, то пролиферация снижается, а дифференцировка нарушается (Blanpain et al., 2006). Возникает ли видимая гиперпролиферация после удаления Notch1 в результате альтераций в неканонической передаче сигналов Notch или в результате косвенных последствий дефектов эпидермального слоя пока неясно. Однако, в отсутствие RBP-J стволовые клетки фолликулов не могут поддерживаться, что наводит на параллели с действием канонической передачи сигналов Notch на эпителиальные стволовые клетки (Blanpain et al., 2006; Yamamoto et al., 2003).
Подобно передаче сигналов Wnt передача сигналов Notch, по-видимому, осуществляет свои эффекты на многих ступенях на путях клонирования. Напр., в волосяных фолликулах NICD1 экспрессируется также в матричных клетках как волосяного стержня, так и в его канале или внутреннем корневом слое (Pan et al., 2004), а условное устранение γ-secretase или комбинированное с потерей любого из
Notch receptor genes или
RBP-J ведет к дефектам развития сальных желез и терминальной дифференцировки внутреннего корневого слоя и стрежня волоса (Blanpain et al., 2006; Pan et al., 2004; Vauclair et al., 2005; Yamamoto et al., 2003) (Рис. 4). Всё это выявляет множественные роли передачи сигналов Notch не только в стволовых клетках, но также позднее в их клонах.
Other Signaling Pathways and Stem Cell Function
Хотя сигнальные каскады Wnt и Notch изучались наиболее интенсивно в эпителиальных стволовых клетках, передача сигналов Bone Morphogenetic Protein (BMP), по-видимому, влияет на активацию многих различающихся типов эпителиальных стволовых клеток. Так, ингибирование передачи сигналов BMP в результате избыточной экспрессии Noggin приводит к индукции образования волосяных плакод и к de novo образованию кишечных крипт (Botchkarev et al., 2001; Haramis et al., 2004; He et al., 2004). Мутации, которые затрагивают передачу сигналов BMP, объясняют почти половину случаев синдрома ювенильного полипоза, заболевания, которое может приводить к раку кишечника (Sancho et al., 2004). Сходным образом условное устранение гена Bmpr1a, кодирующего белок рецептор BMP, приводит к непрерывной активации стволовых клеток волосяного фолликула и в конечном итоге к образованию фолликулярных опухолей (Andl et al., 2004). Передача сигналов BMP также необходима для дифференцировки собственно стволовых клеток, т.к. целенаправленное удаление Bmpr1a ведет к разрастанию недифференцированных волосяных фолликулов и эпителиальных клеток кишечника (Andl et al., 2004; Kobielak et al., 2003; Sancho et al., 2004).
Роль др. сигнальных путей в биологии эпителиальных стволовых клеток менее ясна. Эмбрионы, лишенные Sonic hedgrhog (Shh), напр., обнаруживают сильно нарушенный морфогенез волосяных фолликулов, в то время как развитие кишечника и молочных желез происходит относительно нормально. Напротив, активирующие передачу сигналов Shh мутации или инактивирующие мутации их негативного регулятора (Patched) обнаруживаются при семейных и спорадических базально-клеточных карциномах, частом раке кожи и при некоторых др. типах эпителиальных раковых опухолей, включая карциномы панкреас (Beachy et al., 2004). Неожиданно уменьшение передачи сигналов hedgehog кажется даже усиливает клеточную пролиферацию в кишечнике новорожденных и взрослых (Madison et al., 2005; van den Brink et al., 2004). Всё это указывает на то, что передача сигналов hedgehog может способствовать пролиферации некоторых типов эпителиальных клеток, тогда как в др. эпителиальных клетках она ингибирует пролиферацию или не оказывает эффекта.
Epithelial Stem Cells and Regenerative Medicine
Пионерские исследования H.Green с сотрудниками привели к успешному культивированию эпидермальных кератиноцитов человека, тем они открыли дверь для последующего клинического использования стратифицированных эпителиальных стволовых клеток в регенеративной медицине
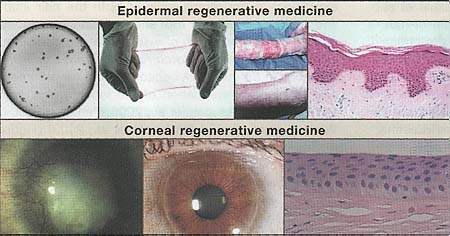 Figure 5. Regenerative Potential of Epidermal and Corneal Epithelium
Top, from left to right: Colonies of human ke-ratinocytes grown on a fibrin matrix can be used to form an epithelial sheet. These sheets were used to treat a patient with bums on over 95% of his body (top image). After 3.5 years, the transplantation has completely healed the patient's skin (bottom image). Histologically, the long-term transplant was normal and contained all of the normal epidermal layers and architecture (reprinted with permission from Lippincott, Williams, and Wilkins; Ronfard et al., 2000). Bottom, from left to right: Long-term potential of the cornea from patient with alkali burns to the cornea causing stromal scarring and neovascularization (Pellegrini, et a)., 1997). Cultures of limbal stem cells isolated from a biopsy of the contralateral eye were transplanted and were able to repair the damaged cornea and produce a healthy cornea, allowing 100% recovery of visual acuity. A biopsy from the regenerated cornea demonstrated that the tissue organization was normal (Courtesy of Drs. Graziella Pellegrini, Paolo Rama, and Michelle DeLuca).
Figure 5. Regenerative Potential of Epidermal and Corneal Epithelium
Top, from left to right: Colonies of human ke-ratinocytes grown on a fibrin matrix can be used to form an epithelial sheet. These sheets were used to treat a patient with bums on over 95% of his body (top image). After 3.5 years, the transplantation has completely healed the patient's skin (bottom image). Histologically, the long-term transplant was normal and contained all of the normal epidermal layers and architecture (reprinted with permission from Lippincott, Williams, and Wilkins; Ronfard et al., 2000). Bottom, from left to right: Long-term potential of the cornea from patient with alkali burns to the cornea causing stromal scarring and neovascularization (Pellegrini, et a)., 1997). Cultures of limbal stem cells isolated from a biopsy of the contralateral eye were transplanted and were able to repair the damaged cornea and produce a healthy cornea, allowing 100% recovery of visual acuity. A biopsy from the regenerated cornea demonstrated that the tissue organization was normal (Courtesy of Drs. Graziella Pellegrini, Paolo Rama, and Michelle DeLuca).
(Rheinwald and Green, 1975; Figure 5). Не все клетки из только что выделенного эпидермиса человека обнаруживают источника молодости потенциал, но некоторые кератиноциты генерируют большие колонии ("holoclones"), которые могут проходить несколько сотен генераций (Barran-don and Green, 1987). Green с коллегами реализовали клинический потенциал своих находок и и использовали его для успешного лечения пациентов с ожогами (O'Connor et al., 1981). Использование фибринового матрикса ускоряло рост кератиноцитов и улучшало долговременные приживление кожных трансплантатов (Pellegrini et al., 1999; Ronfard et al., 2000; Figure 5). Эти процедуры на сегодня спасли жизнь многим ожоговым больным по всему миру. Методы оказались многообещающими также в комбинации с
ex vivo генотерапией, чтобы корректировать разнообразные угрожающие жизни генетические болезни кожи включая ожоги (Mavilio et al., 2006). Недавняя разработка методов для изоляции и очистки клеток дермальных сосочков (Rendl et at., 2005; Richardson et al., 2005) открывает перспективы для понуждения bulge стволовых клеток к регенерации волосяных фолликулов в клинических условиях.
Хотя эпидермис является наиболее вероятным претендентом на арене регенеративной медицины, важность разработки подходов по генерации клеток роговицы для лечения определенных форм слепоты несомненна. Постоянная потеря эпителия роговицы приводит к атипической ре-эпителизации с помощью bulbar клеток конъюнктивы и это в свою очередь стимулирует неоваскуляризацию, воспаление. Кайма (limbus) является предполагаемой нишей стволовых клеток роговицы и limbal трансплантации используются успешно для восстановления эпителия роговицы и зрения (Kenyon and Tseng, 1989). Недавно в случае повреждений глаз стали успешно использовать впервые культивированные limbal стволовые клетки и затем трансплантировать собственный слой эпителия роговицы (Pellegrini et al., 1997). Успех достигнут, достигнутый при регенерации эпидермиса и роговицы при использовании культивируемых стволовых клеток служит прекрасной иллюстрацией того, как достижения лабораторий могут использоваться в терапевтических целях. Эти результаты обнадеживают в отношении разработки новых методов дл репарации или регенерации др. эпителиев, поврежденных в результате ранений или болезни.
Всё ещё остается нерешенным вопрос о степени, с которой мультипотентные стволовые клетки внутри эпителия могут использоваться для генерации др. эпителиальных тканей, при воздействии на них разными мезенхимами. Эмбриональные эпителиальные клетки обладают такой способностью, а как же взрослые эпителиальные стволовые клетки? Если возможно заставить bulge стволовые клетки продуцировать эпителий роговицы, если воздействовать на них мезенхимой роговицы, то это существенно бы расширило клиническое применение этого довольно доступного источника стволовых клеток у взрослых.
Conclusions
In this Review, we have limited our focus to comparative features of epithelial stem cells and what we might gain from such comparisons. There are many other signaling pathways and programs of gene expression that have been elegantly demonstrated to impact on the behavior of specific types of epithelial stem cells. There is a strong likelihood that as we learn more about epithelial stem cells, additional parallels will emerge. This seems especially likely in view of increasing evidence that Wnt and Notch signaling are likely to integrate with other signals such as BMP, Shh, and growth factors emanating from stem cells, their immediate progeny, and their microen-vironment. Taken together, these signals converge to generate the distinct features of stem cells, including self-renewal, proliferation and survival, and suppression of cell-fate commitment and lineage determination.
There are still only a few cases where multipotent epithelial stem cells have been isolated and purified. With the recent isolation of bulge and mammary epithelial stem cells, this should set the stage for rapid advances in the future. Both bulge and mammary epithelial stem cells exist as relatively slow-cycling progenitors, both are positive for the markers keratin .14 and 5, and both express high levels of integrins. Given the existing methods to isolate ceils from transgenic mice on the basis of
their ability to express keratin 5 and integiins and their infrequent cycling (Tumbar et al., 2004), it should be possible to isolate stem cells from a variety of epithe-lia including lung, reproductive tracts, tongue, cornea, esophagus, and sweat glands. Although internal epithe-lia express keratins 8 and 18 instead of 5 and 14 and undergo turnover more rapidly than surface and glandular epithelia, methods^to purify these cells are likely to be forthcoming in the near future.
As characteristics of surface, glandular, and internal epithelial stem cells emerge, it will be interesting to ascertain what features they will share that might account for their common properties of self-renewal and repression of differentiation fates. It will also be exciting to unearth the features that uniquely define Them, such as their different degrees of quiescence and long-term survival or their unipotency versus multipotency. What is the impact of an epithelial stem cell's native niche on its behavior? Which traits are cell autonomous? How similar are corneal, epidermal, and esophageal stem cells? To what extent do eccrine sweat and salivary gland stem cells resemble those of a mammary gland? What prompts them to secrete the tssue-specific products, sweat, saliva, or milk? Defin-ng the mechanisms that govern epithelial stem cell :enavior is not only a rapidly progressing field of sci-once but is also an increasingly important biomedical terrain for devising new and improved treatments of damaged and/or cancerous epithelial tissues. Biologists, clinicians, and patients will watch with interest as the mysteries underlying the fascinating properties of epithelial stem cells continue to emerge.
Сайт создан в системе
uCoz
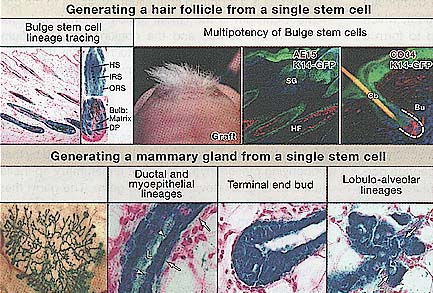 Figure 2. Multipotency of Hair-Follicle and Mammary Gland Stem Cells
Bulge stem cell lineage tracing in vivo. Skin sections from mice expressing a regulatable Cre-re-combinase under the control of a bulge-specific (K15) enhancer element and a lacZ transgene active in all Cre-expressing cells and their progeny (reprinted by permission from MacMillan Publishers Ltd.; Morris et al., 2004). Following Cre activation, all lineages of the new hair follicle expressed LacZ, demonstrating that they arose from bulge cells. Multipotency of bulge cells. CD34+, a6 integrin+ bulge cells were purified by flow cytometry from skin of mice expressing GFP-actin under the control of the K14 promoter (Blanpain et al., 2004). Bulge cells were cultured, and clonally derived keratinocytes from a single cell were used for grafting with unlabeled mesenchymal cells. Nude mice developed tufts of hair at grafted sites (left), and sectioning revealed that the GFP+ cells contributed to the epidermis, sebaceous glands (SG), and hair follicles (reprinted from Cell with permission from Elsevier; Blanpain et al., 2004). Multipotency of mammary gland stem cells. LinCD29hiCD24+ myoepithelial cells were purified by flow cytometry from lacZ+ mice, and individual cells were transplanted into cleared fat pads (Shackleton et al., 2006; StingI et al., 2006) Epithelial grafts from virgin (left and middle) or pregnant recipients (right) demonstrate the ability of single lacZ+ stem cells (blue) to form a complete mammary gland structure. Sections of mammary grafts demonstrate the contribution of LacZ+ (blue) progeny from the single mammary stem cell to the ductal (arrow- heads) and myoepithelial (arrows) cell lineages, the terminal end bud in a virgin recipient, and the lobulo-alveolar epithelium in a mid-term pregnant recipient (right, arrows indicate lipid droplets) (reprinted with permission from MacMillan Publishers Ltd: Shackleton et al., 2006).
Figure 2. Multipotency of Hair-Follicle and Mammary Gland Stem Cells
Bulge stem cell lineage tracing in vivo. Skin sections from mice expressing a regulatable Cre-re-combinase under the control of a bulge-specific (K15) enhancer element and a lacZ transgene active in all Cre-expressing cells and their progeny (reprinted by permission from MacMillan Publishers Ltd.; Morris et al., 2004). Following Cre activation, all lineages of the new hair follicle expressed LacZ, demonstrating that they arose from bulge cells. Multipotency of bulge cells. CD34+, a6 integrin+ bulge cells were purified by flow cytometry from skin of mice expressing GFP-actin under the control of the K14 promoter (Blanpain et al., 2004). Bulge cells were cultured, and clonally derived keratinocytes from a single cell were used for grafting with unlabeled mesenchymal cells. Nude mice developed tufts of hair at grafted sites (left), and sectioning revealed that the GFP+ cells contributed to the epidermis, sebaceous glands (SG), and hair follicles (reprinted from Cell with permission from Elsevier; Blanpain et al., 2004). Multipotency of mammary gland stem cells. LinCD29hiCD24+ myoepithelial cells were purified by flow cytometry from lacZ+ mice, and individual cells were transplanted into cleared fat pads (Shackleton et al., 2006; StingI et al., 2006) Epithelial grafts from virgin (left and middle) or pregnant recipients (right) demonstrate the ability of single lacZ+ stem cells (blue) to form a complete mammary gland structure. Sections of mammary grafts demonstrate the contribution of LacZ+ (blue) progeny from the single mammary stem cell to the ductal (arrow- heads) and myoepithelial (arrows) cell lineages, the terminal end bud in a virgin recipient, and the lobulo-alveolar epithelium in a mid-term pregnant recipient (right, arrows indicate lipid droplets) (reprinted with permission from MacMillan Publishers Ltd: Shackleton et al., 2006).  Figure 3. Wnt/β-Catenin Signaling Regulates Epithelial Stem Cells
(A) Model summarizing the functions of Wnt/p-catenin signaling in the intestine that regulate stem cell renewal and Paneth cell differentiation, p-catenin and Tcf4 appear to regulate c-Myc and EphB2/B3 during renewal, whereas these transcriptional complexes regulate Paneth cell genes during differentiation. (B) Model summarizing functions that have been suggested for Wnt signaling in stem cell maintenance, activation, and hair shaft differentiation in the follicle. Tcf3/4 regulate genes implicated in stem cell quiescence and differentiation, whereas p-catenin and Tcf/Lef complexes regulate genes likely involved in stem cell activation and migration, p-catenin and Lef1 complexes in precorneal cells regulate expression of hair shaft genes. (C) Model summarizing putative functions for Wnt signaling in the mammary gland in cancer development and alveolar differentiation. In combination with Tcf4 and Lef1, p-catenin regulates genes involved in alveolar differentiation. (D) General model depicting these different outcomes: stem cell self-renewal, activation, differentiation, or tumorigenesis, depending upon the level of effective Wnt signaling (that is, β-catenin/Lef/Tcf activity) that an epithelial stem cell receives.
Figure 3. Wnt/β-Catenin Signaling Regulates Epithelial Stem Cells
(A) Model summarizing the functions of Wnt/p-catenin signaling in the intestine that regulate stem cell renewal and Paneth cell differentiation, p-catenin and Tcf4 appear to regulate c-Myc and EphB2/B3 during renewal, whereas these transcriptional complexes regulate Paneth cell genes during differentiation. (B) Model summarizing functions that have been suggested for Wnt signaling in stem cell maintenance, activation, and hair shaft differentiation in the follicle. Tcf3/4 regulate genes implicated in stem cell quiescence and differentiation, whereas p-catenin and Tcf/Lef complexes regulate genes likely involved in stem cell activation and migration, p-catenin and Lef1 complexes in precorneal cells regulate expression of hair shaft genes. (C) Model summarizing putative functions for Wnt signaling in the mammary gland in cancer development and alveolar differentiation. In combination with Tcf4 and Lef1, p-catenin regulates genes involved in alveolar differentiation. (D) General model depicting these different outcomes: stem cell self-renewal, activation, differentiation, or tumorigenesis, depending upon the level of effective Wnt signaling (that is, β-catenin/Lef/Tcf activity) that an epithelial stem cell receives.  Figure 4. Notch Signaling Regulates Lineages Determination of Epithelial Stem Cells In canonical Notch signaling, upon binding to Notch ligands, Notch receptors are cleaved and the intracellular domain translocates to the nucleus to act in concert with an RBP-J transcription factor to regulate gene expression. The schematics illustrate the putative roles of Notch signaling in three different epithelial tissues. (Top) A role for Notch in intestinal stem cell self-renewal and differentiation. Notch/RBP-J restricts the fate of secretory lineages in the intestine (Goblet, Paneth, and enteroendocrine cells). In the absorptive progenitors, Notch activity leads to the expression of Hes1 and subsequent repression of Mathl, leading to enterocyte differentiation. In the absence of Notch signaling, Mathl expression is not repressed and allows secretory progenitors to differentiate into goblet, neuroendrocrine, and Paneth cells. (Middle) A role for Notch in stem cell maintenance and differentiation in the epidermis and hair follicle. Notch promotes spinous cell fate in the interfollicular epidermis (IFE) and regulates differentiation of the sebaceous gland, the hair shaft, and the inner root sheath cells of the hair follicle. (Bottom) A role for Notch signaling in alveolar differentiation in the mammary gland. Mammary stem cells form alveolar and ductal progenitors that each form a myoepithelial cell in addition to tubular and alveolar cells, respectively. Notch signaling regulates the differentiation of alveolar progenitors into alveolar cells.
Figure 4. Notch Signaling Regulates Lineages Determination of Epithelial Stem Cells In canonical Notch signaling, upon binding to Notch ligands, Notch receptors are cleaved and the intracellular domain translocates to the nucleus to act in concert with an RBP-J transcription factor to regulate gene expression. The schematics illustrate the putative roles of Notch signaling in three different epithelial tissues. (Top) A role for Notch in intestinal stem cell self-renewal and differentiation. Notch/RBP-J restricts the fate of secretory lineages in the intestine (Goblet, Paneth, and enteroendocrine cells). In the absorptive progenitors, Notch activity leads to the expression of Hes1 and subsequent repression of Mathl, leading to enterocyte differentiation. In the absence of Notch signaling, Mathl expression is not repressed and allows secretory progenitors to differentiate into goblet, neuroendrocrine, and Paneth cells. (Middle) A role for Notch in stem cell maintenance and differentiation in the epidermis and hair follicle. Notch promotes spinous cell fate in the interfollicular epidermis (IFE) and regulates differentiation of the sebaceous gland, the hair shaft, and the inner root sheath cells of the hair follicle. (Bottom) A role for Notch signaling in alveolar differentiation in the mammary gland. Mammary stem cells form alveolar and ductal progenitors that each form a myoepithelial cell in addition to tubular and alveolar cells, respectively. Notch signaling regulates the differentiation of alveolar progenitors into alveolar cells.
 Figure 5. Regenerative Potential of Epidermal and Corneal Epithelium
Top, from left to right: Colonies of human ke-ratinocytes grown on a fibrin matrix can be used to form an epithelial sheet. These sheets were used to treat a patient with bums on over 95% of his body (top image). After 3.5 years, the transplantation has completely healed the patient's skin (bottom image). Histologically, the long-term transplant was normal and contained all of the normal epidermal layers and architecture (reprinted with permission from Lippincott, Williams, and Wilkins; Ronfard et al., 2000). Bottom, from left to right: Long-term potential of the cornea from patient with alkali burns to the cornea causing stromal scarring and neovascularization (Pellegrini, et a)., 1997). Cultures of limbal stem cells isolated from a biopsy of the contralateral eye were transplanted and were able to repair the damaged cornea and produce a healthy cornea, allowing 100% recovery of visual acuity. A biopsy from the regenerated cornea demonstrated that the tissue organization was normal (Courtesy of Drs. Graziella Pellegrini, Paolo Rama, and Michelle DeLuca).
Figure 5. Regenerative Potential of Epidermal and Corneal Epithelium
Top, from left to right: Colonies of human ke-ratinocytes grown on a fibrin matrix can be used to form an epithelial sheet. These sheets were used to treat a patient with bums on over 95% of his body (top image). After 3.5 years, the transplantation has completely healed the patient's skin (bottom image). Histologically, the long-term transplant was normal and contained all of the normal epidermal layers and architecture (reprinted with permission from Lippincott, Williams, and Wilkins; Ronfard et al., 2000). Bottom, from left to right: Long-term potential of the cornea from patient with alkali burns to the cornea causing stromal scarring and neovascularization (Pellegrini, et a)., 1997). Cultures of limbal stem cells isolated from a biopsy of the contralateral eye were transplanted and were able to repair the damaged cornea and produce a healthy cornea, allowing 100% recovery of visual acuity. A biopsy from the regenerated cornea demonstrated that the tissue organization was normal (Courtesy of Drs. Graziella Pellegrini, Paolo Rama, and Michelle DeLuca).