Autocrine VEGF Signaling Is Required for Vascular Homeostasis
Cell, Volume 130, Issue 4, 24 August 2007, Pages 691-703 | |
|
|
Vascular endothelial growth factor (VEGF) является важным для онтогенетического и патологического ангиогенеза. В работе показано, что в отсутствие какого-либо патологического инсульта, аутокринный VEGF необходим для гомеостаза кровеносных сосудов у взрослых. Генетическая делеция vegf особенно в эндотелиальном клоне ведет к прогрессивной дегенерации эндотелия и к внезапной гимбели у 55% мутантных мышей в возрастек 25 недель. Фенотип проявляется без обнаружимых изменений в общих уровнях мРНК и белка VEGF, указывая тем самым, что паракринный VEGF не может компенсировать отсутствие эндотелиального VEGF. Более того дикого типа эндотелиальные клетки, но не нулевые по VEGF, обнаруживают фосфорилирование VEGFR2 в отсутствие экзогенного VEGF. Активация рецепторов в клетках дикого типа супрессируется с помощью малых молекул антагонистов, но не за счет внеклеточной блокады VEGF. Эти результаты указывают на клеточно автономный путь передачи сишналов VEGF, это важно для гомеостаза сосудов, не безразлично для ангиогенного каскада. |
The VEGF Family, the Inside Story | |
|
REFERENCES
| |
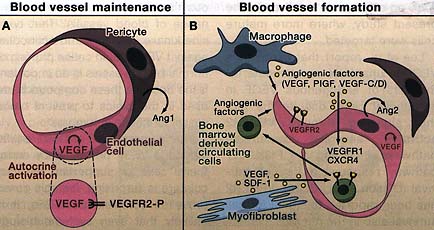 Figure 1. Paracrine and Autocrine Effects of Growth Factors in Capillaries
(A) During steady-state conditions paracrine angiopoietin-1 (Ang1) and low levels of paracrine vascular endothelial growth factor (VEGF) are produced by pericytes and other cell types associated with the endothelium. Lee et al. (2007) show that VEGF produced by endothelial cells promotes intracellular autocrine stimulation of VEGFR2 that supports endothelial cell survival. (VEGFR-2-P, phosphorylated VEGFR2.)
(B) Several pathways are activated during the formation of new blood vessels (angiogen-esis). VEGF production increases in response to ischemia/tissue hypoxia that is in part responsible also for autocrine production of Ang2 involved in pericyte detachment (Yan-copoulos et al., 2000). VEGF and placental growth factor (PIGF) as well as stroma-derived factor-1 (SDF-1) —produced by perivascular myofibroblasts—recruit mononuclear cells into the perivascular space by binding to the receptors VEGFR1 and CXCR4, respectively (Grunewald et al., 2006; Luttun et al., 2002). These cells and related macrophages produce additional angiogenic factors including VEGF, VEGF-C, and VEGF-D, and they may in some cases be responsible for why tumors are refractory to continued anti-VEGF treatment (Shojaei et al., 2007).
Figure 1. Paracrine and Autocrine Effects of Growth Factors in Capillaries
(A) During steady-state conditions paracrine angiopoietin-1 (Ang1) and low levels of paracrine vascular endothelial growth factor (VEGF) are produced by pericytes and other cell types associated with the endothelium. Lee et al. (2007) show that VEGF produced by endothelial cells promotes intracellular autocrine stimulation of VEGFR2 that supports endothelial cell survival. (VEGFR-2-P, phosphorylated VEGFR2.)
(B) Several pathways are activated during the formation of new blood vessels (angiogen-esis). VEGF production increases in response to ischemia/tissue hypoxia that is in part responsible also for autocrine production of Ang2 involved in pericyte detachment (Yan-copoulos et al., 2000). VEGF and placental growth factor (PIGF) as well as stroma-derived factor-1 (SDF-1) —produced by perivascular myofibroblasts—recruit mononuclear cells into the perivascular space by binding to the receptors VEGFR1 and CXCR4, respectively (Grunewald et al., 2006; Luttun et al., 2002). These cells and related macrophages produce additional angiogenic factors including VEGF, VEGF-C, and VEGF-D, and they may in some cases be responsible for why tumors are refractory to continued anti-VEGF treatment (Shojaei et al., 2007).