The EMT in embryonic development
Epithelial to mesenchymal transition (EMT) приводит к выраженным изменениям в морфологии и поведении эпителиальных клеток. Он не только делает в клетках неплотными контакты с их соседями, но и также делает их подвижными, так что они могут проникать через базальную мембрану, которая отделяет разные ткани в эмбрионе. Довольно скоро эмбриологи установили, что эта трансформация (Hay, 1968; Thiery, 1984; Bellairs, 1987; Hay, 1989) происходит частично из-за того, что EMT происходит повторно во время эмбрионального развития для генерации тканей и органов, чьи предшественники возникают далеко от места их финального предназначения. EMT необходим эмбрионам, чтобы позволить эпителиальным клеткам мигрировать на довольно значительные расстояния. Важно отметить, что EMT означает, что эпителиальные клетки, которые воспринимают фенотип мезенхимных клеток, а , следовательно, ни процессы, ни молекулы, которые запускают его (see below) обычно не используются, чтобы способствовать перемещению др. типов клеток, таких как мигрирующие нейроны в развивающемся головном мозге. Др. интересный аспект EMT заключается в том, что необходимо учитывать, что возникнув однажды клетки достигают места своего предназначения, где их дифференцировка в различные типы клеток очень часто использует обратный процесс мезенхимно-эпителиальной трансформации (MET). Преходящая природа трансформации облегчает образование многих разных эмбриональных производных и объясняет, почему термин переход предпочтительнее термина трансформации.
Вычленение нервного гребня из нервной трубки и мезодермы из первичной полоски у амниот рассматриваются как прототип EMTs и эти события дают множество информации, чтобы понять клеточные и молекулярные аспекты EMT (Fig. 1A, B). Эти две ткани дают множество производных и вместе они является предшественниками периферической нервной системы, пигментных клеток, скелета, мышц и компонентов дермиса. Более того, нервный гребень и мезодерма являются эмбриональными тканями, в которых описаны гены Snail среди др. принципиальных индукторов EMT. Elizabeth Hay предположила существование мезенхимных регуляторных генов мастеров, которые активируются, чтобы индуцировать EMT (Hay, 1995). Гены Snail, которые кодируют транскрипционные факторы zinc-finger типа, ведут себя подобно мастер-генам для EMT, т.к. они способны индуцировать весь процесс как in vitro, так и in vivo. Соотв. экспрессия множества молекул,которые влияют на морфологию и поведение. регулируются белками Snail (Fig. 2).
Первым указанием, что гены Snail участвуют в запуске EMT получены в исследованиях на ранних эмбрионах кур. Антисмысловые олигонуклеотиды против Slug (теперь наз. Snail2) предупреждают вычленение нервного гребня и мезодермы (Nieto et al., 1994) , а значит, это подтверждает, что гены Snail являются критическими для индукции EMT у разных видов и тканей (rev. Hemavathy et al., 2000; Nieto, 2002; Ip and Gridley, 2002; De Craene et al., 2005; Barrallo-Gimeno and Nieto, 2005). Помимо участия в нервном гребне и мезодерме гены Snail участвуют вe EMT, необходимом для образования кардиальных подушек (Romano and Runyan, 2000; Carmona et al., 2000; Timmerman et al., 2004), париетальной энтодермы (Velmaat et al., 2000) и закрытия нёба (Martinez-Alvarez et al., 2004; Murray et al., 2007), также как в событиях в др. тканях и органах. Более того, гены Snail явились предметом многочисленных эволюционных исследований, связанными с такими особенностями, как эволюционное чередование паттернов экспрессии разных генов Snail у разных видов и их ассоциация с возникновением нервного гребня (Sefton et al., 1998; Locascio et al., 2002; Manzanares and Nieto, 2003). Сходным образом, был изучен EMT в ходе эволюции, учитывая его родоначальную роль в запуске клеточных перемещений у Metazoa (Fritzenwanker et al., 2004). Др. онтогенетические гены, которые важны для EMT включают транскрипционные факторы Twist (Yang et al., 2004), E47 (Perez-Moreno et al., 2001) и Sip-1 (Comijn et al., 2001). Здесь основное внимание будет уделено генам Snail , тогда как несколько групп, работающих в Испании, внесли существенный вклад в наше понимание того, как эти гены участвуют в процессе EMT как во время эмбрионального развития, так и у взрослых.
The EMT in tumor progression
Взаимоотношения между генами
Snail и EMT, их патологическая активация может вносить вклад в начало инвазии или метастатического фенотипа во время прогресса эпителиальных раковых опухолей (Nieto et al., 1994). На клеточном уровне вычленение злокачественных клеток из первичной опухоли напоминает таковое, осуществляемое клетками нервного гребня и мезодермы. В самом деле, Snail активируется в инвазивных

Fig. 1. Snail and the Epithelial-Mesenchymal Transition (EMT) in health and disease. (A,B) The EMT is fundamental for the development of many tissues and organs, including the neural crest and the mesoderm of amniotes. (C) Snail is activated in vivo at the invasive front of chemically-induced mouse skin tumors and it is present in human carcinomas of different etiologies, where it is inversely correlated with the degree of differentiation and is associated with lymph-node metastasis (see Barrallo-Gimeno and Nieto, 2005, for a review). (D) Multiphoton intravital microscopy has facilitated the visualization of individual primary tumor cells migrating away from the tumor mass (Wang et al., 2002). (E) Snail is maintained silent in the adult and its pathological activation in the kidney leads to renal fibrosis (Boutet et al., 2006).
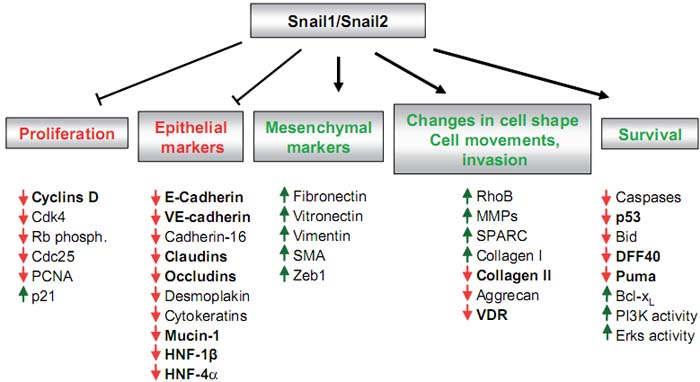
Fig. 2. Downstream targets of Snail. In addition to molecules involved in morphological changes and the acquisition of motile and invasive properties, the Snail genes also regulate cell proliferation and cell death. The targets that are directly regulated by Snail genes are shown in bold. Bid, Bcl interacting death agonist; Cdk, cyclin-dependent kinase; DFF, DNA fragmentation factor; Erks, extracellular signal-regulated kinases; HNF, hepatocyte nuclear factor; MMPs, metalloproteinases; PI3K, phosphoinositide 3-Kinase; p21, cyclin-dependent kinase inhibitor; p53, tumor suppressor; Rb, retinoblastoma; SMA, alpha smooth muscle actin; SPARC, secreted protein, acidic and rich in cysteine; VDR, vitamin D receptor. Updated from a previous version in Barrallo-Gimeno and Nieto, 2005.
областях опухолей, генерируемых кожей мышей (Cano et al., 2000; Fig. 1C), в недифференцированных опухолях молочных желез (Blanco et al., 2002) и в др. карциномах разных этиологий напр., Rosivatz et al., 2002; Saito et al., 2004; Miyoshi et al., 2005; Kuphal et al., 2005; Franci et al., 2006; Boutet et al., 2007). Т.о., Snail сегодня рассматривается как маркер озлокачествления опухолей мишень для противо-инвазивных лекарств. Более того, Snail также участвует в содействии возвращения опухолей (Moody et al., 2005) и регулирует экспрессию др. молекул, не связанных с EMT, таких как vitamin D receptor, что имеет значение для терапии раковых опухолей (Palmer et al., 2004).
Молекулярный анализ Snail-индуцированной EMT показал, что Snail является сильным репрессором транскрипции E-cadherin (Batlle et al., 2000; Cano et al., 2000), это очень сильно влияет на поведение клеток в эмбриональном развитии и при прогрессировании опухолей. В самом деле, потеря экспрессии E-cadherin клинически связано с плохим прогнозом, т.к. она ассоциирует с переходом к инвазивному фенотипу (Perl et al., 1998). Помимо Snail, др. репрессоры E-cadherin, которые вносят вклад в EMT и прогрессирование опухолей, были описаны позднее. Сюда входят члены ZEB и HLH семейств, которые дифференциально распределены в опухолях разного происхождения (see Peinado et al., 2007 for a review).
Важно отметить, что репрессия E-cadherin недостаточна, чтобы индуцировать EMT или инвазивные свойства, т.к. его повторная экспрессия в мезенхимных клетках не индуцирует реверсии к эпителиальному фенотипу (Navarro et al., 1993). В самом деле, репрессоры E-cadherin и в особенности Snail, прямо или косвенно регулируют экспрессию множества дополнительных генов мишеней (Fig. 2), чтобы репрессировать эпителиальные характеристики и провоцировать мезенхимный переход. Более того, разные члены семейства Snail могут быть функционально эквивалентными (Del Barrio and Nieto, 2002) и м. иметь также множество общих мишеней, каждый также может иметь и специфические мишени (MorenoBueno et al., 2006).
Snail может также способствовать прогрессированию опухолей путем активации ангиогенеза (Peinado et al., 2004b) и имеются указания, указывающие на то, что молчание Snail может устранять инвазию (Olmeda et al., 2007). Недавние исследования внесли вклад в наше понимание механизмов, которые контролируют активность Snail как транскрипционного фактора (Peinado et al., 2004a; Peinado et al., 2005).
Животные модели, полученные для изучения роли Snail в туморогенезе, теперь доступны и вполне пригодны для дальнейшего изучения этих процессов (Perez-Mancera et al., 2005a; 2005b). Однако важно учитывать, что эти модели д. учитывать фундаментальные роли, выполняемые Snail во время эмбрионального развития, которое может подвергаться опасности при таких исследованиях. Итак, EMT является важной ступенью в приобретении инвазивного фенотипа опухолями, представляя собой пример важного онтогенетического процесса, который приобретает зловещую роль, как полагает Jean Paul Thiery (Thiery, 2002).
The EMT in organ fibrosis
Неблагоприятная роль EMT у взрослых не ограничивается прогрессированием опухолей и, в самом деле, взрослые нетрансформированные эпителиальные клетки после воздействия Snail подвергаются EMT, нарушая тканевой гомеостаз. Их аберрантная активация во взрослых почках достаточна, чтобы индуцировать EMT в канальцах и развитие фиброза у трансгенных мышей (Fig. 1E) и наблюдается патологическая экспрессия
Snail в областях фиброза почек человека (Boutet et al., 2006). Вплоть до недавнего времени считалось, что почечный фиброз провоцируется за счет активации интерстициального фиброза, который возникает за счет отложения избытка коллагеновых волокон. Однако последние исследования показали, что эпителиальные клетки почечных канальцев подвергаются EMT (Iwano et al., 2002). Более того, усиливается активность Snail во время EMT в затронутых гепатоцитах (Valdes et al., 2002) и мезотелиальных клетках у пациентов, леченный с помощью перитонеального диализа (Yanez-Mo et al., 2003). Т.о., очевидно, что гены
Snail д. поддерживать молчание у взрослых. Активность Snail регулируется не только на уровне транскрипции, но его субклеточная локализация также становится предметом жесткого контроля (Dominguez et al., 2003; Zhou et al., 2004). Эпигенетические механизмы, скорее всего, являются фундаментальными в замалчивании
Snail, поскольку увеличение его экспрессии может быть связано с деметилированием промотора и такое увеличение коррелирует с инвазивными свойствами карциномных линий клеток (Fraga et al., 2004). Интересно, что эта реактивация
Snail может рассматриваться-как возвращение к эмбриональному клеточному состоянию, т.к. оно выполняет те же самые функции у взрослых, что и у эмбрионов, индуцирует of EMT.
The EMT in tumor progression: A hundred years later?
Хотя блистательный вклад Santiago Ramon y Cajal в современную нейробиологию хорошо известен, но не всем ученым известно, что он также внес существенный вклад и в др. областях. Хорошо известна его книга "Textura del sistema nervioso del hombre y los vertebrados" впервые опубликованная в Испании в 1899. Однако он также написал великолепную и исчерпывающую Manual of Pathological Anatomy с его многочисленными гистологическими слайдами и рисунками. В этом учебнике он описал гистопатологию многих болезней в деталях. включая чрезвычайно интерсную главу о карциномах. Его описание клеток в опухолях молочных желез не только чрезвычайно детальное, но и также он далеко опередил свое время в смысле его идей о злокачественности опухолей. Описывая характеристики инвазивной опухоли молочных желез, он упоминает: " The epithelial islands are not surrounded by a basement membrane.. We must mention the fusiform, pear-like and star-like forms.. These cells are not attached to each other.. This explains their invasive ability " (Ramon y Cajal, 1900). Даже сегодня трудно описать лучше эпителиальные клетки, которые приобретают инвазивные свойства. Эти клетки были великолепно проиллюстрированы Cajal, а Fig. 3 включает некоторые рисунки, адаптированные из его Figures 62 and 68 треьего издания его Manual, опубликованного в 1900. Удивительно наблюдать наскоько аккуратно он проиллюстрировал как дифференцированные, так и недифференцированные и инвазивные карциномы молочных желез человека (Fig. 3A and C, respectively). Очень интересно, что в infiltrating ductal breast carcinomas (IDC) экспрессия
Snail обратным образом скоррелирована со степенью дифференцировки (Blanco et al., 2002). До чего же сильно Snail-экспрессирующие клетки в этих опухолях напоминают расположение и форму их, описанных Cajal более 100 лет тому назад (Fig. 3G-H). Очевидно, что Cajal "понял" процесс EMT за много лет до понимания его роли для злокачественных опухолей.
Old views and new perspectives
В противоположность давно установленной концепции о роли EMT в формировании эмбриональных тканей, значение EMT в метастазировании остается предметом дебатов (Tarin, 2005). Фактически существует довольно мало убедительных доказательства, что этот процесс происходит в опухолях людей. Во-первых, EMT является скорее всего локальным событием инициальных стадий туморогенеза и, кроме того, это динамический процесс, затрудняющий визуализацию злокачественных клеток с миграторным мезенхимным фенотипом. Ясно, чтобы сформировались метастазы, клетки д. давать колонии в удаленных местах. Вл время эмбрионального развития миграторные мезенхимные клетки прекращают свою миграцию и дифференцируются, когда достигают места своего предназначения (Sefton et al., 1998). Они одновременно подавляют в себе экспрессию Snail и подвергаются MET, теряя свои мезенхимные свойства. Это делает также очень трудным увидеть их в мезенхимном состоянии, но это согласуется с возобновлением экспрессии E-cadherin, наблюдаемым в в метастахах в подмышечных лимфатических железах (Bukholm et al., 2000) и в некоторых экспериментально вызванных метастазах (Mareel et al., 1991).
Недавнее развитие intravital multiphoton микроскопии одновременно с новйшими подходами по использованию флюоресцентных клеточных маркеров позволяет анализировать инициальные ступени диссеминации опухолей в животных моделях in vivo. Соотв., одиночная карциномная клетка, которая потеряла свою эпителиальную полярность, может быть видимой во время миграции из первичной опухоли (Wang et al., 2002; Condeelis and Segal, 2003; Fig. 1D). Эти данные предоставили первые прямые доказательства EMT на первоначальных стадиях метастатического каскада in vivo.
Др. интересной концепцией является та, согласно которой важно пролиферативное состяние злокачественных клеток, которые выделяются из первичной опухоли. Общепринято. что рак ассоциирует с высокой скоростью пролиферации. Однако относительно невысокая пролиферация наблюдается по инвазивному фронту карцином (Jung et al., 2001) , драматические цитоскелетные изменения, которые происходят во время EMT, по-видимому, несовместимы с клеточными делениями (Barrallo-Gimeno and Nieto, 2005). В самом деле. клетки временно прекращают делиться прежде чем подвергнуться миграции во время эмбрионального развития. Т.о., хотя нерегулируемая пролиферация является фундаментальной для формирования и роста опухолей, этого не происходит во время их фазы озлокачествления. Интересно, что Snail блокирует ход клеточного цикла, репрессируя экспрессию гена Cyclin D и усиливая экспрессию ингибитора клеточного цикла p21 (Vega et al., 2004). Способность визуализовать флюоресцентные клетки, выделяющиеся из опухолей позволяет выделять их и очищать, чтобы определить их молекулярную сигнатуру. Такой анализ продемонстрировал, что инвазивные клетки не является пролиферативными (Condeelis et al., 2005) , указывая тем самым, что пролиферация опухолевых клеток может не совпадать с озлокачествлением.
Наконец, др. свойство, ассоциированное с Snail-индуцированным EMT это резистентность клеток к апоптозу или гибели клеток. В самом деле, эти клетки становятся резистентными к потере факторов жизнеспособности, действию апоптических стимулов и генотоксических стрессов (Inoue et al., 2002; Perez-Losada et al., 2003; Vega et al., 2004, Kajita et al., 2004). Т.о., Snail наделяет селективными преимуществами эмбриональные клетки, мигрирующие в направлении их окончательного места предназначения и инвазивные злокачественные клетки в их попытке диссеминировать и сформировать метастазы. Опять же in vivo очистка диссеминирующих клеток подтверждает, что эти клетки резистентны к обычно химиотерапии (Goswami et al., 2004).
In summary, we have significantly advanced our knowledge in the last decade about the cellular processes that have been hijacked from normal developmental networks and aberrantly employed in adult pathologies. The combination of sophisticated animal models and the development of fluorescent probes and nanodevices that can be incorporated into state-of-the-art intravital microscopes seem to offer promise in our fight against one of the most devastating aspects of cancer, the metastatic process, as well as against degenerative organ diseases.
Сайт создан в системе
uCoz  Fig. 1. Snail and the Epithelial-Mesenchymal Transition (EMT) in health and disease. (A,B) The EMT is fundamental for the development of many tissues and organs, including the neural crest and the mesoderm of amniotes. (C) Snail is activated in vivo at the invasive front of chemically-induced mouse skin tumors and it is present in human carcinomas of different etiologies, where it is inversely correlated with the degree of differentiation and is associated with lymph-node metastasis (see Barrallo-Gimeno and Nieto, 2005, for a review). (D) Multiphoton intravital microscopy has facilitated the visualization of individual primary tumor cells migrating away from the tumor mass (Wang et al., 2002). (E) Snail is maintained silent in the adult and its pathological activation in the kidney leads to renal fibrosis (Boutet et al., 2006).
Fig. 1. Snail and the Epithelial-Mesenchymal Transition (EMT) in health and disease. (A,B) The EMT is fundamental for the development of many tissues and organs, including the neural crest and the mesoderm of amniotes. (C) Snail is activated in vivo at the invasive front of chemically-induced mouse skin tumors and it is present in human carcinomas of different etiologies, where it is inversely correlated with the degree of differentiation and is associated with lymph-node metastasis (see Barrallo-Gimeno and Nieto, 2005, for a review). (D) Multiphoton intravital microscopy has facilitated the visualization of individual primary tumor cells migrating away from the tumor mass (Wang et al., 2002). (E) Snail is maintained silent in the adult and its pathological activation in the kidney leads to renal fibrosis (Boutet et al., 2006). Fig. 2. Downstream targets of Snail. In addition to molecules involved in morphological changes and the acquisition of motile and invasive properties, the Snail genes also regulate cell proliferation and cell death. The targets that are directly regulated by Snail genes are shown in bold. Bid, Bcl interacting death agonist; Cdk, cyclin-dependent kinase; DFF, DNA fragmentation factor; Erks, extracellular signal-regulated kinases; HNF, hepatocyte nuclear factor; MMPs, metalloproteinases; PI3K, phosphoinositide 3-Kinase; p21, cyclin-dependent kinase inhibitor; p53, tumor suppressor; Rb, retinoblastoma; SMA, alpha smooth muscle actin; SPARC, secreted protein, acidic and rich in cysteine; VDR, vitamin D receptor. Updated from a previous version in Barrallo-Gimeno and Nieto, 2005.
Fig. 2. Downstream targets of Snail. In addition to molecules involved in morphological changes and the acquisition of motile and invasive properties, the Snail genes also regulate cell proliferation and cell death. The targets that are directly regulated by Snail genes are shown in bold. Bid, Bcl interacting death agonist; Cdk, cyclin-dependent kinase; DFF, DNA fragmentation factor; Erks, extracellular signal-regulated kinases; HNF, hepatocyte nuclear factor; MMPs, metalloproteinases; PI3K, phosphoinositide 3-Kinase; p21, cyclin-dependent kinase inhibitor; p53, tumor suppressor; Rb, retinoblastoma; SMA, alpha smooth muscle actin; SPARC, secreted protein, acidic and rich in cysteine; VDR, vitamin D receptor. Updated from a previous version in Barrallo-Gimeno and Nieto, 2005.