Три гена мишени для HesC - Alx1, Ets1 и T-brain активируют экспрессию ряда др. транскрипционных факторов в микромерном клоне, которые в свою очередь контролируют экспрессию дополнительных регуляторных генов (Fig. 1B). Большинство транскрипционных факторов экспрессируется ниже HesC, внося непосредственный вклад в транскрипционный контроль генов дифференцировки, участвующих в биоминерализации (Oliveri et al., 2002; Livingston et al., 2006; Oliveri et al., 2008).
Хотя double-negative gate необходим для индукции SM GRN в клетках, производных микромеров, недавно было установлено, что эктопическая экспрессия HesC гена мишени alx1 в макромерных дочерних клетках достаточна, чтобы индуцировать скелетогенную GRN в эктопическом месте у эмбрионов после гаструляции морского ежа Lytechinus variegatus (Ettensohn et al., 2007). Эктопическая экспрессия alx1 и t-brain индуцируется в отсутствие собственно специфицированных SMs, это приводит к респецификации др. типов мезодермальных клеток. Это подразумевает, что SMs из нормальных поздних эмбрионов д. испускать сигналы, которые репрессируют скелетогенные судьбы клеток, включая экспрессию alx1 и tbr в др. мезодермальных клеточных клонах.
Становление специализированного клеточного клона для продукции эмбрионального скелета является эволюционным новшеством современных морских ежей. Единственный др. Class иглокожих, которые обнаруживают эмбриональный скелет, это ophiuroids, которые не формируют микромерного клеточного клона (Primus, 2005). GRN, которая управляет спецификацией скелетогенного клеточного клона, однако, по-видимому, собирается задолго до его использования для образования эмбрионального скелета (Gao and Davidson, 2008). Большинство транскрипционных факторов ниже SM GRN из
pmar1-hesC двойной репрессирующей системы экспрессируются в центрах skeletonization личинок морских ежей, у которых образуется взрослый скелет. Очень сходные результаты были также получены у отдаленно родственной морской звезды
Asterina miniata (Gao and Davidson, 2008). Несмотря на 500 Mya дивергентной эволюции, оба вида, по-видимому, обладают сходным регуляторным инструментарием спецификации клона взрослых скелетогенных клеток. У эмбрионов морских ежей эта предсуществующая сеть может быть рекрутирована в микромерный клон клеток путем постановки его под контроль простой регуляторной переключающей системы, double negative gate.
The onset of the non-skeletogenic mesenchyme gene regulatory network depends on inputs provided by the skeletogenic gene regulatory network
Успешная инициация процесса спецификации SM ведет к продукции разных сигнальных молекул, которые являются необходимыми сигнальными воздействиями на GRNs, управляющими эквивалентными процессами в др. энтомезодермальных клонах. На ст. ранней бластулы, имеется 32 veg2 клеток, производных макромеров, окружающие SM клетки предшественники. Эти клетки дают мезодермальные клоны, которые дают пигментные клетки, клетки балстоцеля, мышечные клетки и целомические карманы и энтодермальные территории, которые д. сформировать кишечник личинок. Однако на этой ранней стадии имеется общее энтомезодермальное регуляторное состояние, экспрессируемое во всех клетках, производных veg2, ожидающее сигнала, который инициирует программы развития или мезодермы или энтодермы. Наиболее важным сигналом для спецификации NSMs, отличающей её от энтодермальной клеточной судьбы, является сигнальный путь Delta/Notch (Sherwood and McClay, 1999; Sweet et al., 1999; Sweet et al., 2002). Эта сигнальная система нуждается, чтобы клетки, экспрессирующие лиганд Delta, имели физический контакт с клетками, которым они передают сигнал. Таким способом, эта сигнальная система может передавать пространственную информацию, гарантируя, что только соседние клетки, экспрессирующие Notch рецепторы, смогут отвечать на сигнал. Экспрессия Delta в клетках, происходящих из микромеров, контролируется с помощью pmar1-hesC subcircuit, тогда как Notch рецептор предоставляется матерински и присутствует повсеместно на этой стадии (Sherwood and McClay, 1997; Sweet et al., 2002). Только veg2-производные клетки, которые располагаются по соседству с SM предшественниками, отвечают на Delta/Notch сигнал и индуцируют программу спецификации NSM. Активация Notch рецептора с помощью Delta ведет к расщеплению Notch, это позволяет внутриклеточной части (NICD) проникать в ядро и взаимодействовать с транскрипционным фактором Suppressor of Hairless (Su(H)), чтобы активировать экспрессию генов мишеней. В отсутствие передачи сигналов Notch, Su(H) ассоциирует с Groucho и этот комплекс репрессирует гены мишени для Delta/Notch. Вмешательство в экспрессию или Delta или Notch у эмбрионов морских ежей тяжело нарушает развитие NSMs, приводя к albino pluteus личинкам, которые лишены NSM-производных пигментных клеток (Sweet et al., 2002). Инъекция мРНК delta эмбрионам L. variegatus , с др. стороны, дает pluteus личинок, обнаруживающих повышенные количества происходящиз из NSM пигментных клеток, клеток бластоцеля и мышечных волокон.
Вскоре после начала экспрессии
delta в микромерах, соседние NSM клетки предшественники начинают экспрессировать glial cell missing (gcm) (Ransick and Davidson, 2006). Как и ожидалось для гена, ответственного за путь передачи сигналов Delta/Notch экспрессия
gcm существенно снижается если сигнальный путь Notch блокирован с помощью избыточной экспрессии доминантно негативной формы Su(H) (dn-Su(H)), как показано на Fig. 3A. Если
gcm в самом деле является мишенью для пути передачи сигналов Notch, то он д. содержать сайты связывания для транскрипционного фактора Su(H) в своем регуляторном аппарате. Это предсказание было протестировано с помощью анализа цис-регуляторных последовательностей, контролирующих экспрессию
gcm. Предполагаемый
gcm цис-регуляторный модуль был идентифицирован недавно, будучи помещен выше GFP репортерной конструкции, он индуцировал экспрессию GFP главным образом в NSM домене (Ransick and Davidson, 2006). Один из таких модулей содержал несколько кандидатов на роль сайта связывания Su(H). Мутации в этих сайтах связывания Su(H) приводили к снижению NSM-специфической экспрессии GFP, а также к увеличению эктопической экспрессии гена в проспективной энтодермальных и эктодермальных клетках. Эти результаты отражают функцию триггерного переключателя для Su(H), репрессирующего gcm в отсутствие передачи сигналов Notch и действующего как активатор транскрипции в контексте as a transcriptional activator in the context of N
ICD. Gcm сам по себе кодирует транскрипционный регуляторный фактор. В отсутствие Gcm, программа спецификации NSM нарушается
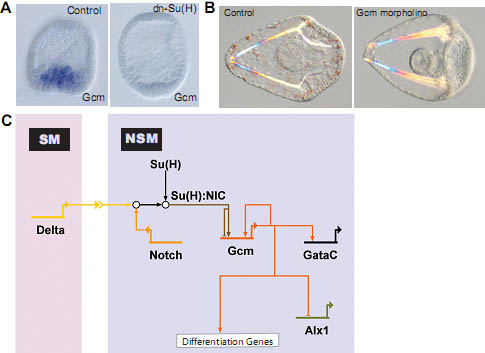 Fig. 3. Role of gcm in the nonskeletogenic mesenchyme gene regulatory network (NSM GRN). (A) WMISH for gcm on control embryos (left) and embryos injected with mRNA encoding a dominant-negative (dn) form of the transcription factor Su(H) (dn-Su(H)) (right). Su(H) mediates a toggle-switch mechanism by interacting either with the repressor protein Groucho or, in the presence of Delta/Notch signaling, with the intracellular part of Notch (NIC). Gcm is expressed in NSM precursors at blastula stage in control embryos, but does not express significantly in embryos injected with dn-Su(H), indicating that gcm is a target gene of Su(H). (Reprinted from Ransick et al., 2006; with permission from Elsevier). (B) Control pluteus larva (left) and pluteus larva that developed after injection of gcm-specific morpholinos (right). Note the lack of pigment cells as a result of interfering with gcm expression, showing that Gcm is required for pigment cell formation. (Reprinted from Ransick et al., 2006; with permission from Elsevier). (C) Model for the GRN underlying NSM specification. Delta expression in micromere-derived cells induces the cleavage of Notch receptor in adjacent NSM precursor cells. NIC interacts with Su(H) leading to activation of gcm expression. Gcm expression is maintained by an autoregulatory feedback loop. Gcm also provides activating inputs into gataC and the differentiation genes. To exclude alternative cell fates, Gcm represses alx1.
Fig. 3. Role of gcm in the nonskeletogenic mesenchyme gene regulatory network (NSM GRN). (A) WMISH for gcm on control embryos (left) and embryos injected with mRNA encoding a dominant-negative (dn) form of the transcription factor Su(H) (dn-Su(H)) (right). Su(H) mediates a toggle-switch mechanism by interacting either with the repressor protein Groucho or, in the presence of Delta/Notch signaling, with the intracellular part of Notch (NIC). Gcm is expressed in NSM precursors at blastula stage in control embryos, but does not express significantly in embryos injected with dn-Su(H), indicating that gcm is a target gene of Su(H). (Reprinted from Ransick et al., 2006; with permission from Elsevier). (B) Control pluteus larva (left) and pluteus larva that developed after injection of gcm-specific morpholinos (right). Note the lack of pigment cells as a result of interfering with gcm expression, showing that Gcm is required for pigment cell formation. (Reprinted from Ransick et al., 2006; with permission from Elsevier). (C) Model for the GRN underlying NSM specification. Delta expression in micromere-derived cells induces the cleavage of Notch receptor in adjacent NSM precursor cells. NIC interacts with Su(H) leading to activation of gcm expression. Gcm expression is maintained by an autoregulatory feedback loop. Gcm also provides activating inputs into gataC and the differentiation genes. To exclude alternative cell fates, Gcm represses alx1.
и эмбрионы обнаруживают сходный albino фенотип, точно такой как при отсутствии передачи сигналов Notch (Fig. 3B). В соответствии с его функцией в качестве гласного интегратора передачи сигналов Notch,
gcm занимает центральную роль в GRN, управляющей спецификацией NSM, как показано с помощью модели сети на Fig. 3C. Позднее, когда SMs начинают проникать в бластоцель, они больше не имеют непосредственных контактов с проспективными NSMs, чтобы предоставлять Delta сигнальный лиганд. Исчезновение воздействия Notch на
gcm компенсируется с помощью позитивной петли обратной связи, в которой Gcm активирует экспрессию своего собственного гена (Fig. 3C; A. Ransick and E.H. Davidson, unpublished results). Подобно многим др. регуляторным белкам в GRN, Gcm также участвует в транскрипционном контроле др. генов транскрипционных факторов, а также генов дифференцировки. Поскольку SM и NSM клетки предшественники физически разделены в течение лишь короткого времени на этой ранней стадии, их регуляторные состояния всё ещё довольно сходны. GRNs , лежащие в основе обеих программ спецификации фактически включают механизмы для избежания приобретения неправильной клеточной судьбы. Gcm, по-видимому, играет двойную роль, действуя как эффектор и как мишень в этом процессе выбора клеточной судьбы. Т.о., в SMs экспрессия
gcm репрессируется с помощью гена мишени для HesC,
alx1 (P. Oliveri and E.H. Davidson, unpublished results). И в свою очередь, gcm вмешивается в SM GRN благодаря репрессии экспрессии
alx1 (Fig. 3C; S. Damle and E.H. Davidson, unpublished results). Такое исключение альтернативных клеточных судеб очень широко встречаемое свойство спецификации GRNs во многих системах животных (Oliveri and Davidson, 2007).
Мы наблюдали, что одним из результатов SM GRN, является экспрессия
delta, детерминирующая непосредственно начало NSM GRN. Связь GRNs гарантирует однонаправленность процесса, координацию программ спецификации, которые имеют место в разных типах клеток. В этой системе пути передачи сигналов Delta/Notch эффективно передают информацию о том когда и где будет происходить процесс спецификации NSM. Важным вводом в NSM GRN являются первично кодируемые с помощью двух цис-регуляторных последовательностей. Первая из них интегрирует поступающие импульсы от ранних транскрипционных факторов в SM GRN, чтобы индуцировать экспрессию
delta в клетках, производных микромеров. Вторая цис-регуляторная область управляет экспрессией
gcm, содержит сайты связывания для транскрипционного фактора, обеспечивающего передачу сигналов Delta/Notch, Su(H). Информация, лежащая в основе передачи и получении сигналов, которые индуцируют спецификацию NSM, , следовательно, непосредственно кодируется в регуляторной части генома.
Conservation of an endoderm subcircuit
Клетки из клона veg2 макромеров, которые расположены значительно дальше от SM предшественников развиваются в клон энтодермальных клеток. Регуляторное состояние в veg2 клоне на ст. бластулы представлено преимущественно факторами, активированными с помощью TCF/β-catenin, т.е. Blimp1, Eve и Hox11/13b, и Otx (Yuh et al., 2002; Arenas-Mena et al., 2006; Smith et al., 2008). В отсутствие ранних импульсов передачи сигналов Notch, эти широко экспрессируемые энтомезодермальные транскрипционные факторы инициируют энтодермальную регуляторную программу (Fig. 1B). Их непосредственные гены мишени это brachyury, foxa и gatae гены, два из последних обладают сильно законсервированной ролью в формировании энтодермы. Brachyury и GataE кроме того ответственны за индукцию экспрессии транскрипционных факторов Hnf1, Tgif и FoxP незадолго перед началом гаструляции (I. Peter and E.H. Davidson, unpublished results). Регуляторное состояние на этой ст. предопределяет состояние спецификации пре-энтодермы, которое вскоре после этого дивергирует, чтобы инициировать разные регуляторные программы, лежащие в основе формирования передней, средней и задней кишки. Перед гаструляцией, однако, транскрипционные факторы, которые позднее ограничиваются специфическим компартментом кишки, экспрессируются в тех же самых клетках.
Инициальный subcircuit энтодермальной GRN использует сильно закрепленный регуляторный subcircuit из пяти генов. Пять узлов в этом subcircuit это blimp1, otx, gatae, foxA и brachyury, как показано на Fig. 4. Ген blimp1, который экспрессируется под контролем TCF/β-catenin и Otx, продуцирует активирующие сигналы для otxβ1/2, альтернативного транскрипта гена otx, который экспрессируется исключительно зиготически (Yuh et al., 2002). Otx экспрессия в дальнейшем стабилизируется с помощью дополнительных позитивных петель обратной связи. первая петля обратной связи предоставляется за счет активации авторегуляции otx. В дополнение к этому имеются два гена мишени для Otx, кодирующие транскрипционные факторы GataE и Brachyury, которые с помощью петли обратной связи контролируют экспрессию otx ((Yuh et al., 2002); I. Peter and E.H. Davidson, unpublished results). Сайты связывания постулированных генов, Blimp1, Otx и GataE, были идентифицированы в цис-регуляторном модуле, управляющем экспрессией otxβ (Yuh et al., 2004). Позитивные петли обратной связи часто обнаруживаемые мотивы в GRNs, поскольку они обеспечивают стабильную генную экспрессию после исчезновения инициального воздействия. В самом деле, экспрессия otxβ и gatae поддерживаются в течение длительного времени после того, как экспрессия blimp1 выключается в клетках, производных veg2. Поскольку gatae необходим не только как активирующее воздействие, осуществляемое с помощью Otx, но и также чувствителен к передаче сигналов Delta/Notch, его экспрессия сначала ограничивается проспективными NSMs и включается в клетках предшественниках энтодермы на ранней мезенхимной ст. бластулы, когда NSM клетки предшественники начинают экспрессировать delta. Один из gatae цис-регуляторных модулей, как было установлено, отражает ранний паттерн экспрессии эндогенного гена, который управляет экспрессией GFP репортерного гена (Lee et al., 2007). Вмешательство в активность или Otx или Su(H) лишь в незначительной степени затрагивает экспрессию гена репортера, тогда как одновременное блокирование регуляторных воздействий строго редуцирует экспрессию GFP. Otx и GataE совместно регулируют экспрессию двух др. регуляторных генов в этом subciruit, foxA и brachyury.
Энтодермальный subcircuit содержит всю информацию, необходимую для инициализации программы развития. Её активация связана с передачей сигналов Wnt от SM GRN посредством blimp1. Она также зависит от NSM GRN, которая обеспечивает передачу сигналов Delta/ Notch в gataE. Более того, этот subcircuit обладает стабилизирующей функцией в форме прямых позитивных петель обратной связи в otx, обеспечиваемых с помощью цис-регуляторных сайтов мишеней. Два из его компонентов, а именно, GataE и Brachyury ответственны за активацию позднее энтодермальных регуляторных факторов (I. Peter and E.H. Davidson, unpublished results). И, наконец, FoxA предупреждает активацию NSM GRN в энтодерме путем репрессии gcm (Oliveri et al., 2006). Не удивительно, что каждый из этих 5 регуляторных белков абсолютно необходим для развития энтодермы: мешая экспрессии каждого из них и тем самым ингибируя формирование кишки.
Дальнейшие доказательства важности этого subcircuit получены в эволюционных исследованиях с использованием морских звезд
Asterina miniata (Hinman et al., 2003). Неожиданность результата заключается в том, что архитектура регуляторных связей между пятью узлами сети, описанная выше, идентична у морских ежей и морских звезд, включая наиболее важную gatae-otx петлю обратной связи, несмотря на 500 миллионов лет независимой эволюции. Большинство др. частей GRN являются однако уникальными для каждого из этих организмов, как показано на Fig. 4 (Hinman et al., 2003; Hinman and Davidson, 2007). Напр.,экспрессия гена
blimp1 выключается с помощью авторегуляторной петли у морских ежей, но не у морских звезд. У морских звезд, с др. стороны, позитивная петля обратной связи между otxβ и gatae ещё больше амплифицирована за счет авторегуляторной активности GataE, которая отсутствует у морских ежей. Этот пример показывает, что изучение эволюции структуры сети предоставляет подход для выяснения модулярности GRNs.
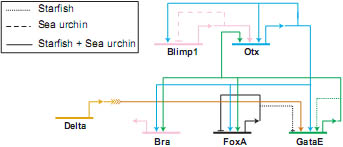 Fig. 4. Evolutionary conservation of a network subcircuit. The regulatory linkages between blimp1, otx, bra, foxA and gataE have been analyzed in sea urchin and starfish embryos. Most of the regulatory interactions between these genes are identical and are shown by solid lines. Otx expression is first induced by Blimp1 and is later on maintained by two positive feedback loops: Otx and one of its target genes, GataE, provide an input into otx. Otx together with GataE control the expression of bra and foxA. Interactions that are unique in one of the species are shown as dashed (sea urchin) or dotted (starfish) lines. Not conserved regulatory linkages include the auto-repression of blimp1 in sea urchin and the autoregulation of gataE in starfish. (Modified from Hinmann et al., 2003).
Fig. 4. Evolutionary conservation of a network subcircuit. The regulatory linkages between blimp1, otx, bra, foxA and gataE have been analyzed in sea urchin and starfish embryos. Most of the regulatory interactions between these genes are identical and are shown by solid lines. Otx expression is first induced by Blimp1 and is later on maintained by two positive feedback loops: Otx and one of its target genes, GataE, provide an input into otx. Otx together with GataE control the expression of bra and foxA. Interactions that are unique in one of the species are shown as dashed (sea urchin) or dotted (starfish) lines. Not conserved regulatory linkages include the auto-repression of blimp1 in sea urchin and the autoregulation of gataE in starfish. (Modified from Hinmann et al., 2003).
A module driving dynamic gene expression patterns
Морских ежей GRN также содержит subcircuit, который активен во всех энтомезодермальных клонах клеток, хотя и различные временные точки. Этот subcircuit, который показан на Fig. 5A, стартует с активации экспрессии генов blimp1 и wnt8с помощью β-catenin/Tcf. Цис-регуляторный анализ показал, что экспрессия blimp1 нуждается в активирующем воздействии двух транскрипционных факторов, Otx и Tcf, и что эти факторы действуют в AND logic gate (Smith et al., 2007). Blimp1 далее активирует экспрессию wnt8. Сайты связывания для Blimp1 и Tcf идентифицированы в wnt8 цис-регуляторном моделе и функционально подтверждены с помощью мутационного анализа (Minokawa et al., 2005). Экспрессия wnt8 поэтому контролируется двумя косвенными позитивными петлями обратной связи. Первая петля обратной связи состоит из β-catenin/Tcf активирующей экспрессии wnt8. Это, в свою очередь, ведет к секреции Wnt8, активации сигнального пути Wnt и к дальнейшей nuclearization β-катенина (β-catenin/Tcf-wnt8). Т.к. вторая ступень в этой петле является результатом пути сигнальной трансдукции, который использует многие др. молекулы, мы обозначили эту структуру circuit как косвенная петля обратной связи. Вторая позитивная петля обратной связи состоит из β-catenin/ Tcf-wnt8-blimp1, включая blimp1 в качестве мишени для β-catenin/Tcf и активатор экспрессии wnt8.
Секреция сигнальных лигандов может иметь два регуляторных эффекта: она может приводить к синхронизации регуляторных состояний внутри клеток одного и того же домена ("community effect") или предоставлять регуляторные воздействия клеткам соседней территории (induction). Фактиычески, было установлено, что nuclearization β-catenin и экспрессия
wnt8 и
blimp1 первыми индуцируются в микромерном клоне и позднее расширяются на др. клоны энтомезодермы
 Fig. 5. Structure and output of a subcircuit driving dynamic gene expression. (A) Model of a subcircuit which results in a dynamic gene expression pattern. Two positive feedback loops induce the activation of this subcircuit in adjacent cells: β-catenin/TCF activates the expression of wnt8 and blimp1. Blimp1 provides an additional input into wnt8. Reception of the Wnt signal leads to nuclearization of β-catenin and activation of this subcircuit in neighboring cells. Blimp1 and β-catenin/TCF are both required to induce the expression of eve and hox11/13b. The expression of blimp1 is turned off by its own gene product, leading to inactivation of the whole subcircuit. (B) Schematic presentation of wnt8 expression pattern. Wnt8 is expressed in the micromere lineage at 5th cleavage, from where it expands to veg2-and veg1-derived cells. Wnt8 is no longer expressed in the SM precursors at blastula stage and in NSM precursors at early mesenchyme blastula. (Modified from Smith et al., 2007).
Fig. 5. Structure and output of a subcircuit driving dynamic gene expression. (A) Model of a subcircuit which results in a dynamic gene expression pattern. Two positive feedback loops induce the activation of this subcircuit in adjacent cells: β-catenin/TCF activates the expression of wnt8 and blimp1. Blimp1 provides an additional input into wnt8. Reception of the Wnt signal leads to nuclearization of β-catenin and activation of this subcircuit in neighboring cells. Blimp1 and β-catenin/TCF are both required to induce the expression of eve and hox11/13b. The expression of blimp1 is turned off by its own gene product, leading to inactivation of the whole subcircuit. (B) Schematic presentation of wnt8 expression pattern. Wnt8 is expressed in the micromere lineage at 5th cleavage, from where it expands to veg2-and veg1-derived cells. Wnt8 is no longer expressed in the SM precursors at blastula stage and in NSM precursors at early mesenchyme blastula. (Modified from Smith et al., 2007).
как показано для wnt8 на Fig. 5B (Logan et al., 1999; Wikramanayake et al., 2004; Minokawa et al., 2005; Livi and Davidson, 2006). Однако спустя лишь несколько часов после активации этот subcircuit выключается в каждом клеточном клоне и снова сначала в микромерном клоне и затем в NSM предшественниках. Механизм, как было установлено, зависит от авторегуляторной активности blimp1. Т.о., сайты связывания Blimp1 внутри blimp1 цис-регуляторной области ответственны за негативную регуляцию экспрессии
blimp1 в мезодермальных клетках предшественниках (Smith et al., 2007). Делеция этих сайтов связывания Blimp1 в конструкции, состоящей из blimp1 цис-регуляторной последовательности, управляющей
blimp1 кДНК, приводит к устойчивой экспрессии не только
blimp1, но и также
wnt8 в проспективных мезенхимных клетках. Более того, Blimp1 и β-catenin/Tcf вместе регулируют экспрессию генов мишеней, включая
eve и hox11/13b (Fig. 5A; (Smith et al., 2008)). Сайты связывания как для Blimp1, так и Tcf были идентифицированы в
eve цис-регуляторных последовательностях и, как было показано, вносят вклад в AND logic функцию, поскольку мутации сайтов связывания для любого из этих факторов устраняют экспрессию репортерных генов.
Специальная архитектура этих регуляторных связей ведет к активации этого subcircuit в последовательных рядах клеток, а его инактивация там, где ранее он был активен, ведет к расширению torus генной экспрессии. Геномные цис-регуляторные последовательности т.о. непосредственно кодируют модулярный сетевой subcircuit, который обеспечивает динамические паттерны генной экспрессии. Наиболее важным конечным следствием этого subcircuit является то, что он контролирует последовательные домены передачи сигналов Notch (Smith and Davidson, 2008): вследствие экспрессии
delta в SM и передачи сигналов Notch в NSM, как обсуждалось выше, ген
delta активируется в NSM и теперь посылает свои сигналы в энтодерму. Механизм заключается в том, что
blimp1-wnt8 subcircuit также контролирует экспрессию
hesC и когда
hesC выключает в NSM ген
delta он продолжает оставаться активным. Кроме того, тот же самый subcircuit контролирует транскрипцию самого гена
notch. Имеется ряд последствий этих взаимоотношений в дополнение к прямой детерминации прогрессивных пространственных доменов передачи сигналов Notch (Smith and Davidson, 2008). Одну вещь они гарантируют, что по ходу развития, везде, где в энтомезодерме экспрессируется
wnt8, не экспрессируется
delta и vice versa; или там, где происходит передача сигналов Notch, ген
delta молчит. Все эти пространственные сигнальные функции непосредственно кодируются в регуляторном геноме и все они , следовательно, вносят вклад в точную активацию NSM и энтодермальной GRNs в пространстве и во времени.
Conclusions
We have discussed here some of the subcircuits underlying the specification program of three different endomesoderm cell lineages in the sea urchin embryo. Although there are obvious differences, both at the level of cell lineage development as well as at the level of network structure, these subcircuits share some general principles.
Control of signaling
Signaling between adjacent cells deriving from the same
progenitor cell introduces a switch function to enable closely related regulatory states to activate different GRNs. Signaling processes link the SM and NSM GRNs ( delta-Su(H)-gcm); the NSM and endoderm GRNs ( delta-Su(H)-gataE); and all three GRNs by the superimposed (β-catenin/Tcfwnt8-blimp1) subcircuit just discussed.
Stabilization
The primary inputs are rapidly processed and positive feed-
back loops then stabilize the regulatory state and uncouple the specification process from the primary inputs. These are typically transient. These positive feedback loops are either direct, as in the feedback between erg, hex, and tgif in the SM GRN, and between otx and gatae in the pre-endoderm GRN; or they are intercellular and indirect as in the wnt8 – β-catenin loop.
Exclusion of alternative cell fates
Regulatory states are very similar in territories which have
been physically separated only a few cell cleavages earlier. Therefore, some mechanisms have to be introduced to avoid the acquisition of alternative cell fates (Oliveri and Davidson, 2007). Network subcircuits frequently repress regulatory genes associated with different specification programs, in order to keep theiractivation mutually exclusive, and several examples are discussed above.
Expression of differentiation genes
At the downstream periphery of every GRN are the differentiation genes, which encode for proteins that will execute the functions of differentiated cells. Some of the regulatory factors contributing to a specification GRN directly feed into the regulation of the differentiation genes, irrespective of their position in the network.
Each of these features of GRNs is the result of regulatory interactions encoded in the regulatory genome and each contributes to the control of patterning. The list of network principles will certainly be extended in the future as more GRN architectures become deciphered.
Сайт создан в системе
uCoz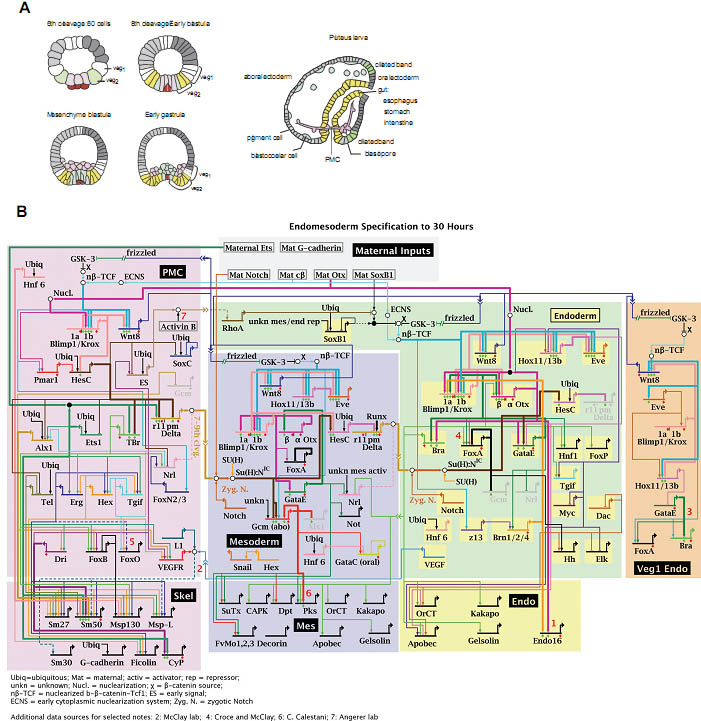 Fig. 1. Schematic representation of sea urchin endomesoderm development and the underlying gene regulatory network (GRN). (A) Schematic sections of embryos at different stages of development. At 6th cleavage stage, endomesoderm precursor cells include the macromere-derived veg2 (green) and veg1 cells, large micromere derivatives (light purple) and the small micromere lineage (dark purple). Mesomeres are depicted in grey and are the precursors of ectoderm. Both, veg2 and veg1 cells will give rise to two different territories, depending on their location relative to the vegetal pole. Proximal veg2 cells are the progenitors of NSMs (blue), whereas the remaining veg2-derived cells contribute to endoderm (yellow), as shown in the scheme for 8th cleavage stage embryos. Veg1-derived cells give rise to endoderm and ectoderm. By the mesenchyme blastula stage, the SMs have ingressed into the blastocoel. NSM precursors start to ingress at beginning of gastrulation and give rise to pigment cells and blastocoelar cells. At pluteus larva stage, SMs have fused and formed the embryonic skeleton. (B) Model for the GRN driving endomesoderm development. Color codes match the embryonic territories depicted in (A). Network nodes represent regulatory genes and connections represent regulatory interactions. Regulatory genes are grouped based on the process they are involved in: SM, NSM or endoderm specification. Updates of the endomesoderm GRN are available at: http://sugp.caltech.edu/endomes (Davidson et al., 2002).
Fig. 1. Schematic representation of sea urchin endomesoderm development and the underlying gene regulatory network (GRN). (A) Schematic sections of embryos at different stages of development. At 6th cleavage stage, endomesoderm precursor cells include the macromere-derived veg2 (green) and veg1 cells, large micromere derivatives (light purple) and the small micromere lineage (dark purple). Mesomeres are depicted in grey and are the precursors of ectoderm. Both, veg2 and veg1 cells will give rise to two different territories, depending on their location relative to the vegetal pole. Proximal veg2 cells are the progenitors of NSMs (blue), whereas the remaining veg2-derived cells contribute to endoderm (yellow), as shown in the scheme for 8th cleavage stage embryos. Veg1-derived cells give rise to endoderm and ectoderm. By the mesenchyme blastula stage, the SMs have ingressed into the blastocoel. NSM precursors start to ingress at beginning of gastrulation and give rise to pigment cells and blastocoelar cells. At pluteus larva stage, SMs have fused and formed the embryonic skeleton. (B) Model for the GRN driving endomesoderm development. Color codes match the embryonic territories depicted in (A). Network nodes represent regulatory genes and connections represent regulatory interactions. Regulatory genes are grouped based on the process they are involved in: SM, NSM or endoderm specification. Updates of the endomesoderm GRN are available at: http://sugp.caltech.edu/endomes (Davidson et al., 2002). 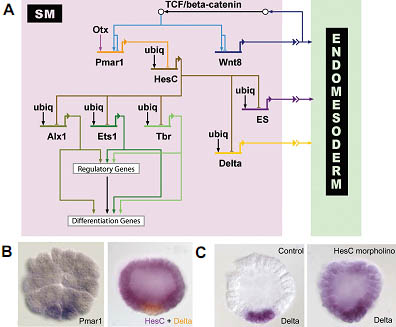 Fig. 2. Expression patterns of genes involved in skeletogenic mesenchyme (SM) specification and SM-gene retulatory network (GRN) model. (A) Model of the GRN driving SM development. The double repression by Pmar1 and HesC gives rise to a micromere-specific expression of alx1, ets1 and t-brain (tbr). All three transcription factors further activate other regulatory genes as well as the differentiation gene battery. The SM GRN drives the expression of three genes encoding signaling molecules which are required for endomesoderm specification: wnt8, the early signal and delta. (B) Left: Whole-mount in situ hybridization (WMISH) of 5th
cleavage stage embryos detecting pmar1 gene expression in micromeres. (Reprinted from Oliveri et al., 2002; with permission from Elsevier). Right: Two color WMISH monitoring hesC (violet) and delta (orange) gene expression in 7th cleavage stage embryos. (Reprinted from Revilla-i-Domingo et al., 2007; with permission from the National Academy of Sciences, USA). Whereas delta is expressed exclusively in the micromeres, hesC expression is ubiquitous except for repression in micromere derivatives by Pmar1. (C) Expression of delta was detected by WMISH in micromere-derived cells of control embryos (left) and ubiquitously in embryos in which HesC expression has been blocked by morpholinos (right). The results show that delta expression is activated by ubiquitous transcription factors and repressed by HesC in all cells except the micromere derivatives, where HesC is not present. (Reprinted from Revilla-i-Domingo et al., 2007; with permission from the National Academy of Sciences, USA).
Fig. 2. Expression patterns of genes involved in skeletogenic mesenchyme (SM) specification and SM-gene retulatory network (GRN) model. (A) Model of the GRN driving SM development. The double repression by Pmar1 and HesC gives rise to a micromere-specific expression of alx1, ets1 and t-brain (tbr). All three transcription factors further activate other regulatory genes as well as the differentiation gene battery. The SM GRN drives the expression of three genes encoding signaling molecules which are required for endomesoderm specification: wnt8, the early signal and delta. (B) Left: Whole-mount in situ hybridization (WMISH) of 5th
cleavage stage embryos detecting pmar1 gene expression in micromeres. (Reprinted from Oliveri et al., 2002; with permission from Elsevier). Right: Two color WMISH monitoring hesC (violet) and delta (orange) gene expression in 7th cleavage stage embryos. (Reprinted from Revilla-i-Domingo et al., 2007; with permission from the National Academy of Sciences, USA). Whereas delta is expressed exclusively in the micromeres, hesC expression is ubiquitous except for repression in micromere derivatives by Pmar1. (C) Expression of delta was detected by WMISH in micromere-derived cells of control embryos (left) and ubiquitously in embryos in which HesC expression has been blocked by morpholinos (right). The results show that delta expression is activated by ubiquitous transcription factors and repressed by HesC in all cells except the micromere derivatives, where HesC is not present. (Reprinted from Revilla-i-Domingo et al., 2007; with permission from the National Academy of Sciences, USA).  Fig. 3. Role of gcm in the nonskeletogenic mesenchyme gene regulatory network (NSM GRN). (A) WMISH for gcm on control embryos (left) and embryos injected with mRNA encoding a dominant-negative (dn) form of the transcription factor Su(H) (dn-Su(H)) (right). Su(H) mediates a toggle-switch mechanism by interacting either with the repressor protein Groucho or, in the presence of Delta/Notch signaling, with the intracellular part of Notch (NIC). Gcm is expressed in NSM precursors at blastula stage in control embryos, but does not express significantly in embryos injected with dn-Su(H), indicating that gcm is a target gene of Su(H). (Reprinted from Ransick et al., 2006; with permission from Elsevier). (B) Control pluteus larva (left) and pluteus larva that developed after injection of gcm-specific morpholinos (right). Note the lack of pigment cells as a result of interfering with gcm expression, showing that Gcm is required for pigment cell formation. (Reprinted from Ransick et al., 2006; with permission from Elsevier). (C) Model for the GRN underlying NSM specification. Delta expression in micromere-derived cells induces the cleavage of Notch receptor in adjacent NSM precursor cells. NIC interacts with Su(H) leading to activation of gcm expression. Gcm expression is maintained by an autoregulatory feedback loop. Gcm also provides activating inputs into gataC and the differentiation genes. To exclude alternative cell fates, Gcm represses alx1.
Fig. 3. Role of gcm in the nonskeletogenic mesenchyme gene regulatory network (NSM GRN). (A) WMISH for gcm on control embryos (left) and embryos injected with mRNA encoding a dominant-negative (dn) form of the transcription factor Su(H) (dn-Su(H)) (right). Su(H) mediates a toggle-switch mechanism by interacting either with the repressor protein Groucho or, in the presence of Delta/Notch signaling, with the intracellular part of Notch (NIC). Gcm is expressed in NSM precursors at blastula stage in control embryos, but does not express significantly in embryos injected with dn-Su(H), indicating that gcm is a target gene of Su(H). (Reprinted from Ransick et al., 2006; with permission from Elsevier). (B) Control pluteus larva (left) and pluteus larva that developed after injection of gcm-specific morpholinos (right). Note the lack of pigment cells as a result of interfering with gcm expression, showing that Gcm is required for pigment cell formation. (Reprinted from Ransick et al., 2006; with permission from Elsevier). (C) Model for the GRN underlying NSM specification. Delta expression in micromere-derived cells induces the cleavage of Notch receptor in adjacent NSM precursor cells. NIC interacts with Su(H) leading to activation of gcm expression. Gcm expression is maintained by an autoregulatory feedback loop. Gcm also provides activating inputs into gataC and the differentiation genes. To exclude alternative cell fates, Gcm represses alx1. Fig. 4. Evolutionary conservation of a network subcircuit. The regulatory linkages between blimp1, otx, bra, foxA and gataE have been analyzed in sea urchin and starfish embryos. Most of the regulatory interactions between these genes are identical and are shown by solid lines. Otx expression is first induced by Blimp1 and is later on maintained by two positive feedback loops: Otx and one of its target genes, GataE, provide an input into otx. Otx together with GataE control the expression of bra and foxA. Interactions that are unique in one of the species are shown as dashed (sea urchin) or dotted (starfish) lines. Not conserved regulatory linkages include the auto-repression of blimp1 in sea urchin and the autoregulation of gataE in starfish. (Modified from Hinmann et al., 2003).
Fig. 4. Evolutionary conservation of a network subcircuit. The regulatory linkages between blimp1, otx, bra, foxA and gataE have been analyzed in sea urchin and starfish embryos. Most of the regulatory interactions between these genes are identical and are shown by solid lines. Otx expression is first induced by Blimp1 and is later on maintained by two positive feedback loops: Otx and one of its target genes, GataE, provide an input into otx. Otx together with GataE control the expression of bra and foxA. Interactions that are unique in one of the species are shown as dashed (sea urchin) or dotted (starfish) lines. Not conserved regulatory linkages include the auto-repression of blimp1 in sea urchin and the autoregulation of gataE in starfish. (Modified from Hinmann et al., 2003).  Fig. 5. Structure and output of a subcircuit driving dynamic gene expression. (A) Model of a subcircuit which results in a dynamic gene expression pattern. Two positive feedback loops induce the activation of this subcircuit in adjacent cells: β-catenin/TCF activates the expression of wnt8 and blimp1. Blimp1 provides an additional input into wnt8. Reception of the Wnt signal leads to nuclearization of β-catenin and activation of this subcircuit in neighboring cells. Blimp1 and β-catenin/TCF are both required to induce the expression of eve and hox11/13b. The expression of blimp1 is turned off by its own gene product, leading to inactivation of the whole subcircuit. (B) Schematic presentation of wnt8 expression pattern. Wnt8 is expressed in the micromere lineage at 5th cleavage, from where it expands to veg2-and veg1-derived cells. Wnt8 is no longer expressed in the SM precursors at blastula stage and in NSM precursors at early mesenchyme blastula. (Modified from Smith et al., 2007).
Fig. 5. Structure and output of a subcircuit driving dynamic gene expression. (A) Model of a subcircuit which results in a dynamic gene expression pattern. Two positive feedback loops induce the activation of this subcircuit in adjacent cells: β-catenin/TCF activates the expression of wnt8 and blimp1. Blimp1 provides an additional input into wnt8. Reception of the Wnt signal leads to nuclearization of β-catenin and activation of this subcircuit in neighboring cells. Blimp1 and β-catenin/TCF are both required to induce the expression of eve and hox11/13b. The expression of blimp1 is turned off by its own gene product, leading to inactivation of the whole subcircuit. (B) Schematic presentation of wnt8 expression pattern. Wnt8 is expressed in the micromere lineage at 5th cleavage, from where it expands to veg2-and veg1-derived cells. Wnt8 is no longer expressed in the SM precursors at blastula stage and in NSM precursors at early mesenchyme blastula. (Modified from Smith et al., 2007).