УЧАСТИЕ В КОНТРОЛЕ РОСТА АКСОНОВ
|
|
Nuclear Power for Axonal GrowthM. C. Subang ( m.c.subang@qmul.ac.uk ) and P. M. Richardson  SCIENCE 2009. - VOL. 326. - P.238-9 www.sciencemag.org
|
A transcription factor involved in oncogenesis and stem cell biology also controls neuronal axon outgrowth.
| | |
References
1. D. L Moore et at, Science 326, 298 (2009).
2. J.Jiang et ai, Nat. Cell Biol. 10, 353 (2008).
3. K. Takahashi et at., Cell 131, 861 (2007).
4. M. 0. Nandan, V. W. Yang, Histol. Histopathol. 24,1343 (2009).
5. T. Kawamura ef ai, Nature 460,1140 (2009).
6. Y. Kawano et ai, Mot. Cell. Biol. 25, 9920 (2005).
7. R. Y. Liu, W. D. Snider, 7. Neurosci. 21, RC164 (2001).
8. N. Arimura, K. Kaibuchi, Nat. Rev. Neurosci. 8,194 (2007).
9. H. Zou, C. Ho, K. Wong, M. Tessier-Lavigne, /. Neurosci. 29, 7116 (2009).
10. T. Miao et ai, ]. Neurosci. 26, 9512 (2006).
11. A. Tedeschi, 5. Di Giovanni, EMBO Rep. 10, 576 (2009).
12. P. Y. Bourillot et ai, Stem Cells 27,1760 (2009).
13. 8. D. Rowland, R. Bernards, D. S. Peeper, Nat. Cell Biol. 7,1074 (2005).
14. K. K. Park et ai, Science 322, 963 (2008). |
|
Нейроны млекопитающих обладают склонностью к аксональному росту во время развития и в разной степени после повреждения аксонов. В целом этот рост излишен для большинства нейронов в течение жизни. У крыс клетки ретинальных ганглиев и др. нейронов ЦНС резко снижают рост примерно к моменту рождения. На стр. 298 этого номера, Moore et al. (1) показали, что регенеративная способность определенных нейронов ЦНС супрессируется с помощью Kruppel-like factor-4 (KLF4), тем самым увеличивается репертуар транскрипционных факторов, которые регулируют рост аксонов.
В целом более 100 нейрональных генов, чья экспрессия в клетках ретинальных ганглиев крыс изменяется к моменту рождения, KLF4 является наиболее мощным ингибитором аксонального роста в нейронах эмбрионального гиппокампа крыс в культуре. Избыточная экспрессия Klf4 уменьшает длину и ветвление аксонов в клетках ретинальных ганглиев и кортикальных нейронов тоже. Напротив целенаправленная делеция гена Klf4 в клетках ретинальных ганглиев мышей ведет к увеличению количества и длины нейритов. Отсутствие Klf4 повышает также регенерацию аксонов после повреждений зрительного нерва. Если повышенная эндогенная активность KLF4 лежит в основе потери способности перинатального роста аксонов в клетках ретинальных ганглиев, то пост-трансляционные модификации транскрипционного фактора могут участвовать, поскольку экспрессия его кодирующей мРНК увеличивается незначительно. Напротив или в добавок , др. члены семейства KLF, в частности, KLF9, могут вносить вклад в супрессию роста аксонов благодаря перекрывающей функции (2).
KLF4 является одним из квартета транскрипционных факторов, достаточных чтобы трансформировать фибробласты в плюрипотентные стволовые клетки (5). Анализ KLF4-дефицитных мышей показал, что он необходим для терминальной дифференцировки эпидермиса и кишечного эпителия (4). Транскрипционный фактор является опухолевым супрессором опухолей кишечника человека, но может быть онкогенным для др. раковых опухолей. Последняя активность отражает антиапоптические свойства KLF4 благодаря супрессии гена опухолевого супрессора p53. Функциональная связь между KLF4 и p53 (также транскрипционным фактором) доказана по генерации плюрипотентных стволовых клеток, где инактивация p53 может замещать избыточную экспрессию KLF4 (5). Moore et al. теперь добавили еще и рост нейронов к функциям KLF4.
Подвижность и увеличение ростового конуса в конечном итоге обеспечиваются ремоделированием актинового и микротубулярного цитоскелета. Внешние факторы, такие как внеклеточный матрикс и факторы диффузного роста действуют посредством поврехностных клеточных рецепторов, чтобы активировать сигнальные каскады, которые сходятся на белках, ремоделирующих actin и tubulin. Как могут изменения в транскрипционной активности в ядре модифицировать чувствительность к внеклеточным сигналам в удаленных ростовых конусах? Наиболее вероятный ответ - посредством увеличения синтеза молекул со скорость ограничивающими функциями в сигнальных путях ростового конуса или белков, которые транспортируют такие молекулы в аксоны (see the figure). Collapsin response mediator protein-2 (CMRP-2) выполняет обе функции (6): он способствует
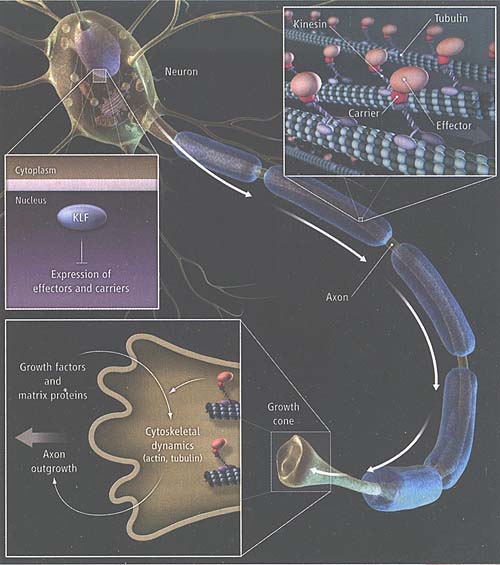 Remote control. In the nucleus of a mammalian neuron, KLF4 could suppress transcription of genes that encode proteins that modify the actin and microtubule cytoskeleton in the growth cone or that transport such growth-enhancing proteins.
Remote control. In the nucleus of a mammalian neuron, KLF4 could suppress transcription of genes that encode proteins that modify the actin and microtubule cytoskeleton in the growth cone or that transport such growth-enhancing proteins.
сборке микротрубочек и действует как линкер между грузом (SRA1-WAVE1) и молекулярным моторным белком (kinesin) для базирующегося на микротрубочках аксонального транспорта в ростовой конус. Комплекс SRA1-WAVE генерирует свободные актиновые филаменты, которые способствуют удлинению аксона. Однако взаимоотношения между транскрипционными факторами и влияющими на рост молекулами, такими как CMRP2 оставались неизвестными. Хотя те же самые механизмы ремоделирования actin и tubulin скорее всего лежат в основе всех форм аксонального роста, нейроны могут использовать разные молекулярные стратегии, чтобы модифицировать механизмы ремоделирования. Напр., первичные сенсорные нейроны используют сигнальные пути, специфически активируемые с помощью neurotrophins и neuropoietic cytokines, чтобы активировать способность к аксональному росту во время развития и регенерации, соотв. (7). Благодаря такой сложности полная информация о инициации аксонов эмбриональными нейронами (8) д. экстраполироваться с осторожностью на возобновление роста некоторыми аксонами взрослых нейронов свыше сантиметров.
KLF4 и KLF9 необычайны среди транскрипционных факторов, обладая супрессирующим скорее, чем стимулирующим влиянием на врожденную способность к аксональному росту. С одной стороны, по крайней мере, 7 нейрональных транскрипционных факторов необходимы и/или достаточны для аксонального роста (9). Два из группы усиления роста, signal transducer and activator of transcription 3 (STAT3) (10) и p53 (11), оказались функционально связаны с KLF4. Хотя STAT3 индуцирует транскрипцию KLF4 (12) и оба транскрипционных фактора способствуют плюрипотентному клеточному фенотипу, но STAT3 и KLF4 оказывают противоположное действие на способность к росту аксонов, хотя и в разных нейронах. Поскольку KLF4 блокирует экспрессию гена p53 (75), то супрессия p53 является механизмом кандидатом, с помощью которого KLF4 супрессирует аксональный рост. Однако , p53 также вносит вклад в гибель axotomized клеток ретинальных ганглиев (14). очевидно. что транскрипционный фактор может участвовать во множественных биологических функциях и биологических функциях, возникающих в результате действия множественных транскрипционных факторов.
The challenge to reengineer axonal growth propensity in adult neurons by gene or small-molecule therapy remains daunting, but less so if a dormant growth program can be derepressed by silencing of one or a few transcription factors.
Сайт создан в системе
uCoz  Remote control. In the nucleus of a mammalian neuron, KLF4 could suppress transcription of genes that encode proteins that modify the actin and microtubule cytoskeleton in the growth cone or that transport such growth-enhancing proteins.
Remote control. In the nucleus of a mammalian neuron, KLF4 could suppress transcription of genes that encode proteins that modify the actin and microtubule cytoskeleton in the growth cone or that transport such growth-enhancing proteins.