Нервный гребень (НГ) даёт клетки предшественники, которые мигрируют по телу, чтобы создать разнообразные набры тканей и позднее дифференцируются в нейроны и глиальные клетки периферической нервной системы, меланоциты кожи, черепно-лицевые хрящи и дентин,зубную пульпу и альвеолярные кости (Dupin et al., 2007; Chung et al., 2009). Мультимодельная сеть регуляторных генов обеспечивает сложные процессы формирования НГ и использует раннюю индукцию и поддержание пула предшественников, эмиграцию предшественников из нервной трубки посредством эпителиально-мезенхимного перехода, миграции клеток предшественников вдоль определенных путей и дифференцировку в разные типы клеток (Sauka-Springler, Bronner-Fraser, 2008; Nikitina et al., 2009). Множество сложных патологий, таких как синдромы DiGeorgr, Trecher Collins, Waardenburg и Дауна, нейрофиброматоз и болезнь Hirschprung's ассоциируют с нарушениями развития НГ (Taneyhill, Bronner-Fraser, 2005; Wurdak et al., 2006; Dixon et al., 2007; Tobin et al., 2008; Roper et al., 2009). Поэтому выяснение развития НГ у человека и механизмов, с помощью которых он нарушен при болезнях может улучшить наше понимание молекулярных основ патогенеза болезней и в конечном итоге создать основу для новых терапевтических вмешательств.
Наше знание биологии НГ человека существенно увеличилось с исследованием in vitro дифференцированных эмбриональных стволовых клеток человека (hESCs). Более того, прорыв в исследованиях репрограммирования стволовых клеток, чтобы получить индуцированные плюрипотентные стволовые клетки (iPS) открыл дверь в удивительный мир генерации специфичных для пациента клеток для регенеративной медицины (Okita et al., 2007; Takahashi et al., 2007).
Существенный успех достигнут в характеристике hESCs с нейральным потенциалом и в разработке протокола нейральной индукции и терминальной дифференцировки (Schwartz et al., 2008). Хотя несколько десятков публикаций описывают методы дифференцировки нервных клеток из эмбриональных стволовых клеток и схожие условия рутинно используются для генерации клеток ЦНС и ПНС, наибольший успех достигнут в направлении спецификации ЦНС, и имеются лишь ограниченные исследования способности эмбриональных стволовых клеток дифференцироваться в стволовые клетки нервного гребня (NCSCs). Будет представлено происхождение NCSCs из hESCs. Эти протоколы используют stromal-derived inducing activity (SDIA), embryoid body (EB) и neural rosettes-derived методы, а также модуляцию сигнальных путей.
SDIA-DERIVED METHODS
Sasai с коллегами показал, что нейроны эффективно индуцируются из ESCs мышей и приматов, если культивируются со стромальной линией мышей PAG (Kawasaki ei aL, 2000: Mizuseki et aL, 2003). Хотя раннее воздействия на SDIA-обработанные клетки BMP4 супрессирует нейральную дифференцировку, позднее воздействие BMP4 (на 5-9 день) из клеток совместно культивируемых с PAG стромальными клетками заставляет клетки дифференцироваться в клетки НГ и наиболее дорсальные клетки ЦНС, при этом автономная система и сенсорные клоны индуцируются преимущественно высокими и низкими концентрациями BMP4, соотв. (Mizuseki ei al 2003). Продемонстрирована способность SDlA-обработанных клеток дифференцироваться в производные эктодермы сенсорные ткани, такие как пигментный эпителий сетчатки (Kawasaki et aL, 2002) и клетки хрусталика (Ooto et al., 2003). Питающий слой стромальных клеток широко используется затем для обогащения как mouse embryonic stem cell (mESC), так и hESC в отношении нейрональных предшественников (Buytacrt-Hoefen et aL, 2004; Takagi et a!., 2005; Ко et aL, 2007; Song et aL, 2007: Elkabetz et aL, 2008: Freed et aL, 2008: Pomp et aL, 2008). Совместное культивирование hESCs с PAG стромальными клетками было использовано, чтобы экспрессировать маркеры НГ и генерировать peripheral sensory neurons (PSN) (Pomp et al.T 2005; Brokhman et aL, 2008; Jiang et ai" 2008; Pomp et aL, 2008). Слабость более ранних исследований заключалась в низком выходе (менее 1%) желаемых PSNs (Pomp et aL, 2005). Чтобы улучшить эффективность, авт. переключились на комбинированное генерирование neurospheres (NSPs) и совместное культивирование клеток PAG. Достигнуто десятикратное увеличение выхода PSNs, когда NSPs генерировали с использованием BMP антагониста Noggin, они были диссоциированы и использованы в качестве стартового материала для совместной культуры со стромальной линией PAG (Brokhman et aL, 2008). Образование NSP в присутствии Noggin в определенной культуральной системе снижает гетерогенную природу EB дифференцировки и позволяет hESC развиваться в основном в NPs, тогда как дифференцировка в др. клоны супрессирована. Дальнейшее улучшение метода было достигнуто при использовании PAG клеток для индукции NSP. Используя этот подход, NSPs были сгенерированы с помощью совместных культур hESCs с клетками PAG в течение 2 недель и для дальнейшей дифференцировки в PSN (Pomp et aL, 2008). По сравнению с предыдущими методами (Pomp et aL, 2005; Brokhman et aL, 2008) PAG генерируемые NSPs существенно снижали время, необходимое для дифференцировки и увеличения не только выхода (более чем в 25%), но и также для чистоты PSNs. Впервые описана экспрессия известных маркеров НГ SNAIL, SOX9, MSX1 и FOXD3 у 4-недельных эмбрионов человека. Более ранние сообщения выявили экспрессию p75 (Josephson ет aL, 2003) и SOX1O (Bondurand et al, '98) у эмбрионов человека этой стадии.
Приведенные выше исследования продемонстрировали, что дифференцированные эмбриональные стволовые клетки селективно индуцируют терминальную дифференцировку производных НГ; однако сами клетки НГ не были идентифицированы в этих исследованиях. Первая демонстрация выделения и направленной дифференцировки в NCSC-подобные клетки была осуществлена с использованием mESCs посредством комбинации с ST2 стромальными клетками в совместной культуре и FACS сортинга (Motohashi et aL, 2007). Ранее было показано той же самой группой, что ко-культивирование mESCs с ST2 стромальными клетками является эффективным источником меланоцитов после 21 дня (Kunisada et aL, 2003). Базируясь на этом наблюдении условия культивирования mESC были улучшены, чтобы индуцировать исключительно меланоциты и и популяцию NCSC-подобных клеток после c-KIT сортировки. Эти клетки были способны дифференцироваться в меланоциты, нейроны и глиальные клетки in vitro. Интересны исследования, которые продемонстрировали появление клеток НГ как из mESC (Rathjen et aL, 2002; Mizuseki et aL, 2003), так и hESC (Lee et aL, 2007; Jiang et al.. 2008; Pomp et aL, 2008), показавшие потенциал этих NCSCs клеток дифференцироваться с сенсорные нейроны, аутономные нейроны, гладкомышечные клетки и глиальные клетки, но не в меланоциты, по крайней мере, без сортировки.
Недавно Jiang et al. (2008) показали, что эффективность NCSC дифференцировки из hESCs может быть существенно улучшена путем комбинирования с SOLA, ко-культура с FACS-based обогащением. Спустя лишь 1 неделю ко-культивирования H9 hESCs с PAG клетками около половины колоний были позитивны по p75 и преобладающее большинство этих клеток также позитивно окрашивалось на HNK1, генеральный маркер NCSC, который был использован для характеристики эмбрионов птиц (Bronner-Fraser, '86) и человеческих NCSC (Lee et aL, 2007). Т.к. необходимы продолжительная инкубация и время для сортировки для двойного окрашивания, поэтому авт. использовали одиночный маркер (p75) FACS сортировки, который существенно улучшал успешность обогащения мультипотентных клеток с генетическими, фенотипическими и функциональными характеристиками NCSCs. Эти клетки не только давали периферические нервы, глиальные b миобробластные клетки в условиях дифференцировки in vitro, но и что важно, также клетки, которые дифференцировались в производные НГ, если их трансплантировали в развивающие эмбрионы кур in vivo. Однако сортировка по одиночному маркеру вызывает проблемы с чистотой. Поэтому важно оптимизировать условия для использования множественных маркеров для выделения клеток. Остаётся неясным, позволит ли комбинированная c-КIT сортировка с p75 и/или с HNK1 селективное выделение SDIA-индуцированных человеческих NCSC, которые будут поддерживать способность дифференцировки в меланоциты.
В др. исследовании краниальные НГ-подобные клетки были получены из hESCs посредством образования EBs и последующей FACS сортировки без использования стромальных клеток. Более 1% клеток были двойными позитивными по избранным маркерам и были способны к самообновлению и поддержанию потенциала мультипотентной дифференцировки (Zhou and Snead, 2008). Более детальная информация о процедурах по генерации NCSCs из ESCs представлена в Table 1.
Несмотря на улучшения основным препятствием для SDlA-based методов является использование не определенных строго культуральных условий, таких как стромальные клетки (PAG, ST2 или MS5). Загрязнение стромальными клетками также может вызывать затруднения для исследований, сфокусированных на биологии НГ. ST2 стромальные клетки могут быть эффективно исключены с помощью жидкостной цитометрии с использованием GFP-mESCs для инициальной дифференцировки (Motohashi et al., 2007). Альтернативно, флюоресцентные стромальные клетки могут быть генерированы для протокола SDIA, способные к негативному сортингу желательных клеточных популяций.
NEURAL ROSETTE-DERIVED NCSCS
Нейральные розетки это онтогенетическое обозначение нейральных предшественников в культуре дифференцирующихся эмбриональных стволовых клеток; розетки являются радиальным расположением цилиндрических клеток, которые экспрессируют большинство белков, экспрессируемых нейроэпителиальными клетками нервной трубки. Хотя и отличающееся по некоторым деталям развитие нейральных розеток осуществляется при альтернативных условиях, при которых плюрипотентные hESCs или дифференцируются в EBs (Zhang et al., 2001: Li et al., 2005) или пролиферируют в присутствии стромальных питающих клеток (Perrier et al., 2004). Любой механизм избирательного выявления нейральных розеток, как было установлено, генерирует популяции, обогащенные нейральными предшественниками (neuroprogenitors), экспрессирующими ранние нейроэктодермальные маркеры, такие как PAX6 и S0X1 (Zhang et al., 2001; Perrier et al., 2004; Wilson and Slice. 2006).
NCSCs были получены из hESCs на ст. нейральной розетки с помощью FACS сортировки по p75 and HNK1 (Lee et al., 2007). При этом нейральные розетки были сгенерированы методом Perrier et al. (2004) посредством ко-культивирования hESCs с MS5 стромальными клетками. Нейральная дифференцировка была индуцирована с помощью изъятия bFGF/EGF и воздействия BDNF, GDNF, NGF и dbcAMP. Такой режим обработки давал как симпатические нейроны (TH+/ Peripherin+ ) так и сенсорные нейроны (Brn3a+/Peripherin+ ). Индуцировалась также дифференцировка Шванновских клеток в таких расширенных p75+/HNK1+ культурах путем обработки CNTF, neuregulin 1 beta, и dbcAMP. Однако эти ранние NCSCs не могут формировать Шванновские клетки in vivo. Сходные результаты были получены в недавнем исследовании, где несмотря на успешную глиальную дифференцировку in vitro NCSCs не дифференцировались в Шванновские клетки ни в развивающихся, ни во взрослых хозяевах in vivo (Jiang et al.,
2008). Эти факты подтверждают мнение, что присущие клетке временные изменения эпигенетического состояния, включая прямое метилирование GFAP промотора, скорее, чем артефакты в культуре in vitroмогут объяснить результаты дифференцировки Шванновских клеток. Общим препятствием процесса промежуточных розеток является то, что процесс нуждается во времени. Он также нуждается в неустановленных культуральных условиях, благодаря использованию стромальных клеток или генерации образования гетерогенных EB.
Клетки предшественники НГ были также получены из нейральных розеток, генерированных из эмбрионов телят (Lazzari et ai., 2006). В этом исследовании нейральные розетки непосредственно происходили из клеток внутренней массы как клонированных (перенос ядер) , так и оплодотворенных (оплодотворение in vitro) эмбрионов телят. После экспансии in vitro нейральные розетки давали линии p75-позитивных клеток предшественников НГ (более 90%), способных к долговременной пролиферации и дифференцировке в аутономные и сенсорные периферические нейроны, глиальные клетки, меланоциты, гладкомышечные клетки и хондроциты, воспроизводя in vitro уникальную пластичность клона НГ (Lazzari et al., 2006). Это исследование предоставляет модель нейральной индукции непосредственно из преимплантационных эмбрионов видов крупных животных и предоставляет беспрецендентный доступ in vitro к ранним ступеням развития нервной системы. Характеристика высоко пролиферативных клеточных линий из НГ демонстрирует возможность получения их непосредственно из эмбрионов, PNS и эктомезенхимных производных для потенциальной клеточной терапии и тканевого преобразования.
Недавние успехи показали, что происходящие из hESC нейральные розетки (наз. R-NSCs) представляют собой новое состояние стволовых клеток, которое в будущем может быть выделено, регионально специфицировано и размножено
in vitro в присутствии SHH/Dll4/Jag без потери свойств розеток (Elkabetz et aL, 2008). Анализ профилей экспрессии выявил уникальный набор генов, специфичных только для R-NSCs (
PLZF, EVI-1, DACH1). Было продемонстрировано, что R-NSCs, происходящие из hESCs (с использованием как базирующегося на стромальных клетках, так и EB-based протоколов), также как и из mESCs и передней части нервной пластинки мышей ст. E8.25, обладают общими характеристиками, указывая тем самым, что R-NSCs могут представлять стадию нейральных стволовых клеток
in vivo на ст. нервной пластинки (Elkabetz et al., 2008). Выделение Forse1
+ /N-cad
+ клеток из R-NSCs было использовано в маркера для проспективной изоляции клеток розеток из передней части нервной пластинки (Elkabetz et al.. 2008). С др. стороны, Forse1
+ /N-cad
+ R-NSCs, как было установлено, обладают способностью генерировать клон НГ, открывая новую стратегию для изучения раннего развития человеческого НГ
in vitro. Потенциал R-NSCs для воссоздания полного нейрологического разнообразия в конечном итоге улучшит доступ к терапевтически важным типам клеток.
TRANSGENESIS
Дифференцировка эмбриональных стволовых клеток может быть перенаправлена за счёт экспрессии транскрипционных факторов, участвующих в выборе судьбы клеток или за счёт избыточной экспрессии или использования систем индуцибельной генной экспрессии. Ограничения подобных подходов связаны с тем, что большинство транскрипционных факторов д. присутствовать только в течение определенного окна в развитии. Использование промоторов, активных только на определенной стадии дифференцировки (напр. Sox1) позволит воспроизвести возможно ближе паттерн физиологической экспрессии транскрипционных факторов. Начало экспрессии Sox1 коррелирует с формированием нервной пластинки и его экспрессия подавляется, когда дифференцируются нервные клетки (Wood and Episkopou. '99) , это делает его идеальным кандидатом для обогащения нейропредшественниками. Генерация клеток, которые экспрессируют GFP под контролем промотора Sox1 делает возможным отсортировку ранних нейроэктодермальных клеток (Aubeit et ai., 2003; Ying et al., 2003). Генетический отбор по of Sox1-GFP экспрессирующим нейральными предшественниками с помощью FACS сортировки, как было установлено, эффективно устраняет нежелательные пролиферирующие типы клеток и избегает образования опухолей после трансплантации (Chung et al., 2006). Альтернативный подход может использовать ткане-специфический промотор, чтобы экспрессировать резистентность к антибиотикам, что позволяет избирательно убивать нежелательные клетки. Хотя большинство исследований по дифференцировке использует Sox1-GFP клетки для генерации производных ЦНС, попытки получить NCSCs также предпринимаются (Rodgers et al., 2009). Основным препятствием для этого метода является низкая жизнеспособность некоторых типов клеток после клеточной сортировки и низкий выход желательных клеток.
Подход обусловленного (conditional) трансгенеза использован для получения линии клеток НГ из НГ туловища мыши (Maurer et al., 2007). Использование трансгенной линии мышей сделало возможным пространственно-временной контроль трансформирующего
c-myc онкогена , получена клеточная линия JoMa1. Эти клетки экспрессируют маркеры NCSC зависимым от активности трансгена способом. transgene-activity-dependent manner. Условный, индуцибельный с помощью 4-OHT
c-MycER , когда "включен", удерживает клетки в мультипотентном пролиферативном состоянии, а когда "выключен" делает возможной дифференцировку в нейроны, глию, гладкомышечные клетки, меланоциты и хондроциты. Этот уникальный подход делает возможной генерацию линий NCSC путем скрещивания c-MycER
T мышей с мышами, содержащими мутации, затрагивающими развитие НГ, тем самым предоставляется дополнительная информация о генетических путях контроля дифференцировки НГ. В целом эта система представляет собой мощный инструмент для изучения биологии NCSC.
MODIFICATION OF SIGNALING PATHWAYS
Оптимизация клеточной дифференцировки посредством нахождения разных внутриклеточных путей становится многообещающим путём исследований. Растут доказательства, указывающие, что самообновление и дифференцировка hESCs может регулироваться с помощью малых молекул, которые модулируют внутриклеточные сигнальные пути (Ding et al., 2003; Hao et al., 2008; Ying et al., 2008). Ингибирование передачи сигналов Activin/Nodal, как было установлено, способствует спецификации hESCs в нейроэктодерму, указывая на роль этого пути в контроле раннего нейрального развития плюрипотентных клеток (Smith et al., 2008). Следовательно, в своём поиске улучшения эффективности генерации нейропредшественников из hESCs, Chambers et al. (2009) использовали ингибиторы передачи сигналов SMAD, чтобы способствовать нейральному превращению человеческих ES и iPS клеток. Синергичное действие Noggin и SB431542 оказалось достаточным для индукции быстрой и полной нейральной конверсии более 80% hESCs в вязких культуральных условиях. После сравнения клеток ранних нейральных предшественников, полученных с помощью двойного ингибирования SMAD с ранее описанными R-NSC (Elkabetz et al., 2008), авт. предположили, что эти нейральные предшественники могут представлять собой наиболее примитивное состояние нервных предшественников, происходящих из hESC, которое затем способно к образованию розеток. Интересно, что FACS сортировка выявляет, что PAX6
+ клетки, обладающие характеристиками передней части ЦНС, тогда как PAX6
- клетки при тех же самых условиях экспрессируют маркеры НГ
AP2a, HNK1, PAX7 и p75. Более того было показано, что соотношение РАХ6
-/РАХ6
+ может регулироваться с помощью манипуляций с плотностями посевов инициальных клеток; при этом более высокая плотность клеток приложима больше к клеткам, ставшими из Рах6
+, тогда как низкая плотность способствует формированию потомства Рах6
- НГ (Chambers et al., 2009). Схематическое представление различных протоколов, используемых для получения NCSCs из hESCs показано на Fig. 1.
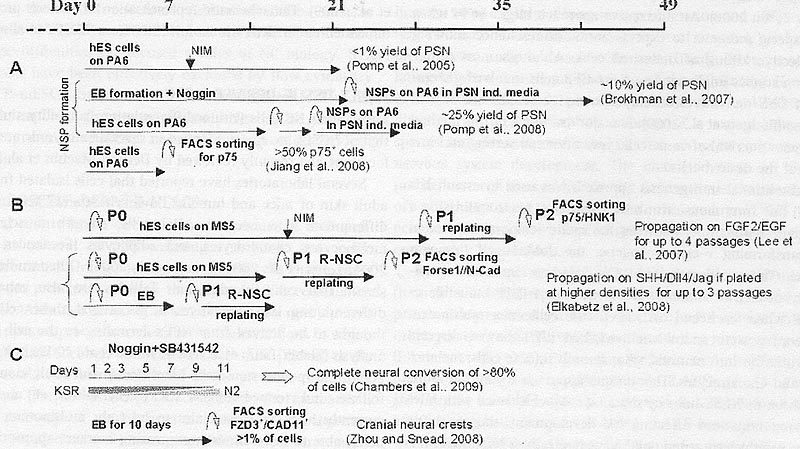
Схематические процедуры получения NCSCs из hESCs. (A) SDIA-протокол, (B) neural rosette- протокол, (С) другие.
ADULT TISSUE-DERIVED NCSC
Мультипотентные клетки НГ, по своей способности к дифференцировке сходных с таковой у NCSCs, были идентифицированы в некоторых местах эмбрионов и взрослых (Delfmo-Machin et al. , 2007). Несколько лаб. сообщили, что клетки , выделенные из кожи взрослых мышей и людей обнаруживают признаки само-обновления и дифференцируются в нейроны, глиальные клетки, гладкомышечные клетки, меланоциты, хондроциты и адипоциты (Femandes et al., 2004; Toma et al, 2005; Wong et al., 2006). Др. исследования показали, что клетки волосяных фолликулов взрослых также способны дифференцироваться в производные НГ и эти клетки, как полагают, происходят из клеток НГ согласно клональному анализу (Sieber-Blum et al., 2004; Amoh et al., 2005a,b; Yu et al., 2006). Плюрипотентные стволовые клетки, обнаруженные в волосяных фолликулах взрослых мышей и наз. EPI-NCSCs (Sieber-Blum et al., 2004) в настоящее время считаются настоящими мультипотентными NCSCs, т.к. способны генерировать клетки, экспрессирующие маркеры, характерные для нейронов, глии, миофибробластов, хондроцитов и меланоцитов. Транскрипционная роль EPI-NCSCs в культуре идентифицируется по "molecular signature" из 19 генов, это отличает их от эпидермальных стволовых (которые генерируют кератиноциты), несмотря на расположение их в общей нише во вздутии волосяного фолликула (Hu et al., 2006). Кроме того, EPI-NCSCs обладают общей частью профиля генной экспрессии стволовых клеток, характерной для iPS клеток (Sieber-Blum and Hu, 2008). Благодаря их способности мигрировать , EPI-NCSCs могут быть выделенные в виде популяции мультипотентных предшественников высокой чистоты и они обладают некоторыми характеристиками, общими с плюрипотентными стволовыми клетками, не обладая при этом туморогенностью. Так как пациенты могут использовать свои собственные EPI-NCSCs для трансплантации, тем самым избегается отторжение трансплантата. Недавние исследования продемонстрировали использование происходящих из взрослых тканей NCSCs с целью репарации нарушений, таких как повреждения спинного мозга, при этом трансплантированные в спинной мозг взрослых EPI-NCSCs не обнаруживали признаков туморогенеза (Sieber-Blum et al., 2006; Song et al., 2008).
Клетки, производные NCSC, такие как меланоциты или глиальные клетки, обнаруживают нестабильные фенотипы клеток НГ и могут дедифференцироваться и затем "дифференцироваться в др. производные НГ". Пигментированные клетки, выделенные из кожи эмбрионов перепела были способны генерировать глиальные клетки и myobroblastic клетки, которые происходят из клеток НГ, если подвергнуты воздействию EDN3 в качестве митотического сигнала (Dupin et al., 2000, 2003; Trentin et al., 2004; Real et al., 2006). Шванновские клетки, выделенные из эмбриональных нервов перепела дают myobroblastic клетки (Real et al., 2005). Меланоциты, которые, как полагают, ограничены их судьбой быть меланоцитами, как было установлено, обладают мультипотентными клеточными судьбами, и способны генерировать нейроны, глиальные клетки и гладкомышечные клетки помимо меланоцитов, даже после того как они мигрировали в направлении своих сайтов мишеней в коже (Motohashi et al., 2009).
CONCLUDING REMARKS
There has been considerable effort in recent years to identify and isolate NCSCs derived from ESCs. The ability to rapidly and reproducibly generate large numbers of NCSCs for biological studies will be invaluable for studies of disrupted NX development and to elucidate the pathogenesis of both benign and malignant human NC disorders. There are several issues that are important to address for cells to be suitable for use in human therapy including establishing a system free of any potential harmful substances. Many protocols involve materials of animal origin, which could be a source for potential pathogens. In addition feeder cells can transfer xenogenous glycans to hESC and induce an immune response. Moreover maintaining naive embryonic stem cells on fibroblast feeder layers make these protocols very labor intensive. Although recent studies reported fully feeder-free method of culturing hESCs (Ludwig et al. 2006), the use of feeder-free hESC for SDIA protocols or derivation of neural rosettes has not vet been reported. In contrast to hESCs, the use of feeder-free mESCs such as the SoxJ-GFP cell line has been implemented. Co-culture systems with stromal cells for neural induction also cause the same problems as the most of these are of animal origin (murine PA6, ST2 MS5 cell lines). One possibility is to replace diem with human stromal cells but generation of such lines has proved to be technically challenging and thus such lines have not been described yet. The use of other ceil types of animal origin such as mouse Serroli cells (Yue et al.,
2006), or chicken somites (Sagha et al., 2009) for co-culturing have been demonstrated to induce neuronal differentiation. On the other hand using selective survival approaches involving transgenes for the generation of neurons raises similar concerns. It is nor clear at this point whether vector-mediated transgenesis of hESCs will be suitable for clinical applications. The use of lentiviral vector-mediated integration of the perspective trans-genes into the host cell genome might present the risk of malignant transformation. Therefore, it is important to develop other strategies such as nonintegrating transgenesis or cell-permeant proteins, to introduce these transcription factors into the host cells.
The majority of neural induction protocols for hESCs rely on EB formation, stromal feeder co-culture or selective survival conditions. Each strategy has considerable drawbacks, such as poorly defined culture conditions, protracted differentiation and low yield. Neural induction by the dual SMAD inhibition helped to overcome some disadvantages of NCSCs from hESCs derivation protocols; it is simple, requires less time, less work, and provide better yields and purity, and defined culture conditions (Chambers et al., 2009).
Another challenge in current differentiation protocols is a lack of synchronicity of the generated cell populations. Transplantation of cells after FACS sorting for NCSC markers effectively eliminated in vivo tumor formation indicating effective removal of predifferentiated cells via sorting (Lee et al., 2007). Given the disparities in the protocols it is conceivable that the SD1A and R-NSC approaches and signaling pathway modulation result in cells ihat correspond to in vivo-derived cells of different developmental stages. Direct comparison of NCSCs derived by different techniques would be important to determine whether or not these NCSCs possess equivalent differentiation and self-renewal capacities in vitro and in vivo. In addition, comparison of hESC-derived NCSCs with adult tissue-derived cells will provide insights into the presumed ontogeny of NC cells and clarify the relationship between these different stern cells.
Сайт создан в системе
uCoz Схематические процедуры получения NCSCs из hESCs. (A) SDIA-протокол, (B) neural rosette- протокол, (С) другие.
Схематические процедуры получения NCSCs из hESCs. (A) SDIA-протокол, (B) neural rosette- протокол, (С) другие.