В последние годы открыты множественные механизмы, которые модулируют активность пути Notch, от транскрипции до внутриклеточного трафика рецептора и лигандов, с упором на механизмы, которые способствую генерации сигнала и активации рецептора во взаимодействующих клетках (rev. Bray, 2006, Schweisguth, 2004).
Во время передачи сигналов Notch, высвобождение NICD в ядро проходит две струпени regulated intramembrane proteolysis (RIP) рецептора, запускаемого связыванием лиганда. Notch рецептор может, т.о., рассматриваться как с вязанный с мембраной транскрипционный ко-фактор, который интегрирует сигнальные события на мембране и передает их непосредственно в ядро, без каких-либо вторичных мессенджеров. Поскольку RIP расщепление удаляет рецептор из клеточной мембраны, то каждая молекула Notch может передавать сигнал только раз, следовательно регуляция количества и доступности Notch рецепторов на клеточной поверхности может быть критической для модуляции силы сигнала. Кроме того, т.к. путь не базируется на вторичных мессенджерах, то амплификация сигнала невозможна и способность передачи сигнала д. очень сильно зависеть от концентрации в ядре NICD, это образует др. узловую точку для регуляции интенсивности и продолжительности передачи сигналов Notch.
Regulation of Notch availability at the cell surface
В последние годы стало ясно, что эндоцитоз и внутриклеточный перенос Notch рецепторов играют важную роль в модуляции сигналов, контролируя не только доступность, но и также "качество" рецепторов и лигандов. Напр., энзим O-fucosyl transferase (O-Fut) инициирует каскад гликозилирования, которые необходим, чтобы генерировать функциональный Notch рецептор (Okajima and Irvine, 2002, Sasamura et al., 2003, Shi and Stanley, 2003), способствуя также укладке и выходу рецепторов из эндоплазматического ретикулема (Okajima et al., 2005). Кроме того, O-Fut может контролировать удаление Notch молекулы с плазматической мембраны и её вступление в компартмент деградации, предупреждая тем самым избыточное накопление свободных рецепторов на клеточной мембране (Sasamura et al., 2007).
Известны и др. механизмы, которые регулируют присутствие Notch рецепторов на клеточной поверхности, использующие активность различных HECT доменовых E3 ubiquitin-лигаз, подобно тем, что принадлежат Nedd4 семейству ( Drosophila Nedd4 and Supressor of Deltex, и Itch млекопитающих). Эти E3-лигазы доставляют Notch молекулы в поздние эндосомы, и происходит последующая деградация с помощью лизосом (rev. Le Borgne, 2006). Напротив, др. E3 ubiquitin-ligase, Deltex, является позитивным регулятором активности Notch у Drosophila (Hori et al., 2004, Matsuno et al., 1995), хотя в клетках млекопитающих она также может действовать, чтобы противодействовать Notch (Izon et al., 2002). Итак, результатом этих ubiquitin модификаций Notch рецепторов является их доступность на клеточной поверхности и, следовательно, сила и продолжительность сигнала.
Существуют и др. механизмы, не обеспечиваемые ubiquitylation, которые также контролируют эндосомальную сортировку рецепторов и способствуют их доставке для лизосомной деградации. Сюда входит активность комплекса ESCRT (Moberg et al., 2005, Thompson et al., 2005, Vaccari and Bilder, 2005) и вновь идентифицированного белка - Lethal Giant Discs (LGD), который играет важные роли в ограничении передачи сигналов Notch (Childress et al., 2006, Jaekel and Klein, 2006, Klein, 2003).
Numb является ассоциированным с мембраной белком, который противодействует передаче сигналов Notch в нервной системе Drosophila, путем подавления активности позитивного регулятора Notch, Sanpodo. Numb является эндоцитотическим регулятором и запускает alpha-adaptin обусловленный эндоцитоз Sanpodo, поставляя его в поздние эндосомы, тем самым ингибируя позитивное взаимодействие с Notch на мембране (Hutterer and Knoblich, 2005). У позвоночных, однако роль Numb в регуляции активности Notch пока дискуссионна. Хотя некоторые исследования указывают на Numb как на негативный регулятор, который поставляет Notch рецепторы для эндоцитоза и последующей деградации (McGill and McGlade, 2003), анализ мутантных мышей без активности Numb во время нейрогенеза затруднен, чтобы подтвердить это мнение о Numb как антагонисте передачи сигналов Notch (Kuo et al., 2006, Li et al., 2003, Petersen et al., 2002, Zhong et al., 2000).
Др. механизм предупреждения активации пути Notch может быть связан с постулированной доминантной активностью Delta лигандов, которые могут связывать Notch рецепторы в cis-положении (внутри той же самой клетки) и предупреждать их взаимодействие в лигандами из соседних клеток (в trans). Эти цис-взаимодействия, как полагают, являются неактивирующими и ведут к подавлению передачи сигналов Notch в клетках с высокими уровнями Delta лигандов. Этот механизм был предположен, исходя из анализа мозаичных мутантов Drosophila (Heitzler and Simpson, 1993), но трудно найти биохимические данные в подтверждение. Всё ещё вполне возможно, что во время LI клетки победители используют свой избыток лиганда не только, чтобы передавать сигналы соседним клеткам, но и также, чтобы избежать активации Notch, путем уменьшения доступности рецепторов на своей клеточной мембране.
В др. ситуациях удаление Notch рецепторов с мембраны является предпосылкой, чтобы увеличить сигнальную способность клетки, избегая возникновения цис-взаимодействий между лигандами и рецепторами, которые могли бы секвестрировать деятельность лиганда. Это было описано во время формирования вульвы у C.elegans, где передача сигналов Lin-3/EGF-Ras-MAPK, как известно, индуцирует удаление Lin-12/Notch с мембраны клетки "победительницы" (P6.p) (Shaye and Greenwald, 2002). Действительно, способность к передаче сигналов у P6.p сильно снижена у мутантов, которые неспособны удалять Lin12/Notch с мембраны, и не происходит LI, чтобы выбирать судьбу вульвы (Shaye and Greenwald, 2005).
TABLE 1
COMPONENTS OF THE NOTCH SIGNALLING PATHWAY ARE EVOLUTIONARILY CONSERVED 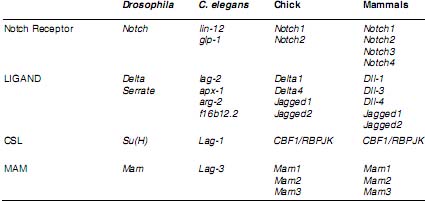
Поскольку этот фенотип зависит от присутствия Lin-12/Notch внеклеточного домена, то было предположено, что избыток рецептора на поверхности мутантных клеток может секвестрировать DSL лиганды в cis и предупреждать их активность, блокируя тем самым латеральную ингибицию соседних клеток (Shaye and Greenwald, 2005).
Notch in the nucleus: stability and degradation
Вследсиве активации Notch и транслокации NICD в ядро, собирается трехсоставной комплекс вокруг ДНК, связанной с CSL транскрипционным фактором, это ведет к экспрессии генов мишеней для Notch. MAM кофактор важен для организации и этого активаторного комплекса, рекрутирует др. белки, которые вносят вклад в транскрипционную активацию генов мишеней. Однако, MAM рекрутирует также комплекс из cyclin C и cyclin-dependent kinase 8 (CycC:CDK8), который непосредственно фосфорилирует NICD и поставляет его на протеосомную деградацию после убиквитинирования с помощью Fbw7/Sel10 ubiquitin ligase (Fryer et al., 2002, Fryer et al., 2004). Т.о., MAM действует подобно "kamikaze" кофактору, который если рекрутируется на транскрипционный комплекс, то вносит также средство стремительного прекращения его активности, позволяя тем самым осуществлять тонкий контроль уровня и времени передачи сигналов Notch.
C-терминальный PEST домен в NICD непосредственно участвует в этом событии фосфорилирования по трем остаткам серина, как известно фосфорилируемыми с помощью CycC:CDK8 kinase (Fryer et al., 2004). Однако др. регион PEST домена, как было установлено участвует в обороте NICD turnover, он содержит вереницу из 4-х остатков Ser residues (WSSSSP), которые не идентифицируются в качестве CycC:CDK8 мишеней. Делеция этой небольшой области молекулы Notch ведет к гипофосфорилированию NICD, снижению оборота и стабилизации CSL/NICD/MAM комплекса с последующим усилением передачи сигналов Notch (Chiang et al., 2006). Эти делеции приводят к строгому фенотипу "избыточности функции" и могут быть выявлены при T-cell acute lymphoblastic leukemia (TALL), в опухоли, происходящей из предшественников Т клеток, что коррелирует с бесконтрольной активностью Notch (Chiang et al., 2006, Weng et al. , 2004).
NICD могут быть также фосфорилированы с помощью др. киназы - GSK3β (Espinosa et al., 2003, Foltz et al., 2002), хотя этого, по-видимому, не происходит, когда NICD присутствует в связанных с ДНК комплексах с CSL и MAM (Fryer et al., 2004). Также неясны результаты подобного фосфорилирования, т.к. оно может приводит к более высокой и более низкой активности NICD в зависимости от клеточного контекста (Espinosa et al., 2003, Foltz et al., 2002).
Target genes and termination of Notch signalling
Хотя NICD является коротко-живущим транскрипционным кофактором, возможно, что его гены мишени кодируют стабильные транскрипционные факторы, которые генерируют устойчивую активность пути. Это, по-видимому, вряд ли возможно, т.к. основные Notch эффекторы принадлежат к семейству HES из bHLH транскрипционных репрессоров, которые также являются предметом тонкой временной регуляции их активности (reviewed in Kageyama et al., 2007b). Действительно, не только HES белки являются коротко-живущими (Hirata et al., 2004), но они таже способны репрессировать транскрипцию своих собственных генов, гарантируя тем самым, что их активность ограничена во времени (Cooper et al., 2000, Fior and Henrique, 2005, Gajewski et al., 2003, Hirata et al., 2004). Более того, некоторые HES белки, как было установлено, фосфорилируются, что ведет к снижению их способности связывать ДНК и репрессировать транскрипцию (Strom et al., 1997), указывая тем самым, что пост-трансляционные механизмы на уровне Notch эффекторов могут также вносить вклад в ограничение продолжительности передачи сигналов Notch.
The importance of a clean termination
Описанные механизмы подавления активности Notch являются важными компонентами LI внутриклеточных петель обратной связи, которые умножают различия между взаимодействующими клетками. Их относительный вклад может варьировать в разных онтогенетических контекстах, но вместе с механизмами, которые позитивно регулируют передачу сигналов Notch, они прекращают детерминацию склонности в отношении направленности передаваемых сигналов, важное свойство LI-обусловленных межклеточных взаимодействий.
Действительно, чтобы достигнуть направленности передачи сигнала в конкурентном механизме, подобном LI, важно не только генерировать избыток сигнальной активности, высвобождаемой клетками "победительницами", но и также максимизировать прием сигнала клетками "неудачницами". Т.о., может показаться парадоксальным, что LI способна оперировать эффективно при ограниченных концентрациях Notch рецепторов на поверхности клеток и NICD в ядре, описанных выше. Однако этот парадокс обманчив и мы д. оспорить, что это ключевое свойство LI механизма, необходимое для достижения эффективного умножения небольших флюктуаций в активности Notch и установления четких различий между клетками с эквивалентным потенциалом. Это применимо, напр., к быстрому обороту NICD, который необходим, чтобы предупредить накопление в ядре до уровней, которые будут должны помимо прочего забуфферивать систему против небольших флюктуаций и блокировать появление "победителей" и "неудачников".
Др. важным следствием быстрого оборота NICD в ядре это то, что он предохраняет NICD от повторного использования для транскрипции генов мишеней, продуцируя тем самым взрывы активности Notch, вместо устойчивой и продолжительной активации. Кроме того, негативная ауто-регуляция генов мишеней/эффекторов hes, вместе с коротко-живущей природой hes мРНК и HES белков, также вносит вклад в этот очень мимолетный характер реакции Notch.
Итак, архитектура пути Notch устроена так, чтобы продуцировать эффективную, но очень мимолетную реакцию во взаимодействующих клетках, с различными механизмами, которые негативно регулируют передачу сигналов Notch, внося свой вклад в этот исход. Постоянно повторяющейся темой в этих механизмах является то, что игроки, которые управляют активностью пути, также служат орудием на последующих ступенях, чтобы ограничить эту активность. Это верно, напр., для O-Fut белка. который важен для генерации активного Notch рецептора, но запускает также др. модификации, которые ограничивают способность рецепторов взаимодействовать со специфическими DSL лигандами. Др. впечатляющим примером является MAM кофактор, который абсолютно необходим для сборки транскрипционно активного комплекса на генах мишенях Notch, но рекрутирует также CycC:CDK8 киназу, чтобы запускать протеосомную деградацию NICD.
Такая специфическая архитектура пути Notch делает возможным тонкий контроль величины передачи сигналов, испытываемой взаимодействующими клетками, и является фундаментальной для функционирования внутриклеточной петли обратной связи, которая умножает сигналные различия во время LI. Кроме того, способность эффективно заканчивать передачу сигналов Notch посредством модификации или элиминации некоторых из её компонентов важна для событий, которые сопровождают LI. Клетки, в которых активность Notch достигает пика могут быстро завершать её, перестраивать свой потенциал и вступать в новый раунд LI, обеспечивая тот же самый или иной набор альтернативных судеб. Это позволяет LI регулировать различные гистогенетические процессы, в которых пул предшественников поддерживается во время продолжительного периода времени, давая тем самым клетки со специфическими и разными судьбами. Прекрасный пример этого существует при нейрогенезе Drosophila и позвоночных, когда нейральные предшественники (нейробласты у Drosophila и нейроэпителиальные предшественники у позвоночных) могут участвовать в нескольких раундах Notch-обеспечиваемых решений, восстанавливая свои уровни активности Notch после каждого раунда. Если эти клетки одновременно способны "перенастраивать" свой потенциал за счет внутренне присущих или внешних механизмов, то способность генерировать последовательные раунды Notch-обусловленных LI может продуцировать дополнительные исходы: приобретение разных нейральных судеб в ходе периода нейрогенеза, т.e., разнообразие нейронов.
Др. онтогенетический процесс, проходящий несколько раундов активности Notch, происходит во время сомитогенеза позвоночных. При этом клетки presomitic mesoderm (PSM) испытывают синхронизированные осцилляции активности Notch, находка, впервые установленная по циклической экспрессии генов
hes в этих клетках (Palmeirim et al., 1997). Недавно с использование флюоресцентных репортеров активности Notch, эти циклы удалось визуализовать
in vivo с помощью цейтраферной съемки развивающейся пресомитной мезодермы (Masamizu et al., 2006). Анализ архитектуры сетей, лежащих в основе этих циклов передачи сигналов Notch подтвердил ключевую роль, выполняемую механизмами, которые прекращают активность Notch (rev. Kageyama et al., 2007a, Pourquie, 2003), с важным вкладом, вносимым механизмом, который контролирует период полу-жизни hes мРНК и белков (Hirata et al., 2004, Lewis, 2003).
Final remarks
In recent years, several mechanisms that positively regulate Notch signalling have been described, involving processes like transcriptional up-regulation of DSL ligands, their selective recycling to the cell membrane, and post-translational modifications of ligands and receptors to increase their mutual affinity (reviewed in Bray, 2006, Le Borgne, 2006, Schweisguth, 2004). However, in a competitive mechanism like LI, the final outcome is dictated by the balance of positive and negative mechanisms, regulated globally in the ensemble of interacting cells through a unique intercellular feedback loop. Here, we discussed some of the mechanisms which are known to negatively regulate Notch signalling, at different steps of the pathway. We propose that these mechanisms are crucial to regulate timing and duration of Notch activity during LI, underlying the generation of signalling directionality during cell interactions. We further propose that switching-off Notch activity after signalling has occurred is a critical aspect of the Notch pathway architecture that allows it to regulate progenitor maintenance and cell type diversification in several histogenic processes.
Сайт создан в системе
uCoz Fig. 1. A partial view of Notch in action, mediating communication between two adjacent cells. The mechanisms that lead to Notch activity in the receiving cell are depicted, including the cleavage of Notch at the cell membrane and the assembly of a tripartite nuclear complex with the transcription factors CSL (CBF-1, Drosophila Supressor of Hairless and C. elegans Lag-1) and MAM (mastermind co-activator).
Fig. 1. A partial view of Notch in action, mediating communication between two adjacent cells. The mechanisms that lead to Notch activity in the receiving cell are depicted, including the cleavage of Notch at the cell membrane and the assembly of a tripartite nuclear complex with the transcription factors CSL (CBF-1, Drosophila Supressor of Hairless and C. elegans Lag-1) and MAM (mastermind co-activator).