Wnt Signaling and the Polarity of the Primary Body Axis | |
|
|
Как животные устанавливают и формируют паттерн первичных осей тела является одной из наиболее фундаментальных проблем биологии. Данные от различных deuterostomes (лягушек, рыб, мышей и amphioxus) и от планарий (protostomes) указывают на то, что передача сигналов Wnt посредством β-catenin контролирует задние характеристики во время формирования плана тела у большинства билатерально симметричных животных. Передача сигналов Wnt также влияет на полярность первичной оси pre-bilaterian животных, указывая тем самым, что роль в формировании аксиального паттерна передачи сигналов Wnt выявляется ещё до эволюции билатерально симметричных животных. Использование задней передачи сигналов Wnt и ингибирования Wnt спереди может быть единым принципом построения плана тела у большинства животных.
Как животные приобретают регионализованные свойства вдоль оси, которая идет от головы до хвоста? Решение этого вопроса является фундаментальным для понимание того, как животные формируются из оплодотворенного яйца. Широко распространенная модель полагает, что молекулярная поляризация эмбрионов вдоль двух осей, передне-задней (от головы к хвосту) и дорсо-вентральной (от спины к животу), задает систему ортогональных координат для формирования регионального паттерна (Nusslein-Volhard and Wieschaus, 1980; Niehrs, 2004).
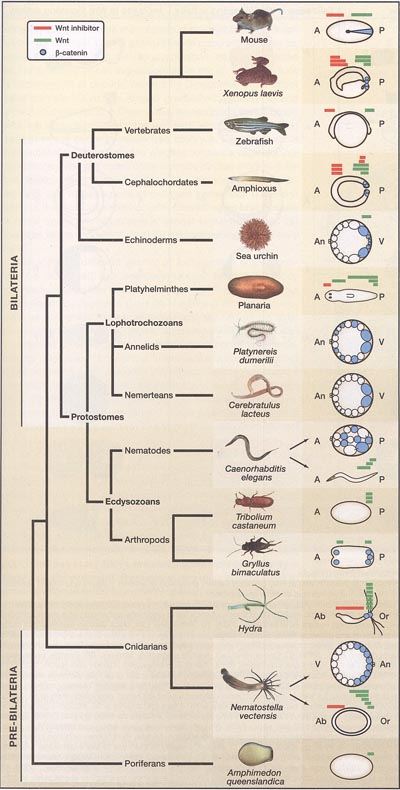 Figure 1. Posterior Wnt Signaling and Anterior Wnt Inhibition in the Metazoa Animals are divided into pre-bilaterians that lack overt bilateral symmetry and bilaterians. Bilaterians are divided into deuterostomes and protostomes, and the latter are further divided into ecdysozoans and lophotrochozoans (Adoutte et al., 2000). Abundant nuclear (3-catenin protein (blue) and Wnt gene expression domains (green) tend to be posterior, whereas Wnt inhibitor gene expression domains (red) tend to be anterior. For simplicity, in most cases only a single developmental stage is shown. (A) Anterior pole, (P) posterior pole, (An) animal pole, (V) vegetal pole, (Ab) aboral pole, (Or) oral pole. Note that in some cases, only the expression of a representative Wnt gene is shown. Early gastrulation stage mouse: cylinder-shaped embryo is depicted as a flattened projection onto two dimensions; (3-catenin protein (blue triangle) and Wnt3 expression are at the prospective primitive streak, and Dkk1 is expressed in the anterior visceral endoderm (Glinka et al., 1998; Liu et al., 1999; Mohamed et al., 2004). Late gastrula stage Xenopus: Xwnt3a, Xwnt8, and Xwntl 1 and nuclear p-catenin protein are posterior and Dkk1/2/4 and sFRP3/4/frzb anterior (Christian and Moon, 1993; McGrew et al., 1997; Glinka et al., 1998; Kiecker and Niehrs, 2001; Schohl and Fagotto, 2002). Zebrafish tailbud stage: wnt8 and wnt3a are posterior and sFRP3/frzb is anterior (Lekven et al., 2001; Shimizu et al., 2005; Thorpe et al., 2005; Tendeng and Houart, 2006). Late gastrula stage amphioxus: Wnt3a and Wnt8 are posterior and Dkk3, Dkk1/2/4, sFRP2-like are anterior. sFRP3/4 and Dkk1/2/4 are also posterior (Yu et al., 2007). Blastula stage sea urchin: vegetal p-catenin protein and Wnt8 (Logan et al., 1999; Wikramanayake et al., 2004). Planaria: Smed-wntP-1, Smed-wntP-2, Smed-wnt11-1 are posterior, Smed-wnt2-1 is in the pre-pharyngeal region, and Smed-sFRP-1 is anterior (Petersen and Reddien, 2008). Cleavage stage Platynereis dumerilii: p-catenin localizes to the vegetal cell of each axial division (Schneider and Bowerman, 2007). Blastula stage Cerebratulus lacteus: vegetal p-catenin protein (Henry et al., 2008). Cleavage stage C. elegans (above): asymmetric localization of WRM-1/р-catenin and SYS-1/р-catenin to the posterior daughters of each axial cell division (Rocheleau et al., 1997; Thorpe et al., 1997; Nakamura et al., 2005; Takeshita and Sawa, 2005; Huang et al., 2007). Larval stage C. elegans (below): //л-44/Wnt, eg/-20/Wnt, and cwn-1/Wnt are posterior (Herman et al., 1995; Coudreuse et al., 2006; Pan et al., 2006). Blastoderm stage Tribolium castaneum: l/iVntA, Wnt1, and Wnt8 are posterior (Bolognesi et al., 2008a). Early segmentation stage Gryllus bimaculatus: w/ng/ess/Wnt and p-catenin protein are in the posterior growth zone and also in the anterior eye-forming zones (36 hr) (Miyawaki et al., 2004). Adult Hydra: nuclear p-catenin protein and expression of Wnt3, Wnt9/10a, Wnt11, Wnt9/10c, Wnt1, Wnt16, and Wnt7 near the oral pole; Dkk1/2/4 expression in body column (Hob-mayer et al., 2000; Broun et al., 2005; Guder et al., 2006; Lengfeld et al., 2009). Blastula stage Nematostella vectensis (above): animal pole p-catenin protein (Wikramanayake et al., 2003). Planula larva stage Nematostella vectensis (below): expression of WntA, Wnt1, Wnt4, Wnt7 orally, Wnt2 mid-axially, and Dkk1/2/4 aborally (Kusserow et al., 2005; Lee et al., 2006). Larval Amphimedon queenslandica: Wnt expression at pole (Adamska et al., 2007). Photo and drawing credits: C. Brown, N. Putnam, K. Tessmar-Raible, N. Meinkoth, P. Greb, M. Adamska, Southeastern Regional Taxonomic Center, Henry et al., 2008; Schneider and Bowerman, 2007; Yu et al., 2007.
Figure 1. Posterior Wnt Signaling and Anterior Wnt Inhibition in the Metazoa Animals are divided into pre-bilaterians that lack overt bilateral symmetry and bilaterians. Bilaterians are divided into deuterostomes and protostomes, and the latter are further divided into ecdysozoans and lophotrochozoans (Adoutte et al., 2000). Abundant nuclear (3-catenin protein (blue) and Wnt gene expression domains (green) tend to be posterior, whereas Wnt inhibitor gene expression domains (red) tend to be anterior. For simplicity, in most cases only a single developmental stage is shown. (A) Anterior pole, (P) posterior pole, (An) animal pole, (V) vegetal pole, (Ab) aboral pole, (Or) oral pole. Note that in some cases, only the expression of a representative Wnt gene is shown. Early gastrulation stage mouse: cylinder-shaped embryo is depicted as a flattened projection onto two dimensions; (3-catenin protein (blue triangle) and Wnt3 expression are at the prospective primitive streak, and Dkk1 is expressed in the anterior visceral endoderm (Glinka et al., 1998; Liu et al., 1999; Mohamed et al., 2004). Late gastrula stage Xenopus: Xwnt3a, Xwnt8, and Xwntl 1 and nuclear p-catenin protein are posterior and Dkk1/2/4 and sFRP3/4/frzb anterior (Christian and Moon, 1993; McGrew et al., 1997; Glinka et al., 1998; Kiecker and Niehrs, 2001; Schohl and Fagotto, 2002). Zebrafish tailbud stage: wnt8 and wnt3a are posterior and sFRP3/frzb is anterior (Lekven et al., 2001; Shimizu et al., 2005; Thorpe et al., 2005; Tendeng and Houart, 2006). Late gastrula stage amphioxus: Wnt3a and Wnt8 are posterior and Dkk3, Dkk1/2/4, sFRP2-like are anterior. sFRP3/4 and Dkk1/2/4 are also posterior (Yu et al., 2007). Blastula stage sea urchin: vegetal p-catenin protein and Wnt8 (Logan et al., 1999; Wikramanayake et al., 2004). Planaria: Smed-wntP-1, Smed-wntP-2, Smed-wnt11-1 are posterior, Smed-wnt2-1 is in the pre-pharyngeal region, and Smed-sFRP-1 is anterior (Petersen and Reddien, 2008). Cleavage stage Platynereis dumerilii: p-catenin localizes to the vegetal cell of each axial division (Schneider and Bowerman, 2007). Blastula stage Cerebratulus lacteus: vegetal p-catenin protein (Henry et al., 2008). Cleavage stage C. elegans (above): asymmetric localization of WRM-1/р-catenin and SYS-1/р-catenin to the posterior daughters of each axial cell division (Rocheleau et al., 1997; Thorpe et al., 1997; Nakamura et al., 2005; Takeshita and Sawa, 2005; Huang et al., 2007). Larval stage C. elegans (below): //л-44/Wnt, eg/-20/Wnt, and cwn-1/Wnt are posterior (Herman et al., 1995; Coudreuse et al., 2006; Pan et al., 2006). Blastoderm stage Tribolium castaneum: l/iVntA, Wnt1, and Wnt8 are posterior (Bolognesi et al., 2008a). Early segmentation stage Gryllus bimaculatus: w/ng/ess/Wnt and p-catenin protein are in the posterior growth zone and also in the anterior eye-forming zones (36 hr) (Miyawaki et al., 2004). Adult Hydra: nuclear p-catenin protein and expression of Wnt3, Wnt9/10a, Wnt11, Wnt9/10c, Wnt1, Wnt16, and Wnt7 near the oral pole; Dkk1/2/4 expression in body column (Hob-mayer et al., 2000; Broun et al., 2005; Guder et al., 2006; Lengfeld et al., 2009). Blastula stage Nematostella vectensis (above): animal pole p-catenin protein (Wikramanayake et al., 2003). Planula larva stage Nematostella vectensis (below): expression of WntA, Wnt1, Wnt4, Wnt7 orally, Wnt2 mid-axially, and Dkk1/2/4 aborally (Kusserow et al., 2005; Lee et al., 2006). Larval Amphimedon queenslandica: Wnt expression at pole (Adamska et al., 2007). Photo and drawing credits: C. Brown, N. Putnam, K. Tessmar-Raible, N. Meinkoth, P. Greb, M. Adamska, Southeastern Regional Taxonomic Center, Henry et al., 2008; Schneider and Bowerman, 2007; Yu et al., 2007.
Поиск механизмов лежащих в основе формирования осей привел к некоторым сюрпиризам в биологии развития. Напр., открытие консервации позиционной роли для Hox генов подтверждает существование системы формирования паттерна первичной оси, используемой большинством, если не всеми билатерально симметричными животными (Slack et al., 1993). Повсеместность позиционной роли для Hox генов указывает на то, что по мере диверсификации животных, некоторые свойства формирования паттерна первичной оси не стали предметом эволюционных изменений. Однако физические события раннего эмбриогенеза могут варьировать драматически среди животных, затрудняя создание генеральной модели для объяснения, как возникают оси у животных.
Передача сигналов Wnt активно исследовалась в отношении её роли в мириадах онтогенетических событий как у хорошо знакомых модельных организмов, так и у представителей многих филетических групп по всему царству животных. Гены Wnt экспрессируются в задних частях большинства билатеральных животных и экспрессируются поляризованным способом вдоль первичной оси у pre-bilaterians (Figure 1). Кроме того, пертурбации с передачей сигналов Wnt генерируют некоторые из наиболее драматических фенотипов первичной оси, которые открыты (Figure 2). Всё это демонстрирует, что предача сигналов Wnt широко используется в поддержке задних поляризованных признаков вдоль оси голова-хвост.
A Comparative Approach Reveals Central Features of Axis Development Чтобы сравнивать и противопоставлять развитие оси у животных необходимо описание терминов для осевых характеристик. Первичная ось обычно совпадает с рострально-каудальной (голова-хвост) и передне-задней (A-P, фронт-спина) осью, при этом "anterior" и "posterior" наиболее часто используется для описания полярности вдоль первичной оси у билатерально симметричных животных. У большинства видов прежде чем будут установлены личиночная и взрослая формы, эмбрион сам по себе имеет анимально-вегетативную ось. Анимальный полюс маркируется полярными тельцами, тогда как вегетативный полюс часто содержит желток, а зародышевые слои (эктодерма, мезодерма и энтодерма) могут быть специфицированы вдоль анимально-вегетативной оси. Взаимоотношение анимально-вегетативной оси с первичной остью личинок и взрослых может варьировать среди видов, хотя в целом голова формируется в чем-то соответствующем анимальному полюсу, а зад/хвост обычно формируется в ориентации. соответствующей вегетативному полюсу (Martindale, 2005). Следовательно, поляризация эмбрионов вдоль анимально-вегетативной оси может влиять на развитие передне-задней оси.
Ранние физические события формирования оси могут отличаться драматически среди животных; возможно потому, что раннее эмбриональное развитие может осуществляться при очень разных селективных условиях (напр., наружное или внутреннее развитие). Внеэмбиональные ткани у мышей могут влиять на полярность самого эмбриона, тогда как многие др. животные лишены внеэмбриональных тканей вообще. Эмбрионы лягушки Xenopus laevis имеют большое количество желтка и подвергаются сложным перемещениям ткани во время гаструляции (involution). Напротив, во время гаструляции многих др. животных перемещения тканей используются для инвагинации (как у морского ежа и amphioxus) или клеточной ингрессии (как у мышей). Основная ось формирует весь паттерн однажды у плодовой мушки Drosophila, но у большинства др. животных ось формируется постепенно во время формирования паттерна и роста. Более того, у Drosophila, градиенты транскрипционных факторов в синцитии формируют паттерн A-P оси, тогда как этот механизм не происходит у cellularized эмбрионов. Развитие нематоды Caenorhabditis elegans следует по пути воспроизводимых клонов клеток, тогда как многие др. животные обнаруживают более регулятивное развитие, при котором клетки могут замещаться соседними и формируются паттерны крупных регионов из клеток. Поэтому изучение молекулярных механизмов, контролирующих эмбриогенез у этих и др. организмов почти определенно выявит различия в способе создания и формирования паттерна первичной оси.
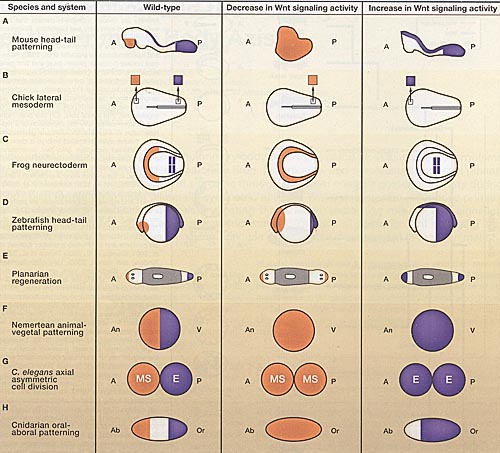 Figure 2. Perturbation of Wnt Signaling Causes Polarized Axial Defects
Regional markers or fates are depicted in orange and purple. A decrease in Wnt activity generally causes expansion of anterior markers and loss of posterior markers. Increase in Wnt activity has the opposite effect. Representative example systems are depicted. Figure 2. Perturbation of Wnt Signaling Causes Polarized Axial Defects
Regional markers or fates are depicted in orange and purple. A decrease in Wnt activity generally causes expansion of anterior markers and loss of posterior markers. Increase in Wnt activity has the opposite effect. Representative example systems are depicted.(A-H) Anterior pole (A), bilaterian animal pole (An), and cnidarian aboral pole (Ab), left. (A) Lateral view. Left, mouse embryo at 8.5 days post-coitus. Markers, Otx2 (orange, forebrain) and brachyury (purple, primitive streak and notochord). Middle, Wnt3 knockout mice fail to gastrulate and remain as a single epithelial sheet at 7.5 days post-coitus (Liu et al., 1999). Right, APC hypomorphic mutant (Ishikawa et al., 2003). (B) Dorsal view. Left, chick embryo mesoderm at stage 5 from which tissues were removed (small boxes within mesoderm) and grown as tissue explants (larger boxes above). Markers, Nkx-2.5 (orange, heart muscle) or globin (purple, embryonic blood); primitive streak, black line. Middle, overexpression of Dkk1 in posterior lateral mesoderm explants. Right, overexpression of Wnt3a and BMP4 in anterior lateral mesoderm explants (Marvin et al., 2001). (C) Dorsal view. Left, neurula stage frog. Markers, Bf1 (orange, prospective forebrain) and Krox20 (purple, prospective hindbrain). Middle, XDkkl or Xfrzb1 overexpression. Right, Xwnt8 overexpression (Kiecker and Niehrs, 2001). (D) Lateral view. Left, zebrafish embryo from 90% epiboly to tailbud stages. Markers, Otx2 or anf/Hesx1 (orange, forebrain), cdxla (purple, posterior mesoderm) (Kim et al., 2000; Shimizu et al., 2005). Middle, injection of morpholinos targeting wnt3a and wnt8 (Shimizu et al., 2005). Right, injection of wnt3a mRNA caused an increase in cdxla expression (Shimizu et al., 2005) and the headless/Tcf loss-of-function mutation caused loss of anf/Hesx1 expression (Kim et al., 2000). (E) Dorsal view. Left, planarian after 14 days of regeneration following removal of head and tail. Markers, sFRP-1 (orange, anterior pole), frizzled-4 (purple, posterior pole), regenerated tissue (white), and pre-existing tissue (gray). Middle, RNA interference (RNAi) knockdown of β-catenin-1 (Gurley et al., 2008; Igiesias et al., 2008; Petersen and Reddien, 2008). Right, RNAi knockdown of APC-1 (Gurley et al., 2008). (F) Left, nemertean worm embryo at late blastula stage. Markers, prospective ectoderm (orange) and prospective endoderm (purple) as determined by lineage observation. Middle, morpholino-mediated knockdown of β-catenin. Right, overexpression of dominant-negative GSK-Зβ (Henry et al., 2008). (G) Left, C. elegans progeny of EMS cell at the 4-cell stage. Markers, presumptive mesoderm daughter cell (orange, MS) and presumptive endoderm cell (purple, E) as determined by lineage observation. Middle, loss-of-function mutations in mom-2/Wnt or wrm-1/β-catenin (Rocheleau et al., 1997; Thorpe et al., 1997). Right, loss-of-function mutation in рор-7/Tcf (Lin et al., 1995). (H) Left, blastula stage cnidarian Clytia hemisphaerica. Markers, CheBra (purple, prospective oral pole) and CheFoxQ2a (orange, prospective aboral pole). Middle, inhibition of Wnt3 by morpholino injection. Right, overexpression of Wnt3 by mRNA injection (Momose et al., 2008).
Как можно примирить разные события раннего эмбриогенеза животных, по-видимому, со сходной голова-хвост архитектурой тела, и доменами экспрессии Hox? Вполне возможно, что clade-специфические процессы способствуют возникновению в консервативных молекулярных процессов. С помощью сравнения аксиального развития у разных видов, могут выявляться законсервированные механизмы (De Robertis, 2008). Идентификация законсервированных механизмов может выявить некоторые фундаментальные механизмы, с помощью которых большинство, если не все, животные формируют паттерн. Кроме того. интерпретация сложных фенотипических отклонений облегчает идентификацию единых принципов, полученных у разных организмов. Напр., разнообразные фенотипические последствия пертурбаций Hox генов обнаруживают общие принципы, что гены Hox контролируют формирование позиционного паттерна.
Идентификация консервативной роли передачи сигналов bone morphogenetic protein (BMP) в dorsal-ventral (D-V) полярности у Drosophila и Xenopus представляет важный и информативный пример разграничения между консервативным и clade-специфическим механизмами формирования паттерна оси (De Robertis and Sasai, 1996). Широкое использование передачи сигналов BMP в формировании дорсо-вентрального паттерна у животных, находится в пределах от позвоночных (Khokha et al., 2005) до планарий (Molina et al., 2007; Orii and Watanabe, 2007; Reddien et al., 2007), это разительны пример сходства в развитии плана тела. Напротив, механизмы, используемые для установления дорсо-вентральной асимметрии активности BMP, могут быть разными. У лягушек оплодотворение ооцита вызывает кортикальную ротацию и активацию β-catenin оппозитно точке проникновения спермия, что приводит к дорсальному установлению организатора Шпемана. Организатор испускает BMP ингибирующие белки (De Robertis,
2006). В противоположность тому, как передача сигналов BMP оказывается поляризующей у Xenopus, у Drosophila Toll-Dorsal сигнальный путь приводит к дорсальной активности градиента BMP-подобного Decapentaplegic (Dpp) белка (Moussian and Roth, 2005). Система Toll-Dorsal не регулирует D-V полярность в др. филетических группах. Следовательно, хотя градиент активности BMP вдоль D-V оси, по-видимому, высоко консервативен, механизмы, которые устанавливают градиенты BMP вдоль D-V оси могут быть очень отличными.
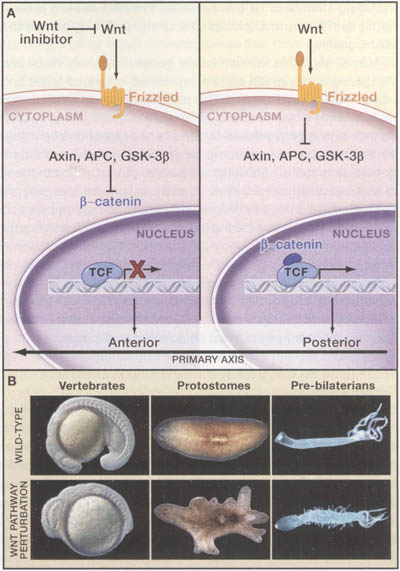 Figure 3. Wnt Signaling Controls Polarized Aspects of the Primary Axis
Figure 3. Wnt Signaling Controls Polarized Aspects of the Primary Axis (A) The primary axis is typically polarized such that a head (in the anterior) and a tail (in the posterior) are found at opposite poles. Posterior canonical Wnt signaling and frequently anterior Wnt inhibition occur in animals throughout the Bilateria. Wnt signaling is also polarized along the primary axis of pre-bilaterians. In some animals, posterior pathway activation controls the patterning of large regions and in others it controls other polarized events such as asymmetric cell division.
(B) Wnt pathway perturbation causes primary axis defects throughout the Metazoa. Left, wnt3a and wnt8 inhibition caused head enlargement and tail development failure in zebrafish (Shimizu et al., 2005, reprinted with permission from Elsevier). Middle, Smed-ficatenin-1 RNA interference causes ectopic head formation in planarians (Gurley et al., 2008; Iglesias et al., 2008; Petersen and Reddien, 2008). Right, |3-catenin overactivation with GSK-3p inhibition caused ectopic tentacle formation in Hydra (Broun et al., 2005, reproduced with permission of the Company of Biologists). Anterior or aboral pole, left. Wnt Signal Transduction В каноническом пути Wnt белки активируют β-catenin белки (Figure ЗА; rev. Logan and Nusse, 2004). Wnts соединяются с Frizzled рецепторами, приводя к смягчению пути ингибирования, вызываемого с помощью GSK-3β, APC и Axin белков. Это стабилизирует β-catenin и способствует его транслокации в ядро, где он регулирует транскрипцию генов-мишеней вместе с Tcf/Lef белками. Хлорид лития ингибирует GSK-Зβ и поэтому обычно используется, чтобы активировать эктопически путь в организмах, лишенных альтернативных способов генетических нарушений. Напротив, внеклеточные секретируемые молекулы, включая членов семейства секретируемых белков Frizzled-related protein (sFRPs) и Dickkopf-like proteins (Dkk), могут ингибировать передачу сигналов Wnt.
Геномы животных содержат много генов, кодирующих Wnts и Wnt антагонисты, которые могут быть экспрессированы в разное время и в разных местах во время развития. Такая сложность затрудняет анализ. Напр., место активности для β-catenin не всегда можно предсказать по месту экспрессии определенных Wnts. Репортерные конструкции для пути активности могут быть хорошим способом уточнения знания о месте действия Wnt во многих примерах, цитируемых ниже. Кроме того, фенотипы, вызываемые избыточной активацией или ингибированием β-catenin могут быть сложными и плейотропными. Наконец, сравнение роли Wnts у разных организмов осложняется если неизвестны ортологи. Напр., некоторые Wnt белки действуют независимым от β-catenin способом, это неканоническая передача сигналов Wnt signaling. Мы будем обсуждать только каноническую β-catenin-зависимую передачу сигналов Wnt. Wnt Signaling Controls A-P Patterning in Diverse Deuterostomes
Наблюдения над различными вторичноротыми (включая лягушек, рыб, млекопитающих, птиц, amphioxus и иглокожих) выявляют эффекты передачи сигналов Wnt или активность β-catenin в многочисленных аспектах полярности первичной оси (Kiecker and Niehrs, 2001; Holland, 2002; Niehrs, 2004). Эксперименты на нейроэктодерме Xenopus проиллюстрировали роль передачи сигналов Wntв задней части и ингибирование Wnt в передней части при формировании A-P паттерна, это открывает возможность, что Wnts могут быть важными общими posteriorizing факторами (Kiecker and Niehrs, 2001). A-P Patterning of Neurectoderm Нейроэктодерма Xenopus распространяется на всю длину развивающейся эмбриональной первичной оси и дает ткани предшественники для переднего, среднего, заднего мозга и спинного мозга на ст. поздней гаструлы. Возникновение спинного мозга, туловища и хвоста происходит позднее во время роста каудального конца эмбриона. Усиление передачи сигналов Wnt может толкать клетки нейроэктодермы в направлении приобретения задних характеристик (Figure 2C) (Christian and Moon, 1993; Fredieu et al., 1997; Kiecker and Niehrs, 2001), а снижение передачи сигналов Wnt может толкать клетки в направлении передних качественных особенностей (Figure 2C) (Leyns et al., 1997; Wang et al., 1997; Glinka et al., 1998; Kiecker and Niehrs, 2001). Из-за ранней роли β-catenin в формировании организатора некоторые ключевые эксперименты вызывали пертурбации Wnt после образования организатора, но во время формирования паттерна нейроэктодермы. На этой ст. поздней гаструлы Wnts продуцируются в задних частях, ингибиторы Wnt продуцируются в передних частях эмбриона и существует задне-передний градиент ядерной активности β-catenin и Tcf-репортерной активности (Figure 1) (Christian and Moon, 1993; McGrew et al., 1995; Leyns et al., 1997; McGrew et al., 1997, 1999; Glinka et al., 1998; Kiecker and Niehrs, 2001; Schohl and Fagotto, 2002).
Данные по рыбкам данио показывают, что формирование паттерна нейроэктодермы с помощью Wnts не отражает специфичных для лягушек инноваций. Wnts экспрессируются сзади на ст. ранней гаструлы, хвостовой почки и сомитов, а ингибитор Wnt экспрессируется в передней нейроэктодерме начиная со стадии хвостовой почки (Figure 1) (Kelly et al., 1995; Lekven et al., 2001; Shimizu et al., 2005; Tendeng and Houart, 2006). Избыточная активация передачи сигналов Wnt у мутантных headless рыбок данио, которые лишены функции Tcf3, приводит к передним дефектам-отсутствию глаз, переднего и среднего мозга (Figure 2D) (Kim et al., 2000). Напротив, ингибирование генов Wnt genes вызывает задние дефекты (такие как увеличение головы и неспособность формировать заднюю мезодерму и поддерживать рост хвостовой почки) (Erter et al., 2001; Lekven et al., 2001; Rhinn et al., 2005; Shimizu et al., 2005; Thorpe et al., 2005). Всё это подтверждает модель формирования паттерна нейроэктодермы у лягушек и рыб, у которых домены внутри поля клеток приобретают передние в противовес задним качественные характеристики в соответствии с локальным уровнем передачи сигналов Wnt (Kiecker and Niehrs, 2001). An Early β-catenin Function Impacts Later Axis Development in Frogs and Fish Каково значение ориентации передачи сигналов Wnt при формировании паттерна нейроэктодермы? Помимо роли для A-P развития нейроэктодермы передачи сигналов Wnt, роль β-catenin также хорошо известна в раннем эмбриогенезе, которая влияет на развитие D-V оси у Xenopus и рыбок данио. Предоставляемый матерями β-catenin играет важную роль в установлении Шпемановского организатора у Xenopus. После оплодотворения кортикальная ротация вызывает локализацию материнского белка β-catenin в ядрах клеток, которые оказываются на проспективной дорсальной стороне эмбриона, противоположно точке проникновения спермия (Schneider et al., 1996; Larabelletal., 1997). Внутри этой области β-catenin способствует образованию Шпемановского организатора. Т.о., любой эксперимент, который нарушает активность β-catenin на этих ранних стадиях (до гаструляции) д. вызывать дефекты, ассоциированные с изменением активности Шпемановского организатора. Результаты таких пертурбаций сказываются на D-V оси. Напр., раннее ингибирование β-catenin в конечном счета нарушает образование дорсальной ткани из-за потребности в Шпемановском организаторе для генерации дорсальной ткани (Heasman et al., 1994). Напротив, избыточная активаци действия β-catenin в раннем развитии (напр., с помощью lithium chloride) приводит к dorsal-anteriorized эмбрионам из-за увеличенного организатора (Kao and Elinson, 1988). Позднее, после mid-blastula перехода, когда начинается экспрессия зиготических генов, становится очевидной роль β-catenin (в канонической передаче сигналов Wnt) в формировании паттерна A-P ткани. Поэтому в зависимости от стадии развития, эксперименты, которые нарушают активность β-catenin, могут затрагивать закладку как D-V, так и A-P оси у Xenopus. Имеются также доказательства у Xenopus сигнальной интеграции между Wnts и BMPs для скоординированного формирования осевого паттерна ортогональных A-P и D-V осей (Fuentealba et al., 2007).
Какие аспекты передачи сигналов Wnt и активности β-catenin законсервированы у др. организмов? Имеется ли ориентация передачи сигналов в отношении одной или др. оси животного, регионализация нейроэктодермы или просто общая поляризация регионов эмбриона? Роль по воздействию на D-V поляризацию β-catenin, или передачи сигналов Wnt, не столь широко наблюдается у животных. Простейшим мнением является то, что ранняя роль β-catenin у Xenopus не отражает эволюционно законсервированной роли в дорсализации. A-P Axiat Patterning of Multiple Tissues Затрагивает ли передача сигналов Wnt формирование А-Р паттерна A-P множественных тканей? В ранней мезодерме вследствие гаструляции сердце происходит из передней латеральной мезодермы, а эмбриональная кровь возникает из задней части латеральной мезодермы. Ингибирование Wnt у кур способствует образованию сердца в передней, а активация Wnt способствует образованию эмбриональной крови в задней части (Figure 2B) (Marvin et al., 2001). Более того ингибирование β-catenin в задней энтодерме у Xenopus вызывает образование зачатков эктодермальных органов, которые экспрессируют маркеры ранней передней кишки, печени и поджелудочной железы. Напротив, активация передачи сигналов Wnt в передней энтодерме элиминирует экспрессию маркеров передней кишки и расширяет экспрессию маркера средней кишки (McLin, et al., 2007; Li et al., 2008). Прежде постериоризующей активности Wnt и антериоризующего ингибирования Wnt затрагивается поляризация многих типов тканей. Primагу Axis Development in Mice Передача сигналов выполняет множественные роли в продукции и формировании паттерна первичной оси мыши, некоторые из которых обнаруживают сходство с формированием А-Р паттерна нейроэктодермы у лягушек и рыб. Два эмбриональных свойства соответствуют передней и задней частям: (1) передняя висцеральная энтодерма (сформированная 5.5 день после зачатия) маркирует будущий передний полюс и (2) первичная полоска (формируемая в начале 6.5 дня post-coitum) является местом гаструляции и маркирует будущий задний полюс. Передняя висцеральная энтодерма экспрессирует Wnt ингибитор Dkk1 (Glinka et al., 1998). Напротив, экспрессия Wnt3, высокие уровни β-catenin и экспрессия TCF-чувствительного промотора выявляются на месте образование первичной полоски в задней части эмбриона (Figure 1) (Liu et al., 1999; Mohamed et al., 2004).
Wnt3 и β-catenin нокаутные мыши неспособны формировать первичную полоску (Figure 2A) (Haegel et al., 1995; Liu et al., 1999; Huelsken et al., 2000), тогда как нокаут Wnt ингибитора Dkk1 приводит к укорочению передней части (Mukhopadhyay et al., 2001). Многочисленные эксперименты показали, что эктопическая активация передачи сигналов Wnt вызывает переднее укорочение и экспансию или бифуркацию первичной полоски, приводящих к частичным удвоениям осевых структур (pperl et al., 1997; Zeng et al., 1997; Ishikawa et al., 2003; rrill et al., 2004). Эти исследования показывают, что формирование головы в передней части и первичной полоски в задней регулируется с помощью локального уровня передачи сигналов Wnt. Таким образом, роль Wnt в раннем развитии голова-хвост у эмбрионов мыши следует рассматривать, как сходное с формированием А-Р паттерна в яйце. Однако, поскольку существуют многочисленные различия в механизмах гаструляции между млекопитающими и амфибиями, то трудно решить на основании только этих двух clades, что это сходство в позиционном использовании передачи сигналов Wnt представляет настоящее наблюдение механизмов, контролирующих оси. Prmагу Axis Polarity in Basal Deuterostomes Изучение передачи сигналов Wnt у основных deuterostomes (Figure 1) может помочь определить, действительно ли осевые роли передачи сигналов Wnt, наблюдаемые у позвоночных, являются результатом консервации родоначальных условий или они возникли независимо. β-catenin контролирует поляризацию вдоль анимально-вегетативной оси у морского ежа (echinoderms), где он активен на вегетативном полюсе (kramanayake et al., 1998, 2004; Logan et al., 1999). Эктодерма возникает из анимального полюса морского ежа, а энтодерма и мезодерма возникают из вегетативного полюса. Избыточная активация β-catenin дает vegetalized эмбрионы с эктопической энтодермой, тогда как ингибирование передачи сигналов Wnt предупреждает формирование энтодермы. Морские ежи лишены распознаваемой оси голова-хвост, это затрудняет сравнение ориентации передачи сигналов Wnt у этих организмов с др. вторичноротыми; однако голова у др. животных часто возникает на анимальном полюсе (Martindale, 2005). Асцидии (urochordates) и морские звезды (echinoderms) являются дрю базовыми вторичноротыми, которые обнаруживают локализованный в ядре β-catenin на вегетативном полюсе (Imai et al., 2000; Miyawaki et al., 2003). Роль β-catenin белков в ранней анимально-вегетативной поляризации обнаруживается у многих организмов, при этом β-catenin локализуется на вегетативном полюсе, по крайней мере, у некоторых базовых вторичноротых и первичноротых, и локализуется на анимальном полюсе у pre-bilaterian кишечнополостных (Figure 1). Однако некоторые вторичноротые не обнаруживают четкого расположения β-catenin в отношении анимально-вегетативной оси. Напр., вследствие кортикальной ротации у Xenopus, β-catenin располагается дорсально в месте инициации гаструляции и необходим для дорсализации мезодермы, но он не нужен для формирования энтодермы, формирования мезодермы или гаструляции (Heasman et al., 1994; Schneider et aL, 1996).
Cephalochordates (amphioxus) являются базовыми хордовыми. У этих видов, бластопор (расположенный на вегетативном полюсе) маркирует проспективный задний конец эмбриона. Ядерный β-catenin присутствует и некоторые Wnts экспрессируются сзади вокруг бластопора, хотя более слабое окрашивание на ядерный β-catenin обнаруживается в передней части эктодермы (Figure 1) (Holland et al., 2005; Yu et al., 2007). Кроме того, Wnt антагонисты экспрессируются в передней части, хотя оба также экспрессируются сзади (Yu et al., 2007). Избыточная активация β-catenin у amphioxus (с помощью lithium chloride) вызывает очевидную потерю нервной пластинки и постериоризацию (Holland et al., 2005; Onai et al., 2009). Эти данные указывают на то, что β-catenin выполняет консервативную роль в обеспечении развития A-P оси скорее, чем в контроле D-V оси (Holland, 2002). Итак, данные по базовым вторичноротым указывают на интригующую возможность, что активность β-catenin и передача сигналов Wnt могут в целом действовать, чтобы поляризовать ранние эмбрионы и формировать паттерна первичной оси (Holland, 2002; Yu et al., 2007). Trunk and Tail Outgrowth У большинства животных формирование инициальной оси и формирование паттерна вдоль оси сопровождаются периодом развития туловища и хвоста в задней части. Wnts действуют вслед за инициацией гаструляции в задней части эмбриона мыши, чтобы сформировать и организовать паттерн мезодермы туловища и хвоста. На 7.5 день post-coitum, экспрессия Wnt3 снижается и Wnt3a начинает экспрессироваться в первичной полоске. Спонтанный гипоморфный аллель Wnt3a, vestigial tail, вызывает отсутствие хвоста, а у Wnt3a нулевых животных отсутствует хвостовая почка и сомиты ниже уровня передних конечностей (Takada et al., 1994). Когда эмбрион растет кзади, то сложный механизм контролирует время и формирование паттерна сомитов в туловище и хвосте (Dubrulle and Pourquie, 2004). Имеется задне-передний градиент ядерного β-catenin в растущем хвосте, а Wnt3a детерминирует передне-заднюю позицию фронта детерминации сомитов (Aulehla et al., 2008; Dunty et al., 2008).
Продолжающееся использование передачи сигналов Wnt в задней части для формирования туловища и хвоста, по-видимому, широко распространено (Martin and Kimelman, 2009). Напр., передача сигналов Wnt участвует в развитии хвоста у рыбок данио (Agathon et al., 2003; Shimizu et al., 2005; Thorpe et al., 2005), и некоторые Wnt гены экспрессируются во время заднего роста хвостовой почки amphioxus во время личиночного развития (Schubert et al., 2001). Эти данные показывают, что многие животные могут использовать передачу сигналов Wnt в задней части в фазе роста туловища/хвоста и в формировании паттерна после инициального установления полярности оси голова-хвост. Wnt Signaling Controls A-P Tissue Identity in Protostomes Хотя данные по вторичноротым указывают на то, что передача сигналов Wnt signaling играет важную общую роль в создании поляризованных A-P признаков, имеется множество возможных интерпретаций данных. Напр., возможно, что некоторые дефекты, вызываемые пертурбациями Wnt, отражают роль Wnt signaling/β-catenin в процессе появления поляризованных мест на проспективной A-P оси (такого как спецификация энтодермы, гаструляция или рост) скорее, чем роль в регуляции A-P полярности per se. Кроме того, передача сигналов Wnt может быть использована независимо, чтобы выполнять цели формирования эмбрионального паттерна у изученных вторичноротых. Дальнейшее исследование случаев, описанных выше важно для выяснения роли Wnts у каждого из организмов. Однако исследование передачи сигналов Wnt у отдаленно родственных первичноротых (которые дивергировали от вторичноротых 500 миллионов лет тому назад) позволяет оценить альтернативные объяснения для фенотипов, ассоциированных с нарушениями Wnt. Поскольку специфические физические процессы д. отличаться по природе и позиции или даже не происходить вообще у отдаленно родственных животных, сходства и различия в роли передачи сигналов Wnt могут помочь сделать различия между моделями передачи сигналов Wnt в развитии оси. Повсеместные позиционные аспекты фенотипов Wnt, напр., подтверждают модель передачи сигналов Wnt в контроле A-P полярности. Ниже будут представлены данные по двум главным группировкам типа protostome, Lophotrochozoa и Ecdysozoa (Figure 1). A-P Polarity in Planarians Планарии являются пресноводными плоскими червями, членами Lophotrochozoa, и знамениты своей способностью регенерировать голову или хвост после поперечного рассечения (Reddien and Sanchez Alvarado, 2004). Благодаря своей способности восстанавливать осевые характеристики при регенерации планарии представляют собой систему, с помощью которой открыты свойства осевой поляризации, которая не зависит от сложных тканевых перемещений и онтогенетических событий, которые скоординировано происходят во время гаструляции. 5 из 9 генов Wnt планарий экспрессируются в доменах вдоль A-P оси, преимущественно в задней части, а ген, подобный ингибитору Wnt, экспрессируется на переднем полюсе (Figure 1) (Petersen and Reddien, 2008).
RNA interference гена β-catenin у планарий S. mediterranea ведет к регенерации обращенных кзади голов скорее, чем хвостов, указывая, что β-catenin планарий контролирует решение детерминации хвоста в противовес голове в ранах обращенных кзади (Figure 2E) (Gurley et al., 2008; Iglesias et al., 2008; Petersen and Reddien, 2008). Интактные планарии постоянно поддерживают свои тела во время гомеостаза. Ингибирование β-catenin-1 заставляет интактных животных случайно формировать эктопические головы, указывая на потребность в β-catenin-1 для поддержания A-P осевых характеристик (Figure 3B). Ингибирование β-catenin-ингибирующего APC-подобного гена ведет к регенерации хвоста из ран, обращенных вперед (Gurley et al., 2008), указывая тем самым, что характеристики голова-или-хвост являются бинарным выбором, контролируемым с помощью высокой активности β-catenin в ранах, обращенных кзади и с помощью низкой активности β-catenin в ранах обращенных вперед. Wnt гены необходимы для этого процесса полярности (Adell et al., 2009; Petersen and Reddien, 2009). Итак, эти результаты согласуются с гипотезой, что передача сигналов Wnt в задней части и ингибирование Wnt в передней присутствует у родоначальников билатерально симметричных животных и является законсервированным свойством формирования осевого паттерна у первичноротых и вторичноротых. Тот факт, что планарии используют этот путь при регенерации A-P оси независимо от сложности раннего развития ещё больше подтверждает возможное существование общей роли передачи сигналов Wnt в регуляции позиционные характеристик скорее, чем единственной общей роли в регуляции какого-либо специфического процесса. β-catenin Can Control Animal-Vegetal Identity in Protostomes Контролирует ли β-catenin ранние эмбриональные аспекты развития оси у первичноротых? У непрямо развивающегося nemertean червя Cerebratulus lacteus (lophotrochozoans, Figure 1), личиночная анимально-вегетативная ось соответствует направлению движений к оси голова-хвост у большинства др. животных (Henry et al., 2008). Green fluorescent protein-нагруженный β-catenin обнаруживает наивысшее скопление в 4-х наиболее vegetal клетках на 64-клеточной стадии (Figure 1). Morpholino нокдаун β-catenin вызывает animalization раннего эмбриона (vegetal судьбы гаструляции и формирования энтодермы, а структуры анимального полюса расширены). Напротив, избыточность функции β-catenin вызывает vegetalization (Figure 2F) (Henry et al., 2008). Следовательно, β-catenin, по-видимому, способствует выбору vegetal в противоположность animal судьбе. Это наблюдение напоминает наблюдаемую роль β-catenin на вегетативном полюсе у морского ежа. После метаморфоза основная ось тела взрослого Cerebratulus является ортогональной по отношению к личиночной animal-vegetal оси и поскольку личинки лишены головного мозга, то неизвестно действительно ли это соответствует bilaterian A-P оси. Однако эти данные иллюстрируют, что у удаленно родственных первичноротых, β-catenin скорее всего участвует в поляризации ранней эмбриональной оси. Axial Asymmetric Cell Divisions В отличие от большинства др видов развитие нематоды C. elegans (члена ecdysozoans; Figure 1) происходит посредством высоко воспроизводимого клеточного клонирования скорее, чем формирования паттерна тканевых полей. Несмотря на это различие в развитии экспрессируемые сзади Wnt гены контролируют принятие задних в противовес передним онтогенетических решений во время эмбрионального и постэмбрионального развития C. elegans. Во время эмбриональных A-P асимметричных клеточных делений два β-catenins (WRM-1 и SYS-1) располагаются в задней дочерней клетке (Figure 1) (Nakamura et al., 2005; Takeshita and Sawa, 2005; Huang et al., 2007). Хорошо изученные клеточные деления на ст. 4-х клеток показали, что задняя P2 клетка секретирует МОМ-2/Wnt, чтобы контролировать асимметричное деление соседней EMS клетки, двая в результате переднюю дочернюю клетку (MS), которая образует мезодерму и заднюю дочернюю клетку (E), которая формирует энтодерму. Потеря функции mom-2/Wnt или wrm-1/β-catenin заставляет заднюю E клетку принимать переднюю судьбу формирования мезодермы (Figure 2G) (Rocheleau et al., 1997; Thorpe et al., 1997). Напротив, потеря функции pop-V Tcf репрессора заставляет переднюю MS клетку воспринимать заднюю судьбу формирования энтодермы (Lin et al., 1995). Следовательно, экспрессируемые сзади Wnt гены контролируют заднюю в противовес передней судьбу клетки на ст. 4-х клеток.
Экспрессируемые сзади Wnt гены продолжают регулировать A-P асимметричные клеточные деления во время постэмбрионального развития также. Экспрессия трех из пяти C. elegans Wnt гомологов-lin-44/Wnt, egl-20/Wnt, and cwn-1/Wnt-локализуются на заднем конце животного со ст. позднего эмбриогенеза в течение всего личиночного развития (Figure 1) (Herman et at., 1995; Coudreuse et al., 2006; Pan et ah, 2006) и могут контролировать A-P полярность аксиальных асимметричных клеточных делений (Herman and Horvitz, 1994; Goldstein et al., 2006). Экспрессируемые сзади Wnt гены также контролируют др. клеточные процессы, которые поляризованы вдоль первичной оси C. elegans, включая миграцию кзади нейробластов, A-P рост аксонов (rev. Silhankova and Korswagen, 2007) и заднее ингибирование образования синапсов моторными нейронами (Klassen and Shen, 2007). Эти данные показывают, что show Wnt гены, экспрессируемые сзади контролируют множественные A-P поляризованные клеточные события у C. elegans.
Передача сигналов Wnt также контролирует осевые асимметричные клеточные деления у аннелид Platynereis dumerilii (членов Lophotrochozoa; Figure 1). β-catenin асимметрично локализуется вдоль анимально-вегетативной оси, так что наивысшие уровни присутствуют в вегетативной дочерней клетке при каждом клеточном делении (Figure 1) (Schneider and Bowerman, 2007). Избыточная активация β-catenin заставляет animal дочерние клетки, возникающие при аксиальных клеточных делениях, воспринимать vegetal судьбы, указывая тем самым, что β-catenin способствует приобретению характеристик non-animal-полюса во время аксиальных асимметричных клеточных делений. Развитие Platynereis является непрямым с эмбриогенезом, продуцирующим trochophore личинку, которая позднее подвергается метаморфозу, чтобы сформировать взрослого червя. Поскольку анимальный полюс большинства животных связан с формированием головы и поскольку head-подобные клетки образуются на animal конце личинки Platynereis (Schneider and Bower-man, 2007), поэтому роль β-catenin в A-V полярных клеточных делениях может быть сходной с его ролью в A-P полярных клеточных делениях у C. elegans.
Роль передачи сигналов Wnt у C. elegans и Platynereis , по-видимому, отличается от таковой у др. изученных видов тем, что вовлекается в контроль полярности индивидуальных клеточных делений в противовес широко контролируемому наделению задними качественными характеристиками тканевых регионов. Одна из возможностей заключается в том, что C. elegans и Platynereis развивают производную версию поляризующей роли β-catenin, при этом она активна в vegetal или задних клетках в большинстве асимметричных делений в противовес формированию паттерна крупных клеточных регионов (Schneider and Bowerman, 2007). Несмотря на эти различия, сходная роль в контроле поляризованных событий на первичной оси в целом и способствование задним характеристикам в частности бросается в глаза. По крайне мере, в случае C. elegans, др. процессы, такие как рост аксонов, миграция клеток и формирование синапсов испытывают влияние позднее от заднего источника Wnts. Эти данные подтверждают мнение, что во время эволюции передача сигналов Wnt используется разными способами у разных метазоа, чтобы контролировать задние позиционные характеристики A-P поляризованных событий. Posterior Growth in Protostomes
На первый взгляд насекомые могут казаться исключением из гипотезы повсеместности Wnt регуляции формирования паттерна A-P оси, поскольку отсутствуют четкие доказательства такой роли у Drosophila. Наиболее охарактеризована роль передачи сигналов Wnt при развитии первичной оси у Drosophila в отношении Wingless/Wnt и повторяющегося A-P тканевого паттерна во время сегментации вдоль первичной оси, wingless экспрессируется в задней части каждого парасегмента, а мутанты wingless обнаруживают дефекты сегментной полярности (Nusslein-Volhard and Wieschaus, 1980). Drosophila является насекомым с длинным зародышевым диском, при этом все сегменты тела формируются одновременно и подвергаются необычному способу формирования оси, инициируемому градиентами транскрипционных факторов внутри синцитиальной бластодермы. Многие др. артроподы, такие как жук Tribolium castaneum, сверчок Gryllus bimaculatus или паук Achaearanea tepidariorum, формируют короткий или промежуточный зародышевый диск, при этом передние сегменты специфицируются до гаструляции, а задние сегменты специфицируются во время последующего заднего роста.
Данные по многим членистоногим указывают на роль Wnt для заднего роста и развития. Три Tribolium Wnt гена экспрессируются на заднем полюсе на ст. ранней бластодермы (Bolognesi et al., 2008a). Кроме того, Wnt гены экспрессируются в задней ростовой зоне у Gryllus, Tribolium и Achaearanea (Figure 1). Нокдаун armadillo/β-catenin у Gryllus, WntS/D у Tribolium или Wnt8 у Achaearanea, вызывает дефекты заднего роста (Miyawaki et al., 2004; Bolognesi et al., 2008b; McGregor et al., 2008). Следовательно, передача сигналов Wnt может контролировать задний рост у членистоногих. Существует сходная экспрессия генов для caudal, even-skipped и brachyury в задней ростовой зоне annelid Platynereis и позвоночных (de Rosa et al., 2005). Это говорит в пользу того, что фаза заднего роста, контролирующая развитие задней части тела широко законсервирована у Bilateria (de Rosa et al., 2005; Martin and Kimelman, 2009). Механизмы, с помощью которых передача сигналов Wnt контролирует формирование задней части тела у членистоногих и др. организмов, станут важной областью будущих исследований.
Итак, роль передачи сигналов β-catenin и Wnt у protostomes касается поддержания и регенерации оси голова-хвост, анимально-вегетативной поляризации ранних эмбрионов, асимметричных клеточных делений, миграции клеток, роста аксонов, формирования синапсов и рост и развитие задней части тела. Во всех этих случаях Wnts и/или β-catenin активны в задней или вегетативной ориентации. Следовательно, передача сигналов β-catenin и Wnt может влиять на самые ранние события анимально-вегетативной поляризации у protostomes, а также позднее на события A-P поляризации. Эти наблюдения обнаруживают сходства в роли по ориентации и поляризации для передачи сигналов Wnt или активности β-catenin с наблюдениями у deuterostomes, описанными выше. Разнообразие онтогенетических стадий и физических процессов под действием передачи сигналов Wnt и/или активности β-catenin затрудняют идентификацию одного родоначального и консервативного процесса, контролируемого этим путем. Одна из возможностей заключается в том, что поляризованный путь активности вдоль первичной оси представляет собой родоначальное состояние и что по мере диверсификации животных множественные процессы независимо начинают подчиняться контролю поляризованной передачи сигналов Wnt или активности β-catenin. Wnt Signaling Controls Axial Identity in Pre-Bilaterians Базовые матазоа, такие как кишечнополостные и губки дивергировали от bilaterians более 500 миллионов лет тому назад и лишены билатеральной симметрии. Эксперименты с этими животными могут помочь в идентификации онтогенетических механизмов у родоначальников всех bilaterians. Напр., anthozoan морская анемона Nematostella vectensis может служить модельной системой для изучения глубоко законсервированных процессов в эволюции животных (Putnam et al., 2007). Какова роль передачи сигналов Wnt и активности β-catenin в построении плана тела этих pre-bilaterians? β-catenin and Wht Signaling Control Animal-Vegetal Axis Polarity in Cnidarians Кишечнополостные имеют первичную ось, oral-aboral ось, с четкой радиальной симметрией вокруг неё. Такая анатомия позволяет анализировать развитие оси у животных служащих в качестве ответвления к bilaterians. Поскольку кишечнополостные лишены многих признаков первичной оси bilaterian (напр., распознаваемого головного мозга), трудно удостовериться в связи между первичной остью членистоногих и первичной осью bilaterian. Сравнение паттернов экспрессии генов, однако, указывает на то, что oral-aboral ось кишечнополостных может быть сходной с передне-задней осью bilaterian. Ротовой конец оси кишечнополостных возникает на анимальном полюсе, а aboral конец появляется на вегетативном полюсе.
Ядерный β-catenin обилен вблизи места гаструляции на анимальном полюсе кишечнополостных (Wikramanayake et al., 2003; Momose et al., 2008). У кишечнополостных происходит гаструляция и энтодерма формируется на анимальном полюсе, тогда как эктодерма происходит из вегетативного полюса (Martindale, 2005). Ингибирование β-catenin у Nematostella с помощью доминантно-негативной конструкции вызывает дефекты в процессах появления анимального полюса (гаструляция и формирование энтодермы) (Wikramanayake et al., 2003). Напротив, избыточная активация β-catenin с помощью воздействия lithium chloride у Nematostella вызывает очевидную экспансию энтодермы, происходящей из анимального полюса (Wikramanayake et al., 2003). Сходные наблюдения были проделаны с гидроидной медузой Clytia hemisphaerica. Morpholino нокдаун Clytia Wnt3 ведет к потере ротовых тканевых характеристик и к экспансии aboral ткани (Figure 2H) (Momose et al., 2008). Избыточная экспрессия Wnt3 у Clytia вызывает экспансию animal/ oral тканевых характеристик за счет vegetal/aboral характеристик (Momose et al., 2008). Вместе эти результаты указывают на то, что Wnts/β-catenin контролируют animal-vegetal поляризацию в эмбриогенезе cnidarian. Эти данные напоминают локализацию на вегетативном полюсе β-catenin у морского ежа (базового deuterostome) и у немертин плоских червей (lophotrochozoan), описанных выше, но в противоположной ориентации. Возможно, что анимально-вегетативная поляризация β-catenin представляет родоначальное состояние для bilaterians, и что его ориентация по отношению к анимально-вегетативной оси была инвертирована или у bilaterians или cnidarians (Martindale and Hejnol, 2009). Primary Axis Polarity in Cnidarians Формирует ли передача сигналов Wnt также паттерн первичной оси cnidarian после раннего развития? Удивительно, множественные Nematostella Wnt гены экспрессируются в доменах вдоль oral-aboral оси в течение всего эмбрионального и личиночного развития со склонностью в направлении ротвого конца (Figure 1) (Kusserow et al., 2005). Сходным образом у Clytia, пять Wnt генов экспрессируются в гнёздных аксиальных доменах, исходящих из oral полюса в течение всего эмбрионального и личиночного развития (Momose et al., 2008). Напротив, Wnt ингибитор экспрессируется на противоположном конце (aborally) личинки Nematostella (Lee et al., 2006). Эти данные указывают на то, что у deuterostomes, так и protostomes, передача сигналов Wnt происходит поляризованным способом вдоль первичной оси.
Др. доказательства постоянной потребности в передаче сигналов Wnt в ходе постэмбрионального развития cnidarian получены в исследованиях на взрослых пресноводных гидрах, которые способны регенерировать все тело из фрагментов ткани. Экспрессия Hydra Wnt ингибитора наблюдается в столбе тела (Guder et al., 2006), а экспрессия Hydra Wnt генов и наивысшие уровни ядерного β-catenin обнаруживаются на оральном конце (Figure 1) (Hobmayer et al., 2000; Broun et al., 2005; Lengfeld et al., 2009). Избыточная активация передачи сигналов Wnt ( GSK-3β ингибирование) ведет к поразительному фенотипу с вовлечением эктопических tentacles по всему стволу тела, указывая, что пространственное ограничение активности β-catenin необходимо, чтобы ограничить регион, содержащий типы клеток или структуры oral полюсом (Figure 3B) (Broun et al., 2005). Следовательно, передача сигналов Wnt может контролировать судьбу вдоль первичной оси взрослых кишечнополостных.
Итак, ранняя роль β-catenin в поляризации анимально-вегетативной оси и более поздняя роль передачи сигналов Wnt при поляризации первичной оси обнаруживаются у кишечнополостных. β-catenin активен на анимальном полюсе, а Wnts преимущественно экспрессируются на oral конце, который формируется из анимального полюса. Эта общая ориентация ранней и поздней ролей активности β-catenin напоминает vegetal (морские ежи, асцидии, немертины) и заднюю роли передачи сигналов β-catenin/Wnt (Xenopus, рыбки данио, мыши, планарии, нематоды, членистоногие) выявляемые у многих bilaterians. На основании экспрессии генов Wnt oral конец кишечнополостных может соответствовать заднему концу bilaterian. На базе экспрессии транскрипционного фактора вдоль основной оси, однако, oral конец разных кишечнополостных, как полагают, соответствует или переднему или заднему концу bilaterian (Yanze et al., 2001; Finnerty et al., 2004). Существует ли ориентация передачи сигналов Wnt относительно др. признаков первичной оси (напр., экспрессии Hox), т.е. противоположная той, что у bilaterians остается важной областью дальнейших исследований (Martindale and Hejnol, 2009). Независимо от этого, эти данные указывают на то, что роль передачи сигналов β-catenin/Wnt в поляризации первичной оси предшествует появлению Bilateria. Polarized Wnt Expression in Sponge Larva Нерегулярная форма взрослых губок может прежде всего указывать,что они не имеют оси совсем. Однако эмбрионы этих рано дивергировавших животных являются свободно плавающими и имеют признаки осевой полярности. После гаструляции личинки haplosclerid demosponge Amphimedon queenslandica формируют пигментированное пятно на полюсе, удалённом от направления движения. Хотя сегодня нет данных по функции генов, Amphimedon Wnt экспрессируется на пигментном полюсе (Figure 1) (Adamska et al., 2007), это согласуется с возможностью роли передачи сигналов Wnt в развитии первичной оси у самых ранних многоклеточных организмов.
Conclusions The processes involved in the formation and patterning of the animal main axis have fascinated biologists for much of the past century. An increasing body of work, as summarized here, indicates that most animals utilize canonical Wnt signaling to control features of the primary axis (Figure ЗА). Wnt pathway perturbation causes dramatic axial consequences throughout the animal kingdom (Figure 3B). Remarkably, the spatial orientation of Wnt signaling (active in the posterior and often involving anterior Wnt inhibition) is found in nearly all animals examined, suggesting that this orientation is representative of the ancestral condition for the Bilateria. β-catenin activity is also often polarized along the animal-vegetal axis of animals, before gastrulationhas occurred and the anteroposterior axis has developed (Mar-tindale, 2005). After initial anteroposterior axis formation, Wnt signaling also often has a role in posterior growth (Martin and Kimelman, 2009). In support of the notion of an ancestral state involving Wnt signaling in the regulation of polarized features of the primary axis, pre-bilaterian cnidarians possess axial polarity of Wnt expression, in which Wnts are expressed at the oral pole and Wnt inhibitors are expressed aborally. The hypothesized central role of Wnt signaling in promoting posterior rather than anterior aspects of animal tissue provides a candidate explanation for a large array of data and predicts that additional posterior-promoting roles for Wnts will continue to be uncovered.
What is the significance of the fact that a great diversity of processes—ranging from neurectoderm patterning to regeneration polarity—are under control of Wnt signaling along the primary axis? Many of these varied processes undoubtedly have distinct evolutionary origins yet appear to share similarity in usage of posterior Wnt signaling. One possibility is that a prominent conserved aspect of Wnt signaling in development is to convey position along the primary axis rather than to control any particular process. Presented data indicate that Wnt signaling might have been involved in the polarization of the primary axis in the very earliest animals. It is therefore possible that there existed an ancestral state of posterior Wnt signaling that came to regulate many processes, such as neurectoderm development, regeneration, posterior growth, and/or head-tail identity, as animals diversified. Derived usage of the polarizing role of Wnt signaling may have evolved in some animals, for example to control asymmetric cell divisions in C. elegans and Platynereis or to establish segment polarity in arthropods.
Other interpretations of the data presented here are possible, although such interpretations are generally less parsimonious than the model that canonical Wnt signaling has a conserved role in regulating positional patterning of the primary body axis. For example, it is possible that Wnt signaling has been recruited variably and independently to axial patterning throughout evolution. However, this hypothesis fails to explain why so many studied animals employ Wnt signaling in A-P axis development in particular and with the same polarity (Wnt activation posterior and Wnt inhibition anterior). Another possible interpretation for some of the data would be that Wnt signaling/β-catenin controls a particular activity (such as growth or gastrulation) that commonly occurs in the posterior or vegetal pole. However, given the large morphological diversity of animals that utilize Wnt signaling to control aspects of the primary axis, it seems that no particular regional structure or process could account for all of the data. The continued exploration of roles for Wnt signaling in axis polarity in diverse organisms will be important for assessing whether specific roles in different animals reflect conservation of polarity control through common ancestry.
Together, a wealth of data demonstrates that the use of canonical Wnt signaling in control of posterior polarized tissue identity is remarkably widespread, similar in its ubiquity to the axial expression of Hox genes or the utilization of BMP signaling to pattern the D-V axis. These observations indicate that A-P patterning by posterior Wnt activation and anterior Wnt inhibition is a core determinate of polarity along the metazoan primary axis.
|