Генерация мРНК сложный процесс с многочисленными точками контроля. Энзим Pol II синтезирует транскрипты мРНК у эукариот и всё появляются дополнительные general transcription factors (GTFs) , необходимые для транскрипции [ 1 ]. Транскрипция регулируется как позитивно, так и негативно с помощью хозяйских факторов, включая промотор-специфические активаторы и репрессоры, с хроматином и гистонами ассоциированные белки и корегуляторные комплексы, которые могут связывать генеральный аппарат транскрипции с регуляторными белками [1 - 4 ]. Транскрипционная реакция состоит из серии ступеней, включая образование преиниационного комплекса на промоторах генов, инициацию транскрипции, уход с промотора и удлинение транскрипта. Сплайсинг пре-мРНК др. регуляторная ключевая ступень в генерации зрелых мРНК. Сплайсинг происходит одновременно с транскрипцией и паттерны альтернативного сплайсинга могут затрагиваться транскрипцией [5,6 ]. Хотя большинство факторов, которые известны, регулируют транскрипцию или альтернативный сплайсинг являются белками, сравнительно небольшое количество не кодирующих РНК (ncРНКs ) также функционируют как регуляторы этого процесса [7 ].
Мобильны ретроэлементы Alu, B1 и B2 являются частью семейства, известного как short interspersed elements (SINEs ). Удивительно 11% генома человека состоит из Alu SINEs [ 8 ]. Для сравнения, мышиный геном содержит приблизительно 550 000 B1 и 350 000 B2 SINEs [9,10 ]. SINEs, которые имеют внутренний РНК polymerase III (Pol III) промотор, кодируют малые РНК и размножаются неавтономно, используя аппарат L1 long interspersed element (LINE), чтобы внедриться в геном своего хозяина [11 ]. SINE элементы повсеместны и располагаются по всему геному своего хозяина от межгенных регионов до внедрения в белок-кодирующие гены [ 12 - 14 ]. Поэтому многие SINE транскрибируются как часть крупных Pol II транскриптов.
Исторически, SINEs рассматривались как отбросы 'junk DNA', пригодные прежде всего для выявления филогенетических взаимоотношений между организмами и исследования видообразования у млекопитающих [ 15 - 17 ]. Однако в ряде лабораторий было установлено, что Pol III SINE транскрипты увеличиваются при разнообразных клеточных стрессах [ 18 - 22 ]. Более того , биоинформационный анализ показал присутствие тысяч SINEs, ограниченное не экзонными элементами, указывая тем самым, что SINEs выполняют биологическую и эволюционную роль [ 23 ].
То, что давно считалось как геномные отбросы, как оказалось являются скрытыми сокровищами; SINEs , как оказалось, выполняют разнообразные и эволюционно важные биологические функции от изменения генной экспрессии, локализации мРНК до выступления в качестве мобильных Pol II промоторов [ 24 - 27 ].
B2 и Alu РНКs act as transregulators of mРНК transcription
Pol III транскрибирует Alu РНК, B2 РНК и B1 РНК регулируемым способом ( Figure 1a) [ 28 - 30 ]. Alu РНК человека длиной в 300 nt и состоит из двух 7SL производных плеч , связанных с помощью A-rich региона [31 ]. В 140 nt мышиная B1 РНК имеет подобные же плечи Alu РНК [ 32 ]. В 180 nt B2 РНК происходит из tРНК и не связана с Alu и B1 РНК по последовательностям или вторичной структуре [33 ]. Наблюдение, что после теплового шока и др. клеточных стрессов , уровни транскрибируемых Pol III Alu, B1 и
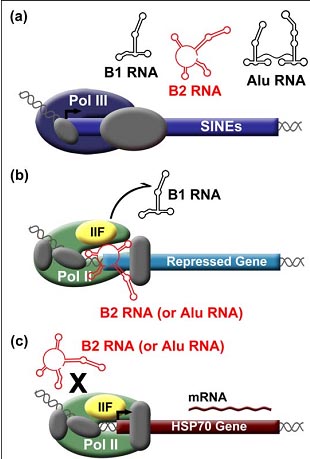 SINE РНКs control the heat shock response in mouse и human cells. (a ) Pol III transcribed SINE РНКs increase upon heat shock. (b ) During heat shock, mouse B2 РНК or human Alu РНК enters complexes at the promoters of repressed genes. TFIIF facilitates dissociation of B1 РНК from Pol II. (c) Heat shock activated genes are resistant to repression by B2 РНК и Alu РНК.
SINE РНКs control the heat shock response in mouse и human cells. (a ) Pol III transcribed SINE РНКs increase upon heat shock. (b ) During heat shock, mouse B2 РНК or human Alu РНК enters complexes at the promoters of repressed genes. TFIIF facilitates dissociation of B1 РНК from Pol II. (c) Heat shock activated genes are resistant to repression by B2 РНК и Alu РНК.
B2 РНК увеличиваются, это привело к гипотезе, что они играют функциональную роль во время реакции на стрессы [22,34 ].
Эксперименты установили, что B2 и Alu РНК действуют как репрессоры транскрипции мРНК во время теплового шока ( Figure 1 b) [ 35,36]. Когда клетки реагируют на тепловой шок, то транскрипция некоторых генов усиливается ( напр., hsp70, Figure 1 c), тогда как транскрипция остальных репрессируется (напр. , actin и hexokinase II). Антисмысловые олигонуклеотиды против Alu РНК или B2 РНК, внесенные в клетки мыши или человека, снимают репрессию транскрипции некоторых генов в ответ на тепловой шок, указывая тем самым, что B2 и Alu РНК действуют, чтобы ингибировать транскрипцию [ 35,36]. В очищенных транскрипционных системах, Alu РНК и B2 РНК оказались мощными репрессорами, тогда как B1 РНК нет [ 36,37 ]. Electrophoretic mobility shift assays (EMSAs) показали, что B2 РНК , Alu РНК и неожиданно B1 РНК, непосредственно соединяются со стержнем Pol II [36,37]. B2 и Alu РНК образуют ансамбли с Pol II, GTFs, и промотором в комплексы, которые могут быть выяснены с помощью EMSA. В согласии с этой находкой, в клетках мыши и человека во время теплового шока B2 РНК или Alu РНК ко-локализуются с Pol II на промоторах транскрипционно репрессированных генов [36]. Вместе эти наблюдения привели к модели, что Alu РНК и B2 РНК позитивно регулируются в ответ на тепловой шок. соединяются с Pol II, вступают в комплексы на промоторах и блокируют транскрипцию (Figure 1 b).
Аналогично регуляторам транскрипции белков B2 и Alu РНКs обладают множественными функциональными доменами, которые могут смешиваться и подгоняться для создания химерных ncРНКs с новыми функциями [ 36]. Первые намеки, что эти ncРНКs обладают отличающимися функциональными доменами получены в исследованиях по делетированию B2 РНК. Нуклеотиды 81 - 130 из B2 РНК были полностью функциональными для связывания Pol II и репрессии транскрипции in vitr ; однако дальнейшее укорочение до 99 - 130 давало РНК домен, способный связывать Pol II, но у него отсутствовала способность репрессировать транскрипцию [ 38 ]. Сходным образом, делеционный анализ Alu РНК продемонстрировал, что она содердит два раздельных 'Pol II связывающих' домена и два разных 'transcriptional repression' домена [ 36]. B1 РНК, заставляет связывать Pol II, но не репрессирует транскрипцию, м. рассматриваться как имеющая Pol II связывающий домен. Слияние репрессивного домена Alu РНК индивидуально с B1 РНК создает химерные РНКs, которые функционируют как транскрипционные репрессоры [ 36]. Вообще-то существуют и др. ncRNAs, которые содержат Pol II связывающие домены и обладают разными функциональными доменами, чтобы регулировать транскрипцию разными способами.
Недавно серия исследований in vitro была предпринята, чтобы определить молекулярный механизм, с помощью которого Alu РНК и B2 РНК репрессируют транскрипцию. Принимая во внимание, что эти ncРНКs оккупируют промоторы совместно с Pol II, они скорее всего репрессируют транскрипцию после того, как комплексы соединятся с ДНК, но до инициации. B2 РНК и Alu РНК , как было установлено, ингибируют транскрипцию с матрицы, предназначенной, чтобы обходить образование открытого комплекса, указывая тем самым, что они репрессируют транскрипцию до того как промотор melting [39]. UV поперечных сшивок и DNase I footprinting методы, использующие комплексы, содержащие ncRNA, Pol II, и GTFs, обнаруживают достоверное разрушение контактов между Pol II и промоторами ДНК, также как и ncRNA-индуцированные конформационные изменения [39]. Эти данные подтверждают модель, согласно которой B2 РНК и Alu РНК репрессируют транскрипцию путем предупреждения Pol II от собственно привлечения ДНК после сборки в комплексы с промоторами ассоциированными GTFs ( Figure 1 b).
B1 РНК и B2 РНК связывают Pol II конкурентно и с одинаковым уровнем сродства, в результате возникает интригующий вопрос, может ли B1 РНК блокировать B2 РНК от связывания Pol II и репрессировать транскрипцию. Эту возможность исследовали, используя систему транскрипции
in vitro и неожиданно, B2 РНК, как было установлено, оказывается репрессирует транскрипцию, когда B1 РНК была предварительно связана с Pol II [ 40]. Дальнейшие эксперименты показали, что TFIIF облегчает диссоциацию B1 РНК от Pol II (Figure 1 b). Более того, слияние домена репрессирующего транскрипцию из Alu РНК с B1 РНК создает химерные ncРНК, которые остаются стабильно связанными с Pol II в присутствии TFIIF, показывая тем самым, что домены репрессии создают Pol II - ncРНК комплексы, резистентные к дестабилизирующих эффектами TFIIF [ 40]. Выяснение точной локализации сайта нахождения ncRNA на Pol II и того, как он взаимодействует с ncРНКs д. прояснить понимание взаимодействия репрессивных доменов ncRNA, Pol II и TFIIF.
A B2 SINE serves as a boundary element to regulate transcription during organogenesis
Недавно было установлено, что B2 SINE регулирует транскрипцию мРНК стадио- и тканеспецифически [ 41](Figure 2 ). Локус гормона роста мыши (GH) обнаруживает профили дифференциальной экспрессии во время развития гипофиза. В специфических клетках надпочечников переходы гена GH из молчащего в транскрипционно активное состояние осуществляются на ст. эмбриогенеза Е17.5. Эксперименты по флюоресцентной гибридизации in situ показали, что локализация гена GH меняется из региона гетерохроматина в эухроматин непосредственно перед стадией развития гипофиза, на которой ген GH активируется. Более того, ChIP анализ показал, что перемещение в эухроматин оказывается по времени связанным с изменением состояния метилирования lysine 9 гистона H3 на промоторе GH. В частности, промотор стартует в состоянии, при котором H3K9 триметилирован, что является меткой конденсированного гетерохроматина и изменяется в состояние, при котором H3K9 становится диметилированным. Более обширный ChIP анализ локуса GH показал, что существует локальный переход между H3K9 trimethyl и H3K9 dimethyl в регионе в 10 - 14 kb выше места старта транскрипции GH. Это наблюдение ведет к гипотезе, что существует пограничный элемент подобной локализации [ 41].
Чтобы протестировать гипотезу пограничных элементов, разные пропорции региона, содержащие предполагаемый пограничный элемент были протестированы на активность по блокированию энхансера с помощью метода преходящей трансфекции. Результаты показали, что регион в 1.1 kb строго блокирует экспрессию репортерного гена, если помещается между энхансером и сердцевиной промотора [41]. Интересно, что этот регион может содержать B2 SINE , а делеция B2 SINE устраняет активность по блокированию энхансера. Нить-специфический RT-PCR выявляет присутствие Pol III (sense) и Pol II (anti-sense) B2 транскриптов, при этом Pol II транскрипт, по-видимому, соответствует изменению в метилировании H3K9. Эксперименты с трансгенами, содержащими ген GH и вышестоящий B2 элемент, лишенный Pol II или Pol III промотор, показали, что оба важны для активности по блокированию энхансера. Очевидно, что начало транскрипции с этих промоторов необходимо для активности по блокированию энхансера, поскольку предоставление B2 транскриптов в транс-положении не оказывало эффекта на функцию энхансера. Итак, эти результаты указывают на то, что мышиный B2 SINE служит в качестве пограничного элемента; его
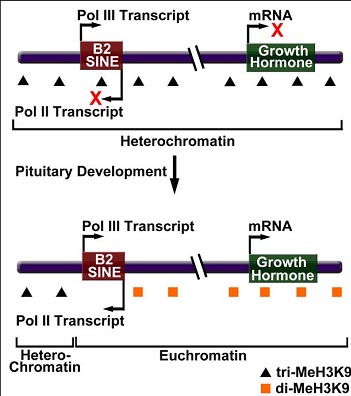 A B2 SINE serves as a boundary element to regulate transcription during pituitary development in mouse cells. Bidirectional transcription of a B2 SINE upstream of the growth hormone locus facilitates a change in chromatin structure from a repressive heterochromatic state to a permissive euchromatic state.
A B2 SINE serves as a boundary element to regulate transcription during pituitary development in mouse cells. Bidirectional transcription of a B2 SINE upstream of the growth hormone locus facilitates a change in chromatin structure from a repressive heterochromatic state to a permissive euchromatic state.
двунаправленная транскрипция вызывает важные для развития изменения в структуре хроматина (от гетерохроматина к эухроматину), которые создают пермиссивное окружение, которое делает возможным транскрипцию гена GH [41]. Интересно, что в клетках человека более 9000 Alu SINEs обнаружены на расстоянии 1 kb от сайтов инициации транскрипции, это делает возможным предположение, что некоторые Alu SINEs также могут влиять на транскрипцию mРНК , служа в качестве пограничных элементов [ 42 ].
Как же двунаправленная транскрипция B2 SINE приводит в действие пограничный элемент пока неясно. Кажется мало вероятным, что способ, с помощью которого устанавливается граница, непосредственно связан с механизмом, с помощью которого Pol III транскрибируемая B2 РНК репрессирует транскрипцию во время теплового шока. В ситуации с тепловым шоком B2 РНК ( Pol III транскрипт ) связывает Pol II в транс-положении и блокирует инициацию транскрипции, тогда как в случае HG локуса функция пограничного элемента нуждается в запуске Pol II и Pol III транскрипции. Гены tРНК , как было установлено, служат в качестве пограничных элементов у дрожжей, но механизм действия также, по-видимому, несколько отличен от такового для GH B2 SINE (as disc ussed in [ 43 ]). Хотя осуществление Pol III транскрипции tРНК генов необходимо для функции пограничных элементов у дрожжей, нет доказательств, что необходима антисмысловая Pol II транскрипция генов tРНК. Более того, Pol III транскрипция дрожжевого tRNA гена может нарушать нуклеосомное построение, что может приводить к неспособности молчащего хроматина к распространению на tРНК ген. Напротив, транскрипция B2 SINE, по-видимому, не изменяет локализации нуклеосом[ 43 ]. Необходимы дополнительные эксперименты для выявления механизма, с помощью которого двунаправленная транскрипция HG B2 SINE устанавливает границы в хроматине.
Alu РНК contained in primary mРНК can change patterns of alternative splicing
Сложность генома увеличивается благодаря способности продуцировать разные злелые мРНКs из одной
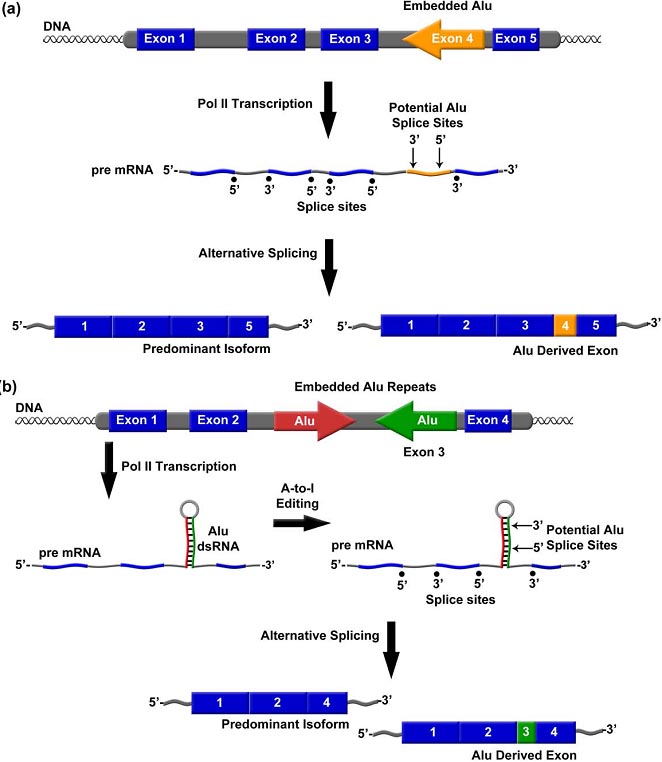
Alu РНК exonization promotes proteome diversity. (a ) Shown is an example in which embedded Alu РНК is exonized via alteРНКtive splicing into an mРНК. (b ) Alu РНК indirect repeats embedded in an mРНК can become double stranded и undergo A-to-I editing, resulting in Alu exonization.
первичной мРНК посредством альтернативного сплайсинга. Биоинформационные исследования показывают, что более 70% человеческих генов подвергаются альтернативному сплайсингу [ 44,45 ]. Недавние исследования установили, что Alu РНК, внедряясь в Pol II транскрипты, могут влиять на альтернативный сплайсинг. Alu SINEs, как полагают, присутствуют в более 5% альтернативно сплайсируемых внутренних экзонных регионах, хотя крупная пропорция зрелых мРНКs содержит кусочки Alu РНК [ 46,47,48 ]. Скорее нежели присутствие в жизненно важных, законсервированных регионах мРНКs, большинство Alu последовательностей, присутствующих в зрелых мРНК, появляется в не консервативных альтернативно сплайсируемых экзонах, это позволяет новым белковым продуктам собираться и отбираться [45,49, 50].
Как смысловая, так и антисмысловая нити Alu содержат ряд потенциальных 5' и 3' сплайс-сайтов, это позволяет ранее интронным Alu элементам альтернативно exonized (переходить в экзоны) в мРНКs ( Figure 3 a) и exonization Alu РНК происходит прежде всего с использованием частей антисмысловой нити из правого плеча [49-5 3 ]. В гене adenosine deaminase acting on RNA 2 (ADAR 2), exonization происходит так, что часть последовательности Alu добавляет 40 аминокислот к продукту альтернативно сплайсированного гена [ 54,55 ]. Исследования, изучающие детерминанты Alu exonization в ADAR2 и минигене putative glucosyltransferase (PGT), выявили множественные механизмы, с помощью которых Alu регулируют альтернативный сплайсинг [ 50,54 ]. Напр., мутации в левом плече Alu могут драматически сдвигать профиль сплайсинга из правого плеча происходящих Alu экзонов, с альтернативного сплайсинга к конституитивному сплайсингу [ 50]. Кроме того, одиночные точковые мутации в 5' сплайс-сайте внутри Alu, внедренного в ADAR2 мРНК, переключает альтернативно сплайсируемый сайт в конституитивно сплайсируемый сайт [ 51]. Исследование 330 Alu-производных экзонов продемонстрировало Alu exonization во многих ткане-специфичных транскриптах [ 47]. Важность Alu exonization в эволюции человека и в усилении разнообразия в геноме человека только начинает выявляться.
Внедренная Alu РНК также влияет на экспрессию гена благодаря adenosine-to-inosine (A-to-I) редактированию двунитчатых Alu РНК с помощью ADARs (Figure 3b). Исследования показали, что 90% от всех A-to-I редактирований происходит в Alu РНК [56,57 ]. Приблизительно 45% Alu элементов, которые располагаются внутри интронных последовательностей присутствуют в множественных копиях на интрон в обеих ориентациях [ 42 , 5 8]. В этих ситуациях Alu РНК инвертированные повторы образуют двунитчатые структуры [56-59 ]. Последующее редактирование Alu dsРНКs может влиять на экспрессию генов посредством варьирующих механизмов, включая делетирование преждевременного стоп-кодона, изменение кодонных триплетов и создание новых сайтов сплайсинга [ 58-6 2 ]. Примеры Alu регулируемой генной экспресии посредством A-to-I редактирования включают и создание 3' сплайс-сайта в гене ADAR, так и создание 3' сплайс-сайта и делеция стоп кодона в гене NARF [61-63 ]. Всё это демонстрирует отсутствие способа, с помощью которого внедренная Alu РНК может влиять на экспрессию генов и на разнообразие протеомов.
Conclusion
It is becoming apparent that SINE encoded РНК s can perform vital roles in regulating transcription и mРНК splicing, there by controlling processes as diverse as the stress response, development, и proteome diversity. During cell stress, Pol III transcribed Alu и B2 RN As repress mРНК transcription. Transcription of B2 RN A can establish a boundary и there by regulate gene expression via controlling the state of chromatin in a developmentally specific manner . Embedded Alu RNAs can affect alternative mRNA splicing, which enables the sampling of new и potentially advantageous proteins. At this juncture it is not obvious that these three regulatory events share common mechanistic features, beyond the involvement of SINE РНКs. Indeed, the vast numbers of SINEs that inhabit mammalian genomes might have established a situation in which different SINEs could evolve distinct and unrelated functions . Bot h the B2 SINE that serves as a boundary element и the cases of Alu SINEs facilitating alternative splicing likely resulted from mammalian evolution taking advantage of SINEs that inserted at specific locations. In the case of Pol III transcribed B2 and Alu РНКs binding Pol II in trans и repressing transcription, it is likely that mammalian evolution took advantage of expressed , structured ncРНКs to play a valuable role in responding to cellular stress. The effects that SINE РНКs have on gene expression are just beginning to be revealed. We imagine that the discoveries of the functions of the ncRNAs expressed from these gems of the genome will delight и astound for many years to come .
Сайт создан в системе
uCoz SINE РНКs control the heat shock response in mouse и human cells. (a ) Pol III transcribed SINE РНКs increase upon heat shock. (b ) During heat shock, mouse B2 РНК or human Alu РНК enters complexes at the promoters of repressed genes. TFIIF facilitates dissociation of B1 РНК from Pol II. (c) Heat shock activated genes are resistant to repression by B2 РНК и Alu РНК.
SINE РНКs control the heat shock response in mouse и human cells. (a ) Pol III transcribed SINE РНКs increase upon heat shock. (b ) During heat shock, mouse B2 РНК or human Alu РНК enters complexes at the promoters of repressed genes. TFIIF facilitates dissociation of B1 РНК from Pol II. (c) Heat shock activated genes are resistant to repression by B2 РНК и Alu РНК. A B2 SINE serves as a boundary element to regulate transcription during pituitary development in mouse cells. Bidirectional transcription of a B2 SINE upstream of the growth hormone locus facilitates a change in chromatin structure from a repressive heterochromatic state to a permissive euchromatic state.
A B2 SINE serves as a boundary element to regulate transcription during pituitary development in mouse cells. Bidirectional transcription of a B2 SINE upstream of the growth hormone locus facilitates a change in chromatin structure from a repressive heterochromatic state to a permissive euchromatic state. 