В иммортализованных клетках, использующих ALT путь, описана ко-локализация BLM с теломерами во время S-фазы и TRF1 и TRF2 [154,155]. TRF2 стимулирует BLM раскручивание теломерного и не-теломерного субстратов, тогда как TRF1 ингибирует только теломерное раскручивание за счет стерических препятствий [156].
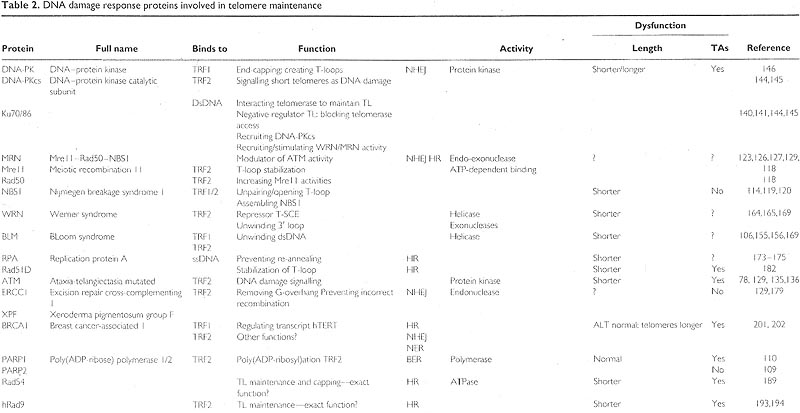
WRN is a unique human helicase with exonuclease activity that dissociates D-loops
Werner syndrome (WS) является редкой геномной нестабильностью. возникающей в результате дефектов в гене WRN [157]. Если теряется функция WRN, то возникают трудности, связанные с репликацией и процессингом повреждений ДНК, приводящими в конечном итоге к аномалиям хромосом и теломер или к раннему старению или усилению апоптоза (rev. [158]). WRN функционально взаимодействует с рядом белков, участвующих в NHEJ, такими как DNA-PKcs [159], и в гомологичной рекомбинации, такими как RPA [160], Rad51 [161] и MRN комплекс [162] в твет на DSBs.
WRN является уникальной RecQ helicase человека, т.к. она обладает 3' to 5' exonuclease активностью [163] и может отщеплять последовательно нуклеотидные основания от свободных концов нуклеиновых кислот. Однако родственные механизмы между активностями helicase и exonuclease всё ещё остаются в основном неизвестными. Обычно helicase домен WRN репрессирует несоответствующую рекомбинацию промежуточных образований, таких как T-SCE, это может способствовать активации пути ALT [164,165]. Ингибирование WRN затрагивает лишь синтез запаздывающей нити на теломерах, который копирует G-rich теломерную нить [166]. WRN может эффективно развертывать G-нить зависимым от геликазы способом, а функциональное взаимодействие WRN с рядом белков, используемое для поддержания длины теломер, указывает на то, что WRN может влиять на доступ telomerase к 3' довеску и тем самым на прогрессию репликационной вилки [167]. WRN также обнаруживается на теломерах telomerase-негативных клеток, которые используют ALT путь для поддержания теломер [167.168]. В этих клетках WRN локализуется в PML-NBs и WRN перемещается в теломерную ДНК в S фазе, когда необходимо разрешение D-петель для теломерной репликации и/или рекомбинации [169]. WRN helicase и exonuclease кооперирую, чтобы диссоциировать модельную структуру теломерной D-петли
in vitro и эти активности регулируются с помощью TRF1 и TRF2 [167]. TRF1 и TRF2 ограничивают степень WRN exonuclease переваривания D-петли, но не блокируют развертывания с помощью WRN helicase такой длины, которая достаточна для присутствия RPA или POT1, чтобы стимулировать высвобождение нити полной длины [79].
RPA prevents reannealing upon helicase dissociation
Replication protein-A (RPA) является гетеротримерным связывающим однонитчатую ДНК белком. который необходим для почти всех аспектов метаболизма клеточной ДНК, таких как репликация, рекомбинация ДНК, checkpoints повреждений ДНК и все основные типы репарации ДНК, включая репарацию DSBs repair [170,171]. RPA напоминает POT1 своим взаимодействием с ssDNA посредством связывания OB [172] и с WRN и BLM, чтобы предупреждать reannealing после диссоциации helicase [173,174]. В противовес POT1 RPA не определяется как один из стержневых компонентов теломерного белкового комплекса человека [68]. RPA может регулировать действие telomerase во время клеточного цикла путем открытия структур G-quadruplex и поддержания их как ssDNA, облегчая тем самым рекрутирование и связывание компонентов telomerase на теломеры [175]. RPA обнаруживается также в ассоциации с APBs в клеточных линиях ALT. Потеря RPA в ALT опухолевых клетках вызывает увеличение однонитчатой теломерной ДНК, повышенное накопление теломерной ДНК в APBs, и генерацию крупных теломерных агрегатов на концах метафазных хромосом U761.
ERCC1/XPF is the main nuclease that removes G-strand overhangs
Excision repair cross-complementing 1 (ERCC1) и xeroderma pigmentosum group F (XPF) формируют комплекс, который функционирует специфичная для структуры endonuclease. Два компонента комплекса взаимозависимы: так, что клетки, лишенные ERCC1 содержат пониженные уровни XPF и vice versa [177,178]. Этот комплекс является главной nuclease, которая удаляет довесок G-нити с непокрытых шапочкой теломер. ERCC1/XPF отщепляет рядом с 3' довеском непосредственно внутри соседней дуплексной ДНК, генерируя субстрат для NHEJс помощью DNA ligases [179]. ERCC1/XPF не только ассоциирует с теломерами, но его минорная фракция ассоциирована также в TRF2 комплекс [179]. Поскольку XPF обладает независимой от nuclease функцией в TRF2-обусловленном укорочении теломер, то было предположено, что ERCC1/XPF играет структурную роль в регуляции TRF2-обусловленного укорочения теломер [180]. Когда ERCC1/XPF-дефицитные клетки делятся, то они генерируют потерю кусков хромосомного материала. содержащего теломерную ДНК, т. наз. 'telomeric DNA-containing double minutes' (TDMs). TDMs являются результатом события рекомбинации между теломерой и сходными последовательностями где-либо ещё на хромосоме [179]. Т.о., ERCC1/XPF выполняет две очень отличающиеся роли на теломерах: помимо удаления G-нитчатого довеска, он предупреждает несоответствующую рекомбинацию во время деления хромосом.
Rad51D as a member of the RAD52 group, stabilizing T-loops
У человека Rad51 паралоги, Rad51B, Rad51C, Rad51D, XRCC2 и XRCC3, вместе с Rad54 являются ключевыми членами RAD52 группы, которые необходимы для гомологичной рекомбинации. Эти Rad51 паралоги необходимы для нормальных уровней резистентности к ДНК-повреждающим агентам [181]. Один из членов этого семейства, Rad51D, также участвует в поддержании теломер. Rad51D ассоциирует с теломерами и играет двойную роль в клетках, участвуя в рекомбинационной репарации DSBs и в защите теломер за счет стабилизации T-loop или Holliday junction-like промежуточных образований на хромосомных концах [182].
Rad54 is a chromatin-remodelling protein involved in maintaining and capping telomeres
Белок Rad54, dsDNA-зависимая ATPase, который принадлежит семейству Swi2/Snf2 хроматин-ремоделирующих белков. играет важную роль в репарации с помощью гомологичной рекомбинации двунитчатых разрывов ДНК [183-185]. Rad54 ремоделирует структуру ДНК, структуру хроматина и Rad51-dsDNA комплексов, показывая тем самым, что Rad54 перемещается вдоль ДНК [186-188]. Изучение точной роли Rad54 на теломерах с использованием Rad54-дефицитных мышей показало, что отсутствие Rad54 ведет к повышению частоты слияний хромосом конец-в-конец и значительной потере теломерных последовательностей в присутствии нормальных уровней активности telomerase, сравнимых с контролем дикого типа. Эти данные указывают на предположительную роль Rad54 в поддержании теломер и в покрытии теломер шапочкой. Исследования на мышах, дефицитных по Rad54 и DNA-PKcs показало, что Rad54 не играет важной роли в обеспечении слияний конец-в-конец незащищенных теломер [189].
hRad9 as a checkpoint protein influences telomere stability and HR in ALT
hRad9 является checkpoint белком, который фосфорилируется с помощью ATM вследствие повреждения ДНК [190]. hRad9 образует ядерный комплекс с hRad1 and hHUS1, который напоминает PCNA и ощущает повреждения ДНК [191,192]. Комплекс локализуется на теломерной ДНК и PML тельцах в ALT клеточных линиях [193]. hRad9 ассоциирует с TRF2 и играет роль в поддержании стабильности теломер, но его точная функция в этом процессе неясна. Нокдаун hRad9 ведет к снижению HR, указывая на возможность, что hRad9 влияет на поддержание теломер посредством своего эффекта на HR [194].
PARP1 and PARP2 are poly(ADP-ribose) polymerases that remove TRF2 from telomeres to allow access by DNA damage repair proteins
PARP1 and PARP2 являются poly(ADP-ribose) полимеразами, спорадически обнаруживаемыми в нормальных теломерах с преимущественной локализацией на поврежденных теломерах [110]. PARP1 и PARP2 ассоциируют с TRF2 и это взаимодействие помогает PARP1/2 лагализоваться в местах разрывов нити ДНК на теломерах. PARP1/2 катализирует poly(ADP-ribosyl)-ation TRF2, диссоциируя его от теломер и открывая доступ к разрывам ДНК аппарата репарации с последующей репарацией поврежденных теломер [ 109,110]. PARP1 и PARP2по-видимому, одинаковым образом ассоциируют с и влияют на TRF2, но в то время как PARP1 колокализуется с TRF2в линии telomerase-позитивных клеток, PARP2 в основном ко-локализуется с TRF2 в telomerase-негативных ALT линиях клеток [109].
BRCA1 is a tumour suppressor involved in DNA repair
Breast cancer associated gene 1 (BRCAI), ассоциирует с наследственным раком груди и яичников, действует как каркас, который организует и координирует ряд белков. участвующих во многих разнообразных сигнальных процессах, таких как реакция на повреждения дНК, контроль checkpoint клеточного цикла, супрессия опухолей. онкогенез, стрессовая реакция и апоптоз [195-198]. BRCA1 играет критическую роль в p53 реакции, при выборе между апоптозом или арестом клеточного цикла, осуществляемым в присутствии или отсутствии дополнительных взаимодействующих белков [199]. BRCA1 играет важные роли в homologous recombination репарации, соединении негомологичных концов и nucleotide excision repair (NER), и обеспечивает эти функции благодаря своему взаимодействию с компонентами аппарата репарации ДНК, такими как Rad51 и MRN комплекс, и регуляции им экспрессии генов. которые участвуют в этих путях репарации повреждений ДНК (rev. [200]).
BRCA1 участвует также в поддержании теломер благодаря своей способности регулировать транскрипцию hTERT [201] и ко-локализации с TRF1 [202]. TRF2 ко-локализуется также с BRCA1в telomerase-позитивных клетках и с небольшим набором ALT-ассоциированных PML телец. Экспрессия доминантно-негативной мутации BRCA1 ведет к увеличению длины теломер в telomerase-позитивных клетках, но не меняет длины теломер в ALT клетках [202]. Точный механизм, с помощью которого нефункциональный BRCA1 влияет на поддержание теломер. остается неизвестным. Участие BRCA1в NHEJ, HR , а также в NER не позволяет определить его точные функции.
Conclusion
Telomeres and their associated proteins display a number of essential functions, whereas disruption or failure of any of the functions could lead to genetic instability, cell transformation and/or continuous growth, all hallmarks of human cancer. Over the last 20 years, the interest in telomere biology and the biochemical and functional characterization of the proteins at the telomeres has increased dramatically. Although most human cancers use telomerase for telomere maintenance and/or lengthening, some use the ALT pathway. Despite intense research, however, much remains unknown about the exact interactions and subsequent molecular mechanisms of the proteins involved. In particular, the factors mediating the ALT pathway remain unclear. Many proteins interact with the telomeres and each other via large protein complexes that shape and safeguard the telomeres. The finding that many DNA damage-response proteins are involved in telomere maintenance, repair and stabilization, and therefore exhibit cross-talk between these different processes, has been of great interest. Understanding these different types of involvement at telomeres may be of help in fighting human cancer and other age-related diseases.
Сайт создан в системе
uCoz