In vertebrates, blood vessels form a treelike, tubular network consisting of arteries, capillaries, and veins. In development, tissue repair, or cancer, the vasculature expands by angiogenesis, the growth and reorganization of existing vessels. By contrast, the earliest vascular structures in the embryo and the two major axial blood vessels (dorsal aorta and cardinal vein) are thought to be generated by the direct assembly of endothelial precursor cells (vasculogenesis) (1, 2). However, on page 294 of this issue (3), Herbert et al. challenge this dogma by showing that cardinal vein formation is very different from what was previously thought.
Zebrafish (Danio rerio) is the shooting star among model organisms for vascular morphogenesis, because it is highly accessible to genetic and live imaging approaches (2). This enabled Herbert et al. to observe that early embryos initially contain only a single axial trunk vessel in the location of the aorta. They propose it to be a common precursor vessel that gives rise to a distinct dorsal aorta and cardinal vein, which can be unambiguously identified by positions and molecular markers. The process involves ventral sprouting from the precursor vessel and the migration of venous-fated endothelial cells (see the figure). Thus, the cardinal vein is formed not by vasculogenesis but by arterial-venous cell segregation, which could be considered a specialized form of angiogenesis or a new mode of vessel growth.
What are the molecular signals controlling the separation of cells within the common precursor vessel? Herbert et al. investigated several known regulators of vascular growth and arterial-venous differentiation. VEGF-C, a member of the vascular endothelial growth factor family, its cellular receptor Flt4/VEGFR3, and the pi \ Oa catalytic subunit of the enzyme phosphoinositide 3-kinase— all of which promote endothelial cell motility (4, 5)—are required for the ventral migration of venous-fated cells and cardinal vein formation. Conversely, VEGF-A, its receptor Kdrl/ VEGFR2, and downstream signaling by the enzyme phospholipase C-yl (PLCyl) restrict this process. Suppressing the latter molecular signals leads to excessive ventral migration of endothelial cells, loss of the aorta, and assembly of a large vessel in the venous position. Signaling triggered by VEGF-A also promotes the expression of activating ligands for the cell surface receptor Notch. Consistent with its role in arterial-venous differentiation (менее 5), Notch promotes dorsal aorta formation and prevents excessive ventral sprouting.
These results suggest that extensive sorting processes separate cells with distinct arterial and venous fates within the common precursor vessel. Ephrin ligands and their cognate Eph receptors control tissue patterning in many biological settings by preventing or resolving cell mixing. In the vasculature, eph-rin-B2 expression in arterial cells increases in response to Notch, whereas expression of the cognate EphB4 receptor is strongest in veins and repressed by Notch (6). Herbert et al. show that ephrin-B2-expressing endothelial cells have limited ability to migrate ventrally, whereas those expressing EphB4 preferentially contribute to the cardinal vein. These findings further delineate a molecular framework for the arterial-venous segregation process.
Although we know very little about the conversion of endothelial cell cords and sprouts into perfused, blood-transporting vessels, it is commonly assumed that blood flow plays a critical role (7). Surprisingly, Herbert et al. find that distinct processes control lumen formation in the dorsal aorta and cardinal vein. Whereas the aortic lumen forms by hollowing of the axial endothelial cell cord (8), hematopoietic cells seem to be important for the cardinal vein. Erythrocytes accumulate beneath the common precursor vessel and move toward the newly forming cardinal vein. They are engulfed by venous endothelial cells and carried away by the circulation after a continuous lumen is established. Thus, lumeniza-tion of the cardinal vein relies on blood cells but precedes blood flow. This somewhat resembles another primitive, embryonic vascular structure: Precursor endothelial cells (angioblasts) enclose hematopoietic cells in embryonic blood islands, which subsequently fuse, form an early vascular plexus, and release blood into the circulation (1).
Could this same principle of arterial-venous segregation apply to mammals? In the mouse, Notch signaling controls the diameter of arteries and veins (9). Moreover, dorsal artery and cardinal vein calibers are reciprocally balanced by Notch, ephrin-B2, and EphB4, and conspicuous connections occur transiently in the anterior part of these two major vessels (10,11). These observations suggest putative similarities between mouse and zebrafish, but formal proof for a conserved arterial-venous segregation process is lacking. An interesting parallel is the development of a second endothelia tubular network—the lymphatic vasculature— later in mouse embryogenesis. It is initiated b differentiation of the first lymphatic endotheli cells within the cardinal vein (4). The segreg tion of these cells from their neighbors, a their migration and assembly into lymph si (which depends on VEGF-C and its recep VEGFR3), recapitulates aspects of the arter venous segregation in zebrafish and hint shared principles.
Herbert et al. provide a first glimpse of an exciting new concept in vascular biology, thus raising many questions. Whether or not other vessels form in the same fashion will need to be determined. It's also not yet clear whether angioblasts have a fixed arterial or venous fate (72) or reprogram in the precursor vessel in response to local cues. If arterial-venous segregation occurs in mammals, we need to consider that distortion of the normal balance during development could be a cause of human cardiovascular malformations.
References
1. I. Flammeef at al. Cell. Physiol. 173, 206 (1997).
2. N. D. Lawson, B. M. Weinstein, Nat. Rev. Genet. 3, 674 (2002).
3. S. P. Herbert et al., Science 326, 294 (2009).
4. K. Alitalo et al., Nature 438, 946 (2005).
5. M. Graupera et at., Nature 453, 662 (2008).
6. F. J. Lin, M. J. Tsai, S. Y. Tsai, EMBO Rep. 8, 920 (2007).
7. M. L. Iruela-Arispe, G. E. Davis, Dev. Cell 16, 222 (2009).
8. L. H. Parker et al., Nature 428, 754 (2004).
9. T. R. Carlson et al., Proc. Natl. Acad. Sri. USA. 102, 9884 (2005).
10. R. Benedito et al., BMC Dev. Biol. 8,117 (2008).
11. Y. H. Kim et al., Development 135, 3755 (2008).
12. T. P. Zhong, 5. Childs,). P. Leu, M. C. Fishman, Nature 414, 216 (2001).
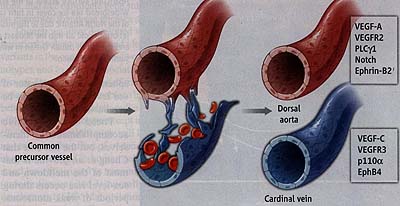 | Blood vessel growth. In zebrafish, the segregation of endothelial cells within a common progenitor vessel gives rise to a dorsal aorta and cardinal vein. The process is controlled by the indicated signaling molecules.
| Blood vessel growth. In zebrafish, the segregation of endothelial cells within a common progenitor vessel gives rise to a dorsal aorta and cardinal vein. The process is controlled by the indicated signaling molecules.
Во время ранних стадий эмбриогенеза позвоночных происходит скоординированная сортировка и расхождение предназначенных для артерий и вен ангиобластов в разные сети артерий и вен, что важно для установления функциональной сосудистой сети. Недавние исследования на мышах и рыбках данио выявили ключевую роль ряда сигнальных путей и транскрипционных регуляторов при артрио-венозной спецификации (7, 2).
Во время развития сосудов у рыбок данио ангиобласты мигрируют из латеральной пластинки мезодермы к срединной линии (3, 4) и в конечном счете образуют первую эмбриональную артерию (dorsal aorta, DA) и вену (caudal vein, CV). Происходящий из хорды Sonic hedgehog, который индуцирует vascular endothelial growth factor a (Vegfa) в вентральных частях сомитов, является важным для дифференцировки ангиобластов (5). Vegfa-индуцированная активация передачи сигналов Notch (5, 6), а также других факторов (2, 7-9), затем способствует артериальной спецификации в субнаборе ангиобластов (4), до артериально-венозного расхождения. Для изучения механизмов сортировки аретрильно-венозных ангиобластов анализировали развитие сосудов с высоким временным разрешением у Tgf(kdrl:GFP)s843 (4) эмбрионов (10). Эти трансгенные эмбрионы экспрессировали green fluorescent protein (GFP) в эндотелиальном клоне, позволяя отслеживать ангиобласты во время ранних стадий сосудистого развития. GFP-позитивные ангиоблесты соединялись по срединной линии, чтобы сформировать одиноный сосудистый тяж на ст. 21 сомита (19.5 hours postfertilization; hpf; Fig. 1, A and B, and fig. SI).
Последующее ремоделирование тяжа ведет к образованию зачатка DA с просветом на 22 hpf. С 21 по 23 hpf, субпопуляция ангиобластов распространяется вентрально от DA зачатка и соединяется (anastomosed) с соседними клетками, чтобы сформировать зачаток CV на 24 hpf (Fig. 1, A to C; figs. SI, S2, and S4; and movies SI and S2). Следовательно, первая артерия и вена обладают общим сосудистым зачатком. Отрастание дорсальных intersegmental vessel (ISV) происходит с регулярными интервалами вдоль DA и инициируется позднее, чем вентральное врастание (23 hpf; Fig. IB), указывая тем самым на разные механизмы, управляющие поведением дорсального и вентрального разрастания. Т.о., DA формируется в результате классического васкулогенеза, тогда как образование CV использует альтернативный механизм, при котором избирательное отрастание предназначенных для вен ангиобластов, последующее прекращение отрастания и межклеточная сегрегация позволяют сформироваться отдельным артериальным и венозным сосудам. Следовательно, в отличие от ангиогенеза, при котором формируемые новые капилляры оказываются в одной сети с исходным сосудом, два не связанных кровеносных сосуда могут происходить из общей группы клеток.
Различия между образованием трубок DA и CV подчеркиваются контрастирующими способами образования просвета. Образование просвета DA происходит в результате образования полости в сосудистом тяже (11), тогда как функциональный CV просвет образуется по другому (Fig. 1, A, D, and E; figs. SI, S2, S5, and S6; and movies S3 and S4). При использовании Tg(gatal:dsRed)сd2 эмбрионов, которые экспрессируют флюоресцентный белок dsRed в эритроцитах (12) и selective plane illumination microscopy (13), мы установили, что первоначальное образование полости в зачатке CV сопровождается быстрым расширением просвета после инвазии эритроцитов, позиционированных вентральнее DA (fig. S6 and movies S3 and S4). Вскоре после этого просвет CV очищается в результате зависимого от тока перемещения эритроцитов, процесс, который не происходит у эмбрионов после инъекции cardiac troponin t2 (tnnt2) morpholino oligonucleotide (MO), у которых отсутствует циркуляция (14) (Fig. IE).
Предполагается, что артериально-венозное расхождение и генерация дух отдельных сосудов может достигаться в результате избирательного включения предназначенных для вен ангиобластов в вентральные отрастания при ограничении вентральной миграции предназначенных для артерий ангиобластов. Vegfa, как было установлено, дифференциально регулирует поведение разрастания ангиобластов, т.к. способствует экспрессии Notch лиганда delta-like 4 (dll4) (15-17). Экспрессия D114 в кончиках клеток ISV активирует передачу сигналов Notch в соседних клетках, ограничивая тем самым поведение дорсального разрастания. Инъекции эмбрионам vegfa MO показали, что передача сигналов Vegfa также ограничивает поведение вентральной миграции ангиобластов (Fig. 2, table SI, fig. S7, and movies S5 and S6). У vegfa MO-инъецированных эмбрионов, ангиобласты первоначально соединяются, чтобы сформировать сосудистый тяж, но затем с излишком мигрируют вентрально, неспособные сегрегировать и, наконец, генерировать одиночную сосудистую трубку, включающую tg(gata1:dsRed)sd2-позитивные эритроциты. Следовательно, Vegfa-обусловленная артериальная спецификация необходима для контроля и завершения вентральной миграции ангиобластов и поддержания интактной DA. Сходный фенотип наблюдался после инъекции MO по plcγl, который кодирует ключевой нижестоящий компонент передачи сигналов Vegfa (6), и после ингибирования активации рецептора Vegfa с использованием SU5416 (Fig. 2, table SI, fig. S7, and movies S5 and S7). ISV разрастание также нарушается у Vegfa-дефицитных эмбрионов, это согласуется с противоположными ролями передачи сигналов Vegfa при индукции дорсального отрастания (sprouting) (6) и ограничения вентрального разрастания. Vegfa влияет на поведение дорсального отрастания косвенно, активируя передачу сигналов Notch (15-17). Соответственно, N-[N-(3,5-difluorophenacetyl)-1 -alanyl]-S-phenylglycine t-butyl ester (DAPT)- обусловленное ингибирование передачи сигналов Notch способствует избыточному вентральному отрастанию(Fig. 2B). Более того, избыточная вентральная миграция обнаруживается также при инъекциях MO по gridlock/hey2, который кодирует ключевой транскрипционный эффектор передачи сигналов notch signaling (7). Т.о., завершение вентрального разрастания регулируется с помощью генов, стоящих ниже передачи сигналов Vegfa и Notch.
Напротив, морфогенез существенно нарушается широкого круга phosphoinositide 3-kinase (PI3K) ингибитором LY294002 (Fig. 2B). Хотя воздействие LY294002 не влияет на общее количество числа ангиобластов, подтверждая отсутствие дефектов пролиферации (table S2), вентральное разрастание нарушается и существенно большее количество клеток остается в DA (Fig. 3, A to C), это согласуется с ролью PI3K в вентральном разрастание ангиобластов [supporting online material (SOM) text SI]. Миграция клеток во время ангиогенного разрастания избирательно нуждается в передаче сигналов посредством p110α изоформы PI3K ниже активации Vegf рецептора (18). Поэтому мы тестировали гипотезу, что подобный p1lOα-зависимый механизм может контролировать вентральное разрастание и образование CV. Мы исследовали группу I семейства PI3K (pllOα, p110β, p110σ, b pllOγ) с помощью изоформ-избирательных ингибиторов (19, 20) (table S3), чтобы избежать ранних онтогенетических дефектов и компенсировать взаимодействия, ассоциированные с генетически молчащими индивидуальными изоформами (19, 21, 22). В соответствии с ролью p110α, обработка эмбрионов ингибиторами в концентрациях, которые ингибируют p110α, блокировала морфогенез вены (fig. S12 and SOM text S2). Использование LY294002 или изоформы избирательного ингибитора, AS605240, в концентрациях, которые блокируют вентральное разрастание, также нарушало дорсальные ответвления (Fig. 3, A to C), указывая тем самым на общую потребность в PI3K при артериально-венозном sprouting.
Общая роль p110α в дорсальном и вентральном разрастании ангиобластов указывает на то, что общие пути регулируют эти процессы. Vegfa способствует дорсальному врастанию ISV после активации его рецептора, Flkl, и нижестоящей pllOα-обусловленной передаче сигналов (18). Ограниченная венозная экспрессия родственного Vegfc рецепторного гена flt4 (fig. S8) подтвержает роль p110α в морфогенезе вены ниже Flt4-обеспечиваемой передачи сигналов. Хотя вентральное разрастание и миграция ангиобластов существенного задерживается у vegfc или flt4 MO-инъецированных эмбрионов (fig. S13 and table S4) , возможное функциональное перекрывание с др. компонентами передачи сигналов Vegf или компенсация за счет альтернативных механизмов, делает возможной образование вены в более поздние промежутки времени. Однако роль передачи сигналов Flt4 в вентральном разрастании ангиобластов подтверждается трансплантациями клеток от Tg(kdrl:GFP)s843 доноров в не трансгенных дикого типа хозяев. Значительно меньшее количество flt4 MO-инъецированных, чем контрольных MO-инъецированных, происходящих от доноров клеток вносит вклад в CV (Fig. 3, D and E, and table 55). Более того, избыточный вклад plcγl MO-инъецированных, производных от донора клеток в CV, блокируется ко-инъекциями flt4 MO. Следовательно, передача сигналов Vegfa/Flkl и Vegfc/Flt4 регулирует многонаправленно артериально-венозное разрастание (sprouting). Однако, vegfc не экспрессируется вентрально по отнрошению к DA, но в самой DA (fig. S14), указывая, что др. механизмы могут ориентировать направление миграции венозных ангиобластов вентрально.
EphB4 рецепторная тирозин киназа и её расположенный на плазматической мембране лиганд, EphrinB2 (EfhB2), демаркируют венозный и артериальный домены, соотв. (23). Исследования EphB4- и EfhB2-нулевых мышей выявляют роли для прямой и обратной передачи сигналов EphB4-EfhB2 в морфогенезе сосудов (23-25); , однако точная функция и способ действия двунаправленной передачи сигналов EphB4-EmB2 остается неизвестным (1). Наблюдения, что экспрессиия Efhb2a у рыбок данио ограничена наиболее дорсальными клетками сосудистого тяжа (4) (fig. S15) и её тонкая регуляция с помощью Vegfa (figs. Sll and SI6), а также передачи сигналов Notch (5-7) приводит нас к гипотезе о роли Ephb4a-Efhb2a в направленном контроле миграции ангиобластов. В согласии с этой гипотезой генерация самостоятельных аптериальных и венозных сосудов нарушена и PDK-зависимая вентральная миграция ангиобластов разрегулирована у efhb2a или ephb4a MO-инъецированных эмбрионов (Fig. 4, A and B, fig. SI7, and table S6). В противоположность vegfa MO-инъецированным эмбионам, efhb2a и ephb4a MO-инъецированные эмбрионы всё ещё формируют ISVs (Figs. 2A and 4, A and B), указывая, что ангиобласты мигрируют как дорсально. так и вентрально, но неспособны сегрегировать. Чтобы выяснить самостоятельные функции Efhb2a и EphMa в артериально-венозной сегрегации мы трансплантировали клетки от Tg(kdrl:GFP)s843 доноров нетрансгенным дикого типа хозяевам. efiib2α MO-инъецированные, происходящие от доноров клетки вносили вклад в CV с вдвое большей частотой чем в контрольных клетках(Fig. 4C, table S6, and figs. S18 and S19). Напротив, значительно меньше ephb4a MO-инъецированных, происходящих от доноров клеток, вносит вклад в CV по сравнению с контролем. Т.о., Efhb2a ограничивает вентральную миграцию венозных ангиобластов, подтверждая роль двунаправленного Ephb4a-Efhb2a-обусловленного отталкивания между артериальными и венозными клетками при контроле направления разрастаний артериальных и венозных клеток (fig. S19). Более того, донорские клетки избыточно экспрессирующие efnb2a или ephb4a преимущественно вносят вклад в ISVs, это согласуется с увеличением отталкивания артериальных ангиобластов от ephb4a-экспрессирующих венозных клеток в ответ на увеличение Efhb2a или мощное форсированное Ephb4a-Efhb2a цис-взаимодействие в ответ на повышение Ephb4a (Fig. 4C, table S6, and figs. SI8 and SI9). Донорские клетки, избыточно экспрессирующие обратный signaling-deficient Efhb2a (26) (ΔC-Efhb2a), не сохраняются в DA (Fig. 4C, table S6, and figs. S18 and S19), подтверждая роль обратной передачи сигналов Ephb4a-Efnb2a в регуляции артериально-венозного расхождения. Следовательно, Vegfa-индуцированная экспрессиия efnb2a и двунаправленная передача сигналов Ephb4a-Efnb2a избирательно исключают артериальные ангиобласты из венозных отрастаний (sprouts) и способствуют вентральной миграции венозных ангиобластов. Эти данные подтверждают концепцию, что Notch, EfnB2, and EphB4 могут регулировать размеры развивающихся артерий и вен и что эндотелиальные клетки из DA могут вносить вклад в формирование CV у мышей (27). Т.о., репульсивная передача сигналов Ephb4a-Efnb2a регулирует направляющий контроль поведения отрастания ангиобластов. Предыдущая работа была сфокусирована на идентификации сигналов, которые модулируют спецификацию артериально-венозных ангиобластов, но как эти сигналы в конечном итоге влияют на клеточное поведение, чтобы сортировать и сегрегировать ангиобласты в самостоятельные сосуды, неизвестно. Наши данные представляют клеточные рамки морфогенеза артериально-венозных трубок, при этом координирующую регуляцию поведения разрастаний артериальных и венозных ангиобластов с помощью передачи сигналов Vegf, Notch и Ephb4a-Efnb2a эффективное формирование эмбриональной сосудистой сети (fig. S20 and SOM text S3) и проливают свет на то, как многонаправленные артериальные и венозные разрастания могут быть достигнуты благодаря поддержанию целостности предшественников сосудов. Наиболее важно, что мы открыли альтернативный способ сосудистого развития, который делает возможным расхождение клеток на дискретные артериальные и венозные сосуды из одного общего сосудистого предшественника. Во время ранних стадий эмбриогенеза позвоночных происходит скоординированная сортировка и расхождение предназначенных для артерий и вен ангиобластов в разные сети артерий и вен, что важно для установления функциональной сосудистой сети. Недавние исследования на мышах и рыбках данио выявили ключевую роль ряда сигнальных путей и транскрипционных регуляторов при аретрио-венозной спецификации (7, 2).
Во время развития сосудов у рыбок данио ангиобласты мигрируют из латеральной пластинки мезодермы к срединной линии (3, 4) и в конечном счете образуют первую эмбриональную артерию (dorsal aorta, DA) и вену (caudal vein, CV). Происходящий из хорды Sonic hedgehog, который индуцирует vascular endothelial growth factor a (Vegfa) в вентральных частях сомитов, является важным для дифференцировки ангиобластов (5). Vegfa-индуцированная активация передачи сигналов Notch (5, 6), а также других факторов (2, 7-9), затем способствует артериальной спецификации в субнаборе ангиобластов (4), до артериально-венозного расхождения. Для изучения механизмов сортировки аретрильно-венозных ангиобластов анализировали развитие сосудов с высоким временным разрешением у Tgf(kdrl:GFP)s843 (4) эмбрионов (10). Эти трансгенные эмбрионы экспрессировали green fluorescent protein (GFP) в эндотелиальном клоне, позволяя отслеживать ангиобласты во время ранних стадий сосудистого развития. GFP-позитивные ангиобласты соединялись по срединной линии, чтобы сформировать одиноный сосудистый тяж на ст. 21 сомита (19.5 hours postfertilization; hpf; Fig. 1, A and B, and fig. SI).
Последующее ремоделирование тяжа ведет к образованию зачатка DA с просветом на 22 hpf. С 21 по 23 hpf, субпопуляция ангиобластов распространяется вентрально от DA зачатка и соединяется (anastomosed) с соседними клетками, чтобы сформировать зачаток CV на 24 hpf (Fig. 1, A to C; figs. SI, S2, and S4; and movies SI and S2). Следовательно, первая артерия и вена обладают общим сосудистым зачатком. Отрастание дорсальных intersegmental vessel (ISV) происходит с регулярными интервалами вдоль DA и инициируется позднее, чем вентральное врастание (23 hpf; Fig. IB), указывая тем самым на разные механизмы, управляющие поведением дорсального и вентрального разрастания. Т.о., DA формируется в результате классического васкулогенеза, тогда как образование CV использует альтернативный механизм, при котором избирательное отрастание предназначенных для вен ангиобластов, последующее прекращение отрастания и межклеточная сегрегация позволяют сформироваться отдельным артериальным и венозным сосудам. Следовательно, в отличие от ангиогенеза, при котором формируемые новые капилляры оказываются в одной сети с исходным сосудом, два не связанных кровеносных сосуда могут происходить из общей группы клеток.
Различия между образованием трубок DA и CV подчеркиваются контрастирующими способами образования просвета. Образование просвета DA происходит в результате образования послости в сосудистом тяже (11), тогда как функциональный CV просвет образуется по другому (Fig. 1, A, D, and E; figs. SI, S2, S5, and S6; and movies S3 and S4). При использовании Tg(gatal:dsRed)сd2 эмбрионов, которые экспрессируют флюоресцентный белок dsRed в эритроцитах (12) и selective plane illumination microscopy (13), мы установили, что первоначальное образование полости в зачатке CV сопровождается быстрым расширением просвета после инвазии эритроцитов, позиционированных вентральнее DA (fig. S6 and movies S3 and S4). Вскоре после этого просвет CV очищается в результате зависимого от тока перемещения эритроцитов, процесс, который не происходит у эмбрионов после инъекции cardiac troponin t2 (tnnt2) morpholino oligonucleotide (MO), у которых отсутствует циркуляция (14) (Fig. IE).
Предполагается, что артериально-венозное расхождение и генерация дух отдельных сосудов может достигаться в результате избирательного включения предназначенных для вен ангиобластов в вентральные отрастания при ограничении вентральной миграции предназначенных для артерий ангиобластов. Vegfa, как было установлено, дифференциально регулирует поведение разрастания ангиобластов, т.к. способствует экспрессии Notch лиганда delta-like 4 (dll4) (15-17). Экспрессия D114 в кончиках клеток ISV активирует передачу сигналов Notch в соседних клетках, ограничивая тем самым поведение дорсального разрастания. Инъекции эмбрионам vegfa MO показали, что передача сигналов Vegfa также ограничивает поведение вентральной миграции ангиобластов (Fig. 2, table SI, fig. S7, and movies S5 and S6). У vegfa MO-инъецированных эмбрионов, ангиобласты первоначально соединяются, чтобы сформировать сосудистый тяж, но затем с излишком мигрируют вентрально, неспособные сегрегировать и, наконец, генерировать одиночную сосудистую трубку, включающую tg(gata1:dsRed)sd2-позитивные эритроциты. Следовательно, Vegfa-обусловленная артериальная спецификация необходима для контроля и завершения вентральной миграции ангиобластов и поддержания интактной DA. Сходный фенотип наблюдался после инъекции MO по plcγl, который кодирует ключевой нижестоящий компонент передачи сигналов Vegfa (6), и после ингибирования активации рецептора Vegfa с использованием SU5416 (Fig. 2, table SI, fig. S7, and movies S5 and S7). ISV разрастание также нарушается у Vegfa-дефицитных эмбрионов, это согласуется с противоположными ролями передачи сигналов Vegfa при индукции дорсального отрастания (sprouting) (6) и ограничения вентрального разрастания. Vegfa влияет на поведение дорсального отрастания косвенно, активируя передачу сигналов Notch (15-17). Соответственно, N-[N-(3,5-difluorophenacetyl)-1 -alanyl]-S-phenylglycine t-butyl ester (DAPT)- обусловленное ингибирование передачи сигналов Notch способствует избыточному вентральному отрастанию(Fig. 2B). Более того, избыточная вентральная миграция обнаруживается также при инъекциях MO по gridlock/hey2, который кодирует ключевой транскрипционный эффектор передачи сигналов notch signaling (7). Т.о., завершение вентрального разрастания регулируется с помощью генов, стоящих ниже передачи сигналов Vegfa и Notch.
Напротив, морфогенез существенно нарушается широкого круга phosphoinositide 3-kinase (PI3K) ингибитором LY294002 (Fig. 2B). Хотя воздействие LY294002 не влияет на общее количество числа ангиобластов, подтверждая отсутствие дефектов пролиферации (table S2), вентральное разрастание нарушается и существенно большее количество клеток остается в DA (Fig. 3, A to C), это согласуется с ролью PI3K в вентральном разрастание ангиобластов [supporting online material (SOM) text SI]. Миграция клеток во время ангиогенного разрастания избирательно нуждается в передаче сигналов посредством p110α изоформы PI3K ниже активации Vegf рецептора (18). Поэтому мы тестировали гипотезу, что подобный p1lOα-зависимый механизм может контролировать вентральное разрастание и образование CV. Мы исследовали группу I семейства PI3K (pllOα, p110β, p110σ, и pllOγ) с помощью изоформ-избирательных ингибиторов (19, 20) (table S3), чтобы избежать ранних онтогенетических дефектов и компенсировать взаимодействия, ассоциированные с генетически молчащими индивидуальными изоформами (19, 21, 22). В соответствии с ролью p110α, обработка эмбрионов ингибиторами в концентрациях, которые ингибируют p110α, блокировала морфогенез вены (fig. S12 and SOM text S2). Использование LY294002 или изоформы избирательного ингибитора, AS605240, в концентрациях, которые блокируют вентральное разрастание, также нарушало дорсальные ответвления (Fig. 3, A to C), указывая тем самым на общую потребность в PI3K при артериально-венозном sprouting.
Общая роль p110α в дорсальном и вентральном разрастании ангиобластов указывает на то, что общие пути регулируют эти процессы. Vegfa способствует дорсальному врастанию ISV после активации его рецептора, Flkl, и нижестоящей pllOα-обусловленной передаче сигналов (18). Ограниченная венозная экспрессия родственного Vegfc рецепторного гена flt4 (fig. S8) подтверждает роль p110α в морфогенезе вены ниже Flt4-обеспечиваемой передачи сигналов. Хотя вентральное разрастание и миграция ангиобластов существенно задерживается у vegfc или flt4 MO-инъецированных эмбрионов (fig. S13 and table S4) , возможное функциональное перекрывание с др. компонентами передачи сигналов Vegf или компенсация за счет альтернативных механизмов, делает возможной образование вены в более поздние промежутки времени. Однако роль передачи сигналов Flt4 в вентральном разрастании ангиобластов подтверждается трансплантациями клеток от Tg(kdrl:GFP)s843 доноров в не трансгенных дикого типа хозяев. Значительно меньшее количество flt4 MO-инъецированных, чем контрольных MO-инъецированных, происходящих от доноров клеток вносит вклад в CV (Fig. 3, D and E, and table 55). Более того, избыточный вклад plcγl MO-инъецированных, производных от донора клеток в CV, блокируется ко-инъекциями flt4 MO. Следовательно, передача сигналов Vegfa/Flkl и Vegfc/Flt4 регулирует многонаправленно артериально-венозное разрастание (sprouting). Однако, vegfc не экспрессируется вентрально по отнрошению к DA, но в самой DA (fig. S14), указывая, что др. механизмы могут ориентировать направление миграции венозных ангиобластов вентрально.
EphB4 рецепторная тирозин киназа и её расположенный на плазматической мембране лиганд, EphrinB2 (EfhB2), демаркируют венозный и артериальный домены, соотв. (23). Исследования EphB4- и EfhB2-нулевых мышей выявляют роли для прямой и обратной передачи сигналов EphB4-EfhB2 в морфогенезе сосудов (23-25); , однако точная функция и способ действия двунаправленной передачи сигналов EphB4-EmB2 остается неизвестным (1). Наблюдения, что экспрессия Efhb2a у рыбок данио ограничена наиболее дорсальными клетками сосудистого тяжа (4) (fig. S15) и её тонкая регуляция с помощью Vegfa (figs. Sll and SI6), а также передачи сигналов Notch (5-7) приводит нас к гипотезе о роли Ephb4a-Efhb2a в направленном контроле миграции ангиобластов. В согласии с этой гипотезой генерация самостоятельных аптериальных и венозных сосудов нарушена и PDK-зависимая вентральная миграция ангиобластов разрегулирована у efhb2a или ephb4a MO-инъецированных эмбрионов (Fig. 4, A and B, fig. SI7, and table S6). В противоположность vegfa MO-инъецированным эмбрионам, efhb2a и ephb4a MO-инъецированные эмбрионы всё ещё формируют ISVs (Figs. 2A and 4, A and B), указывая, что ангиобласты мигрируют как дорсально., так и вентрально, но неспособны сегрегировать. Чтобы выяснить самостоятельные функции Efhb2a и EphMa в артериально-венозной сегрегации мы трансплантировали клетки от Tg(kdrl:GFP)s843 доноров не трансгенным дикого типа хозяевам. efiib2α MO-инъецированные, происходящие от доноров клетки вносили вклад в CV с вдвое большей частотой чем в контрольных клетках(Fig. 4C, table S6, and figs. S18 and S19). Напротив, значительно меньше ephb4a MO-инъецированных, происходящих от доноров клеток, вносит вклад в CV по сравнению с контролем. Т.о., Efhb2a ограничивает вентральную миграцию венозных ангиобластов, подтверждая роль двунаправленного Ephb4a-Efhb2a-обусловленного отталкивания между артериальными и венозными клетками при контроле направления разрастаний артериальных и венозных клеток (fig. S19). Более того, донорские клетки избыточно экспрессирующие efnb2a или ephb4a преимущественно вносят вклад в ISVs, это согласуется с увеличением отталкивания артериальных ангиобластов от ephb4a-экспрессирующих венозных клеток в ответ на увеличение Efhb2a или мощное форсированное Ephb4a-Efhb2a цис-взаимодействие в ответ на повышение Ephb4a (Fig. 4C, table S6, and figs. SI8 and SI9). Донорские клетки, избыточно экспрессирующие обратный signaling-deficient Efhb2a (26) (ΔC-Efhb2a), не сохраняются в DA (Fig. 4C, table S6, and figs. S18 and S19), подтверждая роль обратной передачи сигналов Ephb4a-Efnb2a в регуляции артериально-венозного расхождения. Следовательно, Vegfa-индуцированная экспрессия efnb2a и двунаправленная передача сигналов Ephb4a-Efnb2a избирательно исключают артериальные ангиобласты из венозных отрастаний (sprouts) и способствуют вентральной миграции венозных ангиобластов. Эти данные подтверждают концепцию, что Notch, EfnB2, and EphB4 могут регулировать размеры развивающихся артерий и вен и что эндотелиальные клетки из DA могут вносить вклад в формирование CV у мышей (27). Т.о., репульсивная передача сигналов Ephb4a-Efnb2a регулирует направляющий контроль поведения отрастания ангиобластов. Предыдущая работа была сфокусирована на идентификации сигналов, которые модулируют спецификацию артериально-венозных ангиобластов, но как эти сигналы в конечном итоге влияют на клеточное поведение, чтобы сортировать и сегрегировать ангиобласты в самостоятельные сосуды, неизвестно. Наши данные представляют клеточные рамки морфогенеза артериально-венозных трубок, при этом координирующую регуляцию поведения разрастаний артериальных и венозных ангиобластов с помощью передачи сигналов Vegf, Notch и Ephb4a-Efnb2a эффективное формирование эмбриональной сосудистой сети (fig. S20 and SOM text S3) и проливают свет на то, как многонаправленные артериальные и венозные разрастания могут быть достигнуты благодаря поддержанию целостности предшественников сосудов. Наиболее важно, что мы открыли альтернативный способ сосудистого развития, который делает возможным расхождение клеток на дискретные артериальные и венозные сосуды из одного общего сосудистого предшественника.
Сайт создан в системе
uCoz  | Blood vessel growth. In zebrafish, the segregation of endothelial cells within a common progenitor vessel gives rise to a dorsal aorta and cardinal vein. The process is controlled by the indicated signaling molecules.
| Blood vessel growth. In zebrafish, the segregation of endothelial cells within a common progenitor vessel gives rise to a dorsal aorta and cardinal vein. The process is controlled by the indicated signaling molecules.