Первые дифференцирующиеся нейроны в головном мозге эмбрионов позвоночных формируют ранние каркасные тракты аксонов (Chedotal et al., 1995; Chitnis and Kuwada, 1990; Doldan et al., 2000; Easter et al., 1993; Hartenstein, 1993; Ishikawa et al., 2004; Mastick and Easter, 1996; reviewed in Nieuwenhuys, 1998; Wilson et al., 1990). Ранний каркас из аксонов состоит из нескольких продольных, поперечных и комиссуральных трактов, включая medial longitudinal fascicle (MLF) и posterior commissure (PC), происходящие из области midbrain-forebrain border (MFB) (reviewed in Ahsan et al., 2007). Было предположено, что ранние аксональные каркасы закладывают основные пути в головном мозге путем формирования субстратов для будущих последующих аксонов (Chitnis and Kuwada, 1991, reviewed in Hjorth and Key, 2002). Нарушение образования этих ранних трактов д. приводить к неправильному расположению трактов. развивающихся позднее. В согласии с этой идеей удаление ранних нейронов в вентральной части региона MFB приводило позднее к тому, что PC аксоны вытягивались вдоль аберрантных путей (Chitnis and Kuwada, 1991; Patel et al., 1994). Сходным образом MLF аксоны участвуют в формировании reticulospinal проекций в заднем мозге (Hernandez-Montiel et al., 2003). В головном мозге кур рано развиваются и несколько др. трактов, которые не рассматриваются при описании развития раннего аксонального каркаса у anamniotes (Fig. 1). В частности нейроны мезэнцефалического ядра тройничного нерва и tectobulbar тракт вносят вклад аксонами в lateral longitudinal fascicle (LLF), которые видны в головном мозге кур со ст. Hamburger & Hamilton (HH) 17. Двигательные нейроны в oculomotor ядре также представлены в мезэнцефалоне эмбрионов кур.
Аксоны из раннего аксонального каркаса следуют точными путями, это указывает на то, что их проекции контролируются сигналами наведения. Большинство сигналов наведения длинного ранга аксонов относят к членами трех, сильно законсервированных семейств секретируемых молекул наведения, Netrins, Slits и Class3 Semaphorins (reviewed in Chilton, 2006; Cooper, 2002; Dickson, 2002). Netrins позвоночных первоначально были изолированы как факторы, происходящие из вентральной пластинки нервной трубки, которые способствуют вытягиванию комиссуральных аксонов в спинном мозге (Serafini et al. , 1994). Последующие исследования показали, что они действуют или как хеморепелленты или хемоаттрактанты в зависимости от присутствиях рецептора на развивающихся аксонах (reviewed in Moore et al., 2007; Tessier-Lavigne and Goodman, 1996). Binding of Netrin to DCC (Keino-Masu et al., 1996) или его паралога, Neogenin (Vielmetter et al., 1994), это обеспечивает хемоаттрактивную реакцию, тогда как соединение только с Unc5 (Leonardo et al., 1997) или в комбинации с Neogenin ведет к отталкиванию развивающихся аксонов. Интересно, что DCC не были описаны у кур, несмотря на консервацию у др. позвоночных. Slits являются chemorepulsive молекулами ведения аксонов, они хорошо известны своей ролью по предупреждению повторного пересечения комиссуральными аксонами срединной линии у Drosophila (Tear et al., 1993). У позвоночных идентифицированы три гомолога Slit и два гомолога Robo рецептора (Brose et al. , 1999; Vargesson et al., 2001). Вместе с дивергентным рецептором Rig-1, они участвуют в контроле образования комиссур в спинном мозге (reviewed in Dickson and Gilestro, 2006). Секретируемые Class3 Semaphorins, первоначально были названы "Collapsins", впервые они идентифицированы благодаря своей способности вызывать коллапс ростовых конусов (Luo et al., 1993; Luo et al., 1995). Они образуют большое семейство молекул наведения с 7 членами, идентифицированными у амниот, но, по-видимому, ограничены позвоночными (reviewed in Raper, 2000). Class3 Semaphorins соединяется с Neuropilin рецепторами (He and Tessier-Lavigne, 1997; Kolodkin et al., 1997), которые лишены внутриклеточного домена и поэтому формируют комплекс с Plexin ко-рецепторами, чтобы обеспечить сигнальную трансдукцию (Takahashi et al., 1999; Tamagnone et al., 1999). Два Neuropilins и несколько Plexins были найдены у позвоночных (reviewed in Raper, 2000).
Поскольку ход ранних трактов в головном мозге у эмбрионов позвоночных документирован у нескольких видов, включая кур (Chedotal et al., 1995), молекулярные механизмы, управляющие наведением аксонов вдоль индивидуальных путей раннего аксонового каркаса, менее известны. Предыдущие исследования на Xenopus касались передачи сигналов Netrin и Semaphorin в формировании вентральных комиссур (Anderson et al., 2000a; Anderson et al., 2000b), тогда как Slits участвовали в фасцикуляции MLF у кур (Molle et al., 2004) и формировании тракта постоптических комиссур у рыбок данио (Devine and Key, 2008). Пока в целом мало известно о экспрессии молекул ведения в ростральной части головного мозга в отношении развивающихся трактов. Исследования на рыбках данио подчеркивают корреляцию паттернов экспрессии генов с трактами аксонов (Hjorth and Key, 2001), но исследованы паттерны генов скорее, чем молекулы наведения аксонов. Целью исследования был анализ экспрессии основных групп молекул наведения аксонов в вентральном pretectum и мезэнцефалоне и корреляция паттерна их экспрессии с позицией нейронов и трактов аксонов. Наши результаты показали. что Netrins, Slits и Semaphorins и их рецепторы уже экспрессируются во время инициальных выростов первых аксонов в ростральную часть головного мозга и показали возможные механизмы ведения для продольных трактов.
Class3 Semaphorins, визуализовался с использованием гибридизации in situ на эмбрионах, инкубированных в течение 2 дней (E2, HH13-15), 3 дней (E3, HH17-18) и 4 дней (E4, HH20-21), т.e. между началом образования аксональных трактов в головном мозге и появлением полностью сформированного раннего аксонального каркаса. In situ гибридизация комбинировалась с иммуногистохимией, используя антитела против нейрофиламеент, что делало возможным одновременную визуализацию экспрессии сигналов наведения и тракты аксонов.
Netrins and their receptors Наиболее охарактеризованным Netrin рецептором позвоночных является DCC (Keino-Masu et al., 1996), который, однако, ещё не был описан у кур. Когда наши попытки выделить куриный DCC с помощью PCR с degenerate праймерами не удались, мы подвергли геном кур секвенированию на DCC и получили доказательства делеции всего локуса DCC во время эволюции птиц (manuscript in preparation). Поэтому из-за очевидного отсутствия DCC у кур, связывание Netrin базируется в основном на Neogenin и рецепторе второго класса, Unc5, хотя недавние исследования указывают на то. что др. белки, подобные Dscam также могут действовать как рецепторы Netrin (Andrews et al., 2008). Мы пронализировали паттерны экспрессии молекул ведения аксонов
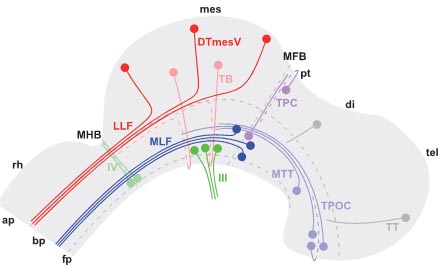 Fig. 1. Schematic representation of early brain organisation in the chick. The diagram depicts regions, neuron clusters and axon tracts in the early embryonic chick brain at E4. The prominent ventral longitudinal bundle (blue) is made up of the TPOC originating in the hypothalamus, the MTT from the ventral diencephalon, and the MLF from the ventral midbrain-forebrain border. At this stage, all axons in the ventral bundle project caudally. The LLF in the mesencephalon is formed of ipsilateral axons from the DTmesV and contralateral axons from the TB (red). The DTmesV neurons are located along the dorsal midline of the mesencephalon and project their axons ventrally along the tectum before turning sharply caudally. The TB fibres extend from the tectum ventrally across the ventral midline before joining the contralateral LLF. Just rostral to the MFB, transversal axons form the TPC (pink). Neurons contributing to the TPC are located dorsally and ventrally in the caudal pretectum. Somatic motor neurons at the MHB (trochlear) and in the mesencephalon (ocular) yield two of the cranial nerves (green). The tracts that are the focus of this study (MLF, DTmesV, III) are shown in darker colour. Key: III (oculomotor nerve), IV (trochlear nerve), ap (alar plate), bp (basal plate), di (diencephalon), DTmesV (dorsal tract of the mesencephalic nucleus of the trigeminal nerve), fp (floor plate), LLF (lateral longitudinal fascicle), MFB (midbrainforebrain border), MHB (midbrain-hindbrain border), MLF (medial longitudinal fascicle), mes (mesencephalon), MTT (mamillotegmental tract), pt (pretectum), rh (rhombencephalon), TB (tectobulbar tract), tel (telencephalon), TPC (tract of the posterior commissure), TPOC (tract of the postoptic commissure), TT (telencephalic tract).
Fig. 1. Schematic representation of early brain organisation in the chick. The diagram depicts regions, neuron clusters and axon tracts in the early embryonic chick brain at E4. The prominent ventral longitudinal bundle (blue) is made up of the TPOC originating in the hypothalamus, the MTT from the ventral diencephalon, and the MLF from the ventral midbrain-forebrain border. At this stage, all axons in the ventral bundle project caudally. The LLF in the mesencephalon is formed of ipsilateral axons from the DTmesV and contralateral axons from the TB (red). The DTmesV neurons are located along the dorsal midline of the mesencephalon and project their axons ventrally along the tectum before turning sharply caudally. The TB fibres extend from the tectum ventrally across the ventral midline before joining the contralateral LLF. Just rostral to the MFB, transversal axons form the TPC (pink). Neurons contributing to the TPC are located dorsally and ventrally in the caudal pretectum. Somatic motor neurons at the MHB (trochlear) and in the mesencephalon (ocular) yield two of the cranial nerves (green). The tracts that are the focus of this study (MLF, DTmesV, III) are shown in darker colour. Key: III (oculomotor nerve), IV (trochlear nerve), ap (alar plate), bp (basal plate), di (diencephalon), DTmesV (dorsal tract of the mesencephalic nucleus of the trigeminal nerve), fp (floor plate), LLF (lateral longitudinal fascicle), MFB (midbrainforebrain border), MHB (midbrain-hindbrain border), MLF (medial longitudinal fascicle), mes (mesencephalon), MTT (mamillotegmental tract), pt (pretectum), rh (rhombencephalon), TB (tectobulbar tract), tel (telencephalon), TPC (tract of the posterior commissure), TPOC (tract of the postoptic commissure), TT (telencephalic tract).
Discussion
Многие рано развивающиеся аксональные тракты в головном мозге позвоночных или происходят или пересекают средний мозг и pretectum. Пока мало известно о сигналах, управляющих ростом этих аксонов. Мы исследовали сигналы, управляющие ростом этих аксонов. Мы исследовали паттерны экспрессии основных секретируемых молекул наведения аксонов, Slits, Netrins и Class3 Semaphorins, и их рецепторов во время ранних стадий развития головного мозга. Многие из сигналов ведения экспрессируются в виде самостоятельных паттернов во время роста пионерских аксонов, и несколько рецепторов соотв. экспрессируются в специфических группах нейронов. Примечательно, что наш анализ ограничен уровнем мРНК и не касается секретируемых белков наведения аксонов или действительного присутствия рецепторных молекул на ростовых конусах ранних аксонов.
The longitudinal guidance system Два продольных тракта аксонов образуются в раннем среднем мозге кур, medial (MLF) и lateral (LLF) longitudinal fascicles. MLF формируются нейронами, расположенными в вентральной части MFB, которые проецируют свои аксоны каудально. Тракт идет как плохо упакованный пучок, соседствующий с вентральной пластинкой нервной трубки через средний и задний мозг в направлении спинного мозга (Ahsan et al., 2007). LLF дает две группы нейронов: нейроны в мезэнцефалическом ядре тройничного нерва обнаруживаются дорсально вблизи дорсальной пластинки нервной трубки и посылают свои аксоны ipsilaterally в тройничный ганглий; нейроны, диспергированные в tectum, в основном проецируют коллатерали, рост их аксонов происходит поперек срединной линии перед соединением LLF, чтобы сформировать tectobulbar тракт.
Паттерны экспрессии некоторых молекул ведения аксонов коррелируют с продольными трактами. Так, Netrins и Slits экспрессируются в разных доменах в или вокруг вентральной пластинки нервной трубки. В спинном мозге эти сигналы ведения контролируют образование комиссур, при этом Netrin действует как аттрактант, а Slit как репелент (reviewed in Chilton, 2006; reviewed in Dickson and Gilestro, 2006). Как и в ранних сообщениях, описывающих Netrin1, как экспрессирующийся в донной пластинке нервной трубки вплоть до каудальной части диэнцефалона (Kennedy et al., 1994), мы обнаружили наиболее сильную экспрессию в вентральной пластинке среднего мозга и pretectum, уменьшающуюся дорсально в базальной пластинке (Fig. 6 A,B). Домен экспрессии включает аксоны MLF, но наиболее интенсивный сигнал Netrin1 располагается в вентральнее MLF. В противовес Netrin1, экспрессия Netrin2 во времени и пространственно ассоциирует с появлением LLF, располагаясь вдоль тракта дорсально и вентрально (Fig. 6 A,B). Среди Netrin рецепторов, Neogenin экспрессируется широко в среднем мозге, тогда как домен экспрессии Unc5H3, рецептора, обеспечивающего chemorepulsion с помощью Netrins, коррелирует с позицией MLF нейронов (Fig. 6 C,D). Мы оказались неспособны выявить DCC у кур, возможно из-за делеции этого гена, это неожиданно, поскольку нокаут DCC у мыши ведет к гибели новорожденных (Fazeli et al., 1997), и DCC и Neogenin обнаруживают самостоятельные разные паттерны экспрессии у мыши (Gad et al., 1997). Экспрессия Slit в перешейке, как было показано ранее, превращает MLF плотный пучок (Molle et al., 2004). Сходно с исследованием Molle et al., мы нашли. что Slit2 экспрессируется вентральнее MLF вдоль всего тракта, а Slit1 экспрессируется дорсальнее MLF в перешейке (Fig. 6 E,F). Широкий вентральный домен экспрессии Robo1 рецептора включает область nMLF, указывая тем самым, что она может содержать рецептор, обеспечивающий Slit отталкивание (Fig. 6 G,H). Такой паттерн экспрессии согласуется с вовлечением Slits в фасцикуляцию MLF, подобно их роли в рострально расположенном тракте postoptic commissure (Devine and Key, 2008).
Предыдущие исследования на Xenopus уже показали, что DCC (Anderson et al., 2000a) и Neogenin (Wilson and Key, 2006) играют роль в наведении ранних трактов в переднем мозге, особенно продольно проецирующегося тракта postoptic commissure (TPOC). Наши результаты указывают на то, что передача сигналов Netrin в комбинации с Slits, скорее всего может быть использована в ведении продольных трактов в pretectum и среднем мозге. В согласии с этим последнее исследование на мышах, касающееся передачи сигналов Slit-Robo с корректным наведением ранних продольных трактов (Farmer et al., 2008).
Expression of guidance molecules at choice points В противоположность широким доменам экспрессии, ассоциированным с продольной системой волокон, некоторые молекулы наведения аксонов обнаруживают локальные домены экспрессии, которые коррелируют с точками выбора для специфических трактов. Для MLF, первым решением является проекция аксонов каудально, а не рострально. Самостоятельный домен экспрессии Sema3A был найден расположенным ростральнее и вентральнее nMLF (Fig. 6 I,J), тогда как сам nMLF экспрессирует Neuropilin1 и PlexinA4 уже во время инициального выроста аксонов (Fig. 6 K,L). Интересно, что у рыбок данио Neuropilin1a экспрессируется клетками, лежащими вдоль путей PC и MLF (Yu et al., 2004). Однако у рыбок данио экспрессия Sema3D расположена ростральнее nMLF, а у Sema3D дефицитных эмбрионов, аксоны MLF распространяются рострально в
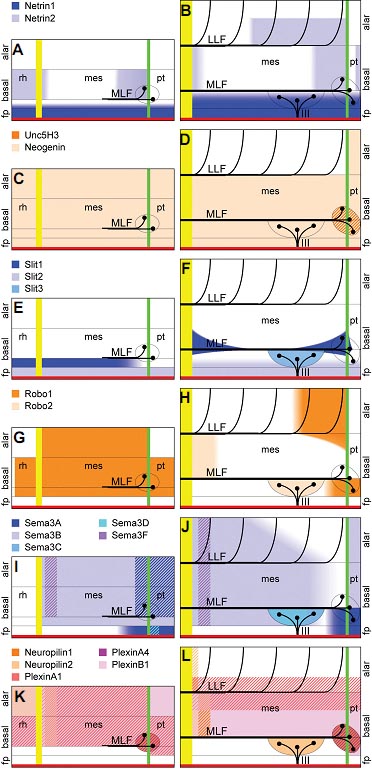 Fig. 6. Schematic representation of axon guidance molecule expression patterns in the mesencephalon. This diagram represents the mesencephalic region analysed at E2 (A,C,E, G,I,K) and E3 (B,D,F,H,J,L). The MFB is represented by a vertical green line, the MHB is shown by a vertical yellow line and the midline is shown as a horizontal red line. Thin horizontal lines separate floor plate, basal plate and alar plate, with a further horizontal line marking the course of the MLF in the basal plate, which forms an expression boundary within the basal plate for some of the genes. Neurons are shown as black circles, with axons representing the MLF, LLF and oculomotor nerve depicted as thick black lines. Gene expression domains are shown as coloured areas, hatched pattern indicating co-expression of genes. (A) At E2, Netrin1 (dark blue) expression in the floor plate extends across hindbrain, midbrain and pretectum, dorsally reaching into the basal plate. Netrin2 (light blue) expression is restricted to the basal plate around the MHB and a small area in the rostral mesencephalon. (B) At E3, the Netrin1 expression domain, in addition to the floor plate, includes the ventral basal plate up to the MLF. Netrin2 is still expressed in the basal plate of caudal and rostral mesencephalon. Further Netrin2 expression domains are the rostral alar plate of the mesencephalon and the basal plate of the rostral pretectum. (C) Neogenin (light orange) is expressed throughout the neural tube at E2, while no Unc5H3 (dark orange) signal is observed. (D) At E3, Neogenin expression remains expressed along the mesencephalon, but predominantly in the basal plate. Unc5H3 expression overlaps with the nMLF. (E) At E2, Slit1 (dark blue) is expressed in the ventral basal plate, weaker at the rostral end of the mesencephalon and more strongly towards the caudal mesencephalon and hindbrain. Slit2 (light blue) is expressed throughout the entire length of the floor plate. No Slit3 (mid blue) expression is observed at E2. (F) Slit2 expression remains throughout the floor plate and ventral basal plate at E3. Slit1 is expressed in two domains in the mesencephalic basal plate, the first rostrally around the MFB and the nMLF, and the second domain caudally. Slit3 expression overlies the oculomotor nucleus. (G) At E2, Robo1 (dark orange) is expressed throughout the basal and alar plates, whilst no Robo2 expression (light orange) is observed. (H) During later stages of development, Robo1 expression becomes restricted to two domains: the first domain is positioned ventral to the nMLF in the basal plate of pretectum and rostral mesencephalon; the second domain is located in the rostral alar plate of the mesencephalon, abutting the MFB. Robo2 is also expressed in two domains, the first overlapping with the oculomotor nucleus and the second in the basal plate of MHB and caudal mesencephalon. (I) At E2, Sema3A (dark blue) is expressed rostral and ventral to the nMLF. Sema3B (light blue) is expressed throughout the mesencephalon and pretectum except the floor plate. Sema3C (mid blue) is not yet expressed at E2. Sema3D (turquoise) is expressed in the floor plate of the pretectum. Sema3F (purple) expression forms a stripe in the caudal mesencephalon, just rostral the MHB. (J) At later stages, Sema3A expression remains both rostral and ventral to the nMLF. Sema3B expression in the mesencephalon is becoming more restricted to the basal plate. Sema3C, and and later also Sema3D expression overlies with the oculomotor nucleus. Sema3C spans the length of the oculomotor nucleus whilst Sema3D expression is more restricted to the caudal region of the oculomotor nucleus. Sema3F expression remains within the caudal mesencephalon. (K) At E2, Neuropilin1 (dark orange) and PlexinA4 (dark magenta) expression domains overlap with the nMLF. Neuropilin1 signals also form a stripe in the caudal mesencephalon, similar to Sema3F signals along the MHB. Neuropilin2 (light orange) is expressed in the alar plate of caudal mesencephalon and MHB. PlexinA1 (light red) and PlexinB1 (light magenta) are both expressed broadly in the neural tube, ventrally delimited by the MLF. (L) At E3, there is no change in Neuropilin1 and PlexinA4 expression. PlexinB1 signals become more restricted to the basal plate, while PlexinA1 expression is strongest around the LLF. Neuropilin2 expression is maintained at the MHB, and an additional expression domain is found in the oculomotor nucleus. Key: III (oculomotor nerve), fp (floor plate), LLF (lateral longitudinal fascicle), MLF (medial longitudinal fascicle), mes (mesencephalon), pt (pretectum), rh (rhombencephalon).
Fig. 6. Schematic representation of axon guidance molecule expression patterns in the mesencephalon. This diagram represents the mesencephalic region analysed at E2 (A,C,E, G,I,K) and E3 (B,D,F,H,J,L). The MFB is represented by a vertical green line, the MHB is shown by a vertical yellow line and the midline is shown as a horizontal red line. Thin horizontal lines separate floor plate, basal plate and alar plate, with a further horizontal line marking the course of the MLF in the basal plate, which forms an expression boundary within the basal plate for some of the genes. Neurons are shown as black circles, with axons representing the MLF, LLF and oculomotor nerve depicted as thick black lines. Gene expression domains are shown as coloured areas, hatched pattern indicating co-expression of genes. (A) At E2, Netrin1 (dark blue) expression in the floor plate extends across hindbrain, midbrain and pretectum, dorsally reaching into the basal plate. Netrin2 (light blue) expression is restricted to the basal plate around the MHB and a small area in the rostral mesencephalon. (B) At E3, the Netrin1 expression domain, in addition to the floor plate, includes the ventral basal plate up to the MLF. Netrin2 is still expressed in the basal plate of caudal and rostral mesencephalon. Further Netrin2 expression domains are the rostral alar plate of the mesencephalon and the basal plate of the rostral pretectum. (C) Neogenin (light orange) is expressed throughout the neural tube at E2, while no Unc5H3 (dark orange) signal is observed. (D) At E3, Neogenin expression remains expressed along the mesencephalon, but predominantly in the basal plate. Unc5H3 expression overlaps with the nMLF. (E) At E2, Slit1 (dark blue) is expressed in the ventral basal plate, weaker at the rostral end of the mesencephalon and more strongly towards the caudal mesencephalon and hindbrain. Slit2 (light blue) is expressed throughout the entire length of the floor plate. No Slit3 (mid blue) expression is observed at E2. (F) Slit2 expression remains throughout the floor plate and ventral basal plate at E3. Slit1 is expressed in two domains in the mesencephalic basal plate, the first rostrally around the MFB and the nMLF, and the second domain caudally. Slit3 expression overlies the oculomotor nucleus. (G) At E2, Robo1 (dark orange) is expressed throughout the basal and alar plates, whilst no Robo2 expression (light orange) is observed. (H) During later stages of development, Robo1 expression becomes restricted to two domains: the first domain is positioned ventral to the nMLF in the basal plate of pretectum and rostral mesencephalon; the second domain is located in the rostral alar plate of the mesencephalon, abutting the MFB. Robo2 is also expressed in two domains, the first overlapping with the oculomotor nucleus and the second in the basal plate of MHB and caudal mesencephalon. (I) At E2, Sema3A (dark blue) is expressed rostral and ventral to the nMLF. Sema3B (light blue) is expressed throughout the mesencephalon and pretectum except the floor plate. Sema3C (mid blue) is not yet expressed at E2. Sema3D (turquoise) is expressed in the floor plate of the pretectum. Sema3F (purple) expression forms a stripe in the caudal mesencephalon, just rostral the MHB. (J) At later stages, Sema3A expression remains both rostral and ventral to the nMLF. Sema3B expression in the mesencephalon is becoming more restricted to the basal plate. Sema3C, and and later also Sema3D expression overlies with the oculomotor nucleus. Sema3C spans the length of the oculomotor nucleus whilst Sema3D expression is more restricted to the caudal region of the oculomotor nucleus. Sema3F expression remains within the caudal mesencephalon. (K) At E2, Neuropilin1 (dark orange) and PlexinA4 (dark magenta) expression domains overlap with the nMLF. Neuropilin1 signals also form a stripe in the caudal mesencephalon, similar to Sema3F signals along the MHB. Neuropilin2 (light orange) is expressed in the alar plate of caudal mesencephalon and MHB. PlexinA1 (light red) and PlexinB1 (light magenta) are both expressed broadly in the neural tube, ventrally delimited by the MLF. (L) At E3, there is no change in Neuropilin1 and PlexinA4 expression. PlexinB1 signals become more restricted to the basal plate, while PlexinA1 expression is strongest around the LLF. Neuropilin2 expression is maintained at the MHB, and an additional expression domain is found in the oculomotor nucleus. Key: III (oculomotor nerve), fp (floor plate), LLF (lateral longitudinal fascicle), MLF (medial longitudinal fascicle), mes (mesencephalon), pt (pretectum), rh (rhombencephalon).
передний мозг (Wolman et al., 2004). У кур не обнаруживается экспресси Sema3D в этом регионе, но паттерн экспрессии Sema3A сравним с тем, который наблюдается для Sema3D у рыбок данио, и Sema3A может играть сходную роль в контроле выростов аксонов MLF. На более поздних стадиях, когда MLF уже установлен, Sema3A, как было показано, экспрессируется в мезэнцефалоне, где он отталкивает аксоны tectobulbar тракта, препятствуя этим аксонам пересекать MLF и направляя его в каудальном направлении (Henke-Fahle et al., 2001).
У Xenopus, NOC2-позитивные аксоны, возникающие в в телэнцефалоне, проецируются посредством тракта из postoptic commissure (Anderson and Key, 1999). В MFB, некоторые из этих аксонов пересекают вентральную срединную линию, чтобы сформировать вентральную комиссуру, тогда как др. соединяются с MLF (Anderson et al., 2000b). Передача сигналов Sema3 посредством Neuropilin1 участвует в принятии решений у Xenopus (Anderson et al., 2000b), интересно, что куриный Sema3D экспрессируется в вентральной срединной лини в MFB на ранних стадиях (Fig. 6I).
Аксоны PC начинают удлиняться позднее, чем аксоны MLF, примерно на ст. HH17 (Chedotal et al., 1995). PC ограничена каудальной порцией pretectum, где PC аксоны первоначально проецируются дорсально в направлении дорсальной пластинки нервной трубки. Netrin2 экспрессируется в вентральной части мезэнцефалона и pretectum, но заметно исключая путь PC в каудальной части pretectum (Fig. 6B). Экспрессия Unc5H3 перекрывает nMLF (Fig. 6D), но вентрально расположенные нейроны, проецирующиеся в тракт PC, перемешаны с MLF нейронами (Schubert and Lumsden, 2005), и поэтому могут также экспрессировать этот рецептор. Следовательно, отталкивание с помощью Netrin2 может участвовать в позиционировании PC в каудальном pretectum.
Guidance cues for the cranial nerves Наш анализ включал два краниальных нерва trochlear, формируемый в перешейке (isthmus) и oculomotor, развивающийся в вентральной части среднего мозга. Рецепторы Robo2 и Neuropilin2 преимущественно экспрессируются в oculomotor ядре (Fig. 6 H,L), указывая тем самым, что oculomotor нейроны может быть чувствительны к передаче сигналов Slit и Sema3. На более поздних стадиях, Slit3 присутствует в oculomotor и trochlear ядрах (Fig. 6F). Аналогичная экспрессия Sema3C и Sema3D была обнаружена в oculomotor ядре (Fig. 6J), как было описано Chilton and Guthrie (Chilton and Guthrie, 2003; Chilton and Guthrie, 2004). Тогда как экспрессия Sema3C обнаруживается в ядрах всех краниальных двигательных нейронов (Chilton and Guthrie, 2003; Melendez-Herrera and Varela-Echavarria, 2006), то экспрессия Sema3D стартует позднее, чем Sema3C,и обнаруживается только в субнаборе oculomotor нейронов (Fig. 6J). Ограниченная экспрессия Sema3D может быть достоверной в отношении дифференциальной иннервации глазных мышц с помощью специфических субъядер в oculomotor комплексе (Chilton and Guthrie, 2004; Heaton and Wayne, 1983). У крыс, Sema3C дополнительно экспрессируется в pretectum и контролирует вырост аксонов dopaminergic нейронов (Hernandez-Montiel et al., 2008). Как было описано ранее (Watanabe et al., 2004), экспрессия Sema3F располагается вдоль ростральной границы перешейка (Fig. 6 I,J), где она, как было установлено, играет роль в проведении trochlear аксонов вдоль MHB (Watanabe et al., 2004).
Conclusions
By analysing the expression patterns of axon guidance molecules within mesencephalon and pretectum during early stages of chick brain development, we have shown that a number of guidance cues are present during the initial formation of the early axon scaffold. Some of the guidance molecules like Netrins and Slits could be involved in establishing the longitudinal tracts, while others like Class3 Semaphorins are more likely to guide specific axons at choice points.
Сайт создан в системе
uCoz  Fig. 1. Schematic representation of early brain organisation in the chick. The diagram depicts regions, neuron clusters and axon tracts in the early embryonic chick brain at E4. The prominent ventral longitudinal bundle (blue) is made up of the TPOC originating in the hypothalamus, the MTT from the ventral diencephalon, and the MLF from the ventral midbrain-forebrain border. At this stage, all axons in the ventral bundle project caudally. The LLF in the mesencephalon is formed of ipsilateral axons from the DTmesV and contralateral axons from the TB (red). The DTmesV neurons are located along the dorsal midline of the mesencephalon and project their axons ventrally along the tectum before turning sharply caudally. The TB fibres extend from the tectum ventrally across the ventral midline before joining the contralateral LLF. Just rostral to the MFB, transversal axons form the TPC (pink). Neurons contributing to the TPC are located dorsally and ventrally in the caudal pretectum. Somatic motor neurons at the MHB (trochlear) and in the mesencephalon (ocular) yield two of the cranial nerves (green). The tracts that are the focus of this study (MLF, DTmesV, III) are shown in darker colour. Key: III (oculomotor nerve), IV (trochlear nerve), ap (alar plate), bp (basal plate), di (diencephalon), DTmesV (dorsal tract of the mesencephalic nucleus of the trigeminal nerve), fp (floor plate), LLF (lateral longitudinal fascicle), MFB (midbrainforebrain border), MHB (midbrain-hindbrain border), MLF (medial longitudinal fascicle), mes (mesencephalon), MTT (mamillotegmental tract), pt (pretectum), rh (rhombencephalon), TB (tectobulbar tract), tel (telencephalon), TPC (tract of the posterior commissure), TPOC (tract of the postoptic commissure), TT (telencephalic tract).
Fig. 1. Schematic representation of early brain organisation in the chick. The diagram depicts regions, neuron clusters and axon tracts in the early embryonic chick brain at E4. The prominent ventral longitudinal bundle (blue) is made up of the TPOC originating in the hypothalamus, the MTT from the ventral diencephalon, and the MLF from the ventral midbrain-forebrain border. At this stage, all axons in the ventral bundle project caudally. The LLF in the mesencephalon is formed of ipsilateral axons from the DTmesV and contralateral axons from the TB (red). The DTmesV neurons are located along the dorsal midline of the mesencephalon and project their axons ventrally along the tectum before turning sharply caudally. The TB fibres extend from the tectum ventrally across the ventral midline before joining the contralateral LLF. Just rostral to the MFB, transversal axons form the TPC (pink). Neurons contributing to the TPC are located dorsally and ventrally in the caudal pretectum. Somatic motor neurons at the MHB (trochlear) and in the mesencephalon (ocular) yield two of the cranial nerves (green). The tracts that are the focus of this study (MLF, DTmesV, III) are shown in darker colour. Key: III (oculomotor nerve), IV (trochlear nerve), ap (alar plate), bp (basal plate), di (diencephalon), DTmesV (dorsal tract of the mesencephalic nucleus of the trigeminal nerve), fp (floor plate), LLF (lateral longitudinal fascicle), MFB (midbrainforebrain border), MHB (midbrain-hindbrain border), MLF (medial longitudinal fascicle), mes (mesencephalon), MTT (mamillotegmental tract), pt (pretectum), rh (rhombencephalon), TB (tectobulbar tract), tel (telencephalon), TPC (tract of the posterior commissure), TPOC (tract of the postoptic commissure), TT (telencephalic tract). Fig. 6. Schematic representation of axon guidance molecule expression patterns in the mesencephalon. This diagram represents the mesencephalic region analysed at E2 (A,C,E, G,I,K) and E3 (B,D,F,H,J,L). The MFB is represented by a vertical green line, the MHB is shown by a vertical yellow line and the midline is shown as a horizontal red line. Thin horizontal lines separate floor plate, basal plate and alar plate, with a further horizontal line marking the course of the MLF in the basal plate, which forms an expression boundary within the basal plate for some of the genes. Neurons are shown as black circles, with axons representing the MLF, LLF and oculomotor nerve depicted as thick black lines. Gene expression domains are shown as coloured areas, hatched pattern indicating co-expression of genes. (A) At E2, Netrin1 (dark blue) expression in the floor plate extends across hindbrain, midbrain and pretectum, dorsally reaching into the basal plate. Netrin2 (light blue) expression is restricted to the basal plate around the MHB and a small area in the rostral mesencephalon. (B) At E3, the Netrin1 expression domain, in addition to the floor plate, includes the ventral basal plate up to the MLF. Netrin2 is still expressed in the basal plate of caudal and rostral mesencephalon. Further Netrin2 expression domains are the rostral alar plate of the mesencephalon and the basal plate of the rostral pretectum. (C) Neogenin (light orange) is expressed throughout the neural tube at E2, while no Unc5H3 (dark orange) signal is observed. (D) At E3, Neogenin expression remains expressed along the mesencephalon, but predominantly in the basal plate. Unc5H3 expression overlaps with the nMLF. (E) At E2, Slit1 (dark blue) is expressed in the ventral basal plate, weaker at the rostral end of the mesencephalon and more strongly towards the caudal mesencephalon and hindbrain. Slit2 (light blue) is expressed throughout the entire length of the floor plate. No Slit3 (mid blue) expression is observed at E2. (F) Slit2 expression remains throughout the floor plate and ventral basal plate at E3. Slit1 is expressed in two domains in the mesencephalic basal plate, the first rostrally around the MFB and the nMLF, and the second domain caudally. Slit3 expression overlies the oculomotor nucleus. (G) At E2, Robo1 (dark orange) is expressed throughout the basal and alar plates, whilst no Robo2 expression (light orange) is observed. (H) During later stages of development, Robo1 expression becomes restricted to two domains: the first domain is positioned ventral to the nMLF in the basal plate of pretectum and rostral mesencephalon; the second domain is located in the rostral alar plate of the mesencephalon, abutting the MFB. Robo2 is also expressed in two domains, the first overlapping with the oculomotor nucleus and the second in the basal plate of MHB and caudal mesencephalon. (I) At E2, Sema3A (dark blue) is expressed rostral and ventral to the nMLF. Sema3B (light blue) is expressed throughout the mesencephalon and pretectum except the floor plate. Sema3C (mid blue) is not yet expressed at E2. Sema3D (turquoise) is expressed in the floor plate of the pretectum. Sema3F (purple) expression forms a stripe in the caudal mesencephalon, just rostral the MHB. (J) At later stages, Sema3A expression remains both rostral and ventral to the nMLF. Sema3B expression in the mesencephalon is becoming more restricted to the basal plate. Sema3C, and and later also Sema3D expression overlies with the oculomotor nucleus. Sema3C spans the length of the oculomotor nucleus whilst Sema3D expression is more restricted to the caudal region of the oculomotor nucleus. Sema3F expression remains within the caudal mesencephalon. (K) At E2, Neuropilin1 (dark orange) and PlexinA4 (dark magenta) expression domains overlap with the nMLF. Neuropilin1 signals also form a stripe in the caudal mesencephalon, similar to Sema3F signals along the MHB. Neuropilin2 (light orange) is expressed in the alar plate of caudal mesencephalon and MHB. PlexinA1 (light red) and PlexinB1 (light magenta) are both expressed broadly in the neural tube, ventrally delimited by the MLF. (L) At E3, there is no change in Neuropilin1 and PlexinA4 expression. PlexinB1 signals become more restricted to the basal plate, while PlexinA1 expression is strongest around the LLF. Neuropilin2 expression is maintained at the MHB, and an additional expression domain is found in the oculomotor nucleus. Key: III (oculomotor nerve), fp (floor plate), LLF (lateral longitudinal fascicle), MLF (medial longitudinal fascicle), mes (mesencephalon), pt (pretectum), rh (rhombencephalon).
Fig. 6. Schematic representation of axon guidance molecule expression patterns in the mesencephalon. This diagram represents the mesencephalic region analysed at E2 (A,C,E, G,I,K) and E3 (B,D,F,H,J,L). The MFB is represented by a vertical green line, the MHB is shown by a vertical yellow line and the midline is shown as a horizontal red line. Thin horizontal lines separate floor plate, basal plate and alar plate, with a further horizontal line marking the course of the MLF in the basal plate, which forms an expression boundary within the basal plate for some of the genes. Neurons are shown as black circles, with axons representing the MLF, LLF and oculomotor nerve depicted as thick black lines. Gene expression domains are shown as coloured areas, hatched pattern indicating co-expression of genes. (A) At E2, Netrin1 (dark blue) expression in the floor plate extends across hindbrain, midbrain and pretectum, dorsally reaching into the basal plate. Netrin2 (light blue) expression is restricted to the basal plate around the MHB and a small area in the rostral mesencephalon. (B) At E3, the Netrin1 expression domain, in addition to the floor plate, includes the ventral basal plate up to the MLF. Netrin2 is still expressed in the basal plate of caudal and rostral mesencephalon. Further Netrin2 expression domains are the rostral alar plate of the mesencephalon and the basal plate of the rostral pretectum. (C) Neogenin (light orange) is expressed throughout the neural tube at E2, while no Unc5H3 (dark orange) signal is observed. (D) At E3, Neogenin expression remains expressed along the mesencephalon, but predominantly in the basal plate. Unc5H3 expression overlaps with the nMLF. (E) At E2, Slit1 (dark blue) is expressed in the ventral basal plate, weaker at the rostral end of the mesencephalon and more strongly towards the caudal mesencephalon and hindbrain. Slit2 (light blue) is expressed throughout the entire length of the floor plate. No Slit3 (mid blue) expression is observed at E2. (F) Slit2 expression remains throughout the floor plate and ventral basal plate at E3. Slit1 is expressed in two domains in the mesencephalic basal plate, the first rostrally around the MFB and the nMLF, and the second domain caudally. Slit3 expression overlies the oculomotor nucleus. (G) At E2, Robo1 (dark orange) is expressed throughout the basal and alar plates, whilst no Robo2 expression (light orange) is observed. (H) During later stages of development, Robo1 expression becomes restricted to two domains: the first domain is positioned ventral to the nMLF in the basal plate of pretectum and rostral mesencephalon; the second domain is located in the rostral alar plate of the mesencephalon, abutting the MFB. Robo2 is also expressed in two domains, the first overlapping with the oculomotor nucleus and the second in the basal plate of MHB and caudal mesencephalon. (I) At E2, Sema3A (dark blue) is expressed rostral and ventral to the nMLF. Sema3B (light blue) is expressed throughout the mesencephalon and pretectum except the floor plate. Sema3C (mid blue) is not yet expressed at E2. Sema3D (turquoise) is expressed in the floor plate of the pretectum. Sema3F (purple) expression forms a stripe in the caudal mesencephalon, just rostral the MHB. (J) At later stages, Sema3A expression remains both rostral and ventral to the nMLF. Sema3B expression in the mesencephalon is becoming more restricted to the basal plate. Sema3C, and and later also Sema3D expression overlies with the oculomotor nucleus. Sema3C spans the length of the oculomotor nucleus whilst Sema3D expression is more restricted to the caudal region of the oculomotor nucleus. Sema3F expression remains within the caudal mesencephalon. (K) At E2, Neuropilin1 (dark orange) and PlexinA4 (dark magenta) expression domains overlap with the nMLF. Neuropilin1 signals also form a stripe in the caudal mesencephalon, similar to Sema3F signals along the MHB. Neuropilin2 (light orange) is expressed in the alar plate of caudal mesencephalon and MHB. PlexinA1 (light red) and PlexinB1 (light magenta) are both expressed broadly in the neural tube, ventrally delimited by the MLF. (L) At E3, there is no change in Neuropilin1 and PlexinA4 expression. PlexinB1 signals become more restricted to the basal plate, while PlexinA1 expression is strongest around the LLF. Neuropilin2 expression is maintained at the MHB, and an additional expression domain is found in the oculomotor nucleus. Key: III (oculomotor nerve), fp (floor plate), LLF (lateral longitudinal fascicle), MLF (medial longitudinal fascicle), mes (mesencephalon), pt (pretectum), rh (rhombencephalon).