Dynamics and interplay of nuclear architecture, genome organization, and gene expression | |
|
The organization of the genome in the nucleus of a eukaryotic cell is fairly complex and dynamic. Various features of the nuclear architecture, including compartmentalization of molecular machines and the spatial arrangement of genomic sequences, help to carry out and regulate nuclear processes, such as DNA replication, DNA repair, gene transcription, RNA processing, and mRNA transport. Compartmentalized multiprotein complexes undergo extensive modifications or exchange of protein subunits, allowing for an exquisite dynamics of structural components and functional processes of the nucleus. The architecture of the interphase nucleus is linked to the spatial arrangement of genes and gene clusters, the structure of chromatin, and the accessibility of regulatory DNA elements. In this review, we discuss recent studies that have provided exciting insight into the interplay between nuclear architecture, genome organization, and gene expression.
|
Геном человека содержит около 35,000 генов и 3.2 биллионов пар оснований ДНК, компактизированных 400,000-раз, чтобы соответствовать объёму ядра~1000 µm3. Упаковка ДНК в хроматин чрезвычайно эффективный способ сортировки ДНК в ядре. Однако генетическая информация оказывается доступной для зависимых от ДНК процессов, таких как транскрипция, репарация ДНК и репликация. Важно, что эта доступность регулируется, т.к. не все регионы генома активны в данное время во время клеточного цикла. Растут доказательства, подтверждающие, что cis- и trans-действующие регуляторные последовательности ДНК могут быть не только детерминантами генной экспрессии, но и что трансакции ДНК также зависят от позиции в геноме генов и субъядерной локализации последовательностей ДНК и сложного взаимодействия генома со специфическими признаками ядерной архитектуры.
Ядро организовано в специфические компартменты, которые включают белковые ядерные тела, эукариотические и гетерохроматические домены хроматина, компартментализованные мультипротеиновые комплексы и ядерные поры, которые делают возможным ядерно-цитоплазматический транспорт. Динамика, временная и пространственная организация ядер эукариотических клеток является центральным детерминантом геномной функции и важна для понимания взаимоотношений между архитектурой ядра, геномной организацией и генной экспрессией.
Внутри ядра описаны многие белковые тела, такие как PML тельца или тельца Cajal ( rev. Spector 2003). Эти тельца обнаруживают неслучайное положение относительно специфических регионов ядра. Разные функции приписываются разным ядерным тельцам, но мы только в начале понимания роли ядерных телец в генной транскрипции, процессинге РНК и репарации ДНК. Интересным свойством ядерных телец является вовлечение их в пост-транскрипционные модификации белков, такие как SUMOylation для телец PML или метилирование аргинина для телец Cajal, в их генерацию и/или поддержание ( rev. Seeler and Dejean 2003; Heun 2007). Chromatin domains Помимо белковых ядерных телец, существуют крупномасштабные домены хроматина. Ещё в 1928 Heitz подразделил хроматин- исходя из внешнего вида-на гетерохроматин и эухроматин (Heitz 1928). Эухроматин коррелирует с массой транскрибируемого хроматина, который находится в "открытой" конформации. Напротив, гетерохроматин коррелирует с более конденсированным хроматином, который обогащен неактивными и молчащими регионами хроматина. Гетерохроматин рассматривался как транскрипционно инертный. Однако в последние годы стало ясно, что такая корреляция структуры хроматина и функции генов ограничена. Недавно группа Bickmore (Gilbert et al. 2004) проанализировала структуру хроматина на более глобальном уровне. Kyb фракционировала хроматин на открытые, большого объёма и закрытые хроматиновые нити и определяли распределение плотности и активности генов в этих фракциях хроматина. Неожиданно, они обнаружили связь между структурой хроматина и плотностью генов независимо от статуса генной активности. Открытые нити хроматина коррелировали с наивысшей плотностью генов, но не с уровнями генной экспрессии, тогда как компактные хроматиновые нити в целом обнаруживали низкую плотность генов, но могли содержать также и активные гены (Gilbert et al. 2004). Способность генов быть активированными не обязательно теряется, если хроматин упакован в более компактные нити. Напротив, неактивные гены близко от активных генов в открытом хроматине могут оставаться неактивными. В этих случаях не локализация генов в гетерохроматиновом или эухроматиновом домене регулирует активность генов, а скорее др. факторы, такие как ковалентные модификации гистонов или ДНК (Spector 2004). Transcription factories Микроскопический анализ мест активной транскрипции в ядрах клеток HeLa с использованием включения Br-UTP, выявляет негомогенные кластеры из ~104
транскрипционных сайтов, с 8000 сайтами, представляющими кластеры RNA polymerase II, и остальные сайты RNA polymerase III транскрипции (Pombo et al. 1999). Количество транскрипционных сайтов варьирует в разных клетках. Эти сайты активной транскрипции представляют собой ~80 nm в диаметре и они наз. "транскрипционными факториями" (Jackson et al. 1998).
Концепцией учебников долгое время было то, что активные гены рекрутируют аппарат транскрипции и что транскрипционная кухня перемещается на активные гены. Однако трехмерная fluorescence in situ hybridization (3D-FISH), иммунофлюоресценция и chromosome conformation capture (3C) анализ, которые обнаруживают тесное физическое расположение между удаленными сегментами хроматина (Dekker 2006), представляют информацию об организации транскрипционных сайтов и понимают вопросы относительно этой догмы. Используя комбинацию этих методов группа Fraser (Osborne et al. 2004) показала, что разделенные активные гены могут колокализоваться в этих сайтах активной транскрипции. Они продемонстрировали, что гены динамически рекрутируются в эти сайты активной транскрипции (но не vice versa), и что большинство генов может перемещаться в и из этих сайтов, приводя к активации или уменьшению их транскрипции (Osborne et al. 2004). Гены, которые способны к высоким уровням экспрессии, такие как β -globin, α -globin и иммуноглобулиновые гены, выглядят как постоянно ассоциированные с "транскрипционными факториями" в клетках, которые экспрессируют эти гены, тогда как временно замалчиваемые аллели располагаются вдали от факторий (Osborne et al. 2004). Активация транскрипции высоко экспрессирующихся генов, таких как непосредственно ранние гены, использует их перемещение в предварительно собранные места транскрипции (Osborne et al. 2007). Эти места транскрипции ограничиваются повсеместно экспрессируемыми генами домашнего хозяйства (Zhou et al. 2006), или с помощью регионов контрольных локусов (Ragoczy et al. 2006).
Согласно модели "транскрипционных факторий" комплексы RNA polymerase и кластеры транскрипционных факторов и формируют "облачки" свыше 20 петель ДНК вокруг транскрипционной фактории (Cook 1999; Faro-Trindade and Cook 2006). полимераза д. быть неподвижным компонентом фактории, а ДНК петли д. появляться и исчезать по мере того, как полимеразы инициируют, удлиняют и заканчивают транскрипцию. Каждая фактория содержит только один тип РНК полимеразы и фактории могут быть обогащены специфическими транскрипционными факторами, участвующими в транскрипции специфических групп генов (Bartlett et al. 2006). Это гены вблизи факторий и д. скорее всего транскрибироваться. Высвобождаясь после завершения транскрипции ген д. всё ещё находиться вблизи фактории и всё ещё нести активные гистоновые модификации, которые д. удерживать его в открытом состоянии, приводя к эффективной повторной инициации (Bartlett et al. 2006). В согласии с этой концепцией домены деконденсированного и недавно транскрибированного хроматина несут гистоновые метки, которые ассоциируют с активной транскрипцией (Muller et al. 2007).
Какие движущие силы перемещают ДНК матрицы в направлении мест транскрипции? Одна из возможеностей заключается в том, что активная полимераза может функционировать как мотор, который тянет на себя свою матрицу. Эксперименты с оптическим пинцетом показали, что сила, продуцируемая одной молекулой полимеразы во время транскрипции может быть существенно большей, чем так, что продуцируется цитоскелетными моторами kinesin и myosin (Yin et al. 1995). Альтернативно, др. молекулярные моторы, такие как ядерные актин и миозин, могут быть использованы для перемещения ДНК матрицы. Др. нерешенный вопрос связан с закреплением мест транскрипции. Многие активные гены и транскрипционные факторы, ассоциированные с "ядерным матриксом," являются недостаточно определенными и дискуссионными субструктурами (Jackson and Cook 1985; Davie 1995; Iborra et al. 1996; Kumar et al. 2007).
Хотя модель "транскрипционных факторий" согласуется с наблюдением, что активные гены могут временно образовывать кластеры (Simonis et al. 2006), нужно иметь в виду, что биохимические доказательства этих "transcription factories," включая их выделение и функциональные характеристики, всё ещё отсутствуют. Organization of chromosomes in interphase nuclei Благодаря своей ассоциации с гистонами и др. не гистоновыми белками ДНК упаковывается с хроматиновую структуру высокого порядка. 120 назад Rabl предположил, что хроматин организован не случайно, а занимает определенные территории. Почти 100 спустя, Cremer et al. (1982) показали, что облучение УФЛ специфических областей интерфазных ядер повреждает дискретные регионы хромосом, указывая на то. что хромосомы занимают определенные позиции в ядре, т.н. территории интерфазных хромосом ( rev. Cremer et al. 2006; Heard and Bickmore 2007). Используя специфические зонды для индивидуальных хромосом для гибридизации in situ несколько групп подтвердили, что каждая хромосома занимает специфическую территорию в ядре (Borden and Manuelidis 1988; Cremer et al. 1988; Pinkel et al. 1988). Эти территории не перекрываются и -по крайней мере в клетках млекопитающих-территории гомологичных хромосом обычно не находятся по соседству (Cremer et al. 2001). Большинство территорий богатых генами хромосом обнаруживает тенденцию концентрироваться внутри ядра, тогда как бедные генами хромосомы стремятся располагаться на периферии ядра (Croft et al. 1999; Boyle et al. 2001). Организация хромосом в специфические территории, как полагают. облегчает взаимодействия хромосом с др. хромосомами и, следовательно, хромосомные территории могут иметь большое значение для зависимых от ДНК процессов, таких как транскрипция.
Доказательства взаимосвязи между физическим размером хромосомы и позицией в ядре всё ещё дискуссионны (Croft et al. 1999; Cremer et al. 2001). Хромосомные территории являются динамическими и пластическими структурами. Индивидуальные хромосомные регионы могут динамически перемещаться. После выхода из клеточного цикла бедные генами хромосомы человека могут перемещаться с периферии ядра в более внутренние сайты, а после повторного вступления в клеточный цикл хромосомы перемещаются обратно на периферию (Wilmut and Campbell 1998; Bridger et al. 2000). Localization within the chromosome territories В первоначальных исследованиях была предложена модель явных границ на на поверхности хромосомных территорий, при этом территория, с одной стороны, и межхромосомное пространство , содержащее аппарат транскрипции, с др. стороны. В целом неактивные гены стремятся сконцентрироваться во внутренних регионах хромосомных территорий, тогда как активные гены стремятся располагаться вдоль периферии близко к межхромосомному пространству (Cremer et al. 2001). Однако это общее правило, по-видимому, слишком упрощено. В противовес этому правилу исследование локуса 11p13, содержащего повсеместно экспрессируемые гены и ткане-специфически экспрессируемые гены, показало, что этот локус располагается внутри дискретной хромосомной территории и что после активации ткане-специфических генов, эти гены не перемещаются на периферию территории (Mahy et al. 2002a,b).
Возникает вопрос, как определяются границы территории и разделены ли территории разных хромосом полностью или хромосомы могут смешиваться. Volpi et al. (2000) показали. что богатый генами major histocompatibilty complex (MHC) может обнаруживаться на большой петле хроматина, содержащей несколько megabases ДНК, которая расширяется прочь от хромосомной территории (see Fig. 1B). Интересно, что позитивная регуляция транскрипции MHC генов ведет к повышению частоты. с которой этот кластер обнаруживается в петле хроматина, исходящей из хромосомной территории (Volpi et al. 2000). Кластер HoxB генов др. пример образования петли их хромосомной территории. Активация кластера генов HoxB во время дифференцировки коррелирует с его перемещением
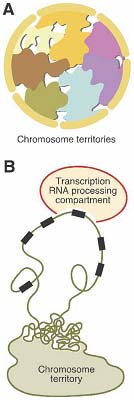 Figure 1. Chromosome territories and looping out of multigene clusters. (A) Schematic structure of chromosome territories and interchromatin space. Chromosomes occupy discrete territories in the nucleus, whereby "decondensed" chromatin loops form the borders of territories, but also intermingle with neighboring chromosome territories. (B) Schematic structure of a transcriptionally active multigene cluster that loops out of the chromosome territory.
Figure 1. Chromosome territories and looping out of multigene clusters. (A) Schematic structure of chromosome territories and interchromatin space. Chromosomes occupy discrete territories in the nucleus, whereby "decondensed" chromatin loops form the borders of territories, but also intermingle with neighboring chromosome territories. (B) Schematic structure of a transcriptionally active multigene cluster that loops out of the chromosome territory.прочь от хромосомной территории (Chambeyron and Bickmore 2004). Т.о., поверхность хромосомной территории может быть увеличена за счет образования петель из ДНК в межхромосомный компартмент и за счет проникновения внутрь территории межхромосомного компартмента (Cremer et al. 2006; Heard and Bickmore 2007). Это позволяет пересмотреть модель хромосомных территорий, принимая во внимание, что активные гены внутри хромосомных территорий (такие как активные гены локуса 11p13) д. быть доступны для аппарата транскрипции зп счет свободных от ДНК каналов (Cremer et al. 2006). В некоторых примерах, таких как кластер генов HoxB, образование петли из хромосомной территории коррелирует с "деконденсацией" хроматина, которая необходим для транскрипции и для гибкости образовавших петли нитей хроматина (Chambeyron and Bickmore 2004). Однако такое петлеобразование и "деконденсация" хроматина не всегда связаны. Напр.. в локусе Hoxd деконденсированные аллели могут обнаруживаться внутри хромосомных территорий и, наоборот, оказавшиеся в петле генные локусы могут быть всё ещё конденсированы (Morey et al. 2007). Эти находки указывают на то, что образование петель и деконденсация не связаны причинно и д. существовать две отдельные модели регуляции. Следовательно, необходимо исследовать, как гистоновые модификации участвуют в петлеобразовании и деконденсации специфических генных локусов, таких как HoxB and HoxD. Недавние исследования с использованием высокого разрешения гибридизации in situ и chromosome conformation-capture подхода показали, что хроматиновые нити с периферии хромосомных территорий перемешиваются в интерфазных ядрах (Branco and Pombo 2006; Simonis et al. 2006). Интересно, что блокирование транскрипции может изменять паттерны перемешивающихся территорий без изменения общих свойст хромосомных территорий (Branco and Pombo 2006). Собранные в петле, активированные HoxB генные локусы обнаруживают усиленные межхромосомные взаимодействия по сравнению с неактивными локусами, которые взаимодействуют преимущественно с др. локусми на той же самой хромосомы (Wurtele and Chartrand 2006). Считается, что хромосомные территории имеют губкообразную архитектуру с межхроматиновым компартментом проникающим и блуждающим в территории благодаря впячиванию, при этом некоторые гены оказываются в петлях, исходящих из территорий, в результате чего смешиваются разные территории (Cremer et al. 2006). Т.о., внутрихромосомные взаимодействия д. способствовать компактности хромосомных территорий, тогда как межхромосомные взаимодействия д. способствовать их смешиванию. Баланс между этими двумя взаимодействиями, по-видимому, зависит от транскрипции, хромосомной структуры и модификаций хроматин. Chromatin modifications Неактивные и активные домены хроматина могут быть также определены молекулярно по присутствию специфических пост-трансляционных гистоновых модификаций. Кстати, описаны многочисленные гистоновые модификации ( rev. Kouzarides 2007). Гистоны могут быть метилированы по аргинину или лизину, фосфорилированы по серинам или лизинам, ацетилированы по лизинам, sumolyated и ubiquitinated по лизинам и ADP-ribosylated. Более того, количество метильных групп, добавляемых к одиночному лизину или аргинину может варьировать. Лизиновые остатки могут быть mono-, di- или trimethylated, а аргининовые остатки могут быть монометлированы и диметилированы симметрично или асимметрично. Важен точный статус метилирования (mono-, di- или trimethylation) он может влиять на транскрипционный статус генов (Schneider et al. 2004). Эти модифкации могут прямо воздействовать на структуру хроматина, напр., путем нейтрализации позитивного заряда гисонов. Кроме того, огромные комбинационный потенциал этих модификаций может быть считан белками, которые соединяются со специфическими модификациями, которые составляют основу для т. наз. гипотезы гистонового "кода" (Turner 1993; Strahl and Allis 2000). Хотя всё ещё не подтверждено, образуют ли эти модификации настоящий "код,"сегодня хорошо известно, что они участвуют в регуляции генной экспрессии (Turner 2007).
В последние годы описаны многие энзимы, которые добавляют эти модификации, такие как histone acetyltransferases, lysine и arginine methyltransferases и энзимы, которые могут удалять эти модификации, такие как histone deacetylases (rev. Couture and Trievel 2006). В противоположность ацетилированию гистонов, метилирование лизина рассматривается как очень стабильная модификация, но недавнее открытие lysine demethylases (Shi et al. 2004) показывает, что метилирование лизина также может быть динамическим. Интересно, что многие из генов, кодирующих энзимы, модифицирующие гистоны, как было установлено, перестраиваются, амплифицируются или мутируют при различного типа раковых опухолях (Schneider et al. 2002). Некоторые исследования были сфокусированы на специфических генах или локусах, они показали, что активный хроматин в целом обогащен ацетилированными гистонами H3, H4, H2A (Davie and Candido 1978), и гистоном H3, который метилирован по Lys 4 (H3/K4) (Litt et al. 2001). H3/K4 di- и trimethylation и ацетилирование H3 коррелируют глобально с открытым хроматином (The ENCODE Project Consortium 2007). В противоположность этому, неактивный хроматин характеризуется гипоацетилированием гистонов и метилированием гистона H3 по Lys 9 (H3/K9) (Litt et al. 2001). Метилирование H3/K9, как полагают, маркирует гетерохроматин. Метилированный H3/K9 может быть "считан" с помощью Heterochromatin Protein 1 (HP1), структурного компонента конденсированного хроматина, который специфически распознает и связывает метилированную форму H3/K9 (Bannister et al. 2001; Lachner et al. 2001). Потеря метилирования K9 в гетерохроматине может влиять на организацию гетерохроматина (Peters et al. 2001). Интересно, что HP1 сам взаимодействует с энзимом, который метилирует H3/K9, формируя позитивную петлю обратной связи, которая позволяет гетерохроматину распространяться на большие регионы хромосом до тех пор, пока распространению не помешает пограничный элемент (Bannister et al. 2001; Lachner et al. 2001).
Изменения в структуре хроматина, которые включают модификации гистонов, могут также играть роль в позиционировании хромосом. Долговременное воздействие на клетки trichostatin A, ингибитора histone deacetylases, которое повышает уровень ацетилирования гистонов, приводит к широко масштабному перемещению центромерного и перицентромерного хроматина на периферию ядра. После удаления хим. соединения эти изменения в локализации быстро возвращаются обратно (Taddei et al. 2001).
Недавние исследования по картированию по всему геному гистоновых модификаций путем комбинирования chromatin immunoprecipitation (ChIP) с микромассивами или прямым секвенированием, сделали возможным картирование с высоким разрешением многих гистоновых меток (Barski et al. 2007).В результате эти исследования выявили, что активно транскрибируемые области хроматина обогащены H3/K4 mono-, di- или trimethylation, H3/K36 trimethylation и monomethylation of H3/K9, H3/ K27 и H4/K20. распределение этих меток по транскрибируемым регионам генов неравномерно; триметилированием H3/K4 обогащен 5' конец транскрибируемых регионов и может служить индикатором места старта транскрипции, тогда как метилированием H3/K36 обогащен 3' конец и это может быть связано с процессингом транскриптов (Bannister et al. 2005). В противовес этому, триметилирование H3/K9, H3/K27 и H3/K79 связано с репрессией (Barski et al. 2007). Интересно, что активные промоторы и энхансеры обнаруживают ассоциацию с метилированием H3/K4 и монометилированием H3/K9. Кроме того, активные промоторы могут быть идентифицированы по присутствию дальнейших активационных меток, которые сцеплены с транскрипционной элонгацией (такие как H3/K36 метилирование) и находятся ниже в транскрибируемой области гена (see Fig. 2; Barski et al. 2007). Эти критерии могут быть использованы для идентификации активных промоторов. Интересно, что в генах, которые регулируются не на уровне инициации транскрипции
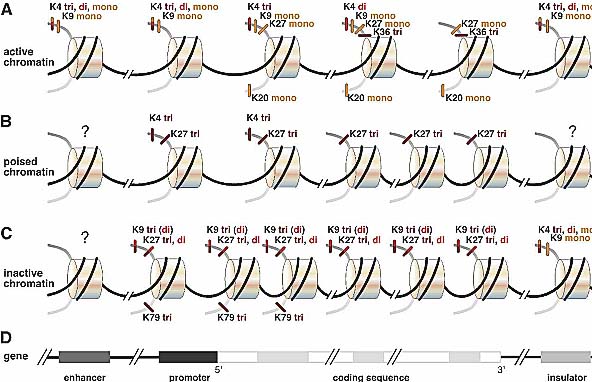 Figure 2. Schematic overview of histone modifications. (A) Active chromatin marks. Nucleosomes encompassing the transcribed region of a gene-a promoter, enhancer, and insulator, respectively-are shown (structure of gene and regulatory elements are represented below). The N-terminal "tails" of histone H3 are shown in dark gray, and the tails of H4 are in light gray. H3/K4 methylation and H3/K9 monomethylation are enriched at the enhancer, the promoter, and the 5 end of the active gene. H3/K27 and H4/K20 monomethylation is enriched over the transcribed region, whereas H3/K36 trimethylation peaks at the 5 of the active gene. Note that active genes are also enriched in H3, H4, and H2A acetylation (not shown). (B) Poised chromatin marks. Four nucleosomes encompassing the transcribed region of a gene poised for transcription and one nucleosome each on a promoter element, an enhancer element, and an insulator are shown. The promoter and the transcribed region are enriched in the repressive mark H3/K27 trimethylation, whereas the region around the transcription start is also enriched in the active mark H3/K4 trimethylation. This combination of active and repressive marks can poise genes for activation and forms a so-called "bivalent domain." (C) Inactive chromatin marks. Modifications of histones H3 and H4 in nucleosomes encompassing a repressed or silenced gene are shown. The coding sequence and promoter of the inactive gene are enriched in H3/K9 and H3/K27 di- and trimethylation. The 5 end of the gene and the promoter region are marked by H3/K79 trimethylation, whereas the insulator element carries activating marks. Data are based on Barski et al. (2007). (D) Scheme of a protein-coding gene with exons shown as light-gray boxes and introns as white boxes. Cis-acting regulatory sequences (enhancer, promoter, and insulator) are represented by black and dark-gray boxes. (polymerase II может быть обнаружена в этих генах), а скорее на уровне элонгации, метилирование H3/K4 встречается часто в промоторе. В соответствии с пост-иниационной регуляцией таких генов, метки, сцепленные с транскрипционной элонгацией, отсутствуют (Guenther et al. 2007). Однако эта "black-and-white" картина активных и репрессивных меток через чур упрощена. Некоторые активирующие метки не только обнаруживаются в генах, которые транскрибируются, но и также в генах, которые готовы к транскрипции. Прекрасный пример представляют гены, которые стимулируются с помощью эндотоксинов в макрофагах. Субнабор таких генов сохраняет некоторые активационные метки после инициальной индукции, понуждая их к эффективной повторной активации (Foster et al. 2007). Кроме того, модификации, рассматриваемые как репрессивные, такие как диметилирование H3/K9, может обнаруживаться не только в гетерохроматине, но и также в определенных активных генах. Более того, в т. наз. "bivalent chromatin domains" репрессивные метки (H3/K27 trimethylation) и активационные метки (H3/K4 trimethylation) могут сосуществовать (see below; Azuara et al. 2006; Bernstein et al. 2006; Lee et al. 2006). Эти находки указывают на то, что гистоновый "код" сложнее, чем ожидалось и что не существует одиночных модификаций, а скорее комбинации модификаций в качестве показателя транскрипционного статуса. В быстро развивающейся области модификаций хроматина многие ажные аопросы ждут своего решения. Сегодня мало известно о том, как эти модификации могут регулировать локализацию специфических генов. Участвуют ли гистоновые модификации в закреплении генов в определенных регионах или компартментах ядра? Являются ли гистоновые модификации причиной или следствием активных/неактивных доменов хроматина? Какова их роль в установлении или поддержании ядерных доменов? Как они изменяются, когда гены выдвигаются в виде петли из своей хроматиновой территории? Важно понять в точности, как гистоновые модификации регулируют функциональный статус не только специфических генов. но и также доменов хроматина и как связан статус модификаций с локализацией специфических генов или перемещением геномных регионов. Mobility and movements of gene loci
Подвижноть и перемещения генетических локусов активно исследовали на живых клетках с помощью трансгенных методов флюоресцентно меченных lac операторов, которые были стабильно интегрированы в различные места хромосомы. Эти исследования показали, что подвижность таких трансгенов преимущественно ограничивается радиусом хромосомной территории и зависит от их относительной локализации в ядре (Vazquez et al. 2001). Более того, трансгены, которые располагаются вблизи периферии ядра или ассоциированы с ядрышком, оказались менее мобильными, чем трансгены, располагающиеся в нуклеоплазме (Chubb et al. 2002). Наконец, перемещение хроматина преимущественно обнаруживалось в G1 фазе клеточного цикла (Thomson et al. 2004). Хотя молекулярные основы перемещения хроматина довольно неясны, пространственное распределение в ядре участвует в установлении и поддержании активных, уравновешенных и репрессированных состояний хроматина. Association of genes with the nuclear periphery and nuclear pores
Ранний ЭМ анализ ядер тимуса телят выявил периферическое расположение конденсированных гетерохроматиновых регионов (Mirsky and Allfrey 1960). У дрожжей роль ядерной периферии в генном молчании была продемонстрирована искусственным прикреплением репортерного гена к ядерной оболочке посредством мембрану пронизывающего якоря (Andrulis et al. 1998). В этих экспериментах репортерный ген был сцеплен с сайтом silencer, которые обеспечивал связывание silent information regulators (Sir белков). Исследования по иммунолокализации показали, что Sir белки накапливаются вблизи ядерной периферии в фокусах теломер, внося тем самым, по-видимому, вклад в молчание генов, расположенных вблизи периферии ядра (Maillet et al. 1996). О
молчание может сохраняться в отсутствие прикрепления к ядерной оболочке (Gartenberg et al. 2004). Молекулярная основа закрепления Sir белкового комплекса на ядерной периферии была установлена путем демонстрации, что Sir4 взаимодействует с ассоциированным с мембраной белком Esc1, который располагается на ядерной периферии, но не колокализуется с ядерными порами (Andrulis et al. 2002).
Помимо участия в генном молчании на периферии ядра (see Fig. 3), ядерные поры участвуют в защите доступных регионов хроматина от распространения репрессии с помощью гетерохроматина. Генетический скрининг у дрожжей с целью идентификации компонентов, которые создают хроматиновые границы активности на синтетическом пограничном элементе, привел к идентификации некоторых генов, которым ранее приписывали ядерно-цитоплазматический перенос tRNA и мРНК (Ishii et al. 2002). Белки, участвующие в трафике тРНК и мРНК, как известно, взаимодействуют во время транзита с рецепторами внутренней корзинки комплекса ядерной поры. В частности, компонент Nup2p комплекса ядерной поры участвует в пограничной активности путем физического прикрепления пограничных элементов к корзинке ядерной поры (Ishii et al. 2002). Потенциальное взаимодействие транскрибируемых генов с комплексами ядерных пор также был изучен с помощью time-lapse исследований живых клеток и с помощью экспериментов chromatin endogenous cleavage (ChEC). Эксперименты ChEC по всему геному, в которых белок Nup2p был слит с micrococcal nuclease, чтобы расщеплять ДНК, которая взаимодействует с ядерной порой, выявили многочисленные транскрибируемые гены, взаимодействующие с
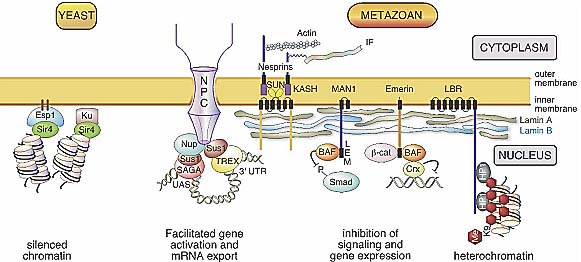 Figure 3. Structural and functional hallmarks of the nuclear periphery in yeast and metazoans. The membrane bilayer of the nucleus is perforated by nuclear pores, which consist of an ? 30-subunit-containing nuclear pore complex (NPC). (Left) In yeast, the Nup1 and Nup2 components of the nuclear pore complex have been found to interact with components of the SAGA coactivator complex via Sus1, which is also a component of the TREX complex, involved in mRNA export. The nuclear periphery, excluding the pores, is also implicated in gene silencing, whereby the yeast Sir4 protein is tethered to the periphery via the enhancer of silent chromatin (Esc1) or Ku protein. (Right) In metazoans, the inner nuclear membrane is associated with lamins and lamin-associated proteins. The lamin B receptor (LBR) has been implicated in heterochromatin regulation via interaction with HP1, which binds to histone H3K9 trimethyl marks. Emerin and Man1 recruit, via their LEM domain, the barrier to autointegration factor (BAF), which associates with transcription repressors such as Crx1. In addition they bind and inhibit the function of the signaling effectors Smad and -catenin. The SUN-Nesprin complex, which is formed by an interaction of the KASH domain of Nesprin with SUN proteins, links the perinuclear skeleton with the cytoplasmic filament system. (IF) Intermediate filament.
Figure 3. Structural and functional hallmarks of the nuclear periphery in yeast and metazoans. The membrane bilayer of the nucleus is perforated by nuclear pores, which consist of an ? 30-subunit-containing nuclear pore complex (NPC). (Left) In yeast, the Nup1 and Nup2 components of the nuclear pore complex have been found to interact with components of the SAGA coactivator complex via Sus1, which is also a component of the TREX complex, involved in mRNA export. The nuclear periphery, excluding the pores, is also implicated in gene silencing, whereby the yeast Sir4 protein is tethered to the periphery via the enhancer of silent chromatin (Esc1) or Ku protein. (Right) In metazoans, the inner nuclear membrane is associated with lamins and lamin-associated proteins. The lamin B receptor (LBR) has been implicated in heterochromatin regulation via interaction with HP1, which binds to histone H3K9 trimethyl marks. Emerin and Man1 recruit, via their LEM domain, the barrier to autointegration factor (BAF), which associates with transcription repressors such as Crx1. In addition they bind and inhibit the function of the signaling effectors Smad and -catenin. The SUN-Nesprin complex, which is formed by an interaction of the KASH domain of Nesprin with SUN proteins, links the perinuclear skeleton with the cytoplasmic filament system. (IF) Intermediate filament. комплексом ядерной поры посредством промоторных последовательностей (Marshall et al. 1997). Сходным образом анализ по всему геному ДНК, которая ко-иммунопреципитируется с компонентами комплекса ядерной поры, показали, что транскрипционно активные гены обогащены в иммунопреципитируемых фракциях (Casolari et al. 2004). Итак, эти исследования предоставили экспериментальное подтверждение "gene gating hypothesis," согласно которой транскрибиремые гены перемещаются ближе к ядерной поре, чтобы обеспечить экспорт мРНК (Blobel 1985). Недавно несколько исследований изучали взаимоотношения транскрипционной активации генов и позиционирования активных генов в комплексах ядерных пор (see Fig. 3). Хотя все исследования смогли продемонстрировать, что гены становятся стабильно ассоциировнными с комплексами ядерных пор после индукции, связанные с промотором компоненты, которые участвуют в периферической локализации генов, по-видимому, различны для индивидуальных генов (rev. Akhtar and Gasser 2007). В частности ассоциации GAL генов с комплексами ядерных пор привлекают транскрипционные коактиваторный комплекс SAGA, который служит в качестве адаптора для комплекса медиатора (Cabal et al. 2006). Делеция или SAGA компонента Ada2 или компонента ядерной поры Nup1 нарушает околоядерное расположение гена , но не влияет на транскрипцию гена. Интересно, что ассоциированный с SAGA белок Sus1 также совместно очищается вместе с компонентами аппарата экспорта мРНК, который связан с Nup1 (RodriguezNavarro et al. 2004). Т.о., Sus1 может создавать физическую связь между связанными с промотором активаторами и аппаратом экспорта мРНК. Анализ динамического 3D отслеживания дрожжевого генного GAL локуса также указывает на то, что транскрипционная активация не только ведет к расположению на периферии ядра, но и также к ограничению динамической подвижности (Cabal et al. 2006). Напротив исследование Laemmli с коллегами (Schmid et al. 2006) показало, что взаимодействие генов GAL с Nup2 нуждается в UAS-связанном белке Gal4 активаторе и в TATA box, но не в комплексе SAGA или активной транскрипции. Т.к. эксперименты ChEC также выявили временные и слабые взаимодействия, то вклад комплекса SAGA в позиционирование транскрибируемых генов на периферии ядра может быть недооценен.
У высших эукариот ядерная оболочка содержит ядерную ламину, которая представлена слоем белков промежуточных филамент между хроматином и внутренней ядерной мембраной. Два белка, Emerin и Man1, как было установлено, играют важную роль в закреплении репрессированных генов на ядерной периферии (Liu et al. 2003). Оба белка имеют LEM домен, который рекрутирует autointegration factor (BAF), ассоциирующих с транскрипционными репрессорами, таким как Crx1 (rev. Schirmer and Foisner 2007). Кроме того, Man1 может взаимодействовать со Smads и β -catenin, противодействуя передаче сигналов TGF-β и Wnt белков, соотв. (Pan et al. 2005; Markiewicz et al. 2006). Более того, lamin B receptor (LBR) участвует в регуляции гетерохроматина посредством взаимодействия с HP1, который соединён с гистоновыми H3K9-trimethyl метками (Makatsori et al. 2001; Polioudaki et al. 2001). Наконец, комплекс SUN-Nesprin связывает околоядерный скелет с системой цитоплазматических филамент (rev. Schirmer and Foisner 2007).
Недавно анализ последовательностей ДНК по всему геному показал, что расположение на периферии ядра осуществляется за счет осуществления слияния lamin-DNA adenine methyltransferase в клетках дрозофилы. Это исследование идентифицировало несколько сот генов, как lamin-ассоциированных генов и установило, что эти гены лишены активных гистоновых модификаций и являются поздно реплицирующимися (Pickersgill et al. 2006). Changes in subnuclear gene localization during cell differentiation 3D-FISH индивидуальных генов в фиксированных клетках показал, что их позиция относительно др. генов или субъядерных компартментов может меняться на разных стадиях активации генов и/или клеточной дифференцировки. В частности, локализация кластера генов тяжелой цепи иммуноглобулинов, как было показано, меняется с периферической позиции в не-лимфоидных клетках на положение внутри ядра в pre-B клетках (Brown et al. 2001; Kosak et al. 2002). Сходным образом крупномасштабная реорганизация хроматина и перемещение в ядре с периферии в центр описано для ассоциации локуса Mash1 во время нейральной индукции (Williams et al. 2006). Хотя геномный сегмент в 2-Mb перемещается, но изменения субъядерной позиции не коррелируют с активностью генов, т.к. некоторые, но не все гены внутри сегмента в 2-Mb транскрибируются при нейральной индукции. Отсутствие простой корреляции между активацией гена и перемещением с периферии ядра в центр было в дальнейшем подтверждено в результате анализа локуса interferon-γ, который остается локализованным на периферии ядра после активации гена и β-globin локус, который перемещается в центр вследствие генной активации (Hewitt et al. 2004; Ragoczy et al. 2006).
Др. тип перемещений хроматина внутри ядра наблюдался в локусах генов рецепторов антигенов, которые подвергаются соматической рекомбинации в лимфоцитах. Кластеры генов тяжелой и легкой цепи иммуноглобулинов и гены T-cell receptor-α и -β содержат прерывистые variable (V), diversity (D) и joining (J) генные сегменты, которые занимают область свыше 0.7-3 Mb и собираются с помощью RAG-обеспечиваемой генной перестройки (rev. Bassing et al. 2002). В кластерах этих генов сотни вариабельных генных сегментов, которые распределяются по регионам хромом в 2.5 Mb и оказываются бок о бок с diversity или joining сегментами, которые находятся на большом расстоянии от дистальных V сегментов. 3D-FISH анализ локусов рецепторов антигенов выявил крупномасштабные перемещения хроматина, которые могут быть объяснены за счет обусловленной образованием петель "contraction" хромосом (Kosak et al. 2002; Fuxa et al. 2004; Sayegh et al. 2005; Skok et al. 2007). Образование петель индивидуальными субдоменами крупных генетических локусов может облегчать или отражать образование синапсов между дистальными V сегментами и проксимальными D или J сегментами. Отметим, что хромосомные контракции являются временными и сопровождаются как "decontraction" хромосом, которая разделяет V и J сегменты, так и рекрутированием локуса в перицентромерных гетерохроматин (Roldan et al. 2005; Skok et al. 2007). Для локуса тяжелой цепи иммуноглобулина деконтракция, как было установлено, происходит на стадии развития, в которой производительная генная перестройка одного аллеля продуцирует активный pre-B-клеточный рецептор, который генерирует сигнал негативной петли обратной связи, ведущий к деконтракции др. аллея и к "allelic exclusion" (Roldan et al. 2005). Сходные временные контракции хромосом были описаны для T-клеточных рецепторов и локусов (Skok et al. 2007). Деконтракция, которая разделяет V и J сегменты, по-видимому, представляет собой генеральный принцип, лежащий в основе аллельного исключения, который проявляется как аллельная асинхронность на ранних стадиях эмбриогенеза мыши (Mostoslavsky et al. 2001; Goldmit et al. 2005). Хотя молекулярные основы возникновения аллельной асинхронности всё ещё неясны, дифференциальное деметилирование и время репликации двух аллелей могут представлять собой важный механизм (Mostoslavsky et al. 2001).
Молекулярные механизмы, лежащие в основе изменений расположения генов из околоядерных или гетерохроматических регионов в транскрипционные фактории или эухроматиновые регионы, всё ещё неясны, но, по-видимому, коррелируют с ацетилированием гистонов (Chowdhury and Sen 2001; Hawwari and Krangel 2005) Напротив, некоторая информация о молекулярных основах внутрихромосомной "contraction" кластеров генов тяжелой цепи иммуноглобулинов была получена путем анализа нокаутных мышей. Как Pax5-дефицитные мыши, так и мыши, дефектные по Ezh2 компоненту PRC2 polycomb repressive complex (H3/K27-specific histone methyltransferase), как было установлено, неспособны подвергаться внутрихромосомным контракциям (Fuxa et al. 2004). Было устанровлено, что это зависит от функции транскрипционного фактора Pax5 и Ezh2 компонента Polycomb repressive complex PRC2 (Su et al. 2003). Рекрутирование PRC2 и сопутствующее метилирование Lys 27 гистона H3 локуса тяжелой цепи иммуноглобулина может привлекать PRC1 комплекс и приводить к контракции локуса (Francis et al. 2004; Su et al. 2005), подтверждая роль этой гистоновой метки в контракции локуса. Interchromosomal interactions Расположение множественных геномных регионов на разных хромосомах относительно др. др. быстро выявило новый и важный детерминант их функции. Образование локальных кластеров генов может иметь регуляторную функцию; напр., за счет регулирования их экспрессии или предоставления возможности взаимодействий с ключевыми регуляторными элементами (for review, see Misteli 2007). Здесь мы обсудим примеры гомологичных и негомологичных межхромосомных взаимодействий, часто наз. "chromosome-kissing." Homologous interchromosomal interactions Физическое спаривание хромосом особенно заметно у двукрылых насекомых, таких как Drosophila. Такое спаривание может позволить одному аллелю поддерживать функцию второго аллеля (rev. Pirrotta 1999; Duncan 2002). E.B. Lewis обозначил этот процесс "transvection." Он установил, что фенотипы мутантного Ubx (Ultrabithorax) аллеля сильнее, если спариванию с аллелем дикого типа мешают хромосомные перестройки. Спаривание может усиливать экспрессию Ubx и позволить аллелям частично дополнять др. др. Такая трансвекция, при которой мутация может быть комплементирован др. аллелем в транс положении, на сегодня обнаружена для ряда локусов у дрозофилы (Duncan 2002). Др. хорошо изученным примером является Hox ген Abd-B (Abdominal-B). Генетические исследования продемонстрировали, что transvection Abd-B зависит от 3' -фланкирующей области, наз. TMR (transvection-mediating region) (Hopmann et al. 1995). Используя RNA FISH, группа M. Levine's (Ronshaugen and Levine 2004) оказалась способной визуализовать события transvection. Они показали, что Abd-B энхансеры, расположенные на одной хромосоме, часто могут спариваться с геном Abd-B на др. гомологичной хромосоме. Последовательность TMR действует как элемент спаривания. Интересно, что этот TMR содержит Polycomb-чувствителный элемент (Zhou and Levine 1999; Zhou et al. 1999; Bantignies et al. 2003). Колокализация позволяет энхансерам, которые обычно образуют петлю в цис-положении, чтобы находить промоторы на той же самой хромосоме, образовывать петлю в транс-положение и активируют ген Abd-B в транс-положении. Чем теснее спаривание, тем чаще происходят транс-взаимодействия между энхансером и геном Abd-B (Ronshaugen and Levine 2004).
Др. хорошо изученный пример межхромосомных взаимодействий гомологичных хромосом касается Х хромосомы млекопитающих (rev. Carrel 2006). Инактивация Х-хромосомы связана с подсчетом хромосом и последующим выбором какая из двух Х хромосом буде инактивирована. Для этого необходимы "communication" между двумя Х хромосомами, которая может происходить благодаря взаимодействиям гомологичных хромосом (Marahrens 1999). В последнее время получена важная информация о спаривании двух Х хромосом. Критическим для Х инактивации является регион Xic (X inactivation center) (Brown et al. 1991; Lee 2005). В двух элегантных исследованиях группы Lee and Heard (Bacher et al. 2006; Xu et al. 2006) использовали FISH в embryonic stem (ES) клетках самок мыши, чтобы продемонстрировать, что во время начала инактивации Х хромсомы перемещаются с периферии ядра, где они находились в случайном положении относительно др. др. и приходят в тесную близость, так что их Xic оказываются бок о бок. Две Х хромосомы не только обнаруживаются вместе во время ранней дифференцировки ES клеток, но и запускается инактивация Х, но не позднее и не раньше этого момента (Fig. 4). Интересно, что делеционные мутанты в Xic регионе, которые нарушают случайную инактивацию Х, также сильно поражают спаривание между Х хромосомами (Bacher et al. 2006; Xu et al. 2006). Во время спаривания две Х хромосомы физически взаимодействуют непосредственно или за счет их связанных с ДНК белков (Xu et al. 2006), это делает возможным взаимное общение и взаимоисключающее обозначение активного и неактивного состояния. После диссоциации двух гомологов неактивная X (Xi) направляется в околоядрышковый компартмент (Fig. 4; Zhang et al. 2007). Xi организуется как богатая повторами сердцевина с богатыми генами регионами вокруг
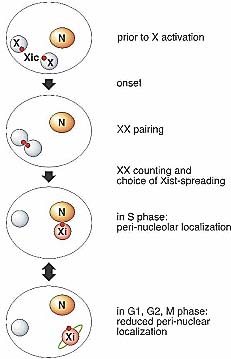 Figure 4. Nuclear reorganization during X-chromosome inactivation. After female ES cells start to differentiate, both X chromosomes (shown as chromosome territories in blue) come close together via juxtaposition of the X-inactivation centers (Xic; red dots). This "kissing" of the X chromosomes is accompanied by the process of X-chromosome counting and the choice of the X chromosome that will be inactivated. On the future Xi chromosome, the Xist RNA (red) is up-regulated and spreads, excluding the transcription machinery. Upon dissociation of the paired X chromosomes, the Xi is targeted to the perinucleolar compartment (nucleus in brown), where the condensed chromatin can be replicated. During S phase the Xi has to visit the perinucleolar compartment for replication. In the other phases of the cell cycle, the Xi can be found in other locations (e.g., nuclear periphery). Genes on the Xi that escape X inactivation are located outside of the Xist-covered Xi-chromosome territory.
Figure 4. Nuclear reorganization during X-chromosome inactivation. After female ES cells start to differentiate, both X chromosomes (shown as chromosome territories in blue) come close together via juxtaposition of the X-inactivation centers (Xic; red dots). This "kissing" of the X chromosomes is accompanied by the process of X-chromosome counting and the choice of the X chromosome that will be inactivated. On the future Xi chromosome, the Xist RNA (red) is up-regulated and spreads, excluding the transcription machinery. Upon dissociation of the paired X chromosomes, the Xi is targeted to the perinucleolar compartment (nucleus in brown), where the condensed chromatin can be replicated. During S phase the Xi has to visit the perinucleolar compartment for replication. In the other phases of the cell cycle, the Xi can be found in other locations (e.g., nuclear periphery). Genes on the Xi that escape X inactivation are located outside of the Xist-covered Xi-chromosome territory.(Chaumeil et al. 2006; Clemson et al. 2006). Согласно современной модели богатые повторами/бедные генами регионы внутри Xi-хромосомной территории инактивируются первыми, в результате накопления Xist РНК образуемого Xist-обусловленного барьера. RNA polymerase II и транскрипционные факторы исключаются из этой стержневой области. Молчащие гены перемещаются в направлении этой богатой повторами сердцевины, тогда как гены, которые избегают Х инактивации и транскрибируются, располагаются вне или на периферии Xi хромосомной территории (Chaumeil et al. 2006). Процессы, участвующие в инактивации включают инкорпорацию гистонового варианта macro H2A (Mermoud et al. 1999) и обогащение неактивного хроматина метками, такими как метилирование ДНК (Norris et al. 1991), dimethylation H3/K9 (Heard et al. 2001; Mermoud et al. 2002) и trimethylation of H3/K27 (Plath et al. 2003; Silva et al. 2003), а также истощение активных меток, таких как ацетилирование H3 и H4 (Jeppesen and Turner 1993; Boggs et al. 1996) и метилирование H3/K4 (Boggs et al. 2002). Xi ассоциирует во время S фазы околоядрышковым компартментом, который специализируется на репликации конденсированного хроматина, чтобы распространить его репрессивный характер, но она может располагаться и на перифериияюра в др. фазах клеточного цикла. Эта околоядрышковая локализация коррелирует по времени с поздней репликацией Xi, которая обычна для репрессированного и конденсированного хроматина (Schwaiger and Schubeler 2006). Аутосомы с эктопическими инсерциями региона Xic также направляются в околоядрышковый компартмент, подтверждая роль Xic в их релокализации (Zhang et al. 2007).
Целенаправленные перемещения хромосом и спариваняи между двумя Х хромосомами важны для инактивации X хромосомы. Они также являются примером двух хромосом, которые обладают двумя противположными эпигенетическими состояниями (активным и неактивным), и перемещаются в специфические субъядерные компартменты. По крайней мере, для Xi локализация может также регулироваться в зависимости от клеточного цикла; т.e., для репликации она перемещается в околоядрышковый компартмент. Xic регион играет важную роль в этих процессах, но всё ещё неясно, образуют ли Xic регионы петлю из хромосомной территории, чтобы взаимодействовать др. с др. и спариваются ли др. регионы Х хромосомы. Более того, не понятны ни движущие силы, ни молекулярные механизмы перемещений хромосом. Nonhomologous interchromosomal interactions Первый пример образования кластеров негомологичных генов был предоставлен рибосомальными генами, которые соединяются в ядрышке. В ядрышке наборы рибосомальных генов из нескольких разных хромосом собираются вместе (rev. Raska et al. 2006). В последнее время новые технологии, такие как гибридизации in situ высокого разрешения и 3C метод предоставили дополнительные примеры образования кластеров транскрибируемых с помощью RNA polymerase II генов, которые располагаются на негомлогичных хромосомах. Человеческие α-globin and β-globin гены на хромосомах 16 и 11, соотв., часто располагаются очень близко др. к др., когда они транскрибируются во время эритроидной дифференцировки (Brown et al. 2006). Однако globin гены не колокализуются непосредственно, а их близкое пространственное расположение не существенно для транскрипции (Brown et al. 2006).
Недавно группа Flavell (Spilianakis et al. 2005) описала первый пример, где гены разных хромсом ассоциировали физически, чтобы скоординировать свою экспрессию. В naive T клетках Ifng (Interleukin) и Th2 локусы располагаются вместе в регионе ядра, предназначенного для экспрессии генов. После стимуляции naive T клеток, в зависимости от стимулов, Ifng (если naive T клетки дифференцируются в TH1 клетки) или Th2 локус (если они дифференцируются в TH2 клетки) активируется, тогда как остальные гены остаются неактивными. Активированный ген удерживает своё положение в ядре, которое предназначено для активации, тогда как молчащий перемещается преимущественно в более репрессивную область ядра. Это перемещение прочь замещает межхромосомные взаимодействия на внутрихромосомные взаимодействия (Spilianakis et al. 2005). К сожалению, др. регионы генома, которые взаимодействуют с этими локусами во время T-клеточной активации пока неизвестны. Интересно, что в TH1 клетках белок SATB1 (special AT-rich sequence-binding protein 1) быстро индуцируется. SATB1 может организовывать специфичную для типа клеток ядерную архитектуру, закрепляя ДНК и рекрутируя хроматин-ремоделирующие факторы. В случае Ifng, SATB1 складывает этот локус в небольшие межхромсомные петли, которые закрепляются с помощью SATB1 в своем основании (Fig. 5). В этом в 200 kb образованном в петлю хроматине гистоны гиперацетилированы и факторы ремоделирования хроматина, такие как Brg1, специфические регуляторы экспрессии Ifng и RNA polymerase II рекрутируются SATB1-зависимым способом (Cai et al. 2006). Эти удивительные находки использования T-клеточной дифференцировки в качестве модели, показали, что хромосомные локусы покидают свои хромосомные территории для внутрихромосомных взаимодействий, а после дифференциальной генной экспрессии они снова разделяются. Это также указывает на чёткую роль белка SATB1 в образовании складок в локусе Ifng в межхромосомные петли. Это ставит вопрос, является ли взаимосвязь между внутри- и межхромосомными взаимодействиями общим феноменом, имеющим место во многих разных типах клеток или он ограничен специальными событиями.
Др. пример межхромсомных взаимодействий предоставляется генами обонятельных рецепторов. В сенсорных нейронах экспрессируется одиночный обонятельный рецептр из большого семейства генов, расположенных в разных хромосомах. Интересно, что экспрессируемый рецепторный ген обнаруживается с помощью 3D-FISH и 3C анализа взаимодействующим с энхансерным элементом, наз. H enhancer, на хромосоме 14 (Lomvardas et al. 2006). Т.к. гены обонятельных рецепторов из разных хромосом были обнаружены взаимодействующими с H энхансером, эта находка интерпретируется как указание, что экспрессия обонятельного рецепторного гена зависит
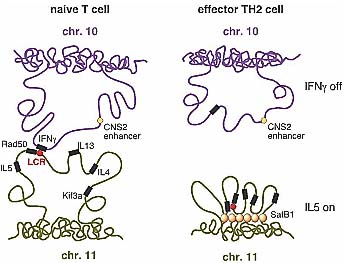 Figure 5. Inter- and intrachromosomal chromatin loops. (Left) In naive T cells the interleukin gene cluster on chromosome 11-carrying the interleukins IL4, IL5, and IL13-loops out and the locus control region (LCR) residing at the 3 end of the Rad50 gene interacts with regulatory sequences of the interferon- (IFN ) gene on chromosome 10. This interchromosomal interaction represents a poised chromatin state, as both IL4 and INF genes are transcriptionally inactive. (Right) In differentiated and IL4-expressing T-helper2 (T2) cells, SATB1-mediated chromatin loops facilitate intrachromosomal interactions between IL4 regulatory sequences and the Rad50 locus control region. In TH/H2 cells, the IFN gene is not transcribed, whereas in T
1 cells the IFN promoter interacts with the CNS2 enhancer by an intrachromosomal loop (not shown).
Figure 5. Inter- and intrachromosomal chromatin loops. (Left) In naive T cells the interleukin gene cluster on chromosome 11-carrying the interleukins IL4, IL5, and IL13-loops out and the locus control region (LCR) residing at the 3 end of the Rad50 gene interacts with regulatory sequences of the interferon- (IFN ) gene on chromosome 10. This interchromosomal interaction represents a poised chromatin state, as both IL4 and INF genes are transcriptionally inactive. (Right) In differentiated and IL4-expressing T-helper2 (T2) cells, SATB1-mediated chromatin loops facilitate intrachromosomal interactions between IL4 regulatory sequences and the Rad50 locus control region. In TH/H2 cells, the IFN gene is not transcribed, whereas in T
1 cells the IFN promoter interacts with the CNS2 enhancer by an intrachromosomal loop (not shown). от его ассоциации с энхансерным элементом в транс-положении. Более того, один аллель H энхансера метилирован по CpA остаткам, это представляет привлекательную модель для правила один рецептор - одна клетка для экспрессии гена обонятельных рецепторов. Однако недавний анализ целенаправленной делеции в H энхансере показал, что только экспрессия генов обонятельных рецепторов, расположенных в цис-положении нарушается, тогда как более удаленные гены по отношению к энхансеру менее затрагиваются делецией, чем поксимальные к энхансеру гены (Fuss et al. 2007). Эти результаты подчеркивают важность функционального анализа и подтверждают, что некоторые наблюдаемые межхромосомные взаимодействия могут быть временными и функционально неважными. Межхромосомные взаимодействия не только используются в регуляции генной экспрессии, но и также в др. процессах, таких как геномный импринтинг. Maternal imprinting control region (ICR) хромосомы 7 мыши контролирует не только в цис-положении экспрессию соседнего Igf2/ H19 локуса (содержащего импринтируемые гены), но и также взаимодействует с локусом Wsb1/Nf1 на хромосоме 11 и контролирует его экспрессию в транс-положении (Ling et al. 2006). Взаимодействие ICR на хромосоме 7 с Wsb1/ Nf1 локусом на хромосоме 11 зависит от присутствия пограничного элемента, связывающего белок CTCF (Ling et al. 2006), соединенного с материнским аллелем, и ведет к регулируемой экспрессии локуса Wsb1/Nf1. Делеция ICR на хромосоме 7 или нокдаун CTCF затрагивает импринтинг Igf2, подтверждая возможность того, что межхромосомное взаимодействие может быть необходимо для правильного импринтинга (Ling et al. 2006). Эта находка представляет интересный пример дальнодействующих аллель-специфических взаимодействий между геномными регионами разных хромосом (Simonis et al. 2006) и показывает, что белок CTCF участвует в обеспечении взаимодействия. В будущем очень важно идентифицировать дополнительные белки, которые способны обеспечивать межхромосомные взаимодействия, чтобы пролить свет на молекулярный механизм такого взаимодействия. Др. недавнее исследование, использующее дифференцирующиеся ES клетки, картировло более 100 дополнительных взаимодействий для H19 ICR, указывая тем самым, что ICR может взаимодействовать со множественными хромосомными областями в цис- и транс-положении (Zhao et al. 2006). Являются ли эти описанные различия (very specific with the Wsb1/Nf1 locus versus with a high number) во взаимодействиях H19 ICR с др. геномными областями обусловлены разными экспериментальными подходами или являются клеточно специфичными, пока неясно.
Некоторая информация о том, как эти дальнодействующие физические взаимодействия между хромосомами могут обеспечиваться получена в исследованиях Polycomb response elements (PRE) у Drosophila. Последовательность Fab-7 содержит PRE и регулирует экспрессию генов локуса bithorax, предмета пространной регуляции во время развития. Fab-7 может действовать в цис--положении, но если Fab-7 трансгены вставляются в геном Drosophila, то эти трансгены (даже если на разных хромосомах) и эндогенный Fab-7 часто ассоциируют в процессе т.наз. trans-ощущения гомологичных последовательностей. Эти ассоциации зависят от присутствия белков группы Polycomb (Bantignies et al. 2003). Интересно, что компоненты аппарата RNA interference (RNAi), такие как dicer-2, также как и гены Argonaute необходимы для дальнодействующих взаимодействий. Аппарат RNAi не нужен для установления межхромосомных взаимодействий, но для их поддержания (Grimaud et al. 2006). Следующая модель может быть предложена: как только устанавливается спаривание и стимулируется антисмысловая транскрипция вблизи и аппарат RNAi продуцирует small interfering RNA (siRNA). siRNA могут затем быть связаны белками Polycomb-группы, чтобы действовать как молекулярный клей, который стабилизирует хромосомное взаимодействие и молчание обоих локусов (Grimaud et al. 2006; Lei and Corces 2006). Несмотря на некоторые первые намеки о роли RNAi в физическом взаимодействии между разными хромосомами, многие механистические вопросы ещё остаются открытыми.
Недавние находки снова ставят вопрос о том, как в целом осуществляются межхромосомные общения. Недавние исследования кластера генов Hox мыши продемонстрировали, что совместная регуляция 4-х кластеров, расположенных на разных хромосомах, не связана с колокализацией локусов (Lanctot et al. 2007). Эти результаты демонстрируют, что корегуляция Hox генов может не зависеть от колокализации. Кроме того, активные α- и β -globin гены колокализуются только в человеческих, но не мышиных эритробластах. Эти различия могут быть обусловлены различным хромосомным содержанием; мышиный локус расположен в регионе, бедном генами, вблизи центромеры, тогда как человеческий локус расположен в богатом генами субтеломерном регионе (Brown et al. 2006). Это указывает на то, что не только транскрипционная регуляция, но и также дополнительные факторы, такие как хромосомные структура, локализация, повторы или плотность генов могут влиять на межхромосомные взаимодействия.
Хотя примеры, рассмотренные выше, строго подтверждают концепцию транс-регуляции посредством межхромосмных контактов и коммуникаций - по крайней мере специфических локусов - и влияние межхромосомных контактов в регуляции состояний генной экспрессии, которые могут быть наследуемыми. Кроме того, чтобы лучше понять цис-взаимодействия на одной и той же хромосоме, эти межхромосомные взаимодействия добавляют дополнительный слой сложности в регуляции зависимых от ДНК процессов. Сегодня мы лишь в начале понимания межхромосомных взаимодействий и они могут иметь центральное значение для их более детального. Наблюдения за живыми клетками говорят нам, что динамика этих взаимодействий может быть временной или продолжительной. Идентификация и манипуляции в элементами ДНК, необходимыми для взаимодействий, д. позволить нам изучить функциональное значение взаимодействий. Многие вопросы ещё остаются без ответа. В самом ли деле хромосомы контактируют физически или только оказываются в тесной близи? Какие белки и белковые комплексы участвуют в этих взаимодействиях? Участвуют ли одни и те же белки в формировании петель и в межхромосомных контактах? Как эти факторы рекрутируются? Какова роль РНК в этом процессе? Существует ли механизм обратной связи, которыей позволяет элементам ДНК взаимодействовать как раз с одним элементом ДНК среди др.?
Лишь новые высокопроизводительные технологии, такие как 3C подходы вместе с микромассивами (Simonis et al. 2006) или прямое секвенирование позволят беспристрастный скрининг генома на ДНК локусы, которые контактируют др. с др. Однако недостатком этой техники является то, что она захватывает и очень временные взаимодействия. Комбинация с высокопроизводительным FISH может быть использована для верификации этих взаимодействий. Nuclear organization and rearrangements in pluripotent cells Плюрипотентные клетки обладают потенциалом самообновления бесконечно и дифференцируются в любой др. тип клеток. Для этого необходимо, чтобы плюрипотентные клетки обладали ядерной архитектурой, которая позволяла бы поддержание плюрипотентного состояния, но которая в то же самое время была был пластична настолько, чтобы позволять вступление на путь дифференцировки. Как только стартует путь дифференцировки и транскрибируется клеточно-специфическая программа. Мы обсудим динамику и пластичность ядерной организации ES клеток и ранних мышиных эмбрионов в сравнении с клон-детерминированными клетками ES cells ES клетки обогащены менее компактным эухроматином и обнаруживают более диффузные гетерохроматиновые структуры. После дифференцировки гетерохроматин перестраивается и количествов гетерохроматиновых локусов увеличивается (rev. Arney and Fisher 2004; Meshorer and Misteli 2006). Крупномасштабная организация хромосомных территорий сходна в ES клетках по сравнению с дифференцированными клетками (Wiblin et al. 2005). Однако, специфичные для ES клеток гены изменяют своё положение во время дифференцировки -напр., у человека ген NANOG перемещается из более периферической позиции в ES клетках в более центральное положение в B клетках - а ген OCT4 образует петли из свой хромосомной территории в ES клетках (Wiblin et al. 2005). Это также коррелирует со временем ранней репликации этих генов в ES клетках по сравнению с более поздней в дифференцированных клетках (Perry et al. 2004). В мышиных ES клетках существуют "домены бивалентного хроматина" из крупных регионов активных и репрессивных гистоновых модификаций. Эти домены содержат хроматин, обогащенный метилированием H3/K27, меткой рассматриваемой как специфическая для репрессивного, конденсированного хроматина; внутри него мы нашли более мелкие регионы, обогащенные метилированием H3/K4, меткой активного хроматина (Azuara et al. 2006; Bernstein et al. 2006; Lee et al. 2006). Эти домены, как полагают, функционируют посредством противоположных гистоновых модификаций, чтобы замалчивать гены развития в ES клетках, в то же время удерживая их готовыми к активации позднее. После дифференцировки ES клеток, когда гены этих бивалентных доменов оказываются включены,репрессивное метилирование H3/K27 снижается, тогда как метилирование H3/K4 сохраняется (Bernstein et al. 2006; rev. Spivakov and Fisher 2007).
Интересно, что недавнее исследование группы Misteli (Meshoer et al. 2006) показало, что хроматин в ES клетках глобально декоденсирован и содержит высокую фракцию лишь рыхло связанных архитектурных хроматиновых белков, включая линкерный гистон H1 и белок HP1. Природа этого пула всё ещё спорна (Gilbert et al. 2007); было показано, что эта гипердинамическая популяция белков является характерным признаком действительно плюрипотентных клеток, тогда как клон-детерминированные клетки не содержат его (Meshorer et al. 2006). В соответствии с этим плюрипотентные клетки обогащены ацетилированными гистонами, а репрессивные гетерохроматиновые метки редуцированы (Kimura et al. 2004). Это открытый гипердинамический хроматин необходим для дифференцировки ES клеток и назван "breathing" хроматином (Meshorer et al. 2006). Этот пул гипердинамических хроматиновых белков может быть необходим для становления хроматиновых доменов, как только клетки начинают программу экспрессии клон-специфических генов за счет секвестрации генов в специфические активные или репрессивные домены хроматина или белковые тельца (Meshorer et al. 2006). Гипердинамический открытый хроматин в ES клетках д. позволять регуляторным факторам достигать их сайтов связывания и также вызывать быструю активацию программ экспрессии клон-специфических генов. Early mouse embryo Подобно ES клеткам у ранних эмбрионов мыши также описана концепция "динамической" хроматиновой структуры, позволяющая развитие плюрипотентных клеток. Недавно исследовали, связи гистоновых модификаций с клеточными судьбами у ранних эмбрионов. Увеличение уровня метилирования аргинина гистонов, обычно рассматриваемое как активирующая метка, приводит к усилению активности nanog и "склонности" выбирать клеточную судьбу в направлении клеток внутренней массы (Torres-Padilla et al. 2007). Однако необходимо исследовать, существует ли какая-либо прямая связь между активацией генов, ограничивающих определенный клон, во время развития и этим хроматином, обогащенным активными метками, и какова точная роль ядерной организации в этих эмбриональных клетках.
Ядерная организация у эмбрионов мыши во время преимплантационного развития (в зиготе и во время первых раундов делений дробления) обнаруживает определённые свойства, которые динамически и драматически отличны от соматических клеток (Morgan et al. 2005); напр., определенная организация и перемещения центромерных повторов в ядре. Вполне возможно. что эти свойства необходимы для репрограммирования хроматина, которое происходит в эмбрионе после оплодотворения. Детальный анализ локализации центромерных крупных и минорных сателлитных повторов (формирующих т. наз. chromocenter) в отцовском и материнском геномах после оплодотворения показал, что ядерная организация центромерных сателлитных регионов оказывается преобразованной в пространстве в течение нескольких часов (Probst et al. 2007). Крупные сателлиты перемещаются в направлении центра пронуклеусов и воспринимают кольце-подобную структуру вокруг ядрышко-подобных телец, которые являются сферическими структурами, рассматриваемыми как предшественники ядер. Это перемещение повторов сопровождает включение времени репликации (Martin et al. 2006) и происходит в то же самое время, что и активация транскрипции молчащего эмбрионального генома. Следствием такой организации является то, что перицентромерные регионы разных хромосом приходят в физическую близость, что в принципе делает возможным некоторое взаимное общение. Известно отметить, что не все хромосомы принимают эту специфическую конфигурацию центромер, т.к. про-хромоцентр-подобная структура превалирует специфически в пронуклеусах самок (Probst et al. 2007). После клеточной дифференцировки во время формирования бластоциста центромерные повторы движутся и приобретают подобную соматической организацию (Martin et al. 2006). Значение для нормального развития и молекулярные механизмы, лежащие в основе этого специфического перемещения центромер остаются неизвестными. Однако у клонируемых эмрионов, возникающих в результате переноса соматических ядер, конфигурация соматического хромоцентра донорского ядра быстро возвращаетя назад (Martin et al. 2006). Это указывает на то, что перемещение крупных геномных регионов и достижение подобной специфической конфигурации хромоцентра необходимы для репрограммирования.
Известно, что плюрипотентные клетки, по-видимому, нуждаются в динамической, активной ядерной организации, позволяющей поддерживать плюрипотентное состояние и потенциал дифференцировки в какой-либо клон. Интенсивное перепрограммирование хроматина у ранних эмбрионов мыши, которое необходимо для пластичности эмбриона, использует гистоновые модификации, перемещения внутри ядра, и в частности, реорганизацию на более глобальном уровне по сравнению с перемещениями хроматина при активации специфических генов. Сегодня наши знания о вкладе ядерной архитектуры в в плюрипотентность сильно ограничены. Дополнительная информация была бы важна, чтобы сравнить ядерную организацию и динамику плюрипотентности и клон-детерминированные клетки более детально.
Perspectives
The understanding of the relationship between nuclear
architecture, genome organization, and gene expression will be aided by the application of new imaging techniques that include improvements of the resolution, time-lapse, and live cell imaging. The advent of highthroughput analysis of histone modifications has provided us with a genome-wide map for many chromatin modifications. Although these data allow for a detailed knowledge of chromatin states, we still have very limited insight into the causal relationship between chromatin modification, higher-order chromatin organization, subnuclear gene localization, and gene expression. In particular, the clarification of the cause–effect relationship of nuclear organization and the function of the genome represents one of the most important future challenges. Further experiments are needed to determine whether the spatial organization of the nucleus is a consequence of genome organization, chromatin modifications, and DNA-based processes, or whether nuclear architecture is an important determinant of the function of the genome. For example, the concept of self-organization of nuclear structures and subcompartments by specific DNA sequences is supported by the extensive analysis of the ribosomal genes and their role in the genesis of the nucleolus. However, this model needs further validation, and its generality has to be addressed, including whether and to what extent such genome-driven nuclear self-organization plays a role at other gene loci. Another important future avenue will be the identification of proteins that, like CTCF, mediate intra- and/or interchromosomal interactions. A molecular characterization of these proteins and their multiprotein complexes will help to understand the coordinate expression of genes that do not reside in gene clusters. Finally, the question of the molecular forces in the nucleus that mediate chromatin mobility will be of utmost importance for our understanding of the dynamics of the genome. With the advent of innovative techniques and interdisciplinary approaches, combined with the enthusiasm of this field of research, we can expect fascinating future insight into a central biological problem.
|