Зачатки конечностей позвоночных развиваются на латеральной поверхности тела эмбриона за счет пролиферации латеральной пластинки мезодермы. Эти рано вырастающие зачатки являются простыми структурами, состоящими из стрежня мезодермальных клеток, покрытого эктодермальным покровом. В ходе развития зачаток подвергается интенсивному росту, а хрящевой примордий скелетных компонентов дифференцируется в центральную область мезодермального стержня. В отличие от этих центральных клеток, предназначенных сформировать хрящ, клетки, окружающие хондрогенные агрегаты, в основном элиминируются за счет апоптоза, скульптуирующего форму окончательной конечности. Противоположные хондрогенная и апоптические судьбы мезодермальных клеток особенно важны во время формирования пальцев в autopodial сегменте конечности. В этой области пальцы развиваются в виде дивергирующих хондрогенных лучей, соединенных с помощью промежуточной межпальцевой ткани, которая позднее удаляется с помощью массивной апоптической клеточной гибели у видов со свободными пальцами (ZuzarteLuis and Hurle. 2002).
Bone morphogenetic proteins (BMPs), Activins and transforming growth factor β 2 (TGFβ 2) являются основными сигнальными молекулами, модулирующими морфогенез пальциев. TGFβ 2 и activins экспрессируются первоначально в мезенхиме, которая д. генерировать пальцы в развивающемся аутоподе. Кроме того, эктопическая избыточная экспрессия любого из них в межпальцевой ткани ингибирует её апоптическую судьбу и индуцирует образование дополнительных избыточных пальцев (Ganan et al., 1996. Merino et al., 1999a, Montero and Hurle, 2007). Bone morphogenetic proteins (BMP2, BMP4, BMP7 and BMP5) экспрессируются в межпальцевой и околопальцевой ткани скорее, чем в пальцевых агрегатах, но они ответственны за рост пальцевых хрящей (Montero and Hurle, 2007). Соотв., избыточная экспрессия BMPs в пальцевой мезенхиме генерирует драматический избыточный рост пальцев, тогда как избыточная экспрессия антагонистов BMP (т.e. noggin или gremlin) ведет к укорочению пальцев (Merino etal., 1998. Merino etal., 1999b). Удивительным аспектом передачи сигналов BMP во время развития конечностей является то, что помимо обеспечения роста скелетных хрящей, они также запускают сигналы запрограммированной клеточной гибели в недифференцированной мезодерме, включая межпальцевую мезенхиму (Ganan et al., 1996, Macias et al., 1997). Следовательно, выяснение функциональной координации между TGFβ /activin и BMPs в регуляции роста и дифференцировки хрящевых скелетных зачатков и запрограммированной клеточной гибели является основным вопросом для понимания морфогенеза пальцев. Поэтому идентификация промежуточных игроков обоих сигнальных путей может помочь в этом отношении.
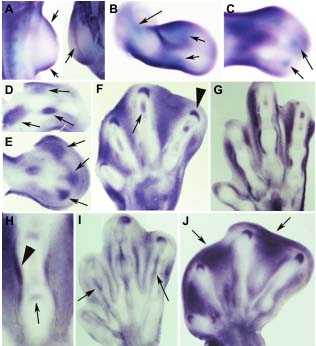 Fig. 1. Id2 expression in the developing limb of chicken
A B C and duck embryos. (A-J) In situ hybridization of chicken
(A-I) and Duck (J) embryos in whole mount (A-C) and
vibratome sections (D-J) specimens, showing the pat-
tern of expression of Id2. (A) Image on the left of panel
A is a lateral view of the limb bud at stage HH21 showing
domains of Id2 in the anterior and posterior mesen-
chyme (arrows). Image on the right of panel A illustrates
a frontal view showing a moderate labeling (arrow) of the
D F G apical ectodermal ridge (AER). (B) Wing bud of stage
HH24 showing Id2 expression in the anterior and poste-
rior mesenchyme with additional domains in the forming
skeletal elements of the stylopod and zeugopod (ar-
rows). (C) Expression of Id2 is recognizable at the level
E of the forming digits at stage HH25 (arrows). (D) Vi-
bratome section of a HH24 limb where domains at the
level of the skeletal elements are more easily recogniz-
able (arrows). (E) Vibratome section of stage 26 limb
showing the expression of Id2 in the prospective digit
mesenchyme (arrows). (F) Id2 is expressed in the
interdigital mesenchyme, the digit tip (arrowhead) and
the developing cartilage of the distal phalanxes (arrow) at
H I J stage HH 30. (G-H) Image in (G) shows appearance of
transcripts at the level of the developing perichondrium
of the digits and the articular cartilage of HH 34 autopod.
These domains are more easily recognizable in a detailed
view of a digit in (H) (arrow and arrowhead). (I) This panel
shows a superficial section of the HH34 autopod of the
chicken embryo showing further domains of expression
at the level of the developing tendons (arrows). (J) Id2 is
preferentially expressed in the distal mesenchyme of the
interdigits 2 and 3 (arrows) of the developing duck
autopod at 9 days of incubation (equivalent to chicken
stage HH31) in contrast to the widespread interdigital
distribution in first interdigit and in the chick autopod (F).
Fig. 1. Id2 expression in the developing limb of chicken
A B C and duck embryos. (A-J) In situ hybridization of chicken
(A-I) and Duck (J) embryos in whole mount (A-C) and
vibratome sections (D-J) specimens, showing the pat-
tern of expression of Id2. (A) Image on the left of panel
A is a lateral view of the limb bud at stage HH21 showing
domains of Id2 in the anterior and posterior mesen-
chyme (arrows). Image on the right of panel A illustrates
a frontal view showing a moderate labeling (arrow) of the
D F G apical ectodermal ridge (AER). (B) Wing bud of stage
HH24 showing Id2 expression in the anterior and poste-
rior mesenchyme with additional domains in the forming
skeletal elements of the stylopod and zeugopod (ar-
rows). (C) Expression of Id2 is recognizable at the level
E of the forming digits at stage HH25 (arrows). (D) Vi-
bratome section of a HH24 limb where domains at the
level of the skeletal elements are more easily recogniz-
able (arrows). (E) Vibratome section of stage 26 limb
showing the expression of Id2 in the prospective digit
mesenchyme (arrows). (F) Id2 is expressed in the
interdigital mesenchyme, the digit tip (arrowhead) and
the developing cartilage of the distal phalanxes (arrow) at
H I J stage HH 30. (G-H) Image in (G) shows appearance of
transcripts at the level of the developing perichondrium
of the digits and the articular cartilage of HH 34 autopod.
These domains are more easily recognizable in a detailed
view of a digit in (H) (arrow and arrowhead). (I) This panel
shows a superficial section of the HH34 autopod of the
chicken embryo showing further domains of expression
at the level of the developing tendons (arrows). (J) Id2 is
preferentially expressed in the distal mesenchyme of the
interdigits 2 and 3 (arrows) of the developing duck
autopod at 9 days of incubation (equivalent to chicken
stage HH31) in contrast to the widespread interdigital
distribution in first interdigit and in the chick autopod (F).
Белки Id (inhibitor of DNA binding/differentiation) относятся к подсемейству helix-loop-helix факторов, которые содержат HLH мотив димеризации, но лишены базового дНК связывающего домена. Семейство Id содержит 4 члена (Id1, Id2, Id3 и Id4) и первоначально было открыто как ингибиторы клеточной дифференцировки, действующих как антагонисты basic helix loop helix (bHLH) транскрипционных факторов (также наз. E-белками). Т.о., после гетеродимеризации с этого типа транскрипционными факторами они нарушают их связывание со специфическими E-Box доменами ДНК из-за отсутствия ДНК связывающих регионов (Benezra etal.. 1990). Сегодня известно, что они могут также ингибировать действие др. транскрипционных факторов, таких как Pax или Ets (Roberts etal.. 2001, Yates etal., 1999). Во время развития Id1, Id2 и Id3 обнаруживают перекрывающиеся паттерны экспрессии, обнаруживая лишь легкие отличия, тогда как Id4 отличается от остальных членов семейства (Jen et al., 1996).
Двойной нокаут мышей по Id1 и Id3 (но не каждого в отдельности) вызывает драматическое ингибирование нейрогенеза и связанного с головным мозгом ангиогенеза и, по-видимому, являются факторами, способными модулировать васкуляризацию опухолей (Lyden et al., 1999). У этих мутантных нейробластов преждевременно прекращается клеточный цикл и обнаруживается более строгая и расширенная экспрессия факторов детерминации и дифференцировки нейрогенных bHLH факторов, коррелирующих с преждевременным окончанием дифференцировки (Lyden et al., 1999). Кроме того, Id 1 и Id3 экспрессируются в кровеносных сосудах нервной системы, а мутанты формируют аберрантный эндотелий с отсутствием ветвления и врастания капилляров нейроэктодермы, обнаруживающей кровоизлияния в вентрикулярной системе мозга. Известно, что мыши, дефектные по этим факторам, значительно меньше допускают опухолевый рост благодаря дефектам ангиогенеза в инвазивной ткани (Lyden et al., 1999).
Некоторые дефекты ассоциированы также с отсутствием Id2 у мышей. Id2 экспрессируется в дендритных клетках (DC), которые являются антиген-презентирующими клетками с жизненно важной ролью в антиген-специфической иммунной реакции. Id2-/- лишены клеток Langerhans (LCs) (кожных представителей DCs) , а количество селезеночных DC сильно снижено. Во время гематопоэтического развития экспрессия Id2 находится под влиянием передачи сигналов TGFβ и модулирует дифференцировку в направлении DC клона, репрессируя судьбу B клеток (Hacker et al., 2003). Сходным образом было предположено, что Id2 способствует дифференцировке natural killer (NK) в противовес клону Т клеток из общего NK/T предшественника, поэтому нулевые Id2 мыши обнаруживают снижение почти на 90% клеток NK по сравнению с диким типом. Интересно, что количество предшественников, по-видимому, одинаково с диким типом, это указывает четко на принуждение в выборе клеточных судеб у таких мышей (Ikava et al., 2001). Итак, Id2-нулевые мыши обнаруживают тяжелое снижение клеток натуральных киллеров и отсутствие некоторых субклассов дендритных клеток.
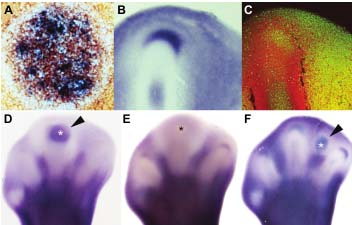 Fig. 2. Id2 shares expression domains with BMP activity and is regulated by BMP and TGFb; signaling. (A) Co-expression of Id2 (red) and Smad8 (blue) shown in a transversal section at the levelof the distal phalanx of digit 3 of HH28 embryo. (B) Detailed view of digit III of a limb autopod from an embryo at stage HH28 showing the characteristic crescent domain of expression of Id2 present at the digit tip. (C) Equivalent view to that in (B) from a limb immunolabeled for phosphorylated SMAD1,5,8 (green) in order to detect regions of BMP activity. Counterstain in red corresponds to actin. (D) BMP7 treatments at the tip of the digit (asterisk in D) cause dramatic induction of Id2 expression (arrowhead in D). (E) Downregulation of Id2 expression 10 hr after application of a Noggin bead (asterisk) at the tip of the digit. (F) Application of a TGF?1 bead (asterisk) in the interdigital tissue causes a transitory upregulation of Id2 expression preceding the formation of an ectopic digit (arrowhead).
Fig. 2. Id2 shares expression domains with BMP activity and is regulated by BMP and TGFb; signaling. (A) Co-expression of Id2 (red) and Smad8 (blue) shown in a transversal section at the levelof the distal phalanx of digit 3 of HH28 embryo. (B) Detailed view of digit III of a limb autopod from an embryo at stage HH28 showing the characteristic crescent domain of expression of Id2 present at the digit tip. (C) Equivalent view to that in (B) from a limb immunolabeled for phosphorylated SMAD1,5,8 (green) in order to detect regions of BMP activity. Counterstain in red corresponds to actin. (D) BMP7 treatments at the tip of the digit (asterisk in D) cause dramatic induction of Id2 expression (arrowhead in D). (E) Downregulation of Id2 expression 10 hr after application of a Noggin bead (asterisk) at the tip of the digit. (F) Application of a TGF?1 bead (asterisk) in the interdigital tissue causes a transitory upregulation of Id2 expression preceding the formation of an ectopic digit (arrowhead).
Кроме того, Id2-нулевые мыши обнаруживают отклонения в репродуктивной системе. Т. о., самки нулевых мышей обнаруживают дефекты лактации, связанные с дефектами хода клеточного цикла и резким снижением пролиферации эпителиальных клеток молочных желез, которая необходима во время ранней беременности (Mori et al., 2000). Самцы нулевых мышей характеризуются существенно сниженным сперматогенезом и аномальными семявыносящими протоками и драматическим снижением клеток Сертоли, это согласуется с экспрессией Id2 в этих клетках (Sablitzky et al., 1998). Было также показано, что снижение Id2 в эпителии кишечника препятствует выходу из клеточного цикла и дифференцировке предшественников энтероцитов во время эмбриогенеза. Сохранение подобной ситуации во взрослой жизни вызывает неопластические трансформации у взрослых (Russell et al., 2004). Однако Id2 обладает важным онкогенным потенциалом, т.к. является прямой мишенью для транскрипционных факторов семейства Мус и избыточно экспрессируется в опухолях, несущих мутации в его членах (Lasorella et al., 2002; Fernandez et al., 2003). Более того, было показано, что только Id2, но не др. члены семейства, Id 1 и Id3, способен устранять антипролиферативные эффекты белков опухолевых супрессоров из семейства retinoblastoma, делая возможным ход клеточного цикла за счет физических взаимодействий с ними (Lasorella et al., 2000).
Наконец, известно, что Id4 выполняет важную роль в созревании олигодендроцитов во время развития, поэтому предшественники, лишенные Id4, созревают преждевременно (Marin-Husstege et al., 2006). Итак, Id факторы могут действовать как важные регуляторы различных биологических процессов и они широко участвуют в поддержании недифференцированного состояния и митотической активности клеток, часто подавляются, когда клетки дифференцируются (Lyden et al., 1999, Shimizu-Nishikawa etal., 1999; Ruzinova and Benezra, 2003, Sikder etal., 2003; lavarone and Lasorella. 2006).
SMAD-связывающие элементы обнаружены в промоторе Id белков (Holinagel et al., 1999). Было продемонстрировано, что Id белки вносят вклад в координацию пролиферации и дифференцировки в клетках, подвергшихся стимуляции с помощью BMP или TGFβ (Kowanetz etal., 2004). Кроме того, известно, что
Id2 экспрессируется в раннем зачатке конечности (Krishan et al., 2005). Поэтому мы исследовали экспрессию и регуляцию этого фактора во время морфогенеза скелета конечностей.
Discussion
Здесь мы описали паттерн экспрессии и регуляции inhibitor of DNA binding/differentiation 2 (Id2), an helix-loop-helix фактора, который секвестрирует bHLH транскрипционные факторы путем образования гетеродимеров, которые лишены способности соединяться с ДНК. Мы показали, что экспрессия Id2 в развивающейся конечности соответствует зоне активной передачи сигналов BMP. В ранних зачатках конечностей Id2 обладает передним и задним мезодермальными доменами, очень точно соответствующими доменам экспрессии BMP4, BMP7 и BMP2 (Montero et al., 2001). Кроме того, Id2 экспрессируется также на низких уровнях в AER. Эта структура является ключевым сигнальным центром зачатка конечности, регулируемым с помощью сложной сигнальной сети, включая и BMPs (Pizette etai., 2001). Экспрессия Id2 в AER, в передней и задней мезодерме может быть связана с продемонстрированной функцией этого транскрипционного фактора в поддержании клеток в недифференцированном состоянии. Хотя мы не можем предоставить разумное объяснение временной экспрессии Id2 в AER, поскольку BMPs активны в этой структуре вплоть до финальной ст. морфогенеза конечностей. Экспрессия Id2 в недифференцированной субэктодермальной мезодерме на передовой стадии развития также согласуется с функцией Id2 в поддержании клеток недифференцированными. Id2 также обнаружена в данном исследовании в областях межпальцевой клеточной гибели, соответствующих проспективным апоптическим территориям у эмбрионов кур и уток. Хорошо известно, что межпальцевая ткань нуждается в поддержке в недифференцированном состоянии, чтобы оставаться чувствительной к сигналам. запускающим клеточную гибель. Этот аспект проявляется с помощью экспрессии в этой ткани маркеров недифференцированности, включая Msx2 или Snail (Ganan et al., 1998. Montero et al., 2001). Учитывая, что Id2, по-видимому, является регулятором недифференцированности (Lyden et al., 1999, Shimizu-Nishikawa et al.. 1999) мы предположили, что экспрессия Id2 в проспективной апоптической ткани может способствовать поддержанию недифференцированного состояния межпальцевой мезенхимы. Однако, Id2 был описан как проапоптический фактор в нейронах (Gleichmann etal.. 2002). Кроме того Zhao et al. (2007) предоставили некоторые доказательства для возможно позитивного влияния Id2 на апоптическую гибель межпальцевых клеток у эмбрионов перепела.
Удивительные находки данного исследования, что Id2 обнаруживает характерные домены экспрессии в дифференцирующихся хондроцитах во время образования скелета конечности. Хондрогенные агрегаты в ранних зачатках конечностей и хондрогенные узелки в культурах микромасс оказываются позитивными по этому гену. Id2 является также ранним маркером территории формирующихся пальцев и экспрессируется на высоком уровне в кончиках растущих пальцев. Кроме того, по ходу морфогенеза Id2 обнаруживает хорошо определяемые домены в хондроцитах развивающихся фаланг. Все эти находки согласуются с функцией Id2 в хондрогенезе. Однако , не было обнаружено хондрогенных фенотипов у мышей, дефицитных по Id2 (Lasorella et al., 2000, Yokota et al., 1999). Принимая во внимание, что Id1 и ID3 экспрессируются в виде сходных паттернов в развивающихся конечностях (Jen et al., 1996), то это скорее всего и объясняет отсутствие скелетного фенотипа у одиночных мутантов по этим генам из-за функционального перекрывания между членами этого семейства. В этом отношении было показано in vitro, что BMP индуцирует некоторые Id гены, когда способствует дифференцировке хондробластов (Liu et al.. 2007).
Динамические домены экспрессии Id2, сопровождающие формирование пальцев, могут иметь разные функциональные значения. Паттерн экспрессии Id2 в диафизах и эпифизах развивающихся фаланг скорее совпадают с зонами высокого включения BrdU в пальцевые бластемы перед гипертрофической дифференцировкой. Такой паттерн экспрессии согласуется с ролью Id белков, способствовать клеточной пролиферации в др. системах (Barone et al.. 1994. Hara et al., 1994. Lyden et al... 1999, Mori et al., 2000, Rothschild et al., 2006), а не с ингибированием клеточной дифференцировки, предположенной для этого транскрипционного фактора. Необходимо принимать во внимание, что на стадиях, изученных в данном исследовании, пролиферирующие хондроциты диафизов находятся в процессе трансформации в пре-гипертрофические хондроциты. Эти находки указывают на то, что роль Id2 в развитии хрящей ассоциирует с ростом скорее, чем с поддержанием клеток недифференцированными. В этой связи также важно, что Id2 транскрипты отсутствуют в развивающихся суставах , несмотря на присутствие формируемых с помощью локальной дедифференцировки пальцевых хрящей (Craig et al.. 1987).
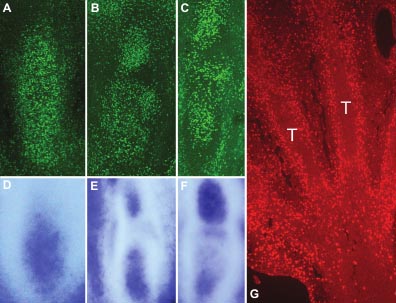 Fig. 3. The pattern of cell proliferation in the developing digits and tendons correlates with the expression of Id2 within the maturating cartilage. (A-F) Different stages of digit development showing immunolabeling against BrdU to compare the pattern of cell proliferation (A-C) with the expression of Id2 (D-F) in digits of equivalent stages. Note the close correlation between BrdU incorporation and the expression of Id2 in digits at initial (A,D) intermediate (B,E) and advanced stages of segmentation into phalanxes (C,F). (G) Superficial
longitudinal section through the developing autopod showing the incorporation of BrdU in the maturing dorsal tendon blastemas (T).
Fig. 3. The pattern of cell proliferation in the developing digits and tendons correlates with the expression of Id2 within the maturating cartilage. (A-F) Different stages of digit development showing immunolabeling against BrdU to compare the pattern of cell proliferation (A-C) with the expression of Id2 (D-F) in digits of equivalent stages. Note the close correlation between BrdU incorporation and the expression of Id2 in digits at initial (A,D) intermediate (B,E) and advanced stages of segmentation into phalanxes (C,F). (G) Superficial
longitudinal section through the developing autopod showing the incorporation of BrdU in the maturing dorsal tendon blastemas (T).
Ранняя экспрессия Id2 в проспективных пальцевых территориях, также как и сохраняющаяся экспрессия в мезенхиме кончиков растущих пальцев могут отражать специфическую функцию в дифференцировке хрящей/сухожилий. Как изначальная мезенхима пальцев ранних зачатков, кончики растущих пальцев являются сложной областью, подвергающейся аггрегации клеток (Montero etal., 2007). Однако после аггрегации клеток дистальная мезодерма аутопода также способна развиваться в предшественников пальцевых сухожилий, которые образуются в тесной связи с хрящевыми аггрегатами (Hurle et al.. 1990, Schweitzer et al., 2001). На молекулярном уровне передачи сигналов TGFβs/Activins и BMP сливаются на этих местах. Tgfβs экспрессируются на высоком уровне в хрящевых конденсатах, однако воздействие TGFβs на межпальцевыую ткань индуцирует хрящевые агрегаты, которым предшествует временный домен экспрессии Id2. В свою очередь, локальное воздействие BMPs или Noggin стимулирует или ингибирует, соотв., как хондрогенез, так и пальцевой домен Id2. Поэтому очень вероятно, что регуляция Id2 с помощью этих сигналов связана со спецификацией хондрогенной в противовес сухожильной судьбы для недифференцированных клеток. В самом деле, Id2 участвует в контроле решений клеточных судеб между двумя разными типами клеток и в др. модельных системах, таких как терминальная дифференцировка разных клонов гематопоэтических клеток из общего предшественника (Ikawa et al., 2001). Сухожилия развиваются в тесной ассоциации с хрящами и scleraxis, helix-loop-helix транскрипционный фактор способствует спецификации мезенхимы в направлении клона сухожилия (Asou etal., 2002, Brent etal., 2003). По крайней мере, в осевом скелете судьбы сухожилий и хрящей являются альтернативными и для дифференцировки хрящей необходимо активное репрессирование развития сухожилий (Brent etal., 2005). Следовательно, вполне возможно, что стимуляция Id2 на кончиках пальцев способствует хондрогенезу и позволяет избегать дифференцировки сухожилий путем ингибирования basic helix-loop-helix транскрипционного фактора scleraxis. В этой связи временная индукция Id2 после воздействия на межпальцевую ткань TGFβs репрессирует эффект TGFβs, способствующий выбору судьбы сухожилия(Liu et al., et al., 1996, Salingcarnboriboon et al., 2003). Более того, в согласии со своими драматическими эффектами на экспрессию Id2 передача сигналов BMP ингибирует scleraxis , тогда как noggin расширяет экспрессию (Schweitzer etal., 2001).
Экспрессия Id2,в созревающих сухожилиях не противоречит нашей интерпретации. Созревающие сухожилия экспрессируют как Id2, так и BMPs, подтверждая, что на этих стадиях Id2 может способствовать росту уже дифференцированной бластемы сухожилия сходным образом с находками, обнаруженными здесь для развивающихся фаланг. Созревающие сухожилия экспрессируют как Id2, так и BMPs и экспрессия Id2 коррелирует с паттерном включения BrdU в дифференцирующуюся бластему сухожилия сходным образом, как и в случает находок, обнаруженных здесь для развивающихся фаланг.
Сайт создан в системе
uCoz  Fig. 1. Id2 expression in the developing limb of chicken
A B C and duck embryos. (A-J) In situ hybridization of chicken
(A-I) and Duck (J) embryos in whole mount (A-C) and
vibratome sections (D-J) specimens, showing the pat-
tern of expression of Id2. (A) Image on the left of panel
A is a lateral view of the limb bud at stage HH21 showing
domains of Id2 in the anterior and posterior mesen-
chyme (arrows). Image on the right of panel A illustrates
a frontal view showing a moderate labeling (arrow) of the
D F G apical ectodermal ridge (AER). (B) Wing bud of stage
HH24 showing Id2 expression in the anterior and poste-
rior mesenchyme with additional domains in the forming
skeletal elements of the stylopod and zeugopod (ar-
rows). (C) Expression of Id2 is recognizable at the level
E of the forming digits at stage HH25 (arrows). (D) Vi-
bratome section of a HH24 limb where domains at the
level of the skeletal elements are more easily recogniz-
able (arrows). (E) Vibratome section of stage 26 limb
showing the expression of Id2 in the prospective digit
mesenchyme (arrows). (F) Id2 is expressed in the
interdigital mesenchyme, the digit tip (arrowhead) and
the developing cartilage of the distal phalanxes (arrow) at
H I J stage HH 30. (G-H) Image in (G) shows appearance of
transcripts at the level of the developing perichondrium
of the digits and the articular cartilage of HH 34 autopod.
These domains are more easily recognizable in a detailed
view of a digit in (H) (arrow and arrowhead). (I) This panel
shows a superficial section of the HH34 autopod of the
chicken embryo showing further domains of expression
at the level of the developing tendons (arrows). (J) Id2 is
preferentially expressed in the distal mesenchyme of the
interdigits 2 and 3 (arrows) of the developing duck
autopod at 9 days of incubation (equivalent to chicken
stage HH31) in contrast to the widespread interdigital
distribution in first interdigit and in the chick autopod (F).
Fig. 1. Id2 expression in the developing limb of chicken
A B C and duck embryos. (A-J) In situ hybridization of chicken
(A-I) and Duck (J) embryos in whole mount (A-C) and
vibratome sections (D-J) specimens, showing the pat-
tern of expression of Id2. (A) Image on the left of panel
A is a lateral view of the limb bud at stage HH21 showing
domains of Id2 in the anterior and posterior mesen-
chyme (arrows). Image on the right of panel A illustrates
a frontal view showing a moderate labeling (arrow) of the
D F G apical ectodermal ridge (AER). (B) Wing bud of stage
HH24 showing Id2 expression in the anterior and poste-
rior mesenchyme with additional domains in the forming
skeletal elements of the stylopod and zeugopod (ar-
rows). (C) Expression of Id2 is recognizable at the level
E of the forming digits at stage HH25 (arrows). (D) Vi-
bratome section of a HH24 limb where domains at the
level of the skeletal elements are more easily recogniz-
able (arrows). (E) Vibratome section of stage 26 limb
showing the expression of Id2 in the prospective digit
mesenchyme (arrows). (F) Id2 is expressed in the
interdigital mesenchyme, the digit tip (arrowhead) and
the developing cartilage of the distal phalanxes (arrow) at
H I J stage HH 30. (G-H) Image in (G) shows appearance of
transcripts at the level of the developing perichondrium
of the digits and the articular cartilage of HH 34 autopod.
These domains are more easily recognizable in a detailed
view of a digit in (H) (arrow and arrowhead). (I) This panel
shows a superficial section of the HH34 autopod of the
chicken embryo showing further domains of expression
at the level of the developing tendons (arrows). (J) Id2 is
preferentially expressed in the distal mesenchyme of the
interdigits 2 and 3 (arrows) of the developing duck
autopod at 9 days of incubation (equivalent to chicken
stage HH31) in contrast to the widespread interdigital
distribution in first interdigit and in the chick autopod (F).
 Fig. 2. Id2 shares expression domains with BMP activity and is regulated by BMP and TGFb; signaling. (A) Co-expression of Id2 (red) and Smad8 (blue) shown in a transversal section at the levelof the distal phalanx of digit 3 of HH28 embryo. (B) Detailed view of digit III of a limb autopod from an embryo at stage HH28 showing the characteristic crescent domain of expression of Id2 present at the digit tip. (C) Equivalent view to that in (B) from a limb immunolabeled for phosphorylated SMAD1,5,8 (green) in order to detect regions of BMP activity. Counterstain in red corresponds to actin. (D) BMP7 treatments at the tip of the digit (asterisk in D) cause dramatic induction of Id2 expression (arrowhead in D). (E) Downregulation of Id2 expression 10 hr after application of a Noggin bead (asterisk) at the tip of the digit. (F) Application of a TGF?1 bead (asterisk) in the interdigital tissue causes a transitory upregulation of Id2 expression preceding the formation of an ectopic digit (arrowhead).
Fig. 2. Id2 shares expression domains with BMP activity and is regulated by BMP and TGFb; signaling. (A) Co-expression of Id2 (red) and Smad8 (blue) shown in a transversal section at the levelof the distal phalanx of digit 3 of HH28 embryo. (B) Detailed view of digit III of a limb autopod from an embryo at stage HH28 showing the characteristic crescent domain of expression of Id2 present at the digit tip. (C) Equivalent view to that in (B) from a limb immunolabeled for phosphorylated SMAD1,5,8 (green) in order to detect regions of BMP activity. Counterstain in red corresponds to actin. (D) BMP7 treatments at the tip of the digit (asterisk in D) cause dramatic induction of Id2 expression (arrowhead in D). (E) Downregulation of Id2 expression 10 hr after application of a Noggin bead (asterisk) at the tip of the digit. (F) Application of a TGF?1 bead (asterisk) in the interdigital tissue causes a transitory upregulation of Id2 expression preceding the formation of an ectopic digit (arrowhead).
 Fig. 3. The pattern of cell proliferation in the developing digits and tendons correlates with the expression of Id2 within the maturating cartilage. (A-F) Different stages of digit development showing immunolabeling against BrdU to compare the pattern of cell proliferation (A-C) with the expression of Id2 (D-F) in digits of equivalent stages. Note the close correlation between BrdU incorporation and the expression of Id2 in digits at initial (A,D) intermediate (B,E) and advanced stages of segmentation into phalanxes (C,F). (G) Superficial
longitudinal section through the developing autopod showing the incorporation of BrdU in the maturing dorsal tendon blastemas (T).
Fig. 3. The pattern of cell proliferation in the developing digits and tendons correlates with the expression of Id2 within the maturating cartilage. (A-F) Different stages of digit development showing immunolabeling against BrdU to compare the pattern of cell proliferation (A-C) with the expression of Id2 (D-F) in digits of equivalent stages. Note the close correlation between BrdU incorporation and the expression of Id2 in digits at initial (A,D) intermediate (B,E) and advanced stages of segmentation into phalanxes (C,F). (G) Superficial
longitudinal section through the developing autopod showing the incorporation of BrdU in the maturing dorsal tendon blastemas (T).