Endoglin (также известен как CD105) является корецептором для сверхсемейства transforming growth factor-beta (TGFβ) (Goumans and Mummery, 2000; Lebrin and Mummery, 2008; ten Dijke et al., 2008). У млекопитающих он экспрессируется в активных эндотелиальных клетках и во время ранней дифференцировки внеэмбриональной мезодермы (Ema et al., 2006; Jonker and Arthur, 2002). У кур эмбриональное кровообращение начинается на ст. Hamburger and Hamilton (HH) 13 (Eichmann et al., 2005; Hamburger and Hamilton, 1992). Паттерн экспрессии Endoglin был изучен у кур в связи с кардиальной дифференцировкой (Vincent et al., 1998) и во взрослых легких и post-circulation сосудистой сети желточного мешка (Raab
et al., 1999). Во время post-circulation развития кур экспрессия Endoglin была также обнаружена внутри эмбриона в кардиальном эндотелии и в развивающихся сосудах, и, как было показано, участвует в процессе epithelial-to-mesenchymal transformation (EMT) во время образования кардиальных клапанов (Mercado-Pimentel et al. , 2007). Мыши Endoglin-/- являются эмбриональными леталями с ангиогенными дефектами помимо разрывов сосудов и отсутствием кардиальной EMT в середине беременности, но сосудистая сеть при этом выглядела нормальной на E8.5 (Arthur et al., 2000; Bourdeau et al., 1999; Li et al., 1999). Endoglin+/- мыши были жизнеспособны и были использованы в качестве модели hereditary hemorrhagic telangiectasia type 1 (HHT1; MIM#187300) (ten Dijke et al., 2008), состояния, наблюдаемого у людей с мутациями в гене Endoglin, приводящими к гаплонедостаточности (Abdalla and Letarte, 2006). Хотя обычно это состояние не летально, но пациенты с HHT1 страдают от хронических носовых кровотечений (epistaxis), telangiectases, имеют высокие показатели легочных и мозговых артерио-венозных нарушений и предрасположены к развитию легочной артериальной гипертензии (Lenato and Guanti, 2006), всё это подчеркивает важность функции Endoglin в становлении и поддержании кровеносной системы.
Более того, было предположено, что Endoglin участвует в раннем гематопоэтическом развитии, при этом Endoglin экспрессируется в mouse embryonic stem cell (mESC), производных мезодермальных FLK1
+ предшественников (Cho et al., 2001) и в blast colony-forming cells (BL-CFCs) (Perlingeiro, 2007).
In vitro метод дифференцировки показал, что Endoglin
-/- mESCs ведут к снижению миэлопоэза и эритропоэза, тогда как формирование лимфоидных и сосудистых предшественников остается неизменным (Cho et al., 2001). Анемия, наблюдаемая у пациентов с HHT1 и у мышей Endoglin
-/- является ещё одним показателем возможной роли Endoglin в эритропоэзе. У взрослых помимо участия в ангиогенезе и репарации сосудов (Hayrabedyan et al., 2005; van Laake et al., 2006), Endoglin экспрессируется в длительное время заселяющих вновь гематопоэтических стволовых клетках из костного мозга (Chen et al., 2002) и, как сообщалось, играет роль в дифференцировке эритроидного клона (Moody et al., 2007). Повышенные уровни экспрессии Endoglin были также обнаружены в опухолях (Fonsatti et al., 2001), атеросклеротических бляшках (Conley et al., 2000) и во время воспаления и заживления ран (Torsney et al., 2002). Экспрессия Endoglin т.о., тесно коррелирует с формированием новых сосудов и может играть роль в патогенезе сосудистых болезней. Однако,
in vitro дифференцировка ангиобластов в Endoglin
-/- mESCs не изменяется (Perlingeiro, 2007) и первичная эндотелиальная сеть у Endoglin
-/- эмбрионов мыши выглядит нормальной (Li et al., 1999), указывая тем самым, что Endoglin может быть безразличен для раннего формирования сосудов.
Results and Discussion
Ген Endoglin кур (AY702002) кодирует полипептид в 644 аминокислот и на 34% идентичен LEndoglin белку человека. Поиски по базе данных EST не выявили существования альтернативно сплайсируемого S-Endoglin у кур, изоформы, активируемой в старых эндотелиальных клетках млекопитающих (Bellon et al., 1993; Blanco et al., 2008; Perez-Gomez et al., 2005; Velasco et al., 2008). Высокая степень сходства между Endoglins кур и млекопитающих обнаружена в трансмембранном и коротких цитоплазматических хвостовых доменах со 100% консервацией последних 24 аминокислотных остатков, содержащих сайты, которые фосфорилируются с помощью активированных TβRII, Alk1 and Alk5 и PDZ мотива (Koleva et al., 2006). Его паттерн экспрессии во внеэмбриональных регионах и в pre-circulation развитии не был изучен. Были получены анти-смысловые зонды, соответствующие аминокислотным остаткам 111-304 полной длины Endoglin кур и осуществлена гибридизация in situвсего эмбриона от ст. HH4, когда кровяные/эндотелиальные предшественники начинают генерироваться из задней части первичной полоски (Jaffredo et al., 2005; Nakazawa et al., 2006; Shin et al., 2009), на ст. HH13, когда инициируется кровообращение.
На ст. HH4,слабая экспрессия Endoglin наблюдалась в Гензеновском узелке и головном отростке (Fig.1A; arrowhead). Это временно, т.к. экспрессии Endoglin
 Fig. 1. Whole-mount in situ hybridization analysis of Endoglin from stage HH4 to stage HH13. (A) At HH4+, Endoglin is expressed very weakly in the Hensen's node and head process (arrowhead) and in the newly formed extraembryonic mesoderm (arrow). (B) At HH6, expression in the node and node-derived tissues is not detected. Broader, yet still very weak, Endoglin expression is observed in the extraembryonic mesoderm (arrow). (C) By HH7, expression in the area vasculosa becomes stronger, especially in the future medial extraembryonic and lateral plate regions. (D) At HH8, robust expression is observed throughout extraembryonic and intraembryonic vasculature. (E) By HH10, extraembryonic vascular expression is reduced significantly, with intraembryonic vasculature (including cardiac and lateral plate vessels) strongly positive for Endoglin. Progenitors for the pronephric duct are also strongly positive. (F) At HH12, vascular expression of Endoglin is further reduced, with strong positive cells confined to mid-level medial splanchnopleural vasculature. Pronephric duct progenitors remain strongly positive. Somatopleural vessels are undergoing active vasculogenesis, marked by strong expression of Endoglin in numerous small clusters in both extra- and intra-embryonic regions. (G) Magnified view of the extraembryonic somatopleural Endoglin positive clusters at HH12. (H) By HH13, Endoglin expression is much reduced throughout the entire developing embryo. Weak expression is still detected in the heart and the posterior part of the embryo, where new vessels continue to be formed.
Fig. 1. Whole-mount in situ hybridization analysis of Endoglin from stage HH4 to stage HH13. (A) At HH4+, Endoglin is expressed very weakly in the Hensen's node and head process (arrowhead) and in the newly formed extraembryonic mesoderm (arrow). (B) At HH6, expression in the node and node-derived tissues is not detected. Broader, yet still very weak, Endoglin expression is observed in the extraembryonic mesoderm (arrow). (C) By HH7, expression in the area vasculosa becomes stronger, especially in the future medial extraembryonic and lateral plate regions. (D) At HH8, robust expression is observed throughout extraembryonic and intraembryonic vasculature. (E) By HH10, extraembryonic vascular expression is reduced significantly, with intraembryonic vasculature (including cardiac and lateral plate vessels) strongly positive for Endoglin. Progenitors for the pronephric duct are also strongly positive. (F) At HH12, vascular expression of Endoglin is further reduced, with strong positive cells confined to mid-level medial splanchnopleural vasculature. Pronephric duct progenitors remain strongly positive. Somatopleural vessels are undergoing active vasculogenesis, marked by strong expression of Endoglin in numerous small clusters in both extra- and intra-embryonic regions. (G) Magnified view of the extraembryonic somatopleural Endoglin positive clusters at HH12. (H) By HH13, Endoglin expression is much reduced throughout the entire developing embryo. Weak expression is still detected in the heart and the posterior part of the embryo, where new vessels continue to be formed.
не обнаруживалосб в узелке или происходящих из него тканей на поздних стадиях.Слабая экспрессия также наблюдалась на этой стадии в будущих внеэмбриональных мезодермальных территориях (Figs. 1A, 2A; arrows). Внеэмбиональная мезодерма на этой ст. строго экспрессирует маркеры предшественников гемангиобластов, гематопоэтических и эндотелиальных предшественников, такие как Gata2, Scl, Lmo2, Ets1 и Vegfr2 (Bollerot et al., 2005; Minko et al., 2003; Nakazawa et al., 2006; Shin et al., 2009), указывая тем самым, что экспрессия Endoglin не коррелирует с инициальными ступенями спецификации эндотелиальных предшественников.
На ст. HH5 and HH6, экспрессия Endoglin во внеэмбриональной мезодерме становится шире, но остается слабой (Fig. 1B; arrow). Более сильная и широкая экспрессия наблюдается на ст. HH7 (Fig. 1C). Внеэмбриональная мезодерма начинает сегрегировать морфологически на три клеточных клона: кровяные, эндотелиальные и гладкомышечные клетки (Shin et al., 2009). Два первых клеточных клона происходят из агрегатов кровяных островков, тогда же начинается экспрессия гена гемоглобина, маркера терминальной дифференцировки кровяных клеток, они обнаруживаются в виде разбросанных клеток внутри популяции кровяных островков (Alev et al., 2008; Nagai and Sheng, 2007; Nakazawa et al., 2009; Nakazawa et al., 2006; Weng et al., 2007). Позитивная регуляция Endoglin на ст. HH7 , по-видимому, маркирует инициацию морфологической дифференцировки клеток, предназначенных стать эндотелиальными. В кровяных островках. расположенных более медиально у эмбриона экспрессия Endoglin обнаруживается в большинстве клеток (Fig. 2B; right arrow), это коррелирует с тем фактом, что наиболее медиально расположенные кровяные островки вносят вклад только в эндотелиальные клетки (Nakazawa et al., 2006). Более латерально расположенные кровяные островки содержат меньше позитивных по Endoglin клеток (Fig. 2B; middle and left arrows; Fig. 2 C,D) и в большинстве случаев эти позитивные клетки располагаются по периферии и на одной стороне кластера кровяных островков (Fig. 2D).
На ст. HH8 экспрессия Endoglin становится более выраженной (Fig. 1D). Строгая экспрессия обнаруживается во всех эндотелиальных предшественниках в процессе, лежащем в основе морфологических изменений, направленных на становление эндотелиальных клеток, включая эндокардиальные предшественники (Fig. 2E), предшественники дорсальной аорты (Fig. 2F) и во всех др. ассоциированных со спланхноплеврой предшественников сосудов как в не-гемогенных (Fig. 2F), так и гемогенных (Fig. 2 G,H) регионах. Вновь сформированные сосудистые эндотелиальные клетки также позитивны по Endoglin (Fig. 2I). Морфологическая дифференцировка клеток эндотелиальных предшественников и формирование сосудистых сплетений происходят активно на ст. HH8 и HH9. Большинство сосудистых эндотелиальных клеток подавляют экспрессию Endoglin вскоре после своей морфологический дифференцировки, и на ст. HH10 (Fig. 1E), строгая экспрессия Endoglin наблюдается только в более медиально расположенных сливающихся эндокардиальных (Fig.3 A,B) и латеральной пластинки сосудистых клетках (Fig. 3C), тогда как внеэмбриональные сосуды не экспрессируют Endoglin совсем на этой ст. (Fig. 3E). Кластеры небольших клеток, расположенных в соматоплевре экспрессируют строго Endoglin (Fig. 3D). Эти клетки, подобно кровяным островкам агрегируют в спланхноплевре, обнаруживая слегка запаздывающую программу дифференцировки, а Endoglin позитивные клетки дифференцируются в небольшие соматоплевральные сосуды (Fig. 3K).
Кровообращение у эмбрионов кур начинается приблизительно на ст. HH12 - HH13.
Fig. 2. Paraffin sections of Endoglin expressing embryos from HH4 to HH8. (A) Section through posterior region of the HH4+ embryo shown in Fig.1A. Arrow indicates very weak expression of Endoglin in a small number of extraembryonic mesoderm cells. (B-D) Sections through the posterior part of the HH7 embryo in Fig.1C. Arrows in (B) indicate that some cells within forming blood island clusters are positive for Endoglin. (C,D) Magnified views of lateral blood island cluster (marked by dotted lines), with some cells in the cluster positive for Endoglin. Blood island clusters in this region normally give rise to both blood cells and endothelial cells, whereas blood islands in more medial regions give rise only to endothelial cells. In these lateral blood island clusters, most Endoglin positive cells are located in the periphery of the cluster as shown in (D). Some are located within the cluster. (E-F) Sections of the HH8 embryo in Fig.1D. (E) A section through the cardiogenic region, with endocardial precursors strongly positive for Endoglin. (F) A section through mid-level of the embryo, with all embryonic endothelial progenitors positive for Endoglin. (G) A section through the extraembryonic region, with medially located blood islands having most of their constituent cells positive for Endoglin and laterally located blood islands having a few positive cells. (H) A magnified view of lateral extraembryonic blood islands, showing peripheral locations of Endoglin positive cells within blood islands (dotted lines). (I) In many lateral plate vessels, strong Endoglin positive signals remain in morphologically differentiated endothelial cells. Scale bar in all panels: 50 µm.
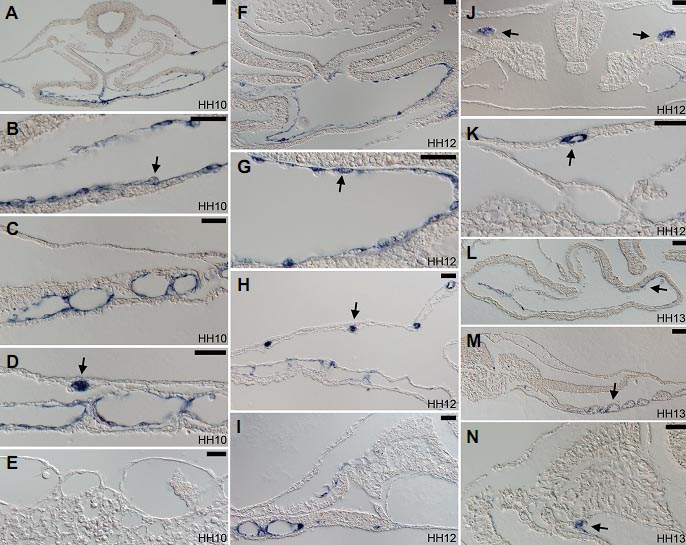
Fig. 3. Paraffin sections of Endoglin expressing embryos from HH10 to HH13. (A-E) Sections of the HH10 embryo shown in Fig.1E. (A) Fusing endocardia are strongly positive for Endoglin (magnified in (B), with arrow indicating a positive endocardial cell). (C) Lateral plate splanchnopleural vessels remain positive for Endoglin. (D) In lateral plate and extraembryonic regions, somatopleural vessel precursors are strongly positive for Endoglin (arrow). (E) Lateral extraembryonic vessels are negative for Endoglin. Blood cells and blood precursors are always negative for Endoglin. (F-K) Sections of the HH12 embryo shown in Fig.1F. (F) Fused endocardium remains positive for Endoglin (magnified view in (G), with arrow indicating a positive endocardial cell). (H) Somatopleural vessel precursors are strongly positive for Endoglin (arrow), whereas splanchnopleural vessels have much reduced expression. (I) Only in the mid-level of the embryo Endoglin in splanchnopleural vessels persists. (J) Developing pronephric duct progenitors (arrows) are strongly positive for Endoglin. (K) Somatopleural vessels (arrow) remain positive for a short period of time after their formation. (L-N) Sections of the HH13 embryo shown in Fig.1H. (L) The endocardium remains weakly positive for Endoglin in some cells (arrow). (M) Newly developed vessels in the posterior part of the embryo are weakly positive for Endoglin. (N) A few cells in the aortic branch in contact with the forming pronephron express Endoglin. Scale bar in all panels: 50 µm.
Уровни экспрессии Endoglin снижаются в большинстве сосудов к началу кровообращения (Fig.1 F,H). В эндокарде экспрессия хорошо заметна на ст. HH12 (Fig.3 F,G), но существенно снижается, хотя всё ещё обнаружена на ст. HH13 (Fig. 3L). Сходное снижение наблюдается в сосудах латеральной пластинки (Fig.3 H,I,M). Экспрессия Endoglin в кластерах небольших клеток в соматоплевре всё ещё сильная на ст. HH12 (Fig.1G; arrows in Fig.3 H,K), но исчезает на HH13 (Fig.1H). На ст. HH13, слабые сигналы Endoglin обнаруживаются в контактном регионе между дорсальной аортой и развивающимися пронефрическими протоками и канальцами (Fig. 3N), возможно это соответствует веточкам аорты в развивающихся наружных гломерулах (Hiruma and Nakamura, 2003). Co ст. HH10 - HH12, предшественники пронефрических протоков строго позитивны по Endoglin (Figs.1E,F, 3J). Они и клетки узелка на ст. HH4 являются единственными не эндотелиальными типами клеток, экспрессирующих Endoglin в данном исследовании.
Итак, установлено, что экспрессия Endoglin во время эмбриональных стадий до начала кровообращения у эмбрионов кур в основном ограничена областями васкулогенеза, она наиболее сильная в эндотелиальных клетках, повергающихся активной васкуляризации и более слабая или не обнаруживается в дифференцированных сосудах. На всех исследованных стадиях сосудистые гладкомышечные клетки и их предшественники не экспрессировали Endoglin. Это подтверждает идею (Carvalho et al., 2004; Ema et al., 2006; Jonker and Arthur, 2002), что Endoglin играет важную роль во время васкулогенеза. У кур, однако, Endoglin, по-видимому, не участвует в спецификации ранних гемангиобластов (общих кровяных и эндотелиальных предшественников) или в гематопоэтическом развитии. Во время дифференцировки эндотелиальных предшественников экспрессия Endoglin, по-видимому, коррелирует лучше всего с фазой морфологических изменений, необходимых для формирования функциональных сосудистых клеток и в меньшей степени для спецификации клеток эндотелиальных предшественников или поддержания морфологии или целостности сосудов после их образования. В сформированных сосудистых структурах, в которых происходит активное ремоделирование, таких как эндокард и сосуды латеральной пластинки спланхноплевры, экспрессия Endoglin поддерживается в течение короткого времени после инициальной морфологической дифференцировки. Следовательно, возможно, что Endoglin обеспечивает TGFβ сигнальный каскад, регулирующий молекулярные сигналы, участвующие в выборе окончательной судьбы эндотелиальными предшественниками, чтобы воспринять дифференцированную эндотелиальную морфологию благодаря инициации синтеза внутриклеточных и внеклеточных молекулярных компонентов, уникальных для функциональных эндотелиальных клеток (напр., специфичные для эндотелия межклеточные соединения и белки внеклеточного матрикса). Во время раннего развития кур, Endoglin, по нашему мнению, является наилучшим молекулярным маркером инициации терминальной дифференцировки клеток эндотелиальных предшественников.
Сайт создан в системе
uCoz Fig. 1. Whole-mount in situ hybridization analysis of Endoglin from stage HH4 to stage HH13. (A) At HH4+, Endoglin is expressed very weakly in the Hensen's node and head process (arrowhead) and in the newly formed extraembryonic mesoderm (arrow). (B) At HH6, expression in the node and node-derived tissues is not detected. Broader, yet still very weak, Endoglin expression is observed in the extraembryonic mesoderm (arrow). (C) By HH7, expression in the area vasculosa becomes stronger, especially in the future medial extraembryonic and lateral plate regions. (D) At HH8, robust expression is observed throughout extraembryonic and intraembryonic vasculature. (E) By HH10, extraembryonic vascular expression is reduced significantly, with intraembryonic vasculature (including cardiac and lateral plate vessels) strongly positive for Endoglin. Progenitors for the pronephric duct are also strongly positive. (F) At HH12, vascular expression of Endoglin is further reduced, with strong positive cells confined to mid-level medial splanchnopleural vasculature. Pronephric duct progenitors remain strongly positive. Somatopleural vessels are undergoing active vasculogenesis, marked by strong expression of Endoglin in numerous small clusters in both extra- and intra-embryonic regions. (G) Magnified view of the extraembryonic somatopleural Endoglin positive clusters at HH12. (H) By HH13, Endoglin expression is much reduced throughout the entire developing embryo. Weak expression is still detected in the heart and the posterior part of the embryo, where new vessels continue to be formed.
не обнаруживалосб в узелке или происходящих из него тканей на поздних стадиях.Слабая экспрессия также наблюдалась на этой стадии в будущих внеэмбриональных мезодермальных территориях (Figs. 1A, 2A; arrows). Внеэмбиональная мезодерма на этой ст. строго экспрессирует маркеры предшественников гемангиобластов, гематопоэтических и эндотелиальных предшественников, такие как Gata2, Scl, Lmo2, Ets1 и Vegfr2 (Bollerot et al., 2005; Minko et al., 2003; Nakazawa et al., 2006; Shin et al., 2009), указывая тем самым, что экспрессия Endoglin не коррелирует с инициальными ступенями спецификации эндотелиальных предшественников.
Fig. 1. Whole-mount in situ hybridization analysis of Endoglin from stage HH4 to stage HH13. (A) At HH4+, Endoglin is expressed very weakly in the Hensen's node and head process (arrowhead) and in the newly formed extraembryonic mesoderm (arrow). (B) At HH6, expression in the node and node-derived tissues is not detected. Broader, yet still very weak, Endoglin expression is observed in the extraembryonic mesoderm (arrow). (C) By HH7, expression in the area vasculosa becomes stronger, especially in the future medial extraembryonic and lateral plate regions. (D) At HH8, robust expression is observed throughout extraembryonic and intraembryonic vasculature. (E) By HH10, extraembryonic vascular expression is reduced significantly, with intraembryonic vasculature (including cardiac and lateral plate vessels) strongly positive for Endoglin. Progenitors for the pronephric duct are also strongly positive. (F) At HH12, vascular expression of Endoglin is further reduced, with strong positive cells confined to mid-level medial splanchnopleural vasculature. Pronephric duct progenitors remain strongly positive. Somatopleural vessels are undergoing active vasculogenesis, marked by strong expression of Endoglin in numerous small clusters in both extra- and intra-embryonic regions. (G) Magnified view of the extraembryonic somatopleural Endoglin positive clusters at HH12. (H) By HH13, Endoglin expression is much reduced throughout the entire developing embryo. Weak expression is still detected in the heart and the posterior part of the embryo, where new vessels continue to be formed.
не обнаруживалосб в узелке или происходящих из него тканей на поздних стадиях.Слабая экспрессия также наблюдалась на этой стадии в будущих внеэмбриональных мезодермальных территориях (Figs. 1A, 2A; arrows). Внеэмбиональная мезодерма на этой ст. строго экспрессирует маркеры предшественников гемангиобластов, гематопоэтических и эндотелиальных предшественников, такие как Gata2, Scl, Lmo2, Ets1 и Vegfr2 (Bollerot et al., 2005; Minko et al., 2003; Nakazawa et al., 2006; Shin et al., 2009), указывая тем самым, что экспрессия Endoglin не коррелирует с инициальными ступенями спецификации эндотелиальных предшественников. 