Единственная несообразность в литературе связана с тем, что избыточно экспрессируемый CENH3 загружается в хроматин смешанным способом преимущественно в домены эухроматина [Collins et al., 2004], тогда как CENH3, соединённый со зрелыми центромерами, по-видимому, чрезвычайно стабилен [Jansen et al., 2007]. Единственным объяснением является то, что CENH3 может соединяться относительно легко с эухроматином без дополнительных взаимодействий, но эти ассоциации может быть коротко живущими. Напротив, инсерции CENH3 вместо эухроматин маркирующих (dime K4 H3) H3 содержащих нуклеосом в центромерных хроматин могут стабилизироваться за счет предсуществующей конформации CEN хроматина и вообще-то ещё больше стабилизироваться с помощью конституитивных белков. связанных с центромерами. CENH3 инкорпорированный в этих условиях может быть дополнительно стабилизирован за счет отложений CENP-A nucleosome-associated complex (CENP-ANAC) и затем нижестоящих компонентов кинетохор. Можо предположить, что факторы, участвующие в загрузке CENH3, могут делать это частично за счет распознавания некоторых аспектов diMe K4 H3 маркированного хроматина. Это открывает возможность, что часть H3 содержащих нуклеосом, которые разбавляют CENH3 метку после S фазы, специфически модифицирована с помощью dime K4 H3 эухроматинового эпигенетического маркера, чтобы застраховаться от того, когда соответственно в G1, некоторые из этих остатков будут заменены на CENH3 содержащие нуклеосомы с помощью гистоны модифицирующих комплексов. такой механизм д. умножать интенсивность CENH3 эпигенетического сигнала до уровня, сходного с тем, что обнаруживается до разбавления в S фазе. Этот сценарий д. приводить к само-обновлению и само-усилению эпигенетического состояния, чтобы надежно маркировать местоположение центромер, а также предоставить оптимальную модификацию хроматина для образования кинетохор.
Недавно Maddox et al. идентифицировали консервативное семейство Myb домен содержащих белков, необходимое для загрузки CENH3 у C. elegans. Белок KNL-2 является членом семейства белков M18BPl/hsKNL2, идентифицированного ранее Fujita et al. и также является важным для загрузки CENH3. Домен myb обладает способностью связывать короткие специфические последовательности ДНК и тем самым обладает потенциалом позволять последовательностям ДНК управлять рекрутированием CENH3 [Maddox et al., 2007). Значение этой характеристики ожидает экспериментальной проверки.
Два дополнительных фактора, участвующие в загрузке CENH3, нуждаются в упоминании. Первый это негистоновый белок Scm3 из почкующихся дрожжей S. cerevisiae [Camahort et al., 2007; Mizuguchi et al., 2007; Stoler et al., 2007]. Этот белок важен для рекрутирования CENH3 гомолога Cse4 на центромеры и для точного расхождения. Scm3 формирует комплекс с Cse4, H4 тетрамерами в центромерном хроматина, указывая тем самым на присутствие нуклеосом, которые лишены H2A и H2B. Эти исследования указывают, что гексамерная структура нуклеосом состоит из из двух Scm3, Cse4 и гистонов H4 на первый взгляд напоминающих hemisome, выделенные у Drosophilia [Dalai et al., 2007]. Эти два примера не-октамерных нуклеосом нуждаются в новой интерпретации классической модели. Scm3 не законсервирован у высших эукариот, однако сходные компоненты нуклеосом нельзя исключить.
Самый последний фактор, который затрагивает загрузку CENH3, это Sim3, белок, выделенный из делящихся дрожжей, который является гомологом гистон связывающего белка NASP человека. Клетки, дефектные по функции Sim3, обнаруживают пониженные уровни CENH3 на центромерах и обнаруживают дефекты расхождения хромосом. Sim3, как полагают, действует как эскорт для CENH3, передавая его факторам сборки хроматина, которые затем инкорпорируют его в центромерный хроматин [Dunleavy et al., 2007]. Глобальная модель загрузки CENH3 нуждается в открытии всех участвующих факторов и в дальнейшем определении путей рекрутирования.
A STRUCTURAL ROLE FOR PERICENTRIC HETEROCHROMATIN IN TENSION SENSING AND SPINDLE ASSEMBLY CHECKPOINT INACTIVATION
Литературные источники подтверждают, что разрушение конформации перицентрического гетерохроматина ведет к дефектам расхождения хромосом [Melcher et al., 2000; Blower and Karpen, 2001; Nonaka et al., 2002; Fukagawa et al., 2004; Guenatri et al., 2004]. В большинстве случаев наблюдаемые дефекты объясняются потерей накопления cohesin, связанного с этим доменом. Ранее мы описали динамическую природу эпигенетической модификации триметилирования lysine 9 гистона H3 во время клеточного цикла. Мы установили, что мышиные клетки, дефицитные по Suv(var)3-9, энзиму, ответственному за эту эпигенетическую метку, и клетки, чьё динамическое метилирование экспериментально блокировано, в обоих случаях обнаруживают дефекты расхождения хромосом [McManus et al., 2006]. В продолжение этого исследования мы проверяли эффект ингибирования метилирования гистонов в короткие периоды во время клеточного цикла, используя общий ингибитор метилирования, adenosine dialdehyde. Мы установили, что обработанные клетки обнаруживают достоверно сниженные уровни метилирования lysine 9 гистона НЗ (H3K9me3) и lysine 20 гистона 4 (H4K20me3). Большая часть клеток, обработанных таким образом, накапливается в метафазе с хромосомами более рыхло расположенными в метафазной пластинке по сравнению с контролем. Эти клетки задерживаются при переходе от метафазы к анафазе, нуждающемуся в активации checkpoint сборки веретена. В конечном счете клетки, неспособные делиться, ведут к накоплению крупных тетраплоидных клеток с нерегулярными границами ядер, указывающими на то, что не происходит инактивации checkpoint веретена. Исследование структуры центромер и кинетохор обработанных и контрольных клеток с помощью ТЭМ выявило нарушения в форме и структуре трёхслойной кинетохорной пластинки. Центромерных хроматин выглядел деконденсированным и сила ассоциации между кинетохорами и поддерживающим CEN хроматином казалась ослабленной. В выборках под напряжением кинетохоры кажутся отделенными от центромер. Изучение расстояний между кинетохорами подтвердило, что кинетохоры обработанных клеток находились под ослабленным натяжением. Эти результаты указывают на то, что интактный перицентрический гетерохроматин необходим для инактивации checkpoint сборки веретена (R. Heit, G. Chan, and M.J. Hendzel, manuscript in preparation). Это можно, по крайней мере, частично объяснить потребностью в полностью конденсированном перицентрическом гетерохроматине для ощущения признаков натяжения, генерируемого сестринскими кинетохорами при соотв. биполярном прикреплении к веретену (Fig. 3).
Функция checkpoint веретена кинетохор, по-видимому, ощущает как прикрепление MT , так и натяжение ими производимое и задерживает переход от метафазы к анафазе до тех пор, пока все сестринские кинетохоры не инициируют соотв. биполярное прикрепление к веретену. Циклы полимеризации и деполимеризации MT создают осциллирующие движения, которые проверяют соединения MT и в конечном итоге упорядочивают прикрепленные хромосомы в митотическую пластинку. Как только достигнута правильная позиция, сестринские кинетохоры подвергается действию более униформного натяжения, то осуществляются направляющие механические натяжения через сестринские центромеры на ультраструктуры кинетохор. Это то натяжение, которое, по-видимому, передает сигнал о корректных условиях для
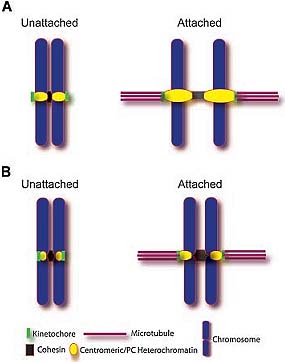 Fig. 3. The involvement of centromeric and pericentromeric heterochromatin in tension-sensing and mitotic checkpoint function. A: Cells with epigenetic defects in pericentromeric heterochromatin have a structurally compromised heterochromatin organization. When bipolar attachment is achieved, the heterochromatin is less able to resist the applied tension and may decondense in response to this tension. The consequence of this decondensation is that the tension requirement for spindle checkpoint inactivation may not be achieved because the tension is absorbed by the unfolding chromatin rather than the kinetochore itself. B: Under normal conditions, the centromeric and pericentromeric heterochromatin remain structurally stable under tension. This allows the force to be transmitted fully to the kinetochore and allows the spindle checkpoint to be satisfied.
Fig. 3. The involvement of centromeric and pericentromeric heterochromatin in tension-sensing and mitotic checkpoint function. A: Cells with epigenetic defects in pericentromeric heterochromatin have a structurally compromised heterochromatin organization. When bipolar attachment is achieved, the heterochromatin is less able to resist the applied tension and may decondense in response to this tension. The consequence of this decondensation is that the tension requirement for spindle checkpoint inactivation may not be achieved because the tension is absorbed by the unfolding chromatin rather than the kinetochore itself. B: Under normal conditions, the centromeric and pericentromeric heterochromatin remain structurally stable under tension. This allows the force to be transmitted fully to the kinetochore and allows the spindle checkpoint to be satisfied.
высоко надежной сегрегации хромосом, инактивирует checkpoint и делает возможным Anaphase Promoting Complex (APC) деградировать cohesin, инициируя необратимо анафазу.
Неприкрепленные кинетохоры и прикрепления MT, которые не создают натяжение, активируют checkpoint. Syntelic (обе кинетохоры прикреплены к MT от одного полюса) и merotelic (одна сестринская кинетохора связана с MT от обоих полюсов, а её сестринская кинетохора соединена только с одним полюсом) прикрепления неспособны обеспечить униформное натяжение и дестабилизируются в процессе с использованием Aurora kinase В обусловленного фосфорилирования белков мишеней, таких как Ndc80 [Pinsky and Biggins, 2005]. Дестабилизация прикреплений MT с помощью Aurora В создает неприкрепленные лишенные натяжения кинетохоры, которые одновременно активируют checkpoint веретена.
Сигнал "ожидания" вызывает образование Mitotic Checkpoint complex (MCC), который содержит APC активатор cdc20 и белки checkpoint сборки веретена Mad2, Mad3 и Bub3. Mad2 является уникальной с двумя состояниями молекулой, регулируемой посредством сложного набора взаимодействий с факторами, такими как Mad1 и p31comet [Yang et al., 2007]. Mad2 накапливается в MCC на неприкрепленных кинетохорах и взаимодействует с cdc20, негативно регулирующим его способность активировать APC комплекс. В отсутствие активности APC cohesin остается интактным и ход митоза останавливается [Musacchio and Salmon, 2007]. Хотя точные механо-химические механизмы, участвующие в восприятии натяжения остаются неизвестными, но ключевые компоненты и некоторые их функции известны. Shugoshin выполняет роль по загрузке Aurora В киназы на центромеры и необходим, чтобы ощущать натяжение [Indjeian et al, 2005]. Polo like kinase 1 (Plkl) фосфорилирует кинетохоры, которые не находятся под натяжением. Оказавшись под униформным натяжением в метафазной пластинке фосфорилирование идет на убыль, но оно немедленно возвращается, если натяжение устраняется за счет добавления MT дестабилизирующих лекарственных препаратов. Plkl, по-видимому, ко-локализуется с антителами (3F3/2) , распознающими её Phosphoepitope в среднем и наружном слоях трёхслойной пластинки [Ahonen et al., 2005]. Plkl interacting checkpoint helicase (PICH) связывает Plkl и также локализуется на внутренней части трехслойной пластинки, где она интегрирует с центромерным хроматином [Baumann et al., 2007]. PICH важна для накопления Mad2 на кинетохорах в зависимости от натяжения. В современной модели, сцепленный CEN хроматин, как полагают, растягивается благодаря реакции на натяжение биполярных кинетохор, заставляя PICH терять конформацию или активность, необходимую для накопления Mad2 в MCC. Потеря Mad2 позволяет cdc20 активировать APC комплекс, ведущий к потере cohesin и инициации анафазы. Когда наступает анафаза, то PICH покрытые хроматиновые волокна могут быть видны, исходящими из недавно разъединенных сестринских кинетохор, указывая тем самым, что сцепленные секции PICH, покрывающие CEN хроматин, избирательно растягиваются в ответ на интенсивное натяжение всё ещё неполного разделения хроматид [Baumann et al., 2007]. Зависит ли это от ремоделирования хроматина с помощью PICH ещё предстоит определить. Она обладает уникальной разъединяющей активностью Topoisomerase II, чтобы разрешить PICH хромтиновым нитям , наконец , позволить независимое расхождение хроматид к митотическим полюсам [Spence et al., 2007].
Наши недавние результаты согласуются с этой моделью. Силы, создаваемые прикреплениями к биполярному митотическому веретену проходят через зрелую триламинарную пластинку центромер. Одним из следствий деконденсации перицентрического гетерохроматина д. быть снижение способности передавать такие силы, без этого хроматиновый домен сам себя деформирует в ответ. Эта сила д. ощущаться механически с помощью PICH, чтобы запустить биохимический каскад, приводящий к инактивации SAC и образованию активного Anaphase promoting complex. Способность перицентрического гетерохроматина передавать силы зависит от его полной конденсации. Эпигенетические метки (H3K9me3) и (H4K20me3) важны для этой функции [Melcher et al., 2000; Schotta et al., 2004], указывая тем самым, что модификации хроматина важны для trilaminar пластинки, чтобы действовать эффективно как структурный элемент в восприятии натяжения и инактивации SAC. Чувствительность любого сценария восприятия натяжения д. зависеть от зрелости структуры, противостоящей натяжению и передающей силу к центру триламинарной пластинки, где согласно современной модели растяжение PICH, покрывающей CEN хроматин, может быть ключевым механизмом восприятия натяжения. Растяжение в др. регионах, где целостность гетерохроматина уменьшена д. осложнять инактивацию checkpoint веретена и приводить к нарушению сегрегации хромосом, обнаруживаемого в экспериментальных системах и при болезнях, где конденсация перицентрического гетерохроматина нарушена. Мы полагаем, что эпигенетические модификации маркируют места локализации центромер, так и диктуют функциональную конформацию зрелой трехслойной структуры.
CONCLUSION
The debate regarding the influence of DNA sequence on centromere location is mooted by the fact that centromeres are reliably maintained, with minor shifting, generation after generation within these a-satellite stretches. Neocentromere formation is rare. De novo centromere formation on artificial human chromosomes also rarely occurs outside of repetitive a-satellite DNA. Thus it is apparent that centromeres evolved to prefer the confines of repetitive DNA. The key may lie in the fact that two identical repetitive domains of DNA can be modified by epigenetic mechanisms to take on differing 3D conformations and thus functions, or the same two stretches can be similarly modified such that two even distal domains have similar conformation and function. This mechanism allows epigenetic modification to define function, whether this is liquid crystal like packaging, cohesin accumulation, or structural integrity.
The exact nature of the CENH3 nucleosome must be determined, especially in light of findings suggesting a configuration differing from the usual octamer. As well the pathway responsible for CENH3 loading must be more fully defined. While it is consensus that CENH3 incorporation defines centromeric chromatin and regulates kinetochore formation, there appears to be a role for each of the other distinguishing epigenetic marks to form a fully functional centromere/kinetochore ultra-structure (Table Г). The phasing of CENH3 with H3 and diMe-K4 H3 required to mark centromere location and initiate kinetochore formation must also be more fully examined.
The role of pericentric heterochromatin should not be understated. The centromere of almost all higher eukaryotes is continuous with at least one domain of heterochromatin, and this is likely the case for functional neocentro-meres as well. Its importance is further highlighted by the growing body of literature showing disruption of heterochromatin by many mechanisms results in chromosome segregation defects. The importance of this chromatin domain for tri-laminar plate formation and cohesin accumulation are well documented, however pericentric heterochromatin may also contribute structural strength to the centromere/kinetochore ultra-structure required for tension sensing and spindle checkpoint inactivation. Studies are currently underway to address this possibility. The severe centromeric defects seen in ICL patients with extreme hypomethylation of satellite and α-satellite DNA and de-condensation of heterochromatin also requires that this enzyme and its epigenetic mark be experimentally investigated.
We conclude that the full function of the mature centromere-kinetochore tri-laminar plate is dependent on its associated epigenetic modifications (Table I). Together these dictate the position and conformation of the centromere and allow the chromatin to provide the essential functions of kinetochore assembly, chromatid cohesion and tension sensing required for genetic stability. These studies further our understanding of how epigenetic modifications regulate such dynamic and critical cellular components. A full understanding of these variables will allow construction of stable artificial chromosomes useful in research and clinically, for gene replacement therapies. By fully understanding the mechanisms of successful chromosome segregation we may eventually target the aneuploidy often associated with cancer.
Сайт создан в системе
uCoz
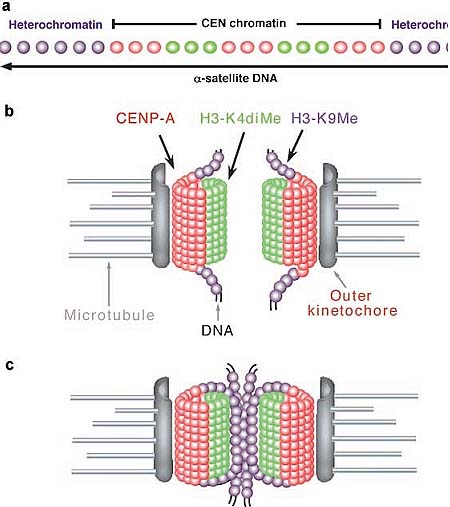 Fig. 1. Unique organization of centromere regions in humans, a: On linear, two-dimensional chromatin fibers, subdomains of nucleosomes containing centromeric (CEN) histone CENP-A (red) are interspersed with H3 dimethylated at lysine 4 (H3K4me2) (green) to form a domain of CEN chromatin on a fraction of the megabase regions of human α-satellite DNA. The remainder of the α-satellite DNA is assembled into heterochromatin (purple) that flanks one or both sides of CEN chromatin doma in. b: At metaphase, when mitotic chromosomes condense, the interspersed domains promote coiling of the DNA so that stacks of CENP-A nucleosomes are presented to the poleward face of the chromosome where they can interact with other kinetochore proteins. H3-containing nucleosomes are oriented between sister kinetochores. c: Heterochromatin defined by nucleosomes containing H3-K9 methylation (purple) is assembled into a domain that is distinct from CEN chromatin. Higher-order packaging of heterochromatin between sister kinetochores may promote orientation of CENP-A, pushing it toward the outside of the chromosome. Heterochromatin in this region is also important for recruiting cohesion proteins that are sustained at the centromere until chromatid separation at anaphase. Reproduced from Schueler and Sullivan (2006).
Fig. 1. Unique organization of centromere regions in humans, a: On linear, two-dimensional chromatin fibers, subdomains of nucleosomes containing centromeric (CEN) histone CENP-A (red) are interspersed with H3 dimethylated at lysine 4 (H3K4me2) (green) to form a domain of CEN chromatin on a fraction of the megabase regions of human α-satellite DNA. The remainder of the α-satellite DNA is assembled into heterochromatin (purple) that flanks one or both sides of CEN chromatin doma in. b: At metaphase, when mitotic chromosomes condense, the interspersed domains promote coiling of the DNA so that stacks of CENP-A nucleosomes are presented to the poleward face of the chromosome where they can interact with other kinetochore proteins. H3-containing nucleosomes are oriented between sister kinetochores. c: Heterochromatin defined by nucleosomes containing H3-K9 methylation (purple) is assembled into a domain that is distinct from CEN chromatin. Higher-order packaging of heterochromatin between sister kinetochores may promote orientation of CENP-A, pushing it toward the outside of the chromosome. Heterochromatin in this region is also important for recruiting cohesion proteins that are sustained at the centromere until chromatid separation at anaphase. Reproduced from Schueler and Sullivan (2006). 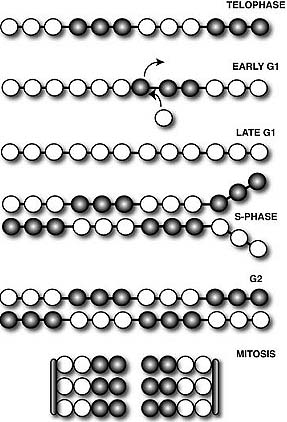 Fig. 2. Cell cycle-dependent changes in centromeric histone composition. At the onset of interphase, centromeric chromatin contains a mixture of histone H3-containing nucleosomes (dark circles) and СЕКНЗ-containing nucleosomes (white circles). During early Gl, the histone H3-containing nucleosomes are replaced with CENH3 through a histone exchange process. As the DNA is replicated during S-phase, the CENH3-containing nucleosomes segregate to both daughter strands. New nucleosomes containing histone H3 are also assembled onto the replicating DMA resulting in a centromeres that contains a mixture of CENH3 and histone H3-coniaining nucleosomes in the centromeric domains of G2 chromatids. During mitosis, the chromatin folds three-dimensionaliy such that the CENH3-containing nucleosomes associate with the outer face of the chromosome to form the base of the kinetochore (bars on the left and right side of the mitotic chromosome).
Fig. 2. Cell cycle-dependent changes in centromeric histone composition. At the onset of interphase, centromeric chromatin contains a mixture of histone H3-containing nucleosomes (dark circles) and СЕКНЗ-containing nucleosomes (white circles). During early Gl, the histone H3-containing nucleosomes are replaced with CENH3 through a histone exchange process. As the DNA is replicated during S-phase, the CENH3-containing nucleosomes segregate to both daughter strands. New nucleosomes containing histone H3 are also assembled onto the replicating DMA resulting in a centromeres that contains a mixture of CENH3 and histone H3-coniaining nucleosomes in the centromeric domains of G2 chromatids. During mitosis, the chromatin folds three-dimensionaliy such that the CENH3-containing nucleosomes associate with the outer face of the chromosome to form the base of the kinetochore (bars on the left and right side of the mitotic chromosome).  Fig. 3. The involvement of centromeric and pericentromeric heterochromatin in tension-sensing and mitotic checkpoint function. A: Cells with epigenetic defects in pericentromeric heterochromatin have a structurally compromised heterochromatin organization. When bipolar attachment is achieved, the heterochromatin is less able to resist the applied tension and may decondense in response to this tension. The consequence of this decondensation is that the tension requirement for spindle checkpoint inactivation may not be achieved because the tension is absorbed by the unfolding chromatin rather than the kinetochore itself. B: Under normal conditions, the centromeric and pericentromeric heterochromatin remain structurally stable under tension. This allows the force to be transmitted fully to the kinetochore and allows the spindle checkpoint to be satisfied.
Fig. 3. The involvement of centromeric and pericentromeric heterochromatin in tension-sensing and mitotic checkpoint function. A: Cells with epigenetic defects in pericentromeric heterochromatin have a structurally compromised heterochromatin organization. When bipolar attachment is achieved, the heterochromatin is less able to resist the applied tension and may decondense in response to this tension. The consequence of this decondensation is that the tension requirement for spindle checkpoint inactivation may not be achieved because the tension is absorbed by the unfolding chromatin rather than the kinetochore itself. B: Under normal conditions, the centromeric and pericentromeric heterochromatin remain structurally stable under tension. This allows the force to be transmitted fully to the kinetochore and allows the spindle checkpoint to be satisfied.