Urochordates обнаруживают трубчатое сердце, состоящее из однослойного миоэпителия, окруженного перикардиальной полостью, единственной целомической полостью у взрослых. Перикардий и миоэпителий происходят из одного и того же целомического пузырька, который инвагинируется в эмбрион. Сердце V-образное у
, и обнаруживает поперечно-исчерченные миофиламенты (Davidson, 2007). Кардиальный миоэпителий качает кровь, меняя направление накачивания каждые несколько минут благодаря чередованию предоминирования пары миогенных ритмоводителей, расположенных на концах трубки (Burighel and Cloney, 1997). Вместо этого, Cephalochordates не обнаруживают дефинитивного сердца, хотя предшественники из midventral-subintestinal сосуда составляют простую миоэпителиальную трубку, экспрессирующую
, ген, сходный с NK2 классом позвоночных (Holland et al., 2003). Циркуляция крови осуществляется за счет пульсации стенок многих сосудов, включая и центростремительные глоточные артерии (Ruppert, 1997).
Несмотря на существенные различия между сердцами metazoan, все они характеризуются общим вовлечением целомического эпителия в своё развитие. Сердце может быть просто складкой этого эпителия, чьи клетки развивают миофибриллы и сокращаются, качая кровь через hemal пространства (миоэпителиальное сердце), или оно может быть, как и у позвоночных, сложным насосом, образуемым множественными слоями поперечно-исчерченных мышц. Но даже в этом случае самые ранние стадии кардиального развития характеризуются присутствием кардиальной трубки, соединенной с целомическим эпителием. Сначала коротко опишем природу и происхождение системы кровообращения у metazoans.
Hemal или циркуляторная система, по-видимому, возникла у вторичнополостных животных из открытых пространств между базальной ламиной энтодермы и целомическим эпителием (Ruppert and Carle, 1983; this is known as the "R&C model"). Эти пространства прогрессировали между целомическими эпителиями, которые оказывались бок о бок, образуя мезентерий. Экспансия этой сети заполненных жидкостью пространств, выстланных базальной ламиной из разных эпителиев, достигали и окружали большинство органов, давая сосуды hemal системы (Figure 1B-D). Важно подчеркнуть, что сосуды беспозвоночных были всегда выстланы базальной ламиной (т.e. внеклеточным матриксом). В некоторых группах целомические миоэпителиальные клетки случайно приобретали способность врастать в др. ткани, образуя тем самым микрососуды в не-органных областях. Это стало причиной васкуляризации мантии моллюсков, которая смогла таким способом стать высоко-производительным органом локомоции. Важно отметить различия между этим "ангиогенезом беспозвоночных" и типичным ангиогенным процессом позвоночных, т.к. последний явился результатом активности эндотелиальных клеток, тогда как микрососуды беспозвоночных состоят только из миоэпителиальных клеток.
Первичные hemal системы устанавливаются между базальными ламинами энтодермы и мезодермы, они имеют два преимущества по сравнению с целомической циркуляцией питательных веществ. Во-первых, они были ближе к энтодермальному эпителию и поэтому питательные вещества, абсорбированные кишечником, достигали hemal пространство раньше, чем целомической полости. Во-вторых, и что более важно, hemal пространства первоначально были выстланы висцеральным слоем целомического эпителия, который часто подвергался миоэпителиальной дифференцировке или он даже давал perintestinal гладкие мышцы. Эволюционно переход от целомического эпителия к миоэпителию и висцеральными гладким мышцам описан Ruppert (Ruppert, 1991; Figure 2). Контрактильная способность висцерального целомического эпителия или их производных клеток вскоре стала использоваться как насос для hemal жидкости (т.e. крови) и активно направлять питательные вещества в направлении органов. Эволюционно источником сердца можно считать специализацию определенной области миоэпителия, покрывающего hemal пространства для прокачивания крови от кишечника в направлении передней части тела и головы (Figure 1C, E). Целомические полости никогда не формировали подобной помповой системы. Однако , hemal и целомические полости "конкурировали" за то, чтобы стать главной системой кровообращения в некоторых metazoan phyla. У nemerteans, напр., хорошо развита система кровообращения, которая, как считают, является исключением в acoelomate группе, сегодня она реинтерпретирована как система целомических каналов, которые действуют как система кровообращения (Turbeville, 1986). У arrhynchobdellid hirudineans (пиявки) система целомических каналов расширена на всё тело и обладает общей с системой кровообращения циркуляторной функцией (Fernandez et al., 1992). Ambulacral система у иглокожих др. пример хорошо развитой целомической системы каналов, которые, в данном случае, становятся специализированными для локомоции и отлавливания пищи, выполняя функцию доставки питательных веществ, приписываемую hemal системе.
Итак, происхождение сердца metazoans можно рассматривать как связанное с сетью hemal полостей, первоначально возникшей между базальной ламиной энтодермы и контрактильным висцеральным целомическим эпителием. примитивное сердце является по существу складкой дорсального (protostomes) или вентрального (deuterostomes) целомического миоэпителия, окружающего hemal полость, а его сократительная способность может быть отслежена, обращаясь назад по этому пути к механизмам перистальтики кишечника.
Heart fields and the making of a heart
Сердце позвоночных в основном состоит из мезодермальной ткани. Эти ткани возникают как только инициируется гаструляция с ингрессией клеток из эпибласта (Tam and Beddington, 1987, 1992). Разные исследования картирования судеб (включая непосредственную нагрузку клеток и их отслеживание, а также сложный клональный генетический анализ) показали, что основная часть клеток в ранней первичной полоске обладает неограниченным потенциалом дифференцировки (Schoenwolf and Alvarez, 1991; Tam and Zhou, 1996; Garcia-Martinez et al., 1997; Tam and Schoenwolf, 1999). Также ясно, что определенная регионализация ткани тесно следует за появлением мезодермы и что многие
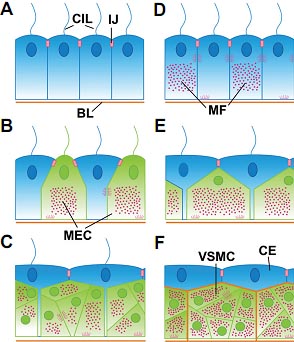 Fig. 2. Model of the evolutionary origin of myoepithelial cells and visceral smooth muscle. Redrawn from Ruppert (1991). (A) Original coelomic cells show cilia (CIL), intercellular junctions (IJ) and a basal lamina (BL). (B) A subset of coelomic cells develop myofilaments, acquiring contractile ability. (C,D) Myofilament-containing contractile cells become myoepithelial cells and relocate most of their cytoplasm towards the basal side, giving rise a pseudostratified epithelium. (E,F) Myoepithelial cells become visceral smooth muscle (VSMC) covered by a typical coelomic epithelium (CE).
Fig. 2. Model of the evolutionary origin of myoepithelial cells and visceral smooth muscle. Redrawn from Ruppert (1991). (A) Original coelomic cells show cilia (CIL), intercellular junctions (IJ) and a basal lamina (BL). (B) A subset of coelomic cells develop myofilaments, acquiring contractile ability. (C,D) Myofilament-containing contractile cells become myoepithelial cells and relocate most of their cytoplasm towards the basal side, giving rise a pseudostratified epithelium. (E,F) Myoepithelial cells become visceral smooth muscle (VSMC) covered by a typical coelomic epithelium (CE).
позиционные сигналы являются детерминантами по наделению специфической онтогенетической компетентностью в разные клеточные популяции. Клеточные предшественники первичной сердечной трубки позвоночных возникают во время ранней и средней гаструляции. Из их оригинального положения в средней линии первичной полоски они перемещаются кпереди и латерально в виде плотной массы мезодермальной мезенхимы, чтобы сформировать классические поля сердца heart field(s) (HFs). Точное распределение этой ткани всё ещё спорно и многие из расхождений, по-видимому, возникают из различий между разными животными моделями. Прекардиальная мезодерма часто описывается как кардиальный полумесяц (подковообразная область), расположенный краниально по отношению к прехордальной пластинке, который тянется с левой на правую сторону, пересекая срединную линию с очень ранней стадии (Rosenquist, 1970). Это всё ещё согласуется со случаем HFs млекопитающих, но недавние исследования показали, что эмбрионы птиц и амфибий имеют два HFs (левое и правое), которые остаются раздельными в течение значительного периода времени (Colas et al., 2000; Collop et al., 2006). Некоторые авт. стремятся рассматривать левую и правую HF популяции как два независимых поля (Kirby, 2002), но в целях простоты мы будем рассматривать их как одно. Во всяком случае, концепция "полумесяца" связана с экспрессией доменов некоторых генов (see below).
Билатеральные поля сердца начинают свою дифференцировку в эндокардиальный и миокардиальный клоны во время своего движения к срединной линии, благодаря силам, генерируемым закрытием переднего кишечного портала и общему складыванию (folding) эмбриона. Т.о., предшественники сердца конвергируют по срединной линии, чтобы дать одиночную кардиальную трубку, этот процесс протекает быстрее у эмбрионов мышей, чем эмбрионов кур (Abu-Issa et al., 2004). Интересно, что слияние парных примордиев является событием, также описанным в сердце Drosophila (Bodmer, 1990; Bodmer et al., 1993), указывая на родоначальные характеристики раннего развития сердечного органа у Metazoans.
Идея, что HFs могут быть полностью охарактеризованы своей ранней экспрессией транскрипционных факторов, подобных Nkx2.5, GATA4, SRF и MEF2c (Croissant et al., 1996; Evans, 1999; Black and Olson, 1998) воспринята широко. Две из этих молекул, SRF и Nkx2.5 предоставляют важную информацию, имеющую отношение к филогенетическому направлению данного обзора. Во-первых, характерная экспрессия SRF в HFs доказывает хорошо известный факт, что транскрипционные сети, которые регулируют дифференцировку миокардиальных и гладких мышц имеют общие элементы, которые не включены в программу регуляции скелетных поперечно-исчерченных мышц; это д. указывать на то, что с эволюционной точки зрения, гладкие мышцы и миокард близко родственны. Затем экспрессия Nkx2.5 в кардиальных полях открывает дискуссию, определяет ли топографическое положение прекардиальной мезодермы абсолютное пееркрывание с доменом некоторых т. наз. "молекулярных маркеров" HFs. В этом отношении элегантная работа Redkar с сотр. (2001) показала, что Nkx2.5 может не предопределять границы прекардиальной мезодермы во время критических стадий развития у птиц (see Eisenberg, 2000 for a full discussion on the subject). Nkx2.5 также, как известно, экспрессируется в передней популяции энтодермальных клеток (Schultheiss et al., 1995), и такая находка независимо от роли в мезодермальной спецификации, ассоциированной с этим транскрипционным фактором, имеет значение для данного обзора. Раннюю энтодермальную экспрессию Nkx2.5 необходимо подчеркнуть, поскольку этот ген д. частично регулироваться энтодермально-мезодермальным взаимодействием, как известно, инициирующим определенные программы развития мышц (Lough and Sugi, 2004). Интересно отметить, что Nk2-класса генов, тесно родственный с Nkx2.5, Ceh-22, экспрессируется в миогенных фарингеальных клетках нематоды C. сaenorhabditis, червя. который лишен какого-либо кровяного насоса. Фактически, индуцированная экспрессия Nkx2.5 рыбок данио у Caenorhabditis активирует экспрессию Myo-2, гена, который переключает на миогенную программу в этих клетках (Okkema and Fire, 1994; Haun et al., 1998). Это указывает на то, что родоначальной ролью Nkx2.5 (до привлечение его в программу кардиальной спецификации) возможно была связана с висцеральной миогенной программой.
Линейная сердечная трубка, как полагают, содержит все компоненты взрослого сердца, которые позднее разовьются в самостоятельные элементы зрелого органа (Davis, 1927). Эта концепция дожила вплоть до настоящего времени (Srivastava and Olson, 2000), но наши знания на развития сердца серьёзно изменили эту точку зрения (Moorman and Christoffels, 2003; Christoffels et al., 2004; Moorman et al., 2004). Сегодня общепринято, что прямая сердечная трубка содержит только основные контуры левого желудочка и часть atrioventricular (AV) региона и регионов предсердий и поэтому классические прекардиальные популяции (HFs) были названы как первое или primary heart field (PHFs). Чтобы завершить эмбриональные очертания сердца миокардиальные предшественники добавляются как к артериальному (переднему), так и венозному (заднему) полюсам сердца. Экспериментальные доказательства, подтверждающие этот важный аспект кардиального развития (Stalsberg and de Haan, 1969; Viragh and Challice, 1973; Arguello et al., 1975), упускались в течение лет и были приняты лишь недавно, что некоторые выдающиеся компоненты сердца, такие как правый желудочек происходят как у млекопитающих, так и у птиц из альтернативного кардиального источника (Kelly et al., 2001; Rana et al., 2007). Точное расположение этих "новых" предшественников на разных ст. эмбрионального развития также противоречиво и поэтому используются разные термины типа "anterior heart field" (AHF), "secondary heart field" и "second heart field" (SHF) для обозначения этой популяции клеток (Kelly et al., 2001; Mjaatvedt et al., 2001; Waldo et al., 2001, 2005; Abu-Issa and Kirby, 2007; Kirby, 2007). Раннее неразборчивое использование трех терминов создавало противоречия, но определенный консенсус достигнут, так "переднее" и "вторичное" кардиальные поля обозначаются как субпопуляции "второго" поля сердца (Buckingham et al., 2005; Abu-Issa and Kirby, 2007). Однако необходимо подчеркнуть, что такое смущение может также происходить из-за различий между животными моделями и техник слежения, используемых в этих исследованиях (Kirby, 2007). Т.о., "второе поле сердца" определяется с помощью молекулярных (экспрессия Isl1) и пространственно-временных критериев (в основном базирующихся на "клональном" или "ретроспективном клональном" анализе (Meilhac et al., 2004; Buckingham et al., 2005). Аспекты, связанные с "полями сердца" проиллюстрированы на Figure 3.
Эта концептуальная рамка безусловно поддерживается характерной для второго поля сердца (SHF) экспрессией некоторых молекул, подобных LIM гомедоменовому транскрипционному фактору Islet1 (Isl1) (Cai et al., 2003; Laugwitz et al., 2005), но т.к. Isl1 , как сообщалось, экспрессируется частично в PHFs (Yuan and Schoenwolf, 2000; Prall et al., 2007), поэтому неясно более того, что этот транскрипционный фактор должен рассматриваться как SHF- специфический. Собственно говоря, SHF проспективный миокардиальный потенциал, по-видимому, при определенной точке зрения, регулируется набором транскрипционных факторов, сходных с таковыми, экспрессирующимися в PHF (напр. Nkx2.5, GATA4 и MEF2c). Эти транскрипционные факторы, по-видимому, экспрессируются при индукции ростовыми факторами семейств BMP и FGF, т.к. известно, что они появляются и в PHF (Buckingham et al., 2005). Следовательно, хотя экспрессия некоторых SHF-специфических молекул, подобных Foxh1, недавно была описана (von Both et al., 2004) и гены, экспрессирующиеся в PHF, которые не характерны для SHF ( Hand1, Tbx5), основные различия между двумя полями скорее всего зависят от дифференциальной регуляции сходной транскрипционной сети.
Мы д. предположить, что SHF транскрипционная программа, по-видимому, является сложной, из-за перекрывания доменов SHF и как переднего "pharyngeal" мезенхимного домена, так и заднего "pronephric" домена (see Figure 3). Эта программа, как полагают включает
Foxh1 ген, который д. действовать как координатор индуктивных активностей FGF8 и 10 в популяции предшественников, экспрессирующих
Isl1 и Tbx1 (Buckingham et al., 2005), которые затем активируют базовый пан-миокардиальный набор транскрипционных факторов, включая GATA4 и Mef2c. Мутации этих генов могут вести к полному искажению развития артериального полюса сердца как это происходит.
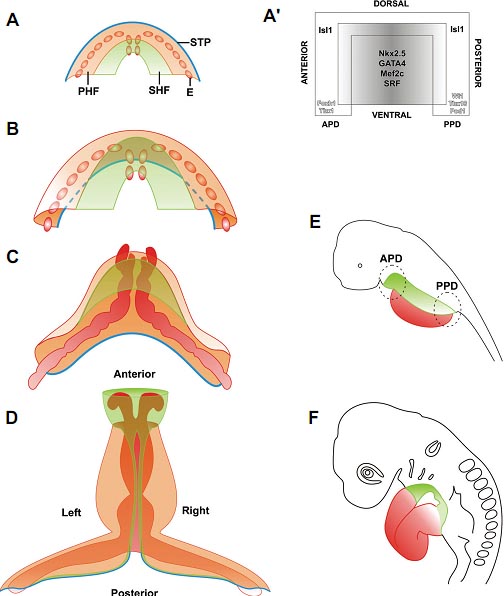 Fig. 3. Cardiac progenitors and heart fields. The drawings represent an ideal vertebrate embryo (not the specific case of the chick or the mouse), and therefore the location of the heart fields is based on an anatomical consensus. The spatial distribution of the different cardiac populations in a cardiac crescent is shown together with the changes affecting to such groups of cells as development proceeds. (A') A simplified diagram representing the domains of the primary heart field (PHF, shadowed central area characterized by the expression of Nkx2.5, GATA4, Mef2c and SRF) and the second heart field (SHF, white inverted-U domain characterized by Isl1 expression) in the forming heart. The expression of characteristic anterior and posterior markers (in white, Tbx1, Foxh1, Wt1, Tbx18, Pod1) may be interpreted as a consequence of the overlapping of myocardial precursors with other non-muscular mesenchymal populations with inherent strong signalling properties (anterior pharyngeal domain or APD and posterior pronephric domain or PPD, arrows). (AD) The PHF is coloured in orange, the SHF in green, the endocardium in red (E) and the progenitors of the septum transversum area (STP) are presented by a blue line. All the cartoons display a dorsal view as indicated in (D). The illustrations in (E,F) (embryos in a left lateral view placed next to the proper crescent stages) help to understand the relative position of the PHF and SHF in the context of the whole embryo; specifically in (E) the mesenchymal anterior pharyngeal (APD) and the posterior pronephric domains (PPD) are shown overlapping with the arterial and venous poles of the heart, respectively. For more details, please refer to the text.
Fig. 3. Cardiac progenitors and heart fields. The drawings represent an ideal vertebrate embryo (not the specific case of the chick or the mouse), and therefore the location of the heart fields is based on an anatomical consensus. The spatial distribution of the different cardiac populations in a cardiac crescent is shown together with the changes affecting to such groups of cells as development proceeds. (A') A simplified diagram representing the domains of the primary heart field (PHF, shadowed central area characterized by the expression of Nkx2.5, GATA4, Mef2c and SRF) and the second heart field (SHF, white inverted-U domain characterized by Isl1 expression) in the forming heart. The expression of characteristic anterior and posterior markers (in white, Tbx1, Foxh1, Wt1, Tbx18, Pod1) may be interpreted as a consequence of the overlapping of myocardial precursors with other non-muscular mesenchymal populations with inherent strong signalling properties (anterior pharyngeal domain or APD and posterior pronephric domain or PPD, arrows). (AD) The PHF is coloured in orange, the SHF in green, the endocardium in red (E) and the progenitors of the septum transversum area (STP) are presented by a blue line. All the cartoons display a dorsal view as indicated in (D). The illustrations in (E,F) (embryos in a left lateral view placed next to the proper crescent stages) help to understand the relative position of the PHF and SHF in the context of the whole embryo; specifically in (E) the mesenchymal anterior pharyngeal (APD) and the posterior pronephric domains (PPD) are shown overlapping with the arterial and venous poles of the heart, respectively. For more details, please refer to the text.
в случает с нехватками Tbx1, это очень напоминает синдром DiGeorge (Baldini, 2005). GATA факторы играют важные роли в спецификации сердца у позвоночных и беспозвоночных путем кооперации с Nkx2.5/Tinman и BMP/Dpp сигналами. чтобы индуцировать экспрессию кардио-специфических генов, таких как
Hand (Han and Olson, 2005). У
Drosophila экспрессия GATA фактора pannier регулируется с помощью Nkx2.5 ортолога tinman, а белок pannier взаимодействует с tinman, активируя синергичным образом нижестоящие кардиальные гены (Gajewski et al., 2001).
Пространственное перемещение SHF в виде прекардиальных предшественников, изменяющих конформацию с 2D на 3D, было продемонстрировано Moorman с коллегами (2004). Их обзор четко иллюстрирует позиционное значение SHF клеток как вносящих вклад в развитие притока сердца, сложной области, которая недавно позволила некоторым исследователям думать о существовании "третьего" заднего поля сердца (Gittenberger de-Groot et al., 2007). По нашему мнению, это отражает реальную сложность региона скорее, чем онтогенетическую реальность (see the discussion below and Figure 3 for more details). В контексте данного обзора, различия между наиболее передним (отток) и задним (приток) субдоменами SHF могут быть связаны с топологическими доменами, где располагается каждая из клеточных популяций ("pharyngeal" и "pronephric", соотв.) скорее, чем с прирожденными различиями между субпопуляциями SHF, поэтому мы хотели бы предположить, что взаимодействие между SHF и некардиальной мезодермой является критическим для предопределения и модуляции его финальной судьбы.
Наше новое предположение о "ancestral pronephric" домене, ассоциированном с более задними (отток) SHF предшественниками (see below for more details) происходит из наших исследований по кардиальному развитию у миног, представителей более примитивных из живущей ветви позвоночных (Pombal et al., 2008). Эти исследования показали, что задний полюс сердца примитивных позвоночных тесно связан с пронефросами, а не с печенью, как это имеет место у gnathostomes (jawed позвоночных). Мы рассмотрим эту точку зрения в секции, посвязенной развитию эпикарда. Этот родоначальный пронефрический домен, в котором располагается задняя часть SHF, объясняет экспрессию клетками на венозном полюсе сердца транскрипционных факторов Tbx18 и Wt1, критически участвующих в развитии почек, а также в морфогенезе тракта притока сердца (Airik et al., 2006; Christoffels et al., 2006). Экспрессия др. связанных с почками генов (напр. podoplanin) также описана в задней части SHF (Gittenberger de-Groot et al., 2007).
Что относительно рассмотрения кардиальных полей в эволюционной перспективе? Легко аргументировать, что SHF является своего рода исходом физиологических нужд, генерируемых water-toland переходом (Moorman et al., 2007). Это, однако, является вздорной гипотезой, поскольку клеточные комбинации PHF и SHF для пульмонального и системного сердечного доменов перекрываются в пространстве. Было предположено, что два миокардиальных клона (PHF и SHF) могли уже предсуществовать у родоначальников позвоночных (Meilhac et al., 2004), предположение, которое будет в дальнейшем подтверждено за счет возможной гомологии между двумя клонами сердечных мышц у рыбок данио (атриальных и вентрикулярных; see Keegan et al., 2004) и PHF и SHF. Наконец, этому можно было бы возразить, что SHF формируется в результате инкорпорации данной массы первоначально не специфицированной в сердце мезодермы (Schoenebeck et al., 2007).
Хотя присутствие более, чем одного "поля сердца" не было описано, соблазнительно связать вторичное поле сердца с присутствием передней и задней зон роста на концах развивающейся сердечной трубки urochordate
Ciona. В этих кардиальных областях клетки пролиферируют и дифференцирутся, добавляя миоэпителиальные клетки к кардиальной стенке и делая возможным продольный рост сердца. Этот процесс роста, по-видимому, активирован в течение всего жизненного периода организма (Millar, 1953, Davidson, 2007) и это напоминает эмбриональное рекрутирование мезодермальных клеток на кардиальный клон у позвоночных. С др. стороны и вообще-то наиболее вероятно существование потенциального "заднего" SHF также экспериментально иллюстрируется у
Ciona, где удлинение кардиальной трубки регулируется с помощью передачи сигналов FGF (Davidson et al., 2006). Предшественники кардиальной трубки у
Ciona экспрессируют Mesp, bHLH транскрипционный фактор, чьи ортологу у позвоночных Mesp1 и 2 необходимы для развития сердца (Kitajima et al., 2000). Однако от Mesp экспрессирующих предшественников у
Ciona, только половина вносит вклад в сердце, остальные специфицируются в передние хвостовые мышечные клетки. Если экспрессия транскрипционного фактора Ets1/2 форсирована в Mesp-экспрессирующих клетках, то все они формируют сердце и такое вытянутое сердце обнаруживает иногда двухкомпартментную структуру, которая работает синхронно, чтобы качать кровь. Этот неожиданный результат показывает, как первоначально не кардиогенные области заднего полюса сердца (т.e. родоначальник "posterior" SHF) может рекрутироваться, чтобы сформировать двухкамерное сердце в качестве переходной ступени в направлении более сложного сердца позвоночных
(Davidson, 2007).
Myocardial origin and diversity
Миокардиальные клетки, как полагают, формируются, когда эндокардиальные предшественники вычленяются из поляризованного эпителия (Peng et al., 1990), который формирует висцеральный слой латеральной пластинки мезодермы. Он находится в тесном контакте с фарингеальной энтодермой, тканью, которая, как сообщалось, является критической для развития кардиальных мышц (Lough and Sugi, 1995, 2000).
Значение миокардиального разнообразия очевидно, поскольку взрослое сердце нуждается в разных типах мышц, чтобы поддерживать скоординированную функцию насоса. Первоначальные различия могут возникать между работающим миокардом развивающихся камер и остатками примитивного миокарда, которые постепенно ограничиваются трактом притока, AV областью и в целом внутренним изгибом исходной сердечной трубки. В этом отношении настоящие сердца (рассматриваемые в гистоморфологической перспективе) могут быть определены как "chambered pumps containing inflow and outflow segments invested at some point in an animal's lifetime with myocytes" (Simoes-Costa et al., 2005). Определение кардиальных камер противоречиво само по себе и в основном базируется на животной модели, т.к. не совсем ясно, что видимые эмбриональные кардиальные компартменты у определенных позвоночных могут в действительности рассматриваться как камеры (напр., sinus venosus или тракт оттока у мыши по сравнению с таковыми у акулы). Более того, рассмотрение сердца, как состоящего из компартментов притока и оттока находит своё отражение не только в оригинальном анатомическом расположении этих двух доменов (дорсальный в противовес вентральному, соотв.), но и также в асимметрии генной экспрессии (for a detailed discussion see Simoes-Costa et al., 2005). Наконец, вполне возможно представить кардиальные камеры не как дискретные единицы, а как финальный результат событий формирования паттерна, происходящий в структуре насоса; retinoic (RA) кислота, как было предположено, детерминирует сегменты кардиального притока и оттока в модели, включая локальное присутствие RA-конвертирующего энзима RALDH2, RA диффузию и вообще более эффективную реакцию на RA в клетках области притока по сравнению с областью оттока (Simoes-Costa et al., 2005; Xavier-Neto et al., 2007).
Примитивный первичный миокард в противоположность камерному миокарду, подвергается глубокому ремоделированию во время эмбрионального развития и оказывается инкорпорированным в часть камер как в случае AV миокарда, который интегрируется в регионы предсердий с гладкими стенками (Lamers et al., 1992; Wessels et al., 1996). В то время как миокард камер обнаруживает постоянную пролиферацию, которая останавливается лишь после рождения, примитивный миокард пролиферирует с довольно низкой скоростью (Soufan et al., 2006). Интересно, что локальные регионы с чрезвычайно низкой митотической активностью в домене первичного миокарда коррелируют с развитием части проводящей системы (Sedmera et al., 2003; Thompson et al., 2003), сеть модифицированных кардиомиоцитов, которая состоит из ритмоводителя сердца и волокон, которые быстро передают импульсы контракции (Wessels et al., 1992; Oosthoek et al.,1993a, b; Takebayashi-Suzuki et al., 2000; Moorman et al., 1998; Moorman and Christoffels, 2003; Mikawa and Hurtado, 2007). Первичный миокард, который является субстратом медленного проведения электрических импульсов в основном из-за отсутствия коннексинов, подобных Cx40 или Cx43, также характеризуется высоким автоматизмом и должен специфически вносить вклад в формирование синусного и атриовентрикулярного узлов и пучка Гиса. Дистальные части проводящей системы, включая волокна Пуркинье, образуются из модифицированного миокарда камер (Moorman et al., 2005; Mikawa and Hurtado, 2007).
Сложная транскрипционная регуляторная сеть недавно описана для контроля различий между первичным и камерным миокардом. В центре сети находится T-box транскрипционный фактор Tbx2, действующий как репрессор дифференцировки миокарда камер. Такая активность осуществляется посредством репрессии Nppa (или atrial natriuretic factor, ANF) (Christoffels et al., 2004; Naiche et al., 2005; Hoogars et al., 2007a). Домен экспрессии Tbx2 комплементарен таковому Nppa, Cx40, Cx43 и Chisel, генов. которые характеризуют миокард камер (Christoffels et al., 2004). Некоторые дополнительные члены семейства Tbx типа Tbx3 регулируют развитие специфических частей проводящей системы, как это имеет место в случае синусно-предсердного узала (Mommersteeg et al., 2007; Hoogaars et al., 2007b), тогда как T-box факторы. подобные Tbx20 и Tbx5 действуют совместно с Nkx2.5 и GATA4 в становлении фенотипа камер (Hoogaars et al., 2007a). Эволюционное значение T-box транскрипционных факторов в развитии миокарда проиллюстрировано их консервативной активностью в регуляции пролиферации кардиальных мышц у низших позвоночных, подобных рыбкам данио (Ribeiro et al., 2007).
T-box гены также важны для кардиального развития у беспозвоночных, хотя их разнообразие заметно ниже. Активные исследования, проведенные на urochordate Ciona (Davidson and Levine, 2003; Takatori et al., 2004; Davidson, 2007), у которых описано 9 T-box генов (представляющих 7 из 8 T-box подсемейств, Davidson, 2007). Хотя нет у Ciona ортолога Tbx4/5 и Tbx20 но, Tbx6 (который удвоен у Ciona), по-видимому, играет основную роль в кардиальном развитии (Davidson, 2007). Tbx6b и Tbx6c индуцируют Mesp в кардиальных предшественниках на стадии 110 клеток. С др. стороны, имеются доказательства, что Tbx6 (dorsocross) и Tbx20 (h15/midline) ортологи участвуют в развитии сердца Drosophila (Reim and Frasch, 2005; Reim et al., 2005; Qian et al., 2005; Miskolczi-McCallum et al., 2005). Поэтому можно предположить, что количество Tbx генов, участвующих в кардиальном развитии д. быть эволюционно связано с прогрессивной функциональной специализацией миокарда и , следовательно, с развитием камер.
Др. доказанное различие, касающееся популяций сердечных мышц заключается в то, что найдены между предсердиями и желудочками миокардиальные компоненты, которые обладают разной контрактильной и электрофизиологической активностями. Регионализация работающего миокарда это сложный вопрос. У кур регионализация стартует сразу же в прямой сердечной трубке в виде белков тяжелой цепи атриального миозина преимущественно накапливающегося в каудальной (задней) позиции трубки (De Jong et al., 1987, 1990; Yutzey et al., 1994). Развитие сердца у мыши происходит медленнее, чем у кур, этим можно объяснить, почему регионализация миокардиальных генов у мышей проясняется только после начала петлеобразования сердца (Lyons et al., 1990, 1994; Kelly et al., 1999). Определение границ в транскрипционных доменах специфических контрактильных белков
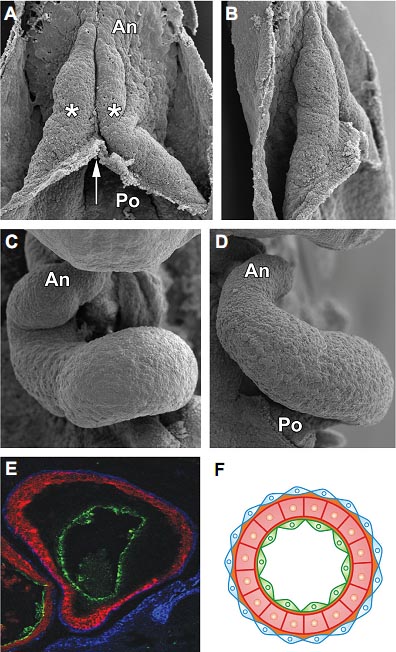 Fig. 4. Looping and layering of the heart. (A-D) The vertebrate heart looping is illustrated with scanning electron micrographs from chick embryos. (A) At HH9 the two bilateral cardiac tubes (asterisks) have just fused in the midline (arrow) forming a single straight heart tube. Anterior arterial (An) and posterior venous (Po) poles of the heart are indicated. (B) Shows a right lateral view of the same specimen with the same anteroposterior orientation. (C,D) Around 20 hours later HH14 embryos have initiated the C-shape phase of the cardiac looping. (C) A frontal view and (D) a right lateral one. (E,F) The characteristic layering of the heart. In (E), the endocardium (green), the myocardium (red) and the epicardium (blue) in a chick heart transversal section have been counterstained using an endothelium-specific lectin and antibodies against heavy myosins and cytokeratins, respectively. The concentric arrangement of the layers is shown in the cartoon in (F).
Fig. 4. Looping and layering of the heart. (A-D) The vertebrate heart looping is illustrated with scanning electron micrographs from chick embryos. (A) At HH9 the two bilateral cardiac tubes (asterisks) have just fused in the midline (arrow) forming a single straight heart tube. Anterior arterial (An) and posterior venous (Po) poles of the heart are indicated. (B) Shows a right lateral view of the same specimen with the same anteroposterior orientation. (C,D) Around 20 hours later HH14 embryos have initiated the C-shape phase of the cardiac looping. (C) A frontal view and (D) a right lateral one. (E,F) The characteristic layering of the heart. In (E), the endocardium (green), the myocardium (red) and the epicardium (blue) in a chick heart transversal section have been counterstained using an endothelium-specific lectin and antibodies against heavy myosins and cytokeratins, respectively. The concentric arrangement of the layers is shown in the cartoon in (F).
является критическим для этого процесса регионализации. Вопрос сложен поскольку разные цепочки миозина ограничивают свои домены экспрессии рано в развитии. Это касается myosin light chain 2v (MLC2V) или β-myosin heavy chain (βMHC), которые в основном становятся вентрикулярными изоформами, начиная с E8.5 и E10.5 соотв. (Lyons et al., 1990; O'Brien et al., 1993), тогда как др. продолжают экспрессироваться разными сегментами сердца в течение длительного периода времени. Напротив, др. белки, подобные α myosin heavy chain (MHCα ) или myosin light chain 1A (MLC1A) экспрессируются на разных уровнях как в предсердиях, так и желудочках (Lyons et al., 1990). MLC2v также накапливается в желудочке птиц (Somi et al., 2006). Несмотря на это, как же предопределяются качественные особенности камер, до сих пор не выяснено. Разные гены. подобные dHAND1 и eHAND, а также Iroquois 4 (Irx4) или Tbx5 обнаруживают уникальные карты ограниченной экспрессии, но не совсем ясно, как эти гены отвечают (или взаимодействуют с др. информационными или сигнальными системами), чтобы повлиять, по крайней мере, на три разные жизненно важные аспекты образования кардиальных желудочков: 1) детерминация L/R асимметрии, 2) контроль пролиферации миокарда и 3) активирование или блокирование синтеза специфических контрактильных белков.
The origin of the endocardium
Эндокард является эндотелиальным, самым внутренним слоем клеток сердца. Клетки эндокардиальных предшественников происходят из прекардиального эпителия в процессе epithelial-mesenchymal transition (EMT). В то время как проспективные эндокардиальные клетки подавляют экспрессию N-cadherin (Manasek, 1968; Linask and Lash, 1993) и мигрируют прочь в направлении энтодермы, мышечные предшественники остаются N-cadherin-экспрессирующей популяцией клеток, покрывающей внутренний формирующийся слой эндокарда (Linask and Lash, 1993; Sugi and Markwald, 1996). Т.о., эндокардиальный и миокардиальный предшественники, по-видимому, происходят из одной и той же популяции клеток (Linask and Lash, 1993; Sugi and Markwald, 1996). Неизвестно, существуют ли общие эндокардиальные/миокардиальные предшественники (Cohen-Gould and Mikawa, 1996), но мезодермальная линия клеток, происходящая из эмбрионов перепела (QCE-6), способна дифференцироваться в миокардиальные и эндокардиальные клетки (Eisenberg and Bader, 1995).
Сердца беспозвоночных лишены эндокарда и это одно из основных отличий с сердцем позвоночных. Отсутствие эндокарда логически связано с отсутствием настоящего эндотелия в сосудах беспозвоночных. Т.о., вопрос о эволюционном происхождении эндокарда непосредственно связан с гипотезой о возникновении эндотелия у позвоночных. Мы опубликовали модель возникновения эндотелия позвоночных (Munoz-Chapuli et al., 2005). Мы полагаем. что эндотелий происходит у родоначальников позвоночных из типа кровеносных клеток (часто наз. amoebocyte), которые способны прилипать к сосудистой базальной пластинке и мигрировать в неё. Amoebocytes временами столь многочисленны, что они выстилают большую часть внутренней поверхности сосудов, как это происходит у головоногих (Budelmann et al., 1997). Однако даже в этом случае они лишены межклеточных соединений и всё ещё способны свободно перемещаться и поэтому эти клетки не могут рассматриваться как настоящий эндотелий.
Переход от специализированных кровеносных клеток к эндотелию связан с приобретением комплексов межклеточных соединений. Важно. что эндотелиальные клетки используют для этих комплексов молекулы, которые также обнаруживаются в кровяных клетках или их предшественниках, такие как PECAM-1 (обнаруживаемые в тромбоцитах и мегакариоцитах) и cadherin-5 (экспрессируется гематопоэтическими предшественниками) (Fraser et al., 2003). Т.о., эндотелий не является "изобретением" системы для становления эндотелия, а просто использует набор молекул, уже присутствующих у их эволюционных прародителей. Как же гипотетический общий предшественник эндокарда и миокарда может быть примирён с нашей моделью кровяных клеток, дающих эндотелий? Мы полагаем. что это возможно, если мы рассмотрим некоторые свойства гемопоэза у беспозвоночных. Эволюционный источник кровяных клеток, по-видимому, располагается в целомическом эпителии (Hartenstein, 2006), т.e. в том же самом слое клеток, который способен приобретать контрактильные способности и давать кардиальную стенку. Примитивные кровяные клетки, возможно были вычленившимися coelomocytes со способностью к фагоцитозу (Munoz-Chapuli et al., 2005). Диверсификация этих примитивных типов клеток сделала возможным приобретение дальнейших функций по иммунологической защите и транспорту кислорода, но целомический эволюционный источник кровяных клеток (а значит и эндотелий позвоночных), по-видимому, воспроизводится в эмбриональном источнике эндокарда из того же самого целомического слоя, который дает миокард. Т.о., не сюрприз, что линия клеток QCE-6, упомянутая выше, которая способна дифференцироваться в эндокард и миокард, может таже давать в культуре эритроциты (Eisenberg and Markwald, 1997). Важно также, что один и тот же транскрипционный активатор, Hand, необходим как для кардиогенеза, так и гемопоэза у Drosophila (Han et al., 2006) под контролем GATA факторов pannier и serpent, соотв.
Выше мы обсуждали о разнообразии миокарда и в то же время обсуждали, может ли эндокард в этой связи быть гомогенной популяцией. Регионализация эндокарда не является доказанным феноменом, поскольку морфология и клеточный фенотип эндокардиальных клеток не выявляют врожденных отличий, затрагивающих эти популяции. Однако хорошо известно, что лишь некоторые эндокардиальные клетки (те, что выстилают AV канал и conal область) обладают способностью подвергаться EMT и тем самым формировать valvuloseptal мезенхимные клетки (предшественники створок кардиальных клапанов). Экспериментальные исследования на эмбрионах кур и мышей с использованием метода эксплантов коллагенового геля строго подтверждают эту точку зрения (Bernanke and Markwald, 1982; Runyan and Markwald, 1983; Mjaatvedt and Markwald, 1989; Timmerman et al., 2004).
Разнообразные члены сверхсемейства TGFβ, их рецепторы и трансдукторы (включая TGFβs, BMPs, TGFRs и Smads) были описаны как ответственные за запуск эндокардиального EMT (Potts and Runyan, 1989; Brown et al., 1996, 1999; Ramsdell and Markwald, 1997; Nakajima et al., 1998; Galvin et al., 2000; Romano and Runyan, 2000; Gaussin et al., 2002, 2005; Jiao et al., 2003). Др. сигнальные молекулы, подобные VEGF, или сигнальные пути, подобные NFATc1/calcineurin, также известны, как имеющие чрезвычайное значение для модулирования развития эмбриональных клапанов (de la Pompa et al., 1998; Dor et al., 2001; Chang et al., 2004).
Специальным случаем является сигнальный путь Notch. Notch является родоначальной межклеточной сигнальной системой, которая прекрасно сохранилась в ходе эволюции. Как рецепторы (Notch1-4), так и лиганды (члены семейств Delta и Jagged) этого пути связаны с мембранами. Notch, который участвует в регуляции решений судеб клеток у позвоночных и беспозвоночных (Artavanis-Tsakonas et al., 1999), недавно был описан как регулируемый с помощью microRNAs (miRNAs) во время кардиальной дифференцировки у Drosophila (Kwon et al., 2005). miRNAs это малые некодирующие РНК, как известно, экспрессирующиеся ткане-специфически у позвоночных и беспозвоночных и, как было установлено, представляют альтернативный регуляторный способ развития, в основном базирующийся на клеточно-специфическои ингибировании трансляции (Kwon et al., 2005; Zhao et al., 2005, 2007; Zhao and Srivastava, 2007).
В развитии позвоночных активность Notch четко различается между разными эндокардиальными доменами, поэтому этот путь участвует в обеспечении в AV клапанах EMT, действуя через репрессор кадгерина Snail (Timmerman et al., 2004) , а также участвуя в координации эндокардиальных сигналов (translocated from the endocardium to the myocardium via the endocardially-secreted neuregulin 1 and its myocardial Erb receptors). которые активируют трабекулярный фенотип, характерный для камер желудочков (Grego-Bessa et al., 2007). Локальная активация Notch, как известно, инициирует механизм латеральной ингибиции, действуя как генератор паттерна во многих тканях (Bray, 1998; Artavanis-Tsakonas, 1999; Kurata et al., 2000; Morrison et al., 2000). Однако, Notch может также вычленять механизмы латеральной активации, которые д. распространять активность Notch на определенные области, это может в свою очередь приводить к появлению территорий клеточной компетентности (Timmerman et al., 2004; Grego-Bessa et al., 2007). В случае эндокарда, Notch д. быть ответственным за контуры онтогенетических границ в кажущемся гомогенном эндокарде.
The origin of the epicardium and the cardiac vessels
Эпикард является наружным слоем сердца позвоночных. Целомический эпителий иногда обнаруживается на поверхности сердец беспозвоночных, но онтогенетическое происхождение эпикарда позвоночных делает его уникальным среди др. наружных кардиальных клеточных выстилок. Эпикард позвоночных возникает из выроста целомических клеток, наз. проэпикардом, который образуется на задней границе сердца между sinus venosus и печенью, вокруг области transverse septum (Manner et al., 2001). Клетки проэпикарда прикрепляются к и распространяются по поверхности миокарда, давая эпикард. Мезенхимные клетки, присутствующие в проэпикарде, выделяются из эпикарда и проникают в субэпикардиальное пространство и миокард и вносят вклад в кардиальные сосуды и соединительную ткань сердца (Fig. 5).
Проэпикард является парным у рыб, только правый проэпикард развивается у птиц и у млекопитающих, два исходных зачатка сливаются по срединной линии, покрывая всю область septum transversum. В литературе отсутствуют предположения о происхождении парных целомических выростов, которые составляют проэпикард. Мы недавно изучали развитие эпикарда у миног, представителя наиболее примитивной ветви позвоночных, бесчелюстных. Мы показали. что проэпикард у про-личинок миног происходит из пары зачатков примитивных пронефрических наружных гломерул, которые всё ещё функциональны на личиночных стадиях (Pombal et al., 2008). Проэпикард миног является, таким образом, элементом пронефросов. Фактически венозный полюс сердца у этих примитивных позвоночных анатомически родственен пронефросам, а не печени, как это имеет место у др. позвоночных. Эта находка объясняет не только эволюционное происхождение проэпикарда/эпикарда, но и также два интресных свойства этой ткани. Во-первых, эпикардом экспрессируемые гены родственны таковым из выделительной системы. Это, напр.,транскрипционные факторы Wt1 (Wilms' tumor suppresor gene), Pod-1/epicardin (Moore et al., 1998; Quaggin et al., 1999) и Tbx18 (Airik et al., 2006; Christoffels et al., 2006). Во-вторых, высокий потенциал продуцировать сосуды у клеток проэпикарда (Perez-Pomares et al., 2006) может быть связан с их исходной функцией развития сосудистой системы для фильтрации крови в наружных гломерулах.
Мы полагаем, что вовлечение производных наружных пронефрических гломерул в кардиальное развитие объясняет ряд основных различий между сердцами позвоночных и беспозвоночных, напр., развитие кардиальных сосудов. С др. стороны, мы можем рассуждать о эволюционных взаимоотношениях, существующих между сердцем и гломерулами связях у позвоночных и в частности о комплексе сердце-почки у полухордовых, типа вторичноротых, филогенетически очень близких к хордовым. Этот комплекс, о котором мы уже упоминали, представлен крупной гломерулой, соединенной с пульсирующим сосудом (Benito and Pardos, 1997). Взаимосвязь между этими органами может быть забракована на первый взгляд из-за их разного топологического расположения. Сердце является вентральным и заглоточным (postpharyngeal) у позвоночных, тогда как комплекс сердце-почка у полухордовых является предротовым и дорсальным относительно кишки. Однако, как уже указывалось, эти различия могут не иметь отношения, поскольку дорсо-вентральная ось у полухордовых возможно обратная по сравнению с таковой у позвоночных. Фактически, экспрессия "дорсальных" генов. таких как Chordin является вентральной у полухордовых, тогда как "вентральные" и связанные с сердцем гены, такие как BMP2, Nkx2.5 или Tbx2-3, экспрессируются дорсально у полухордовых (Lowe et al., 2006). Т.о., зачаток пронефрической наружной гломерулы, который контактирует с сердцем проличинок миног и комплекс сердце-почки полухордовых обнаруживают сходную топологическую локализацию. Гипотетическая гомология этих структур указывает на то, что проэпикард может представлять собой последний остаток комплекса почки-сердце, который присутствует у родоначальников хордовых, хотя он теряется у urochordates и cephalochordates.
Переход васкулогенных гломерулярных клеточных предшественников к примитивному сердцу позвоночных связан с развитием многослойной и трабекулярной стенки сердца, которая нуждается в сосудистом снабжении ином, нежели ток венозной крови , циркулирующей через просвет сердца. Вполне возможно, что оригинальная коронарная система состояла только из капилляров и вен. Венозная сеть на поверхности сердца, даже в отсутствие коронарных артерий возможно достаточна для дренирования крови из межтрабекулярных синусоидов, улучшая таким образом циркуляцию крови через наружный миокардиальный слой (Tota et al., 1983). Дальнейшее увеличение толщины кардиальной стенки и последующей работы сердца у крупных рыб сделало этоу систему недостаточной для метаболических нужд миокарда. Эти нужды были удовлетворены, по-видимому, с помощью коронарных артерий, развившихся из hypobranchial артерий, которые получали обогащенную кислородом кровь непосредственно из эфферентных жаберных артерий. Временное несовпадение а развитии коронарных артерий и кардиальных вен было описано у эмбрионов elasmobranch
Scyliorhinus canicula (De Andres et al., 1993).
The contribution of the neural crest
Финальное различие между сердцами позвоночных и беспозвоночных заключается во вкладе клеток из нервного гребня, популяции, которая характерна исключительно для позвоночных, хотя генетическая программа, ведущая к её развитию частично присутствует не позвоночных хордовых (Barrallo-Gimeno and Nieto, 2006). Нервный гребень состоит из клеточной популяции, которая возникает из краёв нервной пластинки и мигрирует по всему эмбриону, давая многочисленные производные. Т.наз. "кардиальный" нервный гребень возникает между отическим пузырьком и третьим сомитом. Помимо вклада клеток нервного гребня в парасимпатические ганглии сердца, они необходимы для формирования аортико-пульмональной перегородки, делящей кардиальный артериальный полюс на восходящую аорту и легочный ствол и они также предоставляют сигналы, необходимы для поддержания и дифференцировки др. клеточных слоёв в фарингеальных дугах (Brown and Baldwin, 2006; Hutson and Kirby, 2007). У рыбок данио описана даже миокардиальная дифференцировка клеток кардиального нервного гребня (Li et al., 2003; Sato and Yost, 2003). Недавно было показано, что клетки кардиального нервного гребня модулируют передачу сигналов в глотке во время удлинения тракта оттока и что нервный гребень необходим для добавления нового миокарда к тракту оттока из вторичного поля сердца (Waldo et al., 2005; Hutson et al., 2006). Т.о., аномалии во взаимодействиях между клетками кардиального нервного гребня, энтодермой и клетками переднего вторичного поля сердца ведут к дефектам развития тракта оттока (Chen et al., 2007; Goddeeris et al., 2007).
The role of tissue interactions and heart looping in cardiac morphogenesis
Мы д. задаться вопросом, является ли регуляция миокардиальной дифференцировки прирожденной для этой ткани и тем самым независима и изолирована от какого-либо сорта внешней информации. Недавние результаты, по-видимому, показывают, что это не так, т.к. целенаправленная делеция генов. имеющих отношение к развитию не мышечной ткани, подобной эндокарду и эпикарду оказывает существенное влияние на пролиферацию, дифференцировку и созревание
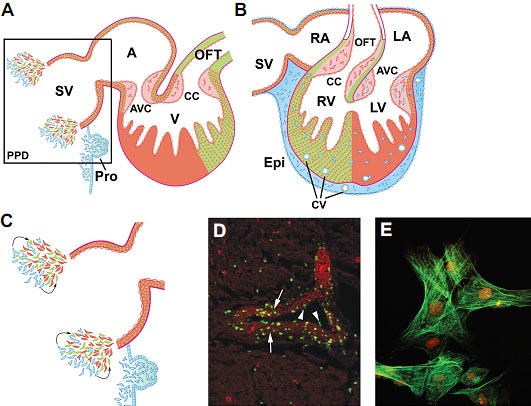 Fig. 5. Proepicardial contributions to heart development. (A,B) Translocation of the epicardial progenitors from the "extracardiac" proepicardium (Pro) to the primitive epicardium (Epi). The red-green code color has been kept to indicate PHF or SHF contributions. In (B) epicardially-derived cells (EPDCs) have already invaded the atrioventricular and ventricular subepicardial space and compact myocardial layers to form coronary vessels (CV). Invasive mesenchymal populations not associated to the coronaries remain in this myocardium and reach the atrioventricular cushions (AVC). The boxed area in (A) has been magnified in (C) to show a hypothesis about the interaction of two pools of cardiac progenitors (from the PHF in red and the SHF in green) with a population of coelomic-derived cells (in blue) at the heart inflow. This latter population of cells would represent at least part of the posterior pronephric domain (PPD, see text for a detailed explanation) that coincides in time and space with cardiac precursors contributing to the morphogenesis of the area, probably by signalling (arrows) to the myocardial progenitors. (D) Aspects of coronary vessel formation from proepicardial cells in a quail to chick proepicardial chimera (see PerezPomares et al., 2002 for details on the transplantation procedure). Note that quail proepicardial cells (green dots) form both the endothelial layer (arrowheads) and smooth muscle wall (arrows, counterstained in red with antibodies against smooth muscle alpha-actin, α-SMA). Some migratory EPDCs (α-SMA-positive) express the coelomic lineage marker Wilms tumor transcription factor (Wt1) in their nuclei (red) for a certain period of time. Abbreviations: AVC, atrioventricular cushions; CC, conal cushions; LA, left atrium; LV, left ventricle; RA; right atrium; RV, right ventricle.
Fig. 5. Proepicardial contributions to heart development. (A,B) Translocation of the epicardial progenitors from the "extracardiac" proepicardium (Pro) to the primitive epicardium (Epi). The red-green code color has been kept to indicate PHF or SHF contributions. In (B) epicardially-derived cells (EPDCs) have already invaded the atrioventricular and ventricular subepicardial space and compact myocardial layers to form coronary vessels (CV). Invasive mesenchymal populations not associated to the coronaries remain in this myocardium and reach the atrioventricular cushions (AVC). The boxed area in (A) has been magnified in (C) to show a hypothesis about the interaction of two pools of cardiac progenitors (from the PHF in red and the SHF in green) with a population of coelomic-derived cells (in blue) at the heart inflow. This latter population of cells would represent at least part of the posterior pronephric domain (PPD, see text for a detailed explanation) that coincides in time and space with cardiac precursors contributing to the morphogenesis of the area, probably by signalling (arrows) to the myocardial progenitors. (D) Aspects of coronary vessel formation from proepicardial cells in a quail to chick proepicardial chimera (see PerezPomares et al., 2002 for details on the transplantation procedure). Note that quail proepicardial cells (green dots) form both the endothelial layer (arrowheads) and smooth muscle wall (arrows, counterstained in red with antibodies against smooth muscle alpha-actin, α-SMA). Some migratory EPDCs (α-SMA-positive) express the coelomic lineage marker Wilms tumor transcription factor (Wt1) in their nuclei (red) for a certain period of time. Abbreviations: AVC, atrioventricular cushions; CC, conal cushions; LA, left atrium; LV, left ventricle; RA; right atrium; RV, right ventricle.
миокарда и тем самым на специфическую миокардиальную морфологию, обнаруживаемую в разных регионах сердца. Значение сигналов, предоставляемых с помощью эндокарда внутренней поверхности сердца, и с помощью эпикарда наружной дает четкий пример при пролиферации трабекулированного и компактного слоя миокарда.
Трабекулы являются характерным признаком раннего желудочка (действительно, наиболее характерный признак любого сердечного желудочка позвоночных) и придают этой эмбриональной кардиальной камере её типичный пористый вид. Трабекулы являются высоко организованными слоями кардиомиоцитов, которые формируют мышечные гребни или проекции, выстланные эндокардиальными клетками (Ben-Shachar et al., 1985). Трабекулы постепенно становятся частью папиллярных мышц, межжелудочковой перегородки и частью проводящей системы (Moorman and Christoffels, 2003).
Разные молекулы описаны, как участвующие в трабекуляции (Gassman et al., 1995; Lee et al., 1995; Meyer and Birchmeier, 1995; Wang et al., 1998; Gerety et al., 1999; Chen et al., 2004), но недавнее сообщение показало, что путь Notch ответственен за координацию событий, ведущих к образованию трабекул.
Notch1 экспрессируется эндокардиальными, но не миокардиальными клетками. Notch1 активен специфически в презумптивных трабекулярных регионах. Эмбрионы, элементов передачи сигналов Notch обнаруживают аномальное образование трабекул и снижение экспрессии специфичных для желудочка эндокардиальных и миокардиальных генов. Более того, специфичная для эндокарда делеция Notch1 дает сходные дефекты (GregoBessa et al., 2007). Это указывает на то, что нарушены коммуникации между эндокардом и миокардом и что сигналы, которые испускаются первым, необходимы последнему для развития. Передача сигналов Notch оказывает воздействие на пролиферацию миокарда посредством миокардиальной экспрессии BMP10, которая нарушена
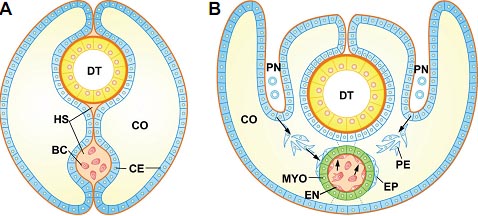 Fig. 6. Extracardiac cell contributions give rise to the trilayered vertebrate heart. Blood-pumping organs are shown in the context of the coelomic cavity. (A) Invertebrate hearts are frequently constituted only by a single layer of myoepithelial cells. (B) The vertebrate heart is characterized by a multilayered myocardium (MYO) lined internally and externally by an endocardium (EN) and an epicardium (EP). From the evolutionary point of view, we suggest that the endocardium, as well as all the vertebrate endothelium, derives from a specialized type of blood cell (Munoz-Chapuli et al., 2005). On the other hand, the epicardium develops from the attachment to the surface of the heart of proepicardial cells (PE) which arose from an ancestral pronephric external glomerulus (Pombal et al., 2008). Endocardium and epicardium have the potential to give rise to mesenchymal cells which will contribute to the valvuloseptal mesenchyme, the coronary vessels and the connective tissue of the heart. A third extracardiac contribution, that from the neural crest, has not been included in the scheme. BC: blood cells; PN: pronephros. Other abbreviations as in precedent figures.
Fig. 6. Extracardiac cell contributions give rise to the trilayered vertebrate heart. Blood-pumping organs are shown in the context of the coelomic cavity. (A) Invertebrate hearts are frequently constituted only by a single layer of myoepithelial cells. (B) The vertebrate heart is characterized by a multilayered myocardium (MYO) lined internally and externally by an endocardium (EN) and an epicardium (EP). From the evolutionary point of view, we suggest that the endocardium, as well as all the vertebrate endothelium, derives from a specialized type of blood cell (Munoz-Chapuli et al., 2005). On the other hand, the epicardium develops from the attachment to the surface of the heart of proepicardial cells (PE) which arose from an ancestral pronephric external glomerulus (Pombal et al., 2008). Endocardium and epicardium have the potential to give rise to mesenchymal cells which will contribute to the valvuloseptal mesenchyme, the coronary vessels and the connective tissue of the heart. A third extracardiac contribution, that from the neural crest, has not been included in the scheme. BC: blood cells; PN: pronephros. Other abbreviations as in precedent figures.
у
Notch мутантов. Вторая промежуточная система, связанная с Notch эффектами, является та, что представлена межклеточной сигнальной системой EphrinB2/EphB4. Экспрессии
EphrinB2 активно способствует в эндокарде Notch, которая в свою очередь косвенно вносит вклад в экспрессию растворимого Neuregulin 1 (NRG1). Миокардиальные рецепторы NRG1 типа ErbB в конечном итоге получают сигналы, способствующие миокардиальной дифференцировке (Grego-Bessa et al., 2007).
Хотя присутствие компактного слоя в желудочках не является характерным для сердец всех позвоночных, его присутствие описывается уже у примитивных позвоночных, подобных акулам. Компактный слой миокарда происходит из первичной эпителиальной стенки кардиальных желудочков. Миокардиальное утолщение стенки сердца совпадает по времени с развитием эпикарда. Нарушение экспрессии специфичных для эпикарда молекул в сердце, подобных Wt1, не только нарушает развитие миокарда, но и также редуцирует пролиферацию компактного миокарда, давая характерный фенотип "тонкостенного миокарда" (Moore et al., 1999). Wt1-нулевые мыши обнаруживают дефицит синтеза RALDH2. RALDH2 является основным энзимом, синтезирующим retinoic acid (RA) у эмбриона. RA, по-видимому, обладает аутокринной сигнальной функцией, действующей на EPDC и индуцирующей продукцию неизвестного трофического фактора, который стимулирует пролиферацию миокарда (Perez-Pomares et al., 2002b; Chen et al., 2002, Stuckmann et al., 2003; Lavine et al., 2006). Всё это строго подтверждает концепцию эпикарда как др. не-мышечной эмбриональной ткани, критической для развития миокарда.
В то же самое время, когда сердце становится более разнообразным в терминах его клеточных компонентов, он также начинает и завершает торсионное вращение. Легко понять, что последовательное расположение кардиальных доменов в прямой сердечной трубке чрезвычайно ограничивает прогресс в направлении более сложного сердца. Эти ограничения становятся очевидными с инвазией сухопутных территорий у примитивных позвоночных. С точки старта плана построения сердца рыб (одиночная трубка, образующая петлю в правую строну), сердечная трубка перестраивается в пространстве до тех пор. пока не будет трансформирована в орган с 4 господствующими камерами (два предсердия, два желудочка), которые работают параллельно и способны распределять кровь по системному и легочному кругу кровообращения. Правостороннее петлеобразование является характерным признаком сердца позвоночных. Даже в редких случаях, в которых тела беспозвоночных развиваются асимметрично (напр., у Amphioxus), срединный вентральный сосуд, который предположительно соответствует сердцу, остаётся в качестве прямой линейной трубки. Исключение из этого правила может быть найдено у urochordate Ciona, где сердечная трубка образует складку в направлении дорсальной стороны и обнаруживает типичную V форму (Davidson et al., 2007), но взаимосвязь этого наблюдения с петлеобразованием сердца у позвоночных неясна.
Определенным образом кардиальное петлеобразование рассматривается как последовательное изменение в позиции определенных кардиальных регионов и не может быть отделено от морфологических изменений, которые затрагивают разные кардиальные домены (т.e. образование миокардиальных камер, ремоделирование первичного миокарда и т.д.). Несмотря на это некоторые характерные движения сердца могут быть распознаны как важные свойства процесса петлеобразования, главным образом "право-направленный" его аспект. В нормальной ситуации сердце начинает изгиб и выпячивается в правую сторону эмбриона и поэтому известно как R-loop; это перемещение использует ротацию трубки по кранио-каудально оси , так что оригинальная вентральная сторона трубки становится латеризованной, формируя на этой ст. наружный изгиб сердца. Если R-loop трансформирует прямую трубку сердца в C-образную структуру (De Haan, 1965; Stalsberg, 1970), то латеральное смещение артериального и венозного полюсов сердечной трубки и "уменьшение" расстояния между этими двумя областями (вдоль кранио-каудальной оси) предопределяет превращение в S-образную конформацию, в которой эмбриональные предсердия становится краниальнее желудочков (De la Cruz, 1998; Taber, 1998). Большинство авт. согласно с рассмотрением конца фазы S-образного сердца как конца кардиального петлеобразования (De la Cruz, 1998; Taber, 1998), тогда как др. полагают, что петлеобразование в действительности не заканчивается вплоть до того, когда кардиальные камеры будут полностью и соотв. установлены и разделены перегородками (Steding and Seidl, 1980; Manner et al., 1993; Manner, 2000; Кардиальное петлеобразование и события образования слоёв представлены на
Figure 4).
Conclusion
The vertebrate heart is unique among the metazoan blood pumping organs but, at the same time, it is possible to account for the origin of most of its exclusive features from the analysis of developmental and comparative data. The establishment of a specific program of myocardial differentiation superimposed to the visceral myogenic original program, the recruitment of mesodermal cells from both ends of the primary cardiac tube, as well as the incorporation of extrinsic cell populations with diverse origins contributed to develop an organ which was pivotal for the evolutionary expansion of vertebrates. The success of the vertebrate heart depended on the morphogenetic and signalling properties of mesenchymal tissues derived from the endocardium (that most likely, like the rest of the vertebrate endothelium, originated from blood cells), the epicardium or the neural crest (summarized in Figure 6). All these tissues were crucial to the development of the sophisticated vertebrate heart that allowed this group of organisms to become exceptionally large and active animals.
Сайт создан в системе
uCoz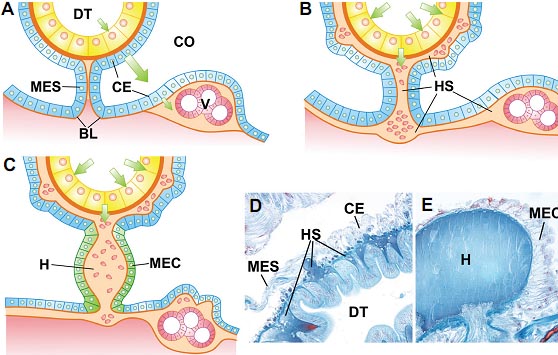 Fig. 1. Development of the hemal system and evolutionary origin of the heart. (A) In coelomate animals, the nutrients (green arrows) absorbed through the digestive tract (DT) arrive to the coelomic cavity (CO), from where they reach the viscerae (V). In this way, the nutrients have to cross twice the coelomic epithelium (CE). (B) The hemal system (in light orange, HS) developed from a network of spaces between the basal laminae (in dark orange, BL) of the gut epithelium (in yellow) and the coelomic epithelium, and also between the basal laminae of the mesenteries (MES). In this way, the nutrients are conveyed directly to the viscerae surrounded by hemal spaces. (C) The heart (H) arose from transformation of the mesenteric coelomic epithelia into myoepithelial cells (MEC), which acquired contractile abilities and pumped the hemal fluid (i.e. the blood) between the digestive tract and the viscerae. (D) The hemal system (HS) can be observed stained in dark blue in this oligochaete annelid ( Lumbricus) between the epithelium of the digestive tract (DT) and the coelomic epithelium (CE). (E) The heart (H) of the same specimen is an enlarged dorsal vessel surrounded by myoepithelial cells (MEC).
Fig. 1. Development of the hemal system and evolutionary origin of the heart. (A) In coelomate animals, the nutrients (green arrows) absorbed through the digestive tract (DT) arrive to the coelomic cavity (CO), from where they reach the viscerae (V). In this way, the nutrients have to cross twice the coelomic epithelium (CE). (B) The hemal system (in light orange, HS) developed from a network of spaces between the basal laminae (in dark orange, BL) of the gut epithelium (in yellow) and the coelomic epithelium, and also between the basal laminae of the mesenteries (MES). In this way, the nutrients are conveyed directly to the viscerae surrounded by hemal spaces. (C) The heart (H) arose from transformation of the mesenteric coelomic epithelia into myoepithelial cells (MEC), which acquired contractile abilities and pumped the hemal fluid (i.e. the blood) between the digestive tract and the viscerae. (D) The hemal system (HS) can be observed stained in dark blue in this oligochaete annelid ( Lumbricus) between the epithelium of the digestive tract (DT) and the coelomic epithelium (CE). (E) The heart (H) of the same specimen is an enlarged dorsal vessel surrounded by myoepithelial cells (MEC). 
 Fig. 2. Model of the evolutionary origin of myoepithelial cells and visceral smooth muscle. Redrawn from Ruppert (1991). (A) Original coelomic cells show cilia (CIL), intercellular junctions (IJ) and a basal lamina (BL). (B) A subset of coelomic cells develop myofilaments, acquiring contractile ability. (C,D) Myofilament-containing contractile cells become myoepithelial cells and relocate most of their cytoplasm towards the basal side, giving rise a pseudostratified epithelium. (E,F) Myoepithelial cells become visceral smooth muscle (VSMC) covered by a typical coelomic epithelium (CE).
Fig. 2. Model of the evolutionary origin of myoepithelial cells and visceral smooth muscle. Redrawn from Ruppert (1991). (A) Original coelomic cells show cilia (CIL), intercellular junctions (IJ) and a basal lamina (BL). (B) A subset of coelomic cells develop myofilaments, acquiring contractile ability. (C,D) Myofilament-containing contractile cells become myoepithelial cells and relocate most of their cytoplasm towards the basal side, giving rise a pseudostratified epithelium. (E,F) Myoepithelial cells become visceral smooth muscle (VSMC) covered by a typical coelomic epithelium (CE). Fig. 3. Cardiac progenitors and heart fields. The drawings represent an ideal vertebrate embryo (not the specific case of the chick or the mouse), and therefore the location of the heart fields is based on an anatomical consensus. The spatial distribution of the different cardiac populations in a cardiac crescent is shown together with the changes affecting to such groups of cells as development proceeds. (A') A simplified diagram representing the domains of the primary heart field (PHF, shadowed central area characterized by the expression of Nkx2.5, GATA4, Mef2c and SRF) and the second heart field (SHF, white inverted-U domain characterized by Isl1 expression) in the forming heart. The expression of characteristic anterior and posterior markers (in white, Tbx1, Foxh1, Wt1, Tbx18, Pod1) may be interpreted as a consequence of the overlapping of myocardial precursors with other non-muscular mesenchymal populations with inherent strong signalling properties (anterior pharyngeal domain or APD and posterior pronephric domain or PPD, arrows). (AD) The PHF is coloured in orange, the SHF in green, the endocardium in red (E) and the progenitors of the septum transversum area (STP) are presented by a blue line. All the cartoons display a dorsal view as indicated in (D). The illustrations in (E,F) (embryos in a left lateral view placed next to the proper crescent stages) help to understand the relative position of the PHF and SHF in the context of the whole embryo; specifically in (E) the mesenchymal anterior pharyngeal (APD) and the posterior pronephric domains (PPD) are shown overlapping with the arterial and venous poles of the heart, respectively. For more details, please refer to the text.
Fig. 3. Cardiac progenitors and heart fields. The drawings represent an ideal vertebrate embryo (not the specific case of the chick or the mouse), and therefore the location of the heart fields is based on an anatomical consensus. The spatial distribution of the different cardiac populations in a cardiac crescent is shown together with the changes affecting to such groups of cells as development proceeds. (A') A simplified diagram representing the domains of the primary heart field (PHF, shadowed central area characterized by the expression of Nkx2.5, GATA4, Mef2c and SRF) and the second heart field (SHF, white inverted-U domain characterized by Isl1 expression) in the forming heart. The expression of characteristic anterior and posterior markers (in white, Tbx1, Foxh1, Wt1, Tbx18, Pod1) may be interpreted as a consequence of the overlapping of myocardial precursors with other non-muscular mesenchymal populations with inherent strong signalling properties (anterior pharyngeal domain or APD and posterior pronephric domain or PPD, arrows). (AD) The PHF is coloured in orange, the SHF in green, the endocardium in red (E) and the progenitors of the septum transversum area (STP) are presented by a blue line. All the cartoons display a dorsal view as indicated in (D). The illustrations in (E,F) (embryos in a left lateral view placed next to the proper crescent stages) help to understand the relative position of the PHF and SHF in the context of the whole embryo; specifically in (E) the mesenchymal anterior pharyngeal (APD) and the posterior pronephric domains (PPD) are shown overlapping with the arterial and venous poles of the heart, respectively. For more details, please refer to the text.  Fig. 4. Looping and layering of the heart. (A-D) The vertebrate heart looping is illustrated with scanning electron micrographs from chick embryos. (A) At HH9 the two bilateral cardiac tubes (asterisks) have just fused in the midline (arrow) forming a single straight heart tube. Anterior arterial (An) and posterior venous (Po) poles of the heart are indicated. (B) Shows a right lateral view of the same specimen with the same anteroposterior orientation. (C,D) Around 20 hours later HH14 embryos have initiated the C-shape phase of the cardiac looping. (C) A frontal view and (D) a right lateral one. (E,F) The characteristic layering of the heart. In (E), the endocardium (green), the myocardium (red) and the epicardium (blue) in a chick heart transversal section have been counterstained using an endothelium-specific lectin and antibodies against heavy myosins and cytokeratins, respectively. The concentric arrangement of the layers is shown in the cartoon in (F).
Fig. 4. Looping and layering of the heart. (A-D) The vertebrate heart looping is illustrated with scanning electron micrographs from chick embryos. (A) At HH9 the two bilateral cardiac tubes (asterisks) have just fused in the midline (arrow) forming a single straight heart tube. Anterior arterial (An) and posterior venous (Po) poles of the heart are indicated. (B) Shows a right lateral view of the same specimen with the same anteroposterior orientation. (C,D) Around 20 hours later HH14 embryos have initiated the C-shape phase of the cardiac looping. (C) A frontal view and (D) a right lateral one. (E,F) The characteristic layering of the heart. In (E), the endocardium (green), the myocardium (red) and the epicardium (blue) in a chick heart transversal section have been counterstained using an endothelium-specific lectin and antibodies against heavy myosins and cytokeratins, respectively. The concentric arrangement of the layers is shown in the cartoon in (F).  Fig. 5. Proepicardial contributions to heart development. (A,B) Translocation of the epicardial progenitors from the "extracardiac" proepicardium (Pro) to the primitive epicardium (Epi). The red-green code color has been kept to indicate PHF or SHF contributions. In (B) epicardially-derived cells (EPDCs) have already invaded the atrioventricular and ventricular subepicardial space and compact myocardial layers to form coronary vessels (CV). Invasive mesenchymal populations not associated to the coronaries remain in this myocardium and reach the atrioventricular cushions (AVC). The boxed area in (A) has been magnified in (C) to show a hypothesis about the interaction of two pools of cardiac progenitors (from the PHF in red and the SHF in green) with a population of coelomic-derived cells (in blue) at the heart inflow. This latter population of cells would represent at least part of the posterior pronephric domain (PPD, see text for a detailed explanation) that coincides in time and space with cardiac precursors contributing to the morphogenesis of the area, probably by signalling (arrows) to the myocardial progenitors. (D) Aspects of coronary vessel formation from proepicardial cells in a quail to chick proepicardial chimera (see PerezPomares et al., 2002 for details on the transplantation procedure). Note that quail proepicardial cells (green dots) form both the endothelial layer (arrowheads) and smooth muscle wall (arrows, counterstained in red with antibodies against smooth muscle alpha-actin, α-SMA). Some migratory EPDCs (α-SMA-positive) express the coelomic lineage marker Wilms tumor transcription factor (Wt1) in their nuclei (red) for a certain period of time. Abbreviations: AVC, atrioventricular cushions; CC, conal cushions; LA, left atrium; LV, left ventricle; RA; right atrium; RV, right ventricle.
Fig. 5. Proepicardial contributions to heart development. (A,B) Translocation of the epicardial progenitors from the "extracardiac" proepicardium (Pro) to the primitive epicardium (Epi). The red-green code color has been kept to indicate PHF or SHF contributions. In (B) epicardially-derived cells (EPDCs) have already invaded the atrioventricular and ventricular subepicardial space and compact myocardial layers to form coronary vessels (CV). Invasive mesenchymal populations not associated to the coronaries remain in this myocardium and reach the atrioventricular cushions (AVC). The boxed area in (A) has been magnified in (C) to show a hypothesis about the interaction of two pools of cardiac progenitors (from the PHF in red and the SHF in green) with a population of coelomic-derived cells (in blue) at the heart inflow. This latter population of cells would represent at least part of the posterior pronephric domain (PPD, see text for a detailed explanation) that coincides in time and space with cardiac precursors contributing to the morphogenesis of the area, probably by signalling (arrows) to the myocardial progenitors. (D) Aspects of coronary vessel formation from proepicardial cells in a quail to chick proepicardial chimera (see PerezPomares et al., 2002 for details on the transplantation procedure). Note that quail proepicardial cells (green dots) form both the endothelial layer (arrowheads) and smooth muscle wall (arrows, counterstained in red with antibodies against smooth muscle alpha-actin, α-SMA). Some migratory EPDCs (α-SMA-positive) express the coelomic lineage marker Wilms tumor transcription factor (Wt1) in their nuclei (red) for a certain period of time. Abbreviations: AVC, atrioventricular cushions; CC, conal cushions; LA, left atrium; LV, left ventricle; RA; right atrium; RV, right ventricle. Fig. 6. Extracardiac cell contributions give rise to the trilayered vertebrate heart. Blood-pumping organs are shown in the context of the coelomic cavity. (A) Invertebrate hearts are frequently constituted only by a single layer of myoepithelial cells. (B) The vertebrate heart is characterized by a multilayered myocardium (MYO) lined internally and externally by an endocardium (EN) and an epicardium (EP). From the evolutionary point of view, we suggest that the endocardium, as well as all the vertebrate endothelium, derives from a specialized type of blood cell (Munoz-Chapuli et al., 2005). On the other hand, the epicardium develops from the attachment to the surface of the heart of proepicardial cells (PE) which arose from an ancestral pronephric external glomerulus (Pombal et al., 2008). Endocardium and epicardium have the potential to give rise to mesenchymal cells which will contribute to the valvuloseptal mesenchyme, the coronary vessels and the connective tissue of the heart. A third extracardiac contribution, that from the neural crest, has not been included in the scheme. BC: blood cells; PN: pronephros. Other abbreviations as in precedent figures.
Fig. 6. Extracardiac cell contributions give rise to the trilayered vertebrate heart. Blood-pumping organs are shown in the context of the coelomic cavity. (A) Invertebrate hearts are frequently constituted only by a single layer of myoepithelial cells. (B) The vertebrate heart is characterized by a multilayered myocardium (MYO) lined internally and externally by an endocardium (EN) and an epicardium (EP). From the evolutionary point of view, we suggest that the endocardium, as well as all the vertebrate endothelium, derives from a specialized type of blood cell (Munoz-Chapuli et al., 2005). On the other hand, the epicardium develops from the attachment to the surface of the heart of proepicardial cells (PE) which arose from an ancestral pronephric external glomerulus (Pombal et al., 2008). Endocardium and epicardium have the potential to give rise to mesenchymal cells which will contribute to the valvuloseptal mesenchyme, the coronary vessels and the connective tissue of the heart. A third extracardiac contribution, that from the neural crest, has not been included in the scheme. BC: blood cells; PN: pronephros. Other abbreviations as in precedent figures.