К сожалению, всё ещё остается задача картирования точных отличий в белковой структуре и рецептор-связывающих свойств разных Wnt белков. Попытки кристаллизовать их и определить их трехмерную структуру остались безуспешными и их гидрофобная природа вплоть до недавнего времени затрудняла из очистку (Willert et al., 2003; Willert, 2008). В целом, исследования, которые непосредственно были адресованы сродству связывания Wnt-Frizzled, ограничены. Эксперименты, которые используют закрепленные на мембране
Wnt белки и растворимые, секретируемые Frizzled CRD домены выявили, что определенные Wnt-Frizzled комбинации, по-видимому, предпочтительнее других (Bhanot et al., 1996; Green et al., 2007; Hsieh et al., 1999; Rulifson et al., 2000; Wu и Nusse, 2002). Однако всё ещё далеко от ясности, до какой степени специфические спаривания Wnt-рецептор, действительно обладают самостоятельными функциями. Более того, эти эксперименты вызывают предостережение, что они не учитывают какие-либо потенциальные модуляции взаимодействий Wnt-рецептор за счёт ко-рецепторов или за счет модификаций самих Wnts, которые могут влиять на реакции, которые возникают в контексте интактного развивающегося организма.
Клеточные реакции данного взаимодействия Wnt-рецептор, по-видимому, возникают в зависимости, по крайней мере частично, от сигнальной специфичности рецептора. В частности, последовательность C-конце белка Frizzled влияет на способность рецептора активировать передачу сигналов β-catenin/TCF. У Drosophila, Fz участвует в становлении planar cell polarity (PCP). Он обладает более низким сродством к Wg, чем Fz2, который участвует в передаче сигналов β-catenin/TCF скорее, чем в PCP (Bhanot et al., 1996; Bhat, 1998; Tomlinson et al., 1997). Обмен C-терминальной последовательностью Fz и Fz2 меняет их поведение (Boutros et al., 2000).
Хотя такие разные сигнальные активности согласуются с моделью, в которой исходное событие передачи сигналов Wnt детерминируется рецепторами, с которыми сталкиваются на клеточной поверхности, имеются множество примеров, демонстрирующих, что это может быть слишком упрощенным мнением относительно рецепторов, как единственных детерминантов активации передачи сигналов Wnt. Напр.,
Xenopus Fz7, как было установлено, обеспечивает множественные внутриклеточные реакции. Fz7 влияет на движения конвергентного удлинения независимым от β-catenin/TCF способом, который использует Dishevelled, Syndecan 4 и Cdc42, но он также необходим для спецификации дорсо-вентральной мезодермы выше β-catenin/TCF (Medina et al., 2000; Munoz et al., 2006; Sumanas и Ekker, 2001; Sumanas et al., 2000). Сходным образом многие исследования продемонстрировали роль Ror2 в передаче сигналов Wnt5A, которые в конечном итоге ингибируют передачу сигналов β-catenin/TCF. Ror2, по-видимому, действует как настоящая RTK в данном случае (Billiard et al., 2005) (Fig. 1C). Недавние сообщения, однако, показали, что в разных клеточных контекстах, Ror2 может действовать, чтобы усиливать передачу сигналов β-catenin/TCF, индуцируемую с помощью Wnt1 или Wnt3A (Li et al., 2008; Winkel et al., 2008). Последний, по-видимому, не нуждается в тирозин киназной активности Ror2, это открывает возможность того, что Ror2 может также действовать как ко-рецептор, который только помогает презентации Wnts для Frizzled (Fig. 1D). Исследования на
C. elegans указывают на ещё одну возможную функцию для Ror2.
C. elegans. Ror2 гомолог CAM-1 противодействует клеточно-неавтономной передаче сигналов β-catenin/TCF (означая, что действует на клетки, другие, нежели клетки мишени для Wnt) и независимо от его цитоплазматического домена (Green et al., 2007). Т.к. CAM-1 способен взаимодействовать со многими
C. elegans Wnts, поэтому авт. предложили модель, согласно которой CAM-1 действует как котлован для секвестрирования Wnt белков, ограничивая тем самым их эффективные диапазоны и концентрации. Остается определить, выполняет ли Ror2 сходную роль у др. организмов. Как иллюстрируется этими примерами, в то время как Wnt белки не могут быть строго подразделены на классы со специфическими активностями, функции Frizzleds и др. Wnt рецепторов и ко-рецепторов также контекст зависимы.
Dynamic interactions determine the cellular response to Wnts
В дополнение к Wnt белкам, обладающим потенциалом использовать разнообразные трансмембранные рецепторы, как Wnts и их рецепторы сталкивались с ко-регуляторами хозяина во внутри- и внеклеточном пространстве, многие из которых, по-видимому, выполняли двойную роль. Ниже мы обсудим некоторые из этих контекст-зависимые модификаторы детальнее, чтобы проиллюстрировать, как кумулятивные взаимодействия между этими разными факторами делают возможными гибкие и динамичные клеточные реакции на присутствие сигнала Wnt. Это - ни в коем случае исчерпывающий список, но служит, чтобы подчеркнуть динамику взаимодействий, которая скорее всего существует между многими из вовлеченных игроков.
Как упоминалось выше каноническая β-catenin-зависима и неканоническая β-catenin-независимая реакции на Wnt стимуляцию в целом рассматриваются как отдельные пути. В частности, рекрутирование LRP ко-рецептора, по-видимому, является предварительным условием для индукции передачи сигналов β-catenin/TCF (Tamai et al., 2000; Wehrli et al., 2000). Недавно, однако, LRP6 оказался также вовлеченным в движения конвергентного вытягивания и в становление тканевой полярности у позвоночных (Bryja et al., 2009; Tahinci et al., 2007). LRP ко-рецептору может помешать вступлению в Wnt-Frizzled комплекс Kremen, пронизывающий один раз трансмембранный рецептор, и Dickkopf (Dkk), растворимый секретируемый белок, который если связан LRP, обеспечивает его интернализацию (Fig. 1A). Чтобы способствовать этой Dkk-обеспечиваемой интернализации LRP, Kremen негативно регулирует передачу сигналов Wnt/β-catenin (Mao et al., 2002). В отсутствие Dkk, однако, Kremen вместо этого способствует локализации на поверхности клетки LRP (Hassler et al., 2007). Как подчеркивается Cselenyi и Lee (Cselenyi и Lee, 2008), стимулирующие активности Kremen, одной стороны, и его ингибирующие активности, с др. стороны, д. позволять генерировать бифазные реакции: в регионах низкой концентрации Dkk Kremen д. усиливать Wnt/β-catenin передачу сигналов, тогда как он может активно ингибировать передачу сигналов Wnt/β-catenin, как только будет превзойдена критическая концентрация Dkk.
Подобно LRP6, Dkk сегодня связывают как с каноническими, так и неканоническими сигнальными событиями. Делеция материнского Dkk у эмбрионов Xenopus приводит к эктопической активации передачи сигналов β-catenin/TCF, а также нарушает движения конвергентного вытягивания β-catenin-независимым способом как результат усиленной активности Jnk (Caneparo et al., 2007; Cha et al., 2008). Это и др. исследования показали, что каноническая и неканоническая реакции могут быть значительно сильнее интимно связаны, чем это предполагалось ранее.
LRP6-связывающий белок Wise (Sostdc1) др. прекрасный пример контекст-зависимого модификатора (Fig. 1A). Ранние эксперименты на Xenopus выявили как стимулирующие, так и ингибирующие активности для белка по отношению к передаче сигналов Wnt/β-catenin, а также его роль в регуляции движений конвергентного вытягивания (Itasaki et al., 2003). В завершенном исследовании было показано, что Wise, может ингибировать активности некоторых Wnt белков, но усиливает активность других. Более того, Wise, как было установлено, обладает как внеклеточной, так и внутриклеточной функциями (Guidato и Itasaki, 2007). Мутантный Wise белок, который сохраняется в эндоплазматическом ретикулеме, вызывает снижение экспрессии на клеточной поверхности LRP6. Хотя сегодня неизвестно, продуцируется ли эндогенный Wise в секретируемой, а также во внутриклеточной форме in vivo, важно отметить, что некоторые фенотипы, наблюдаемые вследствие избыточной экспрессии или нокдауна дикого типа Wise лучше всего воспроизводятся с помощью секретируемой формы белка, а др. с помощью эндоплазматической, сохраняемой в ретикулёме формы.
Недавняя идентификация collagen triple helix repeat-containing protein 1 (Cthrc1) в качестве модификатора передачи сигналов Wnt иллюстрирует важность внеклеточных ко-факторов для генерации функциональной единицы Wnt-рецептор (Yamamoto et al., 2008). В отношении функции, Cthrc1 взаимодействует с основным PCP белком Vangl2у мыши, это указывает на роль его в установлении тканевой полярности. В экспериментах по избыточной экспрессии Cthrc1 физически взаимодействует с рядом Wnts (Wnt3A, Wnt5A и Wnt11) и Frizzleds (Fz3, Fz5 и Fz6) , а также с Ror2. Более того, Cthrc1 специфически усиливает формирование комплекса Wnt-Fz-Ror2 за счёт комплексов Wnt-Fz-LRP6 - активность, которая, как полагают авт., может приводить к одновременному ингибированию передачи сигналов β-catenin/TCF и активации внутриклеточных сигнальных событий, которые вносят вклад в становление тканевой полярности. Хотя Ror2 действует как настоящий Wnt рецептор в силу своего собственного CRD домена (Fig. 1C), исследование Yamamoto et al., указывает на то, что Ror2 может также действовать как часть крупного комплекса, в котором он сотрудничает с рецептором Frizzled (Fig. 1D) (Yamamoto et al., 2008). Это согласуется с ранее опубликованными данными, которые показали физическое взаимдействие между Ror2 и Frizzled (Oishi et al., 2003).
В свете образования Wnt-Fz-Ror2 комплекса, описанного Yamamoto et al. (Yamamoto et al., 2008) и сообщений о димеризации индивидуальных рецепторов (Carron et al., 2003; Liu et al.,2008), присутствие множественных Wnt рецепторов в одиночном комплексе открывает возможность, что Wnt белки действуют как мультимеры, а не мономеры (Fig. 1E). Недавнее исследование Heasman и co-workers продемонстрировало это: и Wnt5A и Wnt11, как было установлено, формируют гомодимеры, которые затем взаимодействуют, чтобы сформировать функциональные олигомерные Wnt5A-Wnt11 комплексы (Cha et al., 2008).
Наконец, ещё один дополнительный уровень регуляции связан с секретируемыми Wnt ингибиторами, такими как Wif белок, домен взаимодействия с Wnt которого сходен с таковым у рецепторов Ryk и секретируемыми frizzled-related proteins (Sfrps), которые содержат CRD, который сходен с Wnt-interacting доменами как рецепторов Frizzled, так и Ror (Fig. 1F). Wifs и Sfrps могут непосредственно соединяться с Wnt белками во внеклеточном пространстве, это влияет на расположение рецепторов и в конечном итоге на клеточные реакции (Bovolenta et al., 2008; Kawano и Kypta, 2003).
Challenges in studying Wnt signaling in development
В то время как исследования in vitro и биохимические подходы неоценимы для выявления функций индивидуальных компонентов передачи сигналов Wnt, их значение для развития ещё предстоит продемонстрировать in vivo. Здесь ситуация очень быстро усложняется, т.к. клетки могут воспринимать множественные сигналы в одно и то же время и которые могут действовать совместно, чтобы вызывать желаемый эффект. Напр., у C. elegans, два противоположных сигнальных Wnt события сотрудничают в ориентации клеточной полярности (Green et al., 2008). С др. стороны, Wnt/LIN-44 и Wnt/MOM-2, действующие посредством Fz/LIN-17 и Ryk/LIN-18, индуцируют передачу сигналов посредством β-catenin/TCF. Зато, Wnt/EGL-20 действует посредством Ror2/CAM-1, в сотрудничестве с PCP белком Vangl1/VANG-1. Все эти сигналы одновременно управляют ориентированными клеточными делениями, которые необходимы, чтобы поляризовать клетки собственно во время формирования вульвы. Если интерпретировать эти результаты, то мы д. учитывать, что роли разных белков и специфическое поведение клеток, которое они вызывают, скорее всего оказываются диверсифицированными в ходе эволюции. Напр., функция Arrow у Drosophila, по-видимому, ограничена передачей сигналов Wnt/β-catenin. Не идентифицировано очевидных гомологов LRP/Arrow у C. elegans. Всё же у позвоночных, LRP6 участвует как в β-catenin-зависимых, так и -независимых реакциях, как обсуждалось выше. Также установление тканевой полярности у Drosophila, по-видимому, нуждается в Frizzled, но не в Wnt (Chen et al., 2008). Напротив, Wnt белки участвуют в конвергентном удлинении и тканевой полярности у позвоночных (Dabdoub et al., 2003; Heisenberg et al., 2000; Kilian et al., 2003; Qian et al., 2007).
Принимая во внимание большое количество Wnt и Frizzled гомологов у высших позвоночных, остается обескураживающей задачей определить роль каждого из них в данном онтогенетическом процессе. Даже у Drosophila, исчерпывающие исследования их природы ещё не осуществлены. У C. elegans, однако, Zinovyeva et al. недавно исследовали участие всех 5 Wnt белков и и всех 4-х рецепторов Frizzled в эмбриональной и пост-эмбриональной миграции клеток (Zinovyeva et al., 2008). Они установили, что все они участвуют, также как и Ror2/CAM-1. Более того, сравнение фенотипов, наблюдаемых у пятикратных Wnt мутантов и четырехкратных Frizzled мутантных червей подтвердили существование дополнительных Frizzled-независимых ролей для Wnt, и Wnt-независимых ролей для Frizzled. Авт. полагают, что одновременная экспрессия множественных Wnt гомологов в одной и той же ткани может обеспечивать усиленной позиционной и направляющей информацией и помогать тонкой настройке клеточных реакций.
У C. elegans, также как и др. видов животных от Drosophila до Xenopus и мыши, белки Wnt и их рецепторы экспрессируются тонко настраиваемым простанственно-временным способом, начиная с раннего развития. Во время имплантации бластоциста мыши, напр., Wnts и Frizzleds уже экспрессируются в виде очень разных и динамических паттернов, которые указывают на столь же динамичную регуляцию нижестоящих сигнальных событий (Hayashi et al., 2009). Недавно были разработаны продвинутые высокопроизводительные подходы и количественные анализы, позволяющие сконструировать более детальную картину динамичных паттернов экспрессии генов Wn, их рецепторов и ко-регуляторов во время развития. В конечностях мыши. напр., Witte и colleagues осуществили детальный анализ локализации транскриптов, которые кодируют белки Wnt и их секретируемые антагонисты, и выявили динамичный паттерн распределения (Witte et al., 2009). Сходная ситуация наблюдалась для экспрессии различных генов рецепторов Frizzled в головном мозге мыши (Fischer et al., 2007). Однако для многих недавно идентифицированных Wnt рецепторов и ко-рецепторов, также как и для большинства анатомических мест, характеристики экспрессии остаются в основном неизвестными. Доступные базы данных, такие как Gene Paint Atlas (http://www.genepaint.org) и Edinburgh Mouse Atlas (http://genex.hgu.mrc.ac.uk/intro.html), становятся всё более информативными в отношении передачи сигналов Wnt по мере накопления этих данных.
Наконец, более продвинутые техники позволят нам найти ответы на злободневные вопросы широкого диапазона. Каковы сигналы, которые регулируют экспрессию разных лигандов и рецепторов? Каковы механизмы обратной связи, с помощью которых белки Wnt могут влиять на репертуар экспрессии рецепторов? У Drosophila, напр., fz3 является мишенью Wg, и его активация в свою очередь ослабляет передачу сигналов Wg (Sato et al., 1999). У позвоночных, некоторые негативные регуляторы передачи сигналов Wnt, такие как Axin2 и Dkk4, также были идентифицированы как гены мишени для Wnt (Bazzi et al., 2007; Jho et al., 2002). Такие негативные петли обратной связи могут иметь важные онтогенетические следствия. Напр., они могут вызывать стабильные осцилляции, которые наблюдаются во время сомитогенеза, когда перемежаются периоды высокой и низкой сигнальной активности Wnt (Aulehla et al., 2003; Aulehla et al., 2008; Suriben et al., 2006), или в регулярном пространственном распределении волосяных фолликулов на коже (Sick et al., 2006).
Действительно ли происходят разные сигнальные события внутри одной и той же клетки? Как возникающие сигнальные события в соседних клетках или даже в клетках, которые отстоят далеко, влияют на реакцию ткани как целого? Как. напр., клеточно-неавтономная роль Ror2/CAM-1 у C. elegans (Green et al., 2007), может влиять на реакцию на Wnt путем функционирования в клетках соседних, но отличающихся от клеток мишеней для Wnt. Насколько далеко разные Wnt сигналы распространяются in vivo? Можно ли различить между прямыми реакциями и вторичными эффектами? Последние важные, хотя часто забытые, источники неразберихи. Важно понять, что окончательный онтогенетический результат (read-out) (т.e. фенотип) и прямая, инициальная реакция на стимуляцию с помощью Wnt лиганда (напр.. формирование рецепторного комплекса или стабилизация β-catenin) сильно разделены по времени в онтогенезе и поэтому д. различаться др. от др.
Новые imaging инструменты д. предоставить нам достаточное разрешение, чтобы увеличить события сигнальной трансдукции Wnt
in vivo. С-терминальные хвосты белков Fz и Fz2 дрозофилы, напр., предопределяют их субклеточную локализацию (Wu et al., 2004). С-конец Fz управляет апикальной локализацией в эпителиальных клетках крыловых имагинальных дисков дрозофилы, где он способствует передаче сигналов PCP, но ингибирует передачу сигналов посредством β-catenin/TCF. Напротив С-конец Fz2 способствует более базальной локализации, где он соединяется с Wg и способствует передаче сигналов посредством β-catenin/TCF. Это наблюдение указывает на то, что разные внутриклеточные реакции могут происходит в разных субклеточных компартментах. Сходным образом поляризованное распределение
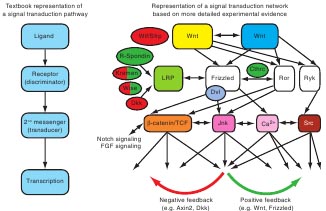 Fig. 2. Signal transduction networks. Textbook molecular biology ascribes that a signal transduction cascade begins with the binding of an extracellular ligand to a membrane receptor, after which cytoplasmic second messengers transduce the signal to the nucleus, resulting in the transcription of a given set of target genes. In reality, the situation is not that simple, и complications exist at practically every level. A wide variety of ligands exists. The mammalian genome, for instance, encodes 19 different Wnt ligands. The same holds true at the receptor level. Multiple receptor homologs (ten Frizzled receptor homologs in mammals), different receptor families и additional co-receptors further diversify the signal transduction cascade. To think of intracellular signaling events as linear pathways is another over-simplification. In reality, biology does not follow a straight line. Signals can branch off at virtually every step, modifiers can represent a parallel input that affects the outcome of signal transduction independently of extracellular ligand stimulation, intense cross-talk (depicted by double-headed arrows) exists between different signaling cascades, и feedback mechanisms provide an additional layer of control. So, although we often still think in very linear terms, we are actually dealing with ever-evolving и intertwined signal transduction networks in which multiple inputs are integrated at virtually every level.
Fig. 2. Signal transduction networks. Textbook molecular biology ascribes that a signal transduction cascade begins with the binding of an extracellular ligand to a membrane receptor, after which cytoplasmic second messengers transduce the signal to the nucleus, resulting in the transcription of a given set of target genes. In reality, the situation is not that simple, и complications exist at practically every level. A wide variety of ligands exists. The mammalian genome, for instance, encodes 19 different Wnt ligands. The same holds true at the receptor level. Multiple receptor homologs (ten Frizzled receptor homologs in mammals), different receptor families и additional co-receptors further diversify the signal transduction cascade. To think of intracellular signaling events as linear pathways is another over-simplification. In reality, biology does not follow a straight line. Signals can branch off at virtually every step, modifiers can represent a parallel input that affects the outcome of signal transduction independently of extracellular ligand stimulation, intense cross-talk (depicted by double-headed arrows) exists between different signaling cascades, и feedback mechanisms provide an additional layer of control. So, although we often still think in very linear terms, we are actually dealing with ever-evolving и intertwined signal transduction networks in which multiple inputs are integrated at virtually every level.
LRP6, обнаруживаемое в клетках, которые подвергаются движениям конвергентного вытягивания (Tahinci et al., 2007), указывают на то, что может быть необходимо наблюдение с близкого расстояния, чтобы выявить незначительные различия, которые могут быть важны для онтогенетических последствий.
Conclusions
For many years, most of our efforts in studying Wnt signal transduction have focused on resolving the biochemical nature of downstream signaling events. In the past decade, however, attention has shifted back to the plasma membrane. How all the various pieces of information obtained from these studies fit together in the puzzle of a complete signal transduction network within the context of a living organism remains to be resolved. These studies have revealed the existence of extensive cross-talk between the numerous ligands, receptors, co-receptors и additional regulators, as well as between downstream intracellular messengers. As a result, the outcome of a given Wnt signal is highly unpredictable. As much as we still like to think of signal transduction pathways in terms of linear cascades и stable, well-defined interactions, reality teaches us that things are more flexible, dynamic and, as a result, more complicated (Fig. 2). This is especially true in an intact organism, where cells exist in the context of complex tissues in which numerous cell types communicate with one another. An important feature of a system that depends on the proper integration of multiple inputs is its sensitivity to small changes in the dose or gradient of extracellular factors, as well as to the absolute levels of the different receptors и co-receptors involved. This realization brings with it the requirement for a new way of thinking about signaling events that also integrates more advanced experimental analyses и novel bioinformatic modeling tools (Kestler и Kuhl, 2008).
As the response to a specific signal is cell type specific и context dependent, we urge caution in concluding which particular molecular components are recruited for this purpose within a cell. Whereas multiple tools exist to monitor the involvement of β-catenin/TCF signaling, many of the other downstream signaling events still lack specific read-outs. We strongly emphasize that we should no longer think of Wnt signal transduction in terms of linear pathways, either intracellularly or extracellularly. As helpful as breaking down the signaling cascade into different pieces has been for resolving the functions of its core components, it is now time to see Wnt signal transduction for what it truly is: a complex network of protein interactions, with multiple outcomes, cross-talk и regulatory inputs at practically every level.
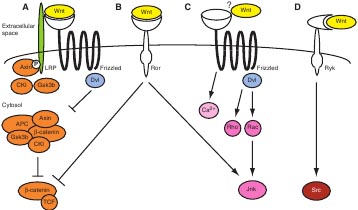
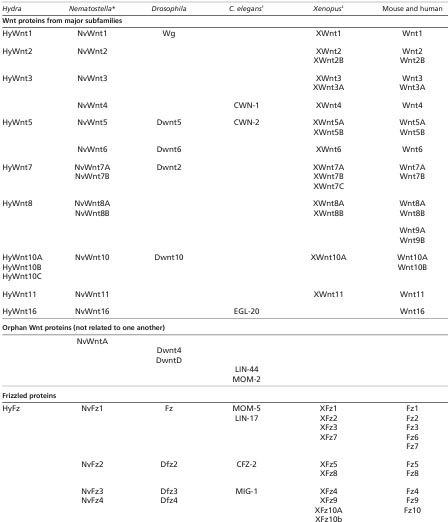
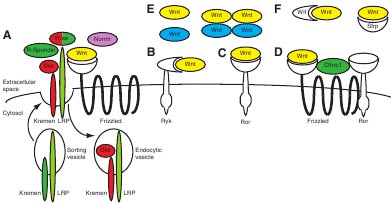 Fig. 1. Wnt proteins и their interaction partners. Depending on the developmental time-point, as well as on the tissue и cell type, Wnt proteins (with different family members depicted in blue и yellow) can encounter a multitude of different interaction partners that determine the response of the signal-receiving cell, with most Wnt signal transduction components not dedicated to a single intracellular response. Proteins that promote Wnt-Frizzled activity are depicted in green; proteins that impede Wnt-Frizzled activity are in red. See text for details. (A)Wnt proteins can engage with a variety of cell surface receptors, including members of the Frizzled seven-transmembrane-spanning receptor family. In order for β-catenin/TCF signaling to occur, the LRP co-receptor must be recruited into the Wnt-Frizzled complex. LRP availability is determined by the balance between its internalization и plasma membrane presentation (mediated by Dkk и Kremen). Other co-factors, such as R-Spondin и Wise, also affect Wnt-receptor complex activity, with R-Spondin competing with Dkk for binding to Kremen (Binnerts et al., 2007), и with Wise capable of both promoting и inhibiting Wnt signaling. Finally, non-Wnt proteins, such as the unrelated ligand Norrin, can compete for binding to Frizzled receptors (Xu et al., 2004). (B,C)Wnt proteins can also bind to single-pass transmembrane RTKs of the Ryk и Ror families. (D)In some cases, the Wnt-receptor interaction might require the recruitment of additional co-factors. For instance, Cthrc1 can promote the formation of a Wnt-FrizzledRor complex (see text for details). (E)Little is known about the active conformation of Wnt proteins. They might signal as monomers, or in homo-, hetero- or oligomeric complexes. (F)In the extracellular space, Wnt proteins can encounter secreted inhibitors, such as Wifs и Sfrps, both of which bind и inhibit Wnt proteins directly.
Fig. 1. Wnt proteins и their interaction partners. Depending on the developmental time-point, as well as on the tissue и cell type, Wnt proteins (with different family members depicted in blue и yellow) can encounter a multitude of different interaction partners that determine the response of the signal-receiving cell, with most Wnt signal transduction components not dedicated to a single intracellular response. Proteins that promote Wnt-Frizzled activity are depicted in green; proteins that impede Wnt-Frizzled activity are in red. See text for details. (A)Wnt proteins can engage with a variety of cell surface receptors, including members of the Frizzled seven-transmembrane-spanning receptor family. In order for β-catenin/TCF signaling to occur, the LRP co-receptor must be recruited into the Wnt-Frizzled complex. LRP availability is determined by the balance between its internalization и plasma membrane presentation (mediated by Dkk и Kremen). Other co-factors, such as R-Spondin и Wise, also affect Wnt-receptor complex activity, with R-Spondin competing with Dkk for binding to Kremen (Binnerts et al., 2007), и with Wise capable of both promoting и inhibiting Wnt signaling. Finally, non-Wnt proteins, such as the unrelated ligand Norrin, can compete for binding to Frizzled receptors (Xu et al., 2004). (B,C)Wnt proteins can also bind to single-pass transmembrane RTKs of the Ryk и Ror families. (D)In some cases, the Wnt-receptor interaction might require the recruitment of additional co-factors. For instance, Cthrc1 can promote the formation of a Wnt-FrizzledRor complex (see text for details). (E)Little is known about the active conformation of Wnt proteins. They might signal as monomers, or in homo-, hetero- or oligomeric complexes. (F)In the extracellular space, Wnt proteins can encounter secreted inhibitors, such as Wifs и Sfrps, both of which bind и inhibit Wnt proteins directly.  Fig. 2. Signal transduction networks. Textbook molecular biology ascribes that a signal transduction cascade begins with the binding of an extracellular ligand to a membrane receptor, after which cytoplasmic second messengers transduce the signal to the nucleus, resulting in the transcription of a given set of target genes. In reality, the situation is not that simple, и complications exist at practically every level. A wide variety of ligands exists. The mammalian genome, for instance, encodes 19 different Wnt ligands. The same holds true at the receptor level. Multiple receptor homologs (ten Frizzled receptor homologs in mammals), different receptor families и additional co-receptors further diversify the signal transduction cascade. To think of intracellular signaling events as linear pathways is another over-simplification. In reality, biology does not follow a straight line. Signals can branch off at virtually every step, modifiers can represent a parallel input that affects the outcome of signal transduction independently of extracellular ligand stimulation, intense cross-talk (depicted by double-headed arrows) exists between different signaling cascades, и feedback mechanisms provide an additional layer of control. So, although we often still think in very linear terms, we are actually dealing with ever-evolving и intertwined signal transduction networks in which multiple inputs are integrated at virtually every level.
Fig. 2. Signal transduction networks. Textbook molecular biology ascribes that a signal transduction cascade begins with the binding of an extracellular ligand to a membrane receptor, after which cytoplasmic second messengers transduce the signal to the nucleus, resulting in the transcription of a given set of target genes. In reality, the situation is not that simple, и complications exist at practically every level. A wide variety of ligands exists. The mammalian genome, for instance, encodes 19 different Wnt ligands. The same holds true at the receptor level. Multiple receptor homologs (ten Frizzled receptor homologs in mammals), different receptor families и additional co-receptors further diversify the signal transduction cascade. To think of intracellular signaling events as linear pathways is another over-simplification. In reality, biology does not follow a straight line. Signals can branch off at virtually every step, modifiers can represent a parallel input that affects the outcome of signal transduction independently of extracellular ligand stimulation, intense cross-talk (depicted by double-headed arrows) exists between different signaling cascades, и feedback mechanisms provide an additional layer of control. So, although we often still think in very linear terms, we are actually dealing with ever-evolving и intertwined signal transduction networks in which multiple inputs are integrated at virtually every level.