Spatial organization of intracellular communication: insights from imaging | ||
|
Signal transduction is the transfer of information about the compositional state of the extracellular environment to the intracellular cytoplasm that elicits a morphological or genetic response. In more general terms, this can also be the communication of the state of supramolecular structures, such as the plasma membrane or chromatin, in the cell. This information is relayed through space by the cytoplasm and is mediated by transitions between the steady states of the cytoplasm’s reaction networks. To uncover the principles that underlie the generation of spatiotemporal patterns of activity which guide cellular behaviour, functional imaging techniques that report on the activity of molecules must be combined with imaging techniques that report on the mobility of molecules
Dissipative system A dynamic system that operates far out of equilibrium and exchanges energy and matter with its environment. Stigmergy Derived from the Greek ‘stigma’, meaning mark or sign, and ‘ergon’, meaning work or action. This concept was used to describe termite mound construction, in which the work in progress provides marks for further work. Cytoplasmic state One of a limited number of dynamically maintained, inter-converting states of an intracellular signalling network that define distinct cellular behaviours. Fluorescence photobleaching Irreversible photo-destruction of fluorescent molecules by prolonged and/or intense illumination. Quantum dots Inorganic, semi-conductor crystals, which are used as alternatives to organic fluorophore dyes owing to their bright fluorescence and high photostability Diffraction pattern A pattern, forming by constructive and destructive interference, that occurs if waves encounter an obstacle or a medium with varying refractive index. The interference pattern sets a limit to resolve two closely spaced structures by optical methods. Total internal reflection fluorescence microscopy A microscopy method in which total reflection is used to generate an exponentially decaying evanescent wave at a glass–water interface, with a depth of 50–300 nm, to selectively excite fluorescent molecules near a surface. Multifocal plane microscopy An extension to standard microscopy techniques in which multiple images at distinct focal planes are recorded simultaneously to allow the accurate positioning of particles in 3D. Fluorescence correlation spectroscopy A microscopic method to measure diffusion coefficients and concentrations of fluorescent molecules by detecting their passage through a small volume generated by the focus of a confocal microscope. Fluorescence speckle microscopy A microscopy method to determine protein mobilities by substochiometric fluorescent labelling of intracellular supramolecular structures. Chromophore The part of a molecule that absorbs visible light and thereby provides colour to the molecule. If the molecule re-emits excited-state energy as light, it is also a fluorophore. Acceptor-sensitized emission Fluorescence emission of an acceptor fluorophore that is excited by FRET. Fluorescence lifetime imaging microscopy A microscopy method to image the excited state lifetimes of fluorophores. Solvatochromic dye A fluorophore that changes its spectral properties owing to a change in solvent polarity. Michaelis constant The substrate concentration atwhich the rate of an enzymatic reaction (that is governed by Michaelis–Menten kinetics) is at half of its maximal value. Michaelis–Menten kinetics A widespread model for saturable enzyme kinetics, described in Michaelis, L., Menten, M. L. Biochem. Z. 49, 333–369 (1913). Hysteresis A path-dependent lag in a dynamic process, which leads to an asymmetry in forward and backward transitions. Shmoo A tip structure (named after a cartoon character) involved in cell fusion of mating yeast that emerges after pheromone stimulation. Hydrodynamic radius The radius of a hypothetical solid sphere that has the theoretical diffusional mobility of a measured particle in a given solvent. Aster The star-shaped geometric arrangement of filaments. |
Живая материя характеризуется как оперирующая далеко от равновесного состояния, это означает, что она поддерживает свою организацию за счёт потребления энергии. Такие системы обозначаются как dissipative системы, которые отличаются от само-собирающихся систем, которые обладают стабильными структурами при энергетическом минимуме, напр.. кристаллы. Клетки являются диссипативными системами, состоящими из агентов (белков) в нанометровой шкале, которые могут самоорганизовываться в динамически поддерживаемые микроскопические паттерны. Локальные взаимодействия между агентами и флюктуации в их плотностях являются критическими компонентами для само-организации1.
Рассмотрим строительство термитника тысячами термитов. Ясно, что не существует проекта или лидера, для координации строительства этой сложной структуры, которая превышает продолжительность жизни индивидуальных агентов, которые её конструируют. Grasse описал в 1959 минимальную модель того, как термиты координируют свою строительную активность посредством средств коммуникаций когда идет работа, процесс он назвал stigmergy2. Этот процесс обнаруживает типичные компоненты само-организации: флюктуации в плотности термитов за счёт их случайных перемещений и локальных взаимодействий с катышами растительной земли, которые являются строительным материалом (FIG. 1). Термиты общаются посредством структур, которые строятся путем отложение феромонов на грязевых катушках, которые затем поднимаются, переносятся и опускаются случайно. Шансы поднятия грязевых катышков или опускания их на др. недавно отложенные катушки увеличиваются с концентрацией феромонов, которые генерируют локальную позитивную петлю обратной связи. Истощение грязевых катышков между областями отложения составляет дальнодействующую негативную систему обратной связи. Эта простая система, диктуемая правилами локального взаимодействия и флюктуациями в плотности термитов и катышков, генерирует структуру, состоящую из столбов с регулярными расстояниями3,4. Такое stigmeric взаимодействие между формированием пространственного паттерна и флюктуирующими агентами также происходит в клетках; напр., в сигнальной передаче, обеспечиваемой с помощью нейротрансмиттера GABA (γ-aminobutyric acid), который. помимо др. функций, регулирует хемотактическую ориентацию ростового конуса нейронов5 (FIG. 1). В этом случае флюктуирующими единицами являются микротрубочки в ростовом конусе, которые отбирают образцы среды путем постоянного роста и сокращения во всех направлениях, свойство наз. динамической нестабильностью 6. The GABAA receptor (GABAAR) постоянно перенаправляется в ростовой конус в результате временных взаимодействий со случайно растущими микротрубочками. Внеклеточный градиент GABA ориентирует рост ростового конуса путем соединения с GABAAR, в результате чего происходит локальное увеличение Ca2+ в цитоплазме. Этот Ca2+ затем локально увеличивает скорость роста и стабильность микротрубочек, вызывая большее транспортирование GABAAR в этом направлении и в конце концов увеличивая уровни локально высвобождаемого Ca2+ . Флюктуации в плотности микротрубочек т. о. локально умножаются в этой stigmergic системе обратной связи. Однако в этом случае внешние неравномерно распределенные матрицы(GABA градиент) оказывается воспринимаемым и амплифицируемым в ростовом конусе. Такие матрицы, которые приводят к процессам самоорганизации также присутствуют внутри клеток. Напр., хроматин передает сигналы о своём положении посредством градиента активности малых GTPase RAN микротрубочкам веретена и управляет самоорганизацией микротрубочек в веретено в этой области (see below). Интересно, что королева горы у термитов также передаёт сигналы о своём положении термитам
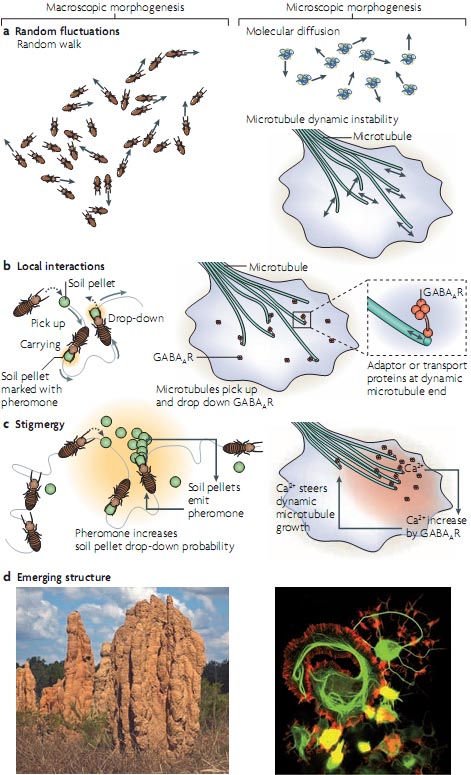 Figure 1 | Comparison of macroscopic and microscopic self-organization. a | Random walks of termites, diffusion of molecules or stochastic, alternating microtubule growth and shrinkage allow dynamic sampling of possible spatial configurations. b | Local interactions between agents, such as the termites or microtubule ends, and building blocks, such as soil pellets or transported GABAAR (γ-aminobutyric acid receptor), enable a dynamic building process based on exploratory fluctuations. c | If the building process itself can send positive feedback signals to the fluctuating entities (black arrows), a stigmergic growth process can be initiated. d | In termite building behaviour, the complex interplay of many dynamic processes involving stigmergy and other self-organizing processes aided by structural templates are thought to be responsible for the emergence of higher-order structures in the termite mound, without a blueprint. In cells, similar stigmergic building principles might be responsible for the emergence of cellular morphologies such as neurites. The figure shows neuroblastoma cells in which neurite protrusions were induced by the expression of the neuronal microtubule stabilizer microtubule-associated protein 2C (MAP2C; microtubules are shown in green and the actin cytoskeleton in red).
с помощью градиента феромона, вокруг которой описанные выше stigmergic термиты создают динамическую структуру, которая адаптирована к её размеру3. Следовательно, марицы, на которых структуры само-организуются, по-видимому, общий феномен для разных шкал.
Figure 1 | Comparison of macroscopic and microscopic self-organization. a | Random walks of termites, diffusion of molecules or stochastic, alternating microtubule growth and shrinkage allow dynamic sampling of possible spatial configurations. b | Local interactions between agents, such as the termites or microtubule ends, and building blocks, such as soil pellets or transported GABAAR (γ-aminobutyric acid receptor), enable a dynamic building process based on exploratory fluctuations. c | If the building process itself can send positive feedback signals to the fluctuating entities (black arrows), a stigmergic growth process can be initiated. d | In termite building behaviour, the complex interplay of many dynamic processes involving stigmergy and other self-organizing processes aided by structural templates are thought to be responsible for the emergence of higher-order structures in the termite mound, without a blueprint. In cells, similar stigmergic building principles might be responsible for the emergence of cellular morphologies such as neurites. The figure shows neuroblastoma cells in which neurite protrusions were induced by the expression of the neuronal microtubule stabilizer microtubule-associated protein 2C (MAP2C; microtubules are shown in green and the actin cytoskeleton in red).
с помощью градиента феромона, вокруг которой описанные выше stigmergic термиты создают динамическую структуру, которая адаптирована к её размеру3. Следовательно, марицы, на которых структуры само-организуются, по-видимому, общий феномен для разных шкал. Чтобы понять как информация перерабатывается клетками, чтобы вызывать изменения в их морфологии, необходимо знать, как подвижность и локальные взаимодействия молекул наномолекулярных размеров приводят к созданию внутриклеточных паттернов на микрометровой шкале. Как затем отображаются молекулярные процессы в сигнальной трансдукции, чтоб помочь нам лучше понять переработку информации клетками? На фундаментальном уровне флюктуации в позиции молекул внутри клетки могут осуществляться за счет диффузии, (BOX 1), которая аналогична случайным перемещениям термитов, описанных выше10. Альтернативные пути перемещения молекул включают процессы динамического роста и механизмы транспорта, управляемые молекулярными моторами. Наблюдения за флюоресцентными биосенсорами позволяют измерять паттерны молекулярной активности в клетках. Однако из-за динамического взаимодействия между реактивностью и подвижностью молекул, наблюдения таких паттернов самих по себе не выявляет фундаментальных механизмов их образования. Чтобы получить доступ к этим фундаментальным молекулярным процессам сигнальной трансдукции, которые передают информацию (белковые активности) через пространство (за счет подвижности белков), измерения активностей необходимо комбинировать с оптическими методами, которые позволяют измерять подвижность белков внутри клеток. Microscopic imaging of protein mobility Внутриклеточная подвижность белков может быть сильно гетерогенной в пространстве и времени. Следовательно, микроскопические методы необходимы для картирования этого свойства в клетках. Два концептуально различных способа оценки подвижности белков - это измерение транспорта больших масс и измерение подвижности на уровне одиночных частиц.
Measurements of protein ensemble mobility. Подвижность больших масс белков может быть определена с помощью photoconversion флюоресцентно меченных молекул в определенных регионах и последующего измерения восстановления или дисперсии флюоресценции. В последнее время это было достигнуто с помощью fluorescence photobleaching, с использованием высокой силы света, чтобы обратимо разрушать яркие флюорофоры и затем измерять динамику восстановления флюоресценции11,12. FIGURE 2a иллюстрирует использование недавно разработанного photoactivatable13 и
Box 1 | Intracellular communication by diffusion or directional transport
|
Changes in the extracellular environment are usually transmitted in the cell through changes in the conformation or association of intracellular proteins. In the simplest case, the information contained in the state of these proteins is transmitted through space by their diffusional mobility. According to Fick's first law of diffusion, the mass transfer J of such a protein through an area is proportional to the gradient of its concentration (that is, the change of concentration δc per change in position δx): J = -D δc/δx.
The proportionality factor is called the diffusion coefficient D. If this component is an active form of a signal molecule, J also represents the transfer of signalling information in space. Fick's second law of diffusion, δc/δt = Dδ2/δx2
, describes the change of concentration gradients over time δc/δt, which is proportional to the second derivative (that is, the curvature) of the protein concentration δ2c/δx2. For the initial conditions of a point source of material and the border conditions of finite amount of material n0 in a three-dimensional (3D) volume, a solution of Fick's second law can be found, which describes the concentration at the distance x from the point source over time: c(x,t) = n0/8(πDt)3/2 exp(-x2/4Dt). From this equation, the mean square displacement can be derived by volume integration:
The average radius (r) that is sampled by randomly diffusing molecules at a given time is:  Efficient mass transport of proteins over longer distances (for example, fast axonal transport) is typically achieved by directional transport along cytoskeletal tracks116. Wave propagation uses efficient coupling of many rapid small-scale diffusion processes with reactions114. In this case, the cytoplasm is viewed as an excitable medium. This is analogous to a fire spreading in the dry grass of a savannah. Classical examples in cell biology include electrical signal propagation in axons118 and Ca2+ waves in oocytes119. Similar rapid propagation mechanisms were also proposed for kinase-phosphatase reaction cycles at growth factor receptors in the plasma membrane. Thus, to understand how information travels through space, two molecular properties in cells need to be analyzed: diffusion and reaction. In the graph, ? indicates proportionality. GFP, green fluorescent protein.
Efficient mass transport of proteins over longer distances (for example, fast axonal transport) is typically achieved by directional transport along cytoskeletal tracks116. Wave propagation uses efficient coupling of many rapid small-scale diffusion processes with reactions114. In this case, the cytoplasm is viewed as an excitable medium. This is analogous to a fire spreading in the dry grass of a savannah. Classical examples in cell biology include electrical signal propagation in axons118 and Ca2+ waves in oocytes119. Similar rapid propagation mechanisms were also proposed for kinase-phosphatase reaction cycles at growth factor receptors in the plasma membrane. Thus, to understand how information travels through space, two molecular properties in cells need to be analyzed: diffusion and reaction. In the graph, ? indicates proportionality. GFP, green fluorescent protein. |
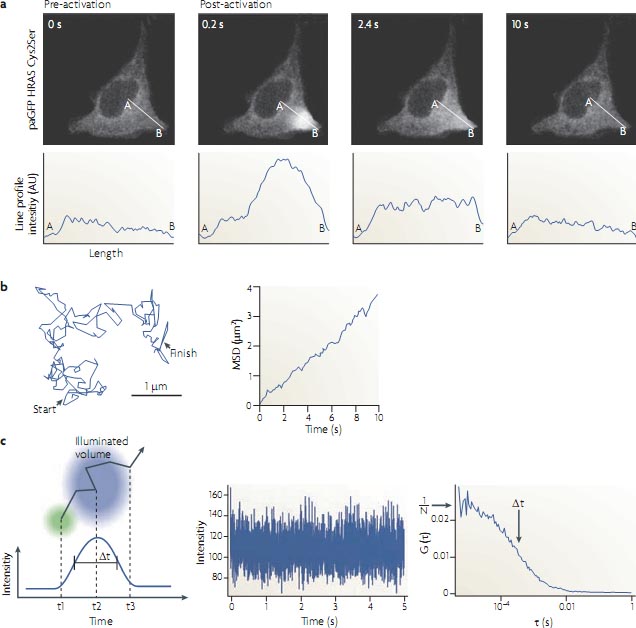
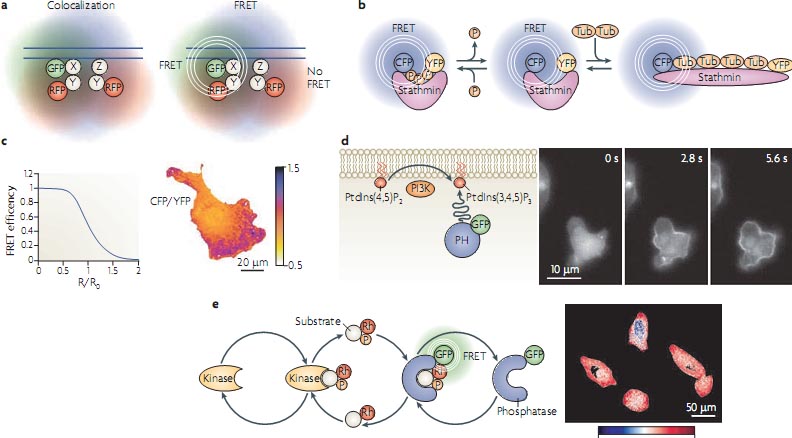
 Figure 4 | Kinase-phosphatase reaction cycles. a | Diagrams of kinase activation (input) and the corresponding substrate phosphorylation response. Michaelian-Menten kinetics of the kinase and phosphatase reaction in the cycle lead to high sensitivity in response to kinase activation (ultrasensitivity). Additional positive feedback from the phosphorylated substrate to the kinase leads to a discontinuity in the dose response and irreversibility. b | In quiescent conditions, intracellular phosphatase activity maintains a low net phosphorylation state of receptor Tyr kinases (RTKs) that have a basal kinase activity (1). Extracellular ligand binding increases the kinase activity of the RTKs, shifting the balance towards more phosphorylated receptors (2). Endocytosed receptors maintain their signalling activity (3) until endosomes reach a perinuclear area, where increased phosphatase activity shifts the balance back to dephosphorylated receptors (4). Straight lines are causalities, curved lines represent chemical conversions and thick arrows indicate increased enzyme activity. Transparent RTKs denote low abundance.
более стабильного интерфазного состояния на высоко динамичное митотическое состояние. Состояние активности сигнальной сети, в которую эти регуляторы внедрены, может быть интерпретировано как состояние цитоплазмы. Биохимическое описание цитоплазматического состояния и понимание его влияния на клеточное поведение в контексте регуляции микротрубочек был внесено в исследовании яйцевых экстрактов X. laevis. В этом исследовании переход между цитоплазматическими состояниями регуляторов микротрубочек измерялось путем наблюдения динамики взаимодействий множественных белков в экстрактах посредством рекрутирования флюоресцентных жертвенных (prey) белков на наживку в виде белком покрытых кусочков77.
Figure 4 | Kinase-phosphatase reaction cycles. a | Diagrams of kinase activation (input) and the corresponding substrate phosphorylation response. Michaelian-Menten kinetics of the kinase and phosphatase reaction in the cycle lead to high sensitivity in response to kinase activation (ultrasensitivity). Additional positive feedback from the phosphorylated substrate to the kinase leads to a discontinuity in the dose response and irreversibility. b | In quiescent conditions, intracellular phosphatase activity maintains a low net phosphorylation state of receptor Tyr kinases (RTKs) that have a basal kinase activity (1). Extracellular ligand binding increases the kinase activity of the RTKs, shifting the balance towards more phosphorylated receptors (2). Endocytosed receptors maintain their signalling activity (3) until endosomes reach a perinuclear area, where increased phosphatase activity shifts the balance back to dephosphorylated receptors (4). Straight lines are causalities, curved lines represent chemical conversions and thick arrows indicate increased enzyme activity. Transparent RTKs denote low abundance.
более стабильного интерфазного состояния на высоко динамичное митотическое состояние. Состояние активности сигнальной сети, в которую эти регуляторы внедрены, может быть интерпретировано как состояние цитоплазмы. Биохимическое описание цитоплазматического состояния и понимание его влияния на клеточное поведение в контексте регуляции микротрубочек был внесено в исследовании яйцевых экстрактов X. laevis. В этом исследовании переход между цитоплазматическими состояниями регуляторов микротрубочек измерялось путем наблюдения динамики взаимодействий множественных белков в экстрактах посредством рекрутирования флюоресцентных жертвенных (prey) белков на наживку в виде белком покрытых кусочков77. 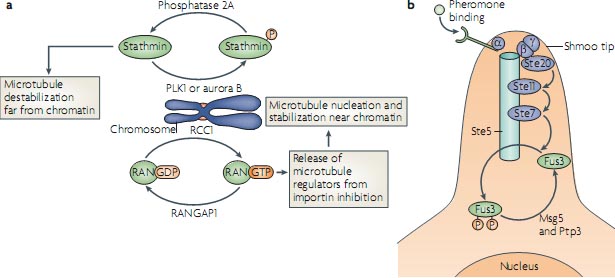 Figure 5 | gradients generate local cytoplasmic states, which steer morphological processes. a | Stathmin (also known as OP18) and RAN activity gradients around chromatin are generated by reaction cycles involving chromatin-bound activators (the kinases Polo-like kinase 1 (PLK1) and aurora B, and the RAN exchange factor regulator of chromosome condensation 1 (RCC1)) and cytosolic inactivators (phosphatase 2A and RAN GTPase-activating protein 1 (RANGAP1)) to generate local cytoplasmic states that promote self-organized spindle building by local control of microtubule dynamics. b | Mitogen-activated protein kinase (MAPK) activity gradients in the pheromone response of budding yeast. The Ste5 scaffold protein localizes pheromone-induced phosphorylation of the yeast MAPK Fus3 to the shmoo tip (the phosphorylated Fus3 level is indicated in orange in the cytoplasm and nucleus). The homogenously distributed phosphatases Msg5 and Ptp3 dephosphorylate Fus3 globally. Dissociation and diffusion of phosphorylated Fus3 induces the formation of activity gradients, which propagate signals from the shmoo tip and define local cytoplasmic states дифференцировк, β and γ are the subunits of trimeric GTP-binding proteins, and Ste20, Ste11 and Ste7 are kinases in a phosphorylation cascade.
состоящего из importin-β и and importin-β-связывающих доменов7,80. Взаимодействие RAN-GTP с importin-β запускает высвобождение nuclear localization signal (NLS)-содержащих регуляторов микротрубочек, которое косвенным образом было измерено в этих исследованиях (FIG. 5a). Прямые количественные измерения градиента взаимодействия между флюоресцентно нагруженным RAN и importin-β с помощью FLIM измерений FRET, комбинировали с доступными кинетическими данными, это позволило создать компьютерную модель функционально важного градиента свободных NLS-содержащих регуляторов микротрубочек, который оказался сходным по размеру с митотическим веретеном9. Этот градиент активности, как было установлено, влияет на нуклеацию микротрубочек и стабилизацию на разных расстояниях от хроматина, подтверждая тем самым идею, что градиенты активности локальных цитоплазматических состояний, которые управляют динамикой микротрубочек вокруг хроматина во время морфогенеза веретена81,82. Градиент фосфорилирования регулятора микротрубочек stathmin вокруг хроматина,был показан, используя fluor escent protein-based конформационный сенсор (discussed above)52 (FIG. 3b).
Figure 5 | gradients generate local cytoplasmic states, which steer morphological processes. a | Stathmin (also known as OP18) and RAN activity gradients around chromatin are generated by reaction cycles involving chromatin-bound activators (the kinases Polo-like kinase 1 (PLK1) and aurora B, and the RAN exchange factor regulator of chromosome condensation 1 (RCC1)) and cytosolic inactivators (phosphatase 2A and RAN GTPase-activating protein 1 (RANGAP1)) to generate local cytoplasmic states that promote self-organized spindle building by local control of microtubule dynamics. b | Mitogen-activated protein kinase (MAPK) activity gradients in the pheromone response of budding yeast. The Ste5 scaffold protein localizes pheromone-induced phosphorylation of the yeast MAPK Fus3 to the shmoo tip (the phosphorylated Fus3 level is indicated in orange in the cytoplasm and nucleus). The homogenously distributed phosphatases Msg5 and Ptp3 dephosphorylate Fus3 globally. Dissociation and diffusion of phosphorylated Fus3 induces the formation of activity gradients, which propagate signals from the shmoo tip and define local cytoplasmic states дифференцировк, β and γ are the subunits of trimeric GTP-binding proteins, and Ste20, Ste11 and Ste7 are kinases in a phosphorylation cascade.
состоящего из importin-β и and importin-β-связывающих доменов7,80. Взаимодействие RAN-GTP с importin-β запускает высвобождение nuclear localization signal (NLS)-содержащих регуляторов микротрубочек, которое косвенным образом было измерено в этих исследованиях (FIG. 5a). Прямые количественные измерения градиента взаимодействия между флюоресцентно нагруженным RAN и importin-β с помощью FLIM измерений FRET, комбинировали с доступными кинетическими данными, это позволило создать компьютерную модель функционально важного градиента свободных NLS-содержащих регуляторов микротрубочек, который оказался сходным по размеру с митотическим веретеном9. Этот градиент активности, как было установлено, влияет на нуклеацию микротрубочек и стабилизацию на разных расстояниях от хроматина, подтверждая тем самым идею, что градиенты активности локальных цитоплазматических состояний, которые управляют динамикой микротрубочек вокруг хроматина во время морфогенеза веретена81,82. Градиент фосфорилирования регулятора микротрубочек stathmin вокруг хроматина,был показан, используя fluor escent protein-based конформационный сенсор (discussed above)52 (FIG. 3b). 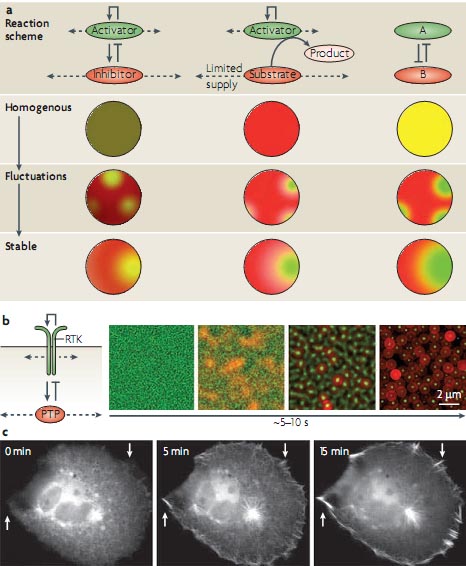 Figure 6 | Self-organization in intracellular pattern formation and structural growth processes. a | Coupling of reaction-diffusion mechanisms with positive feedback regulation can lead to the emergence of stable patterns from homogenous mixtures through intermediate, self-amplifying random fluctuations. The classical Turing model describes a system with short-range activation coupled to long-range inhibition (left). The substrate depletion variant of the Turing model does not require an explicit inhibitor (middle). Mutual inhibition is an alternative to self-amplification and can also produce positive feedback and the emergence of patterns from homogenously distributed activity states (right). b | Cellular automaton simulation for hypothetical Turing-based pattern formation of receptor Tyr kinase (RTK) activity. RTKs (green) are autocatalytic, membrane-associated, slowly diffusing activators of their own rapidly diffusing inhibitor, a protein Tyr phosphatase (PTP; red). Within ~ 5-10 seconds, spotted RTK activity patterns on a micrometre scale emerge spontaneously from fluctuations in a homogenous RTK activity distribution. c | Force-mediated positive feedback in a stigmergic morphological growth process can lead to the focusing of pushing forces into cell protrusions in a model system for neurite initiation. White arrows indicate foci in which the membrane curvature is locally increased by microtubule clustering. Image in part b is courtesy of M. Schmick, Max Planck Institute, Dortmund, Germany. Image in part c is reproduced, with permission, from REF. 113 © (2006) Springer.
Figure 6 | Self-organization in intracellular pattern formation and structural growth processes. a | Coupling of reaction-diffusion mechanisms with positive feedback regulation can lead to the emergence of stable patterns from homogenous mixtures through intermediate, self-amplifying random fluctuations. The classical Turing model describes a system with short-range activation coupled to long-range inhibition (left). The substrate depletion variant of the Turing model does not require an explicit inhibitor (middle). Mutual inhibition is an alternative to self-amplification and can also produce positive feedback and the emergence of patterns from homogenously distributed activity states (right). b | Cellular automaton simulation for hypothetical Turing-based pattern formation of receptor Tyr kinase (RTK) activity. RTKs (green) are autocatalytic, membrane-associated, slowly diffusing activators of their own rapidly diffusing inhibitor, a protein Tyr phosphatase (PTP; red). Within ~ 5-10 seconds, spotted RTK activity patterns on a micrometre scale emerge spontaneously from fluctuations in a homogenous RTK activity distribution. c | Force-mediated positive feedback in a stigmergic morphological growth process can lead to the focusing of pushing forces into cell protrusions in a model system for neurite initiation. White arrows indicate foci in which the membrane curvature is locally increased by microtubule clustering. Image in part b is courtesy of M. Schmick, Max Planck Institute, Dortmund, Germany. Image in part c is reproduced, with permission, from REF. 113 © (2006) Springer.