Рыбки данио предоставляют редкую возможность визуализовать и количественно оценить в реальном времени микроскопическое развитие живого глаза. В биологии зрительной системы необходим эффективный оптический элемент из прозрачной, преломляющей свет, коллагенозной роговицы и дифференцировка симметричного, преломляющего свет хрусталика, состоящего из прозрачных клеток. Синхронизованная пролиферация, миграция и элонгация дифференцирующихся клеток хрусталиковых волокон, которые резистентны к стрессам изменяющегося клеточного окружения без сосудистой сети, иннервации или лимфатических сосудов регулируются генетическими механизмами. Поскольку биологические хрусталики часто рассматривают как неодушевленный оптический элемент, сходный с искусственным хрусталиком или синтетическим фокусирующим элементом в камере, микроскопе или телескопе, нет ничего более ошибочного. Хрусталик уникален как единственная прозрачная клеточная ткань у позвоночных. Микроскопические технологии для исследования генетических основ дифференцировки живых клеток в хрусталике позвоночных необходимы для характеристики динамики симметричного роста и развития хрусталика in vivo. Данное исследование проверяло гипотезу, что мультифотонное построение изображения с использованием трансгена palmitoylated cyan флюоресцентного белка в качестве мембранной метки в глазах живых рыбок данио представляет собой технологическое преимущество, необходимое для пространственно-временного анализа in vivo прогрессивных изменений в структуре дифференцирующихся хрусталиковых волокон из хрусталиковой плакоды в симметричные, преломляющие свет хрусталики. Рыбки данио обладают уникальными преимуществами перед др. моделями позвоночных для изучения зрительной системы (Schmitt and Dowling, 1994; Easter and Nicola, 1996; Glass and Dahm, 2004; Fadool and Dowling, 2008). Быстрое развитие вне матки, прозрачность ранних эмбрионов, высокое воспроизведение и относительно легкие генетические манипуляции позволяют экспериментальные исследования in vivo , которые невозможны у млекопитающих. Одним из самых больших преимуществ рыбок данио является их способность осуществлять в реальном времени построение клеточных картин у живых, развивающихся эмбрионов.
Хрусталик позвоночных начинается с утолщения поверхности эктодермы, чтобы сформировать хрусталиковую плакоду (Lang, 2004; Lovicu and Robinson, 2004; Vihtelic, 2008; Schoenwolf and Larsen, 2009). Хрусталиковая плакода млекопитающих и птиц подвергается инвагинации и отшнуровывается от поверхностной эктодермы в виде полого хрусталикового пузырька. Клетки задней половины пузырька удлиняются, чтобы заполнить полость пузырька и дифференцируются в клетки первичных волокон. Клетки передней половины узелка становятся передним эпителием хрусталика. Эпителиальные клетки пролиферируют и мигрируют по периферии к экватору, где начинают скоординировано удлиняться и дифференцируются в прозрачные вторичные хрусталиковые волокна. Удлиняющиеся волокна отсоединяются от хрусталиковой капсулы и формируют слои вторичных волокон, окружающие эмбриональные первичные волокна в ядро хрусталика. Синхронизированное развитие трех типов хрусталиковых клеток, т.е. , переднего эпителия, первичных и вторичных волокон является императивом для формирования прозрачного, симметричного, преломляющего хрусталика, который по своим свойствам сходен у взрослых рыбок данио и млекопитающих (Dahm et al., 2007; Greiling and Clark, 2008).
Поскольку немногие впечатляющие гистологические исследования иллюстрируют раннее развитие хрусталика рыбок данио (Glass and Dahm, 2004; Soules and Link, 2005; Dahm et al., 2007), то многие детали нуждаются в выяснении, при этом хрустали рыбок данио имеет некоторые важные отличия от хрусталика человека во время раннего развития. Вместо инвагинации и образования пузырька хрусталик рыбок данио развивается как плотная масса клеток, которая отслаивается от поверхностной эктодермы (Schmitt and Dowling, 1994; Easter and Nicola, 1996). Этот процесс развития и дифференцировки эпителия хрусталика, первичных волокон и вторичных волокон без стадии хрусталикового пузырька остается плохо изученным. Наблюдение за развитием живого позволяет анализировать легкие фенотипические изменения, создаваемые генными мутациями и морфантами, которые лучше всего воспроизводят болезни человека и старение и могут быть легко пропущены из-за искажений, вносимых обычными гистологическими разредами.
В данной работе приводится впервые системное, высокого разрешения, количественное в реальном времени трёххмерное описание развития хрусталика у живых позвоночных от стадии плакоды в 16 hours postfertilization (hpf) до 4 days postfertilization (dpf). Получение картин живых клеток дает прямое и прогрессивное представление становления первичных волокон, переднего эпителия и вторичных волокон во время развития симметричного прозрачного хрусталика. Эктодермальные клетки в цефалическом плакодном утолщении, пролиферируют и преобразуются в первичные волокна развивающегося стержня хрусталика без стадии образования пузырька. Нет доказательств апоптоза как механизма отщепления и отшнуровки хрусталика рыбок данио от поверхности эктодермы. Продукция новых вторичных волокон увеличивает диаметр хрусталика с ростом глаз рыбок данио. Наблюдение за развитием первичных волокон и пролиферацией, миграцией и элонгацией вторичных волокон позволяет непосредственно видеть у живого позвоночного процесс дифференцировки, который включает фундаментальные стадии эпителиально-мезенхимного перехода и имеет множество сходств с развитием хрусталика человека. Исследование подкрепляется преимуществами наблюдения за живыми клетками и подготавливает почву для будущего анализа структурных исследований механизмов, ответственных за клеточную дифференцировку при формировании прозрачного, симметричного и преломляющего хрусталика. responsible for cellular differentiation in formation of a transparent, symmetric, and refractile lens.
DISCUSSION
Хотя структура и функция взрослого хрусталика рыбок данио напоминает зрелый хрусталик человека в отношении симметрии, рефракции, прозрачности и оптической функции, наблюдаются разные механизмы раннего структурного развития. Хрусталик рыбок данио начинается с хрусталиковой плакоды, как и у млекопитающих и после постепенного отслоения округляется. чтобы сформировать сферическую плотную массу клеток, которая отделяется от развивающейся роговицы, чтобы сформировать явственный хрусталик спустя 24 ч после оплодотворения. Хрусталиковый пузырёк, которыей характерен для хрусталиков млекопитающих, не обнаруживается. Суммарная диаграмма дифференцировки живых клеток у живого позвоночного характеризует три типа клеток на базе 3D live-cell imaging (Fig. 10). Хрусталиковая плакода формируется на 16 hpf в виде слоя столбчатого эпителия (purple мембраны), который удлиняется вертикально в развивающиеся первичные волокна (голубые мембраны) на ст.
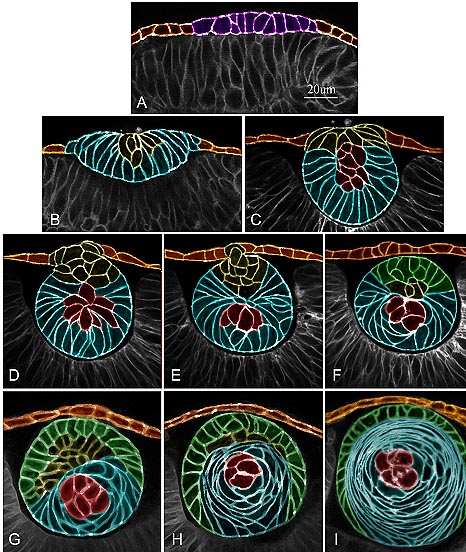 Fig. 10. Summary diagram representing the progressive stages of lens development in the zebrafish from the placode to spherical lens and the presumptive cellular differentiation at each stage. The corresponding threedimensional (3D) movie of each 2D image can be referenced for more detail. Cell membranes have been pseudocolored. A: At approximately16 hours postfertilization (hpf), the cells in the surface ectoderm are orange, and the cells in the lens placode are purple. See Supp. Movie S1. B: At 18 hpf, elongating fiber-like cells are blue. See Supp. Movie S2. C: At 20 hpf, the cells in the organizing center (red) of the delaminating and elongated lens mass are surrounded by columnar primary fiber cells (blue). See Supp. Movie S3. D-F: At 22 hpf, 23 hpf, and 24 hpf, respectively, delamination completes the separation of the spherical lens from the developing cornea. Morphologically undifferentiated cells at the anterior surface of the lens mass (yellow) appeared to reorganize and lose adhesion contacts with the surface ectoderm. See Supp. Movies S4-S6. G: After delamination, at approximately 24 hpf, the anterior epithelium (green) began to form. See Supp. Movie S7A. H: At 28 hpf, a transitional zone corresponding to the bow region in the mammal was located on the posterior half of the lens. See Supp. Movie S7B. I: By approximately 36 hpf, a complete anterior epithelium (green) was in direct contact with the underlying fiber cells (blue). An umbilical suture appeared at the posterior pole and the transitional region was observed laterally where the epithelium was found. See Supp. Movie S7C. The white bar in A represents 20 m; all images to same scale.
Fig. 10. Summary diagram representing the progressive stages of lens development in the zebrafish from the placode to spherical lens and the presumptive cellular differentiation at each stage. The corresponding threedimensional (3D) movie of each 2D image can be referenced for more detail. Cell membranes have been pseudocolored. A: At approximately16 hours postfertilization (hpf), the cells in the surface ectoderm are orange, and the cells in the lens placode are purple. See Supp. Movie S1. B: At 18 hpf, elongating fiber-like cells are blue. See Supp. Movie S2. C: At 20 hpf, the cells in the organizing center (red) of the delaminating and elongated lens mass are surrounded by columnar primary fiber cells (blue). See Supp. Movie S3. D-F: At 22 hpf, 23 hpf, and 24 hpf, respectively, delamination completes the separation of the spherical lens from the developing cornea. Morphologically undifferentiated cells at the anterior surface of the lens mass (yellow) appeared to reorganize and lose adhesion contacts with the surface ectoderm. See Supp. Movies S4-S6. G: After delamination, at approximately 24 hpf, the anterior epithelium (green) began to form. See Supp. Movie S7A. H: At 28 hpf, a transitional zone corresponding to the bow region in the mammal was located on the posterior half of the lens. See Supp. Movie S7B. I: By approximately 36 hpf, a complete anterior epithelium (green) was in direct contact with the underlying fiber cells (blue). An umbilical suture appeared at the posterior pole and the transitional region was observed laterally where the epithelium was found. See Supp. Movie S7C. The white bar in A represents 20 m; all images to same scale.
18 hpf. Дискообразная хрусталиковая масса начинает округляться после 20 hpf с изменением морфологии клеток дифференцирующихся первичных волокон, исходящих лучами кзади и латерально от центрального кластера округлившихся клеток. Удлиняющиеся первичные хрусталиковые волокна закручиваются вокруг кластера округлых клеток в сердцевину эмбрионального хрусталикового ядра (красные мембраны). Отсоединение хрусталиковой массы от роговицы (orange membranes) происходит в период примерно 19-24 hpf. Во время этого периода клетки на передней поверхности хрусталиковых масс (yellow membranes) реорганизуются и, по-видимому, теряют адгезивные контакты с поверхностной эктодермой. Апоптоза не наблюдается в этих клетках. После отсоединения клетки на передней поверхности хрусталика формируют одиночный слой кубовидного эпителия (green membranes). Группа морфологически недифференцированных клеток глубже переднего эпителия (yellow membranes) на ст. 24 hpf, по-видимому, подвергается апоптозу или дифференцируется так, что к 36 hpf, передний эпителий покрывает приблизительно 7/8 поверхности хрусталика и находится в непосредственном контакте с подлежащими клетками волокон. Как только устанавливается передний эпителий, то клетки вторичных волокон удлиняются и мигрируют из переходной области, расположенной позади экватора. Задний шов становится видимым на 48 hpf и образуется раньше переднего шва (suture), это сходно с развитием эмбрионального хрусталика кур, у которых задний шов формируется на 6 день эмбриогенеза, на 1-2 дня раньше переднего suture (Shestopalov and Bassnett, 2000). Полный связующий шов (suture) очевиден на 3 dpf, когда хрусталик становится функциональным оптическим элементом зрительного пути (Easter and Nicola, 1996).
Образование клеток первичных волокон это первое отличие между развитием хрусталика у рыбок данио и млекопитающих. Первичные волокна у млекопитающих находятся позади эпителиальных клеток, которые удлиняются, чтобы заполнить хрусталиковый пузырёк. Как только начинается элонгация, то клетки первичных волокон выходят из клеточного цикла (McAvoy, 1978; Lovicu and McAvoy, 1999). В отсутствие хрусталикового пузырька формирование первичных волокон нуждается в переопределении. Наблюдение живых клеток показывает, что первичные волокна в хрусталике рыбок данио возникают из хрусталиковой плакоды и реорганизуются, чтобы сформировать слои, окружающие клетки сердцевины эмбрионального хрусталика или "организующий центр" Неизвестно, выходят ли эти клетки из клеточного цикла. Наблюдение за живыми клетками демонстрирует, что вторичные волокна начинают формироваться в переходной зоне приблизительно в 28-36 hpf, так что все волокна, образуются прежде этой стадии являются первичными волокнами (которые не дифференцируются из переднего эпителия). Организация первичных волокон в ядро хрусталика рыбок данио совершенно отлична от образования ядра хрусталика у эмбрионов млекопитающих.
Напротив образование и морфология клеток вторичных волокон сходны у рыбок данио и млекопитающих. У рыбок данио вторичные хрусталиковые волокна формируются из пролиферативной зоны переднего эпителия и мигрируют в направлении заднего полюса хрусталика, где они удлиняются, чтобы сформировать полукруглые слои, окружающие первичные волокна. Вторичные волокна удлиняются и мигрируют из переходной зоны и организуются симметричным способом, чтобы сформировать связующий suture. Подобно хрусталикам взрослых (Dahm et al., 2007), положение переходной / изогнутой области в эмбриональном хрусталике рыбок данио располагается позади экватора скорее, чем на экваторе как у млекопитающих. Как результат задняя переходная зона оказывается такой, что передняя элонгация вторичных волокон больше, чем задняя элонгация, это может объяснить появление заднего suture прежде переднего suture. Неизвестно, расположена ли пролиферативная зона переднего эпителия или нет более кзади, чем у млекопитающих.
Наиболее очевидны отличием между млекопитающими и рыбками данио это отсутствие стадии хрусталикового пузырька. Было предположено, что др. рыбы и амфибии также образуют сплошные хрусталики скорее, чем хрусталиковые пузырьки (Dahm et al., 2007). Отсутствие стадии пузырька у рыбок данио не уникально. У них и нервная "трубка", оптический "пузырёк" и отический "пузырёк" формируются как сплошные массы клеток, которые позднее подвергаются кавитации, чтобы сформировать просвет (Schmitt and Dowling, 1994; Haddon and Lewis, 1996; Lowery and Sive, 2004). Даже в очень раннем эмбриогенезе бластоцист рыбок данио лишен бластоцеля, а гаструла лишена первичной кишки (archenteron) (Kimmel et al., 1995). Сходный генетический механизм может быть ответственен за отсутствие образования полостей как общее свойство органогенеза у рыбок данио. Процесс отшнуровки хрусталика от поверхностной эктодермы является ещё одним отличием. Предыдущие исследования показали, что отделение хрусталиковой массы связано с апоптозом клеток между 24-26 hpf (Soules and Link, 2005; Dahm et al., 2007). Данное in vivo исследование установило, что отделение хрусталика от роговицы пошаговый процесс между 19 hpf и 24 hpf когда хрусталик округляется, а соединяющая хрусталик и роговицу ножка постепенно уменьшается в толщине, преимущественно за счёт изменений адгезивных контактов в плоть до полного разделения. Апоптические клетки не обнаруживались в соединяющей ножке. Этот процесс, по-видимому, аналогичен инвагинации и отшнуровке хрусталикового пузырька у млекопитающих, хотя хрусталиковая масса рыбок данио это сплошной шар из клеток, который округляется и отшнуровывается. Хотя апоптические клетки не обнаруживались между хрусталиком и роговицей, множественные небольшие апоптические тела наблюдались на передней поверхности хрусталика начиная с 18-22 hpf,, по-видимому, они находились в перидерме, которая покрывает эмбрион с 3.5 hpf вплоть до 48 hpf и, по-видимому, устраняется приблизительно во время вылупления эмбриона (Kimmel et al., 1990). Перидерма это специализированный поверхностный эпителий, происходящий из покрывающего слоя, который не вносит вклада в какие-либо взрослые ткани у млекопитающих и не экспрессирует mCFP (который управляется с помощью энхансера Pax6) подобно поверхностной эктодерме головы и сетчатке. Тесные взаимоотношения между апоптическими телами и поверхностью развивающегося хрусталика д. указывать на то, что апоптоз появляется в хрусталике с 18-22 hpf. Апоптоз, по-видимому, появляется в клетках в глубине поверхностного эпителия с 23-28 hpf. Необходимы дальнейшие эксперименты, чтобы подтвердить эту гипотезу и выяснить роль апоптоза в развитии хрусталика рыбок данио.
Количественные результаты динамического роста хрусталик или др. тканей могут быть оценены только при наблюдении живых клеток. Преимущества наблюдений над живыми клетками рыбок данио в быстром преобразовании от плакоды доя симметричного, прозрачного, преломляющего хрусталика. Только наблюдение за живыми клетками позволяет количественно оценить динамику дифференцировки, развития роста в реальном времени. В хрусталике рыбок данио наблюдаются три компонента в кривой роста. Один компонент коррелирует с экспансией плакоды во время первых нескольких часов развития. С продолжением роста второй компонент коррелирует с отшнуровкой от поверхностной эктодермы и образованием массы хрусталика. Третий компонент кривой роста коррелирует с медленным прогрессивным ростом функционального хрусталика. Количественная оценка кривых роста пригодна для оценки специфических молекулярных и генетических механизмов, которые могут оказывать едва уловимые воздействия на нормальную дифференцировку и рост развивающегося прозрачного хрусталика у рыбок данио, это важное преимущество по сравнению с описательными методами в анализе взаимоотношений генотип-фенотип.
Основным препятствием в биологии это количественная оценка взаимоотношений между структурными вариациями и клеточными адаптациями в тканевом росте и развитии, регулируемых с помощью экспрессии генов. Кстати, генетические и молекулярные подходы оказываются непригодны для выяснения механизмов регуляции динамических вариаций в дифференцировке, это обусловлено структурными специализациями и симметрией клеточной структуры прозрачного и преломляющего хрусталика. Сегодня гипотеза рефракции является единственной теорией, касающейся молекулярной генетики прозрачности и преломляющей силы биологической оптики (Piatigorsky, 2001, 2008). Краеугольным камнем гипотезы рефракции является то, что хрусталик и роговица накапливают разные, таксон-специфические мультифункциональные белки с помощью стратегии владения совместных генов (gene sharing), которая вносит вклад в оптические свойства обеих тканей. Характеристика их общих генетических механизмов, таких как gene sharing, можно ожидать расширит наше понимание фундаментальных генетических процессов, вносящих вклад в прозрачность биологических клеток и тканей. Рыбки данио обладаю уникальными экспериментальными преимуществами, которые делают их выдающейся моделью для изучения количественных признаков развития прозрачного хрусталика.
The preliminary quantitative structural studies presented in this report begin the systematic correlation of phenotypic reorganization with development to help elucidate the fundamental mechanisms responsible for the establishment and maintenance of a symmetric, refractile, transparent optical element in the visual system of a living vertebrate animal.
Сайт создан в системе
uCoz Fig. 10. Summary diagram representing the progressive stages of lens development in the zebrafish from the placode to spherical lens and the presumptive cellular differentiation at each stage. The corresponding threedimensional (3D) movie of each 2D image can be referenced for more detail. Cell membranes have been pseudocolored. A: At approximately16 hours postfertilization (hpf), the cells in the surface ectoderm are orange, and the cells in the lens placode are purple. See Supp. Movie S1. B: At 18 hpf, elongating fiber-like cells are blue. See Supp. Movie S2. C: At 20 hpf, the cells in the organizing center (red) of the delaminating and elongated lens mass are surrounded by columnar primary fiber cells (blue). See Supp. Movie S3. D-F: At 22 hpf, 23 hpf, and 24 hpf, respectively, delamination completes the separation of the spherical lens from the developing cornea. Morphologically undifferentiated cells at the anterior surface of the lens mass (yellow) appeared to reorganize and lose adhesion contacts with the surface ectoderm. See Supp. Movies S4-S6. G: After delamination, at approximately 24 hpf, the anterior epithelium (green) began to form. See Supp. Movie S7A. H: At 28 hpf, a transitional zone corresponding to the bow region in the mammal was located on the posterior half of the lens. See Supp. Movie S7B. I: By approximately 36 hpf, a complete anterior epithelium (green) was in direct contact with the underlying fiber cells (blue). An umbilical suture appeared at the posterior pole and the transitional region was observed laterally where the epithelium was found. See Supp. Movie S7C. The white bar in A represents 20 m; all images to same scale.
Fig. 10. Summary diagram representing the progressive stages of lens development in the zebrafish from the placode to spherical lens and the presumptive cellular differentiation at each stage. The corresponding threedimensional (3D) movie of each 2D image can be referenced for more detail. Cell membranes have been pseudocolored. A: At approximately16 hours postfertilization (hpf), the cells in the surface ectoderm are orange, and the cells in the lens placode are purple. See Supp. Movie S1. B: At 18 hpf, elongating fiber-like cells are blue. See Supp. Movie S2. C: At 20 hpf, the cells in the organizing center (red) of the delaminating and elongated lens mass are surrounded by columnar primary fiber cells (blue). See Supp. Movie S3. D-F: At 22 hpf, 23 hpf, and 24 hpf, respectively, delamination completes the separation of the spherical lens from the developing cornea. Morphologically undifferentiated cells at the anterior surface of the lens mass (yellow) appeared to reorganize and lose adhesion contacts with the surface ectoderm. See Supp. Movies S4-S6. G: After delamination, at approximately 24 hpf, the anterior epithelium (green) began to form. See Supp. Movie S7A. H: At 28 hpf, a transitional zone corresponding to the bow region in the mammal was located on the posterior half of the lens. See Supp. Movie S7B. I: By approximately 36 hpf, a complete anterior epithelium (green) was in direct contact with the underlying fiber cells (blue). An umbilical suture appeared at the posterior pole and the transitional region was observed laterally where the epithelium was found. See Supp. Movie S7C. The white bar in A represents 20 m; all images to same scale.