Морфогенез тканей зависит от механизмов само-регулировки, которые буферируют генетические и средовые отклонения. За исключением само-регуляторной передачи сигналов bone morphogenetic protein (BMP) во время гаструляции, механизмы обеспечивающие развитие позвоночных в основном неизвестны (1, 2). Зачатки конечностей позвоночных являются классической моделью для изучения органогенеза, их развитие управляется с помощью сигнальных взаимодействий между двумя инструктивными центрами (3, 4). Sonic hedgehog (SHH)/Gremlin1 (GREM1)/ fibroblast growth factor (FGF) петля обратной связи (5-7) координирует передачу сигналов SHH с помощью мезенхимной zone of polarizing activity (ZPA) с передачей сигналов FGF с помощью apical ectodermal ridge (AER) (4,8-10). В зачатках конечностей Grem1-дефицитных мышей, эта петля обратной связи не устанавливается, это нарушает оба сигнальных центра и дистальное развитие, т.к. выявляется слияние ulna и radius
и потеря пальцев (Fig. 1 A). Предыдущие исследования (5-7) показали, что GREM1-обусловленный антагонизм мезенхимных BMPs является ключевым для SHH-обеспечиваемой спецификации пальцев 2 - 5 и пролиферативной экспансии пальцевой территории (autopod) (8,10). Три BMP лиганда экспрессируются в зачатках конечностей (fig. SI) (11), а генетические исследования показали, что передача сигналов мезенхимных BMP ингибирует переднюю экспансию экспрессии AER-Fgf и Polydactyly (формирование дополнительных пальцев) (12, 13) и что минимальный порог BMP необходим для инициации хондрогенеза задних пальцев (14,15).
Чтобы идентифицировать BMP лиганд(ы), которым противодействует GREM1, мы осуществляли скрининг генетических взаимодействий у эмбрионов мышей. Уменьшение вдвое доз генов Bmp2 или Bmp7 лишь слегка улучшало развитие конечностей (Fig. 1A), тогда как инактивация одного аллеля Bmp4 восстанавливала zeugopod (ulna и radius) и наиболее задние пальцы (Fig. IB) (n = 24/24). Полная инактивация Bmp7 приводила к сходному восстановлению (fig. S2), это указывает на то. что GREM1 может снижать общую активность BMP. Перекрестная регуляция между BMP лигандами вряд ли возможна . т.к. генетическое уменьшение одного Bmp не меняло экспрессии др. (figs. SI and S2). Развитие задних конечностей также восстанавливалось, но мы показываем только передние конечности, т.к. молекулярные альтерации в зачатках Grem1Δ/Δ конечностей лечше всего охарактеризованы в передних конечностях (5-7). Кроме того, Prxl-Cre трансген был активен в зачатках передних конечностей на ранних стадиях.
Т.к. генетическое снижение Bmp4 у Grem1Δ/Δ эмбрионов было наиболее мощным, мы использовали гипоморфный floxed Bmp4 аллель (Bmp4hf) (16) с пониженной активностью (fig. S1). чтобы редуцировать дозу Bmp4 гена постепенно. В этой аллельной серии развитие передних конечностей восстанавливалось всё в большей степени в проксимо-дистальном направлении и в последовательности сзади кпереди (Fig. IB). В частности низкие уровни Bmp4 восстанавливают pentadactyly в Grem1Δ/ΔBmp4Δ/hf зачатках конечностей (Fig.1B) (n = 10/14). Приблизительно треть этих конечностей имеют 5 почти нормальных пальцев [Fig. 1B, right-most panel (n = 3/10) и fig. S3], тогда как пальцы 2 и 3 остаются проксимально слитыми у всех остальных [Fig. 1B (n = 7/10) и fig. S3]. Это восстановление скорее всего является следствием восстановления клеточной жизнеспособности и дистальных 5 ' Hoxd доменов экспрессии. которые нарушаются в зачатках Grem1-дефицитных конечностей (fig. S4) (5-7).
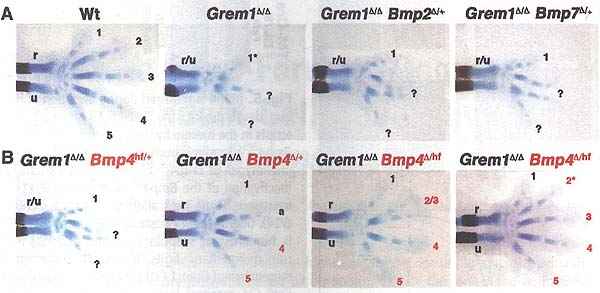 Fig. 1. Genetic reduction of BMP4 preferentially restores Gremi-deficient forelimb buds. Alcian blue and alizarin red stained skeletal preparations of mouse forelimbs at E14.5. Digit identities are indicated by numbers 1 (thumb, anterior) to 5 (little finger, posterior). Fused digits 2 and 3 are indicated as "2/3," digits with unclear anterior identity (digit 2 or 3) as "a," and hypoplastic digits with an asterisk. Question marks indicate digits with unknown identity, a hallmark of Greml-deficient limbs, r, radius; u, ulna; r/u, fused radius and ulna. (A) Wt, wild-type; 6remlAIA, Grem1 deficient; Grem1Δ/ΔBmp2Δ/+and Grem1Δ/ΔBmp7Δ/+embryos heterozygous for Bmp2 or Bmp7, respectively. (B) Allelic series to reduce the Bmp4 gene dosage in a stepwise manner in Grem1Δ/Δ forelimbs using both the hypomorphic Bmp4hf and loss-of-function Bmp4Δ alleles. The activity of the Bmp4hf allele is reduced to slightly less than 50% (fig. S1). Digit identities were determined using morphological criteria in combination with carpal elements and Sox9 expression (fig. S3). Digits with restored identity are indicated in red. All panels are oriented anterior to the top and posterior to the bottom.
Fig. 1. Genetic reduction of BMP4 preferentially restores Gremi-deficient forelimb buds. Alcian blue and alizarin red stained skeletal preparations of mouse forelimbs at E14.5. Digit identities are indicated by numbers 1 (thumb, anterior) to 5 (little finger, posterior). Fused digits 2 and 3 are indicated as "2/3," digits with unclear anterior identity (digit 2 or 3) as "a," and hypoplastic digits with an asterisk. Question marks indicate digits with unknown identity, a hallmark of Greml-deficient limbs, r, radius; u, ulna; r/u, fused radius and ulna. (A) Wt, wild-type; 6remlAIA, Grem1 deficient; Grem1Δ/ΔBmp2Δ/+and Grem1Δ/ΔBmp7Δ/+embryos heterozygous for Bmp2 or Bmp7, respectively. (B) Allelic series to reduce the Bmp4 gene dosage in a stepwise manner in Grem1Δ/Δ forelimbs using both the hypomorphic Bmp4hf and loss-of-function Bmp4Δ alleles. The activity of the Bmp4hf allele is reduced to slightly less than 50% (fig. S1). Digit identities were determined using morphological criteria in combination with carpal elements and Sox9 expression (fig. S3). Digits with restored identity are indicated in red. All panels are oriented anterior to the top and posterior to the bottom.
Чтобы отследить BMP активность, мы оценивали транскрипцию Msx2, непосредственной и ранней мишени сигнальной трансдукции BMP в зачатках конечностей (11). Экспрессия Msx2 повышалась примерно вдвое в мезенхиме Grem1-дефицитных зачатков конечностей, тогда как она была снижена до уровней дикого типа в зачатках Grem1Δ/ΔBmp4Δ/hf конечностей (Fig. 2A and fig. S5). Экспрессия Shh и экспрессия AER-Fgf были существенно снижены в зачатках конечностей. дефицитных по Grem1 (5-7), но частично восстанавливались в Grem1Δ/ΔBmp4Δ/hf зачатках конечностей (Fig. 2B and fig. S5). Т.о., аберрантно высокая активность BMP4 в Grem1Δ/Δ зачатках конечностей противодействует развитию дистальных частей конечностей и спецификации качественных особенностей пальцев за счет вмешательства транскрипционной позитивной регуляции f ZPA-SHH (8-10) и передачи сигналов AER-FGF (4) .
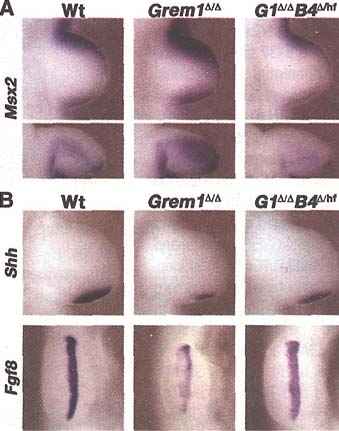 Fig. 2. Restoration of signaling in Grem1Δ/ΔBmp4Δ/hf limb buds. (A) Detection of Msx2 transcripts by in situ hybridization in wild-type, Grem1Δ/Δ and Grem1Δ/ΔBmp4Δ/hf (G1Δ/ΔB4Δ/hf) forelimb buds (35 somites). Bottom panels show posterior views (dorsal, top; ventral, bottom) of the limb buds in the top panels. (B) Detection of Shh (top, 37 somites) and Fgf8 (bottom, 36 somites) transcripts.
Fig. 2. Restoration of signaling in Grem1Δ/ΔBmp4Δ/hf limb buds. (A) Detection of Msx2 transcripts by in situ hybridization in wild-type, Grem1Δ/Δ and Grem1Δ/ΔBmp4Δ/hf (G1Δ/ΔB4Δ/hf) forelimb buds (35 somites). Bottom panels show posterior views (dorsal, top; ventral, bottom) of the limb buds in the top panels. (B) Detection of Shh (top, 37 somites) and Fgf8 (bottom, 36 somites) transcripts.
Чтобы проверить эти взаимодействия, мы инактивировали один Shh аллель у Grem1-дефицитных эмбрионов с редуцированной дозой гена Bmp4. При всем остальном контексте дикого типа инактивация одного аллеля Shh оказывалась полностью компенсированной (Fig. 3A). Напротив, гетерозиготность Shh вызывала потерю переднего пальца в Grem1Δ/ΔBmp4Δ/hf зачатках конечностей, скорее всего как следствие дальнейшего снижения трансдукции SHH сигналов (Fig. 3B) (n = 12/12). Идентифицируемые как задние, пальцы были потеряны у ShhΔ/+Grem1Δ/ΔBmp4Δ/+ эмбрионов в сочетании даже более низкой трансдукцией SHH и повышенной трансдукцией BMP сигналв (Fig. 3C) (n = 6/8). Эти результаты указывают на то, что BMP и SHH активности противодействуют одна др. и устанавливают, что передача сигналов интактной epithelial-mesenchymal (e-m) обратной связи забуферивает гетерозиготность по Shh (Fig. 3 A), тогда как её нарушение вызывает чувствительность к дозе гена Shh (Fig. 3, B and C).
Сходным образом, снижение дозы только гена
Bmp4 не меняет формирования паттерна скелета конечностей (fig. S6). Однако экспрессия
Grem1 редуцируется в зачатках конечностей Bmp4
Δ/hf (Fig. 4A, B), это забуферивает сигнальную трансдукцию BMP так, что Msx2 затрагивается лишь слегка, а Shh остается нормальным (fig. S6). Известно, что BMPs позитивно регулируют экспрессию своего антагониста Grem1 (17, 18), но функциональное значение этого само-регуляторного взаимодействия остается неясным. Чтобы определить кинетику, с помощью которой BMP4 и SHH совместно регулируют экспрессию
Grem1 (5, 6,18), сферические частицы носителя, смоченные рекомбинантными лигандами. были имплантированы в культивируемые мышиные зачатки конечностей. Инициальная реакция на BMP4
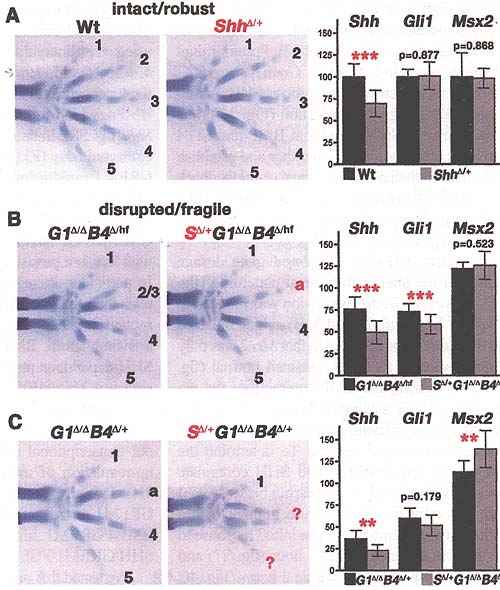 Fig. 3. Heterozygosity for Shh is no longer compensated in Grem1Δ/ΔBmp4Δ/hf
and Grem1Δ/ΔBmp4Δ/+ limb buds (ShhΔ/+Grem1Δ/ΔBmp4Δ/hf и
Shh Δ/+Grem1Δ/ΔBmp4Δ/+. Left and middle panels, fore-limb skeletons at E14.5; right panels, QPCR quantification of the Shh, Gli1, and Msx2 transcript levels; bare represent the average of nine limb bud pairs (34 to 38 somites) with SDs. (A) Heterozygosity for Shh (ShhΔ/+)
does not affect digit specification or Gli1 and Msx2 transcription when e-m feedback signaling is intact (B and C) Disruption of e-m feedback signaling renders digit specification and SHH and BMP signal transduction (assessed by Gli1 and Msx2 transcript levels) sensitive to the Shh gene dosage. The genotypes are indicated for Shh (S), Grem1 (G1), and Bmp4 (B4) as follows: G1Δ/ΔB4Δ/hf, Grem1Δ/ΔBmp4Δ/hf; SΔ /+G1Δ/ΔB4Δ/+, ShhΔ/+Grem1Δ/ΔBmp4Δ/+; G1Δ/ΔB4Δ/+, Grem1Δ/ΔBmp4Δ/+; SΔ/+G1Δ/ΔB4Δ/+, ShhΔ/+Grem1Δ/ΔBmp4Δ/+.
Shh transcription is reduced about 30% when one Shh allele is inactivated Error bars ± SD *** , p < 0.001; P<0.01
Fig. 3. Heterozygosity for Shh is no longer compensated in Grem1Δ/ΔBmp4Δ/hf
and Grem1Δ/ΔBmp4Δ/+ limb buds (ShhΔ/+Grem1Δ/ΔBmp4Δ/hf и
Shh Δ/+Grem1Δ/ΔBmp4Δ/+. Left and middle panels, fore-limb skeletons at E14.5; right panels, QPCR quantification of the Shh, Gli1, and Msx2 transcript levels; bare represent the average of nine limb bud pairs (34 to 38 somites) with SDs. (A) Heterozygosity for Shh (ShhΔ/+)
does not affect digit specification or Gli1 and Msx2 transcription when e-m feedback signaling is intact (B and C) Disruption of e-m feedback signaling renders digit specification and SHH and BMP signal transduction (assessed by Gli1 and Msx2 transcript levels) sensitive to the Shh gene dosage. The genotypes are indicated for Shh (S), Grem1 (G1), and Bmp4 (B4) as follows: G1Δ/ΔB4Δ/hf, Grem1Δ/ΔBmp4Δ/hf; SΔ /+G1Δ/ΔB4Δ/+, ShhΔ/+Grem1Δ/ΔBmp4Δ/+; G1Δ/ΔB4Δ/+, Grem1Δ/ΔBmp4Δ/+; SΔ/+G1Δ/ΔB4Δ/+, ShhΔ/+Grem1Δ/ΔBmp4Δ/+.
Shh transcription is reduced about 30% when one Shh allele is inactivated Error bars ± SD *** , p < 0.001; P<0.01
обнаруживалась в течение 1 ч (fig. S7), а Grem1 позитивно регулировался в течение 2-го часа (Fig. 4C and fig. S7), тогда как SHH понадобилось около 6 ч (Fig. 4D). В свою очередь, GREM1 необходим минимально в течение 6 ч, чтобы активировать AER-Fgfs (fig. S7). Т.о., SHH/GREM1/FGF петля обратной связи (5-7) оперирует внутри промежутка времени приблизительно в 12 ч, тогда как BMP4/GREM1 модуль обратной связи примерно в 6 раз быстрее (Fig. 4E). Временная динамика этих dual-time петель обратной связи была стимулирована с использованием обыкновенного дифференциального уравнения (Fig. 4, F to H) (15, 19) , чтобы проверить свойства лежащей в основе сети. Это моделирование указывает на то, что BMP4, который действует выше Grem1 и Shh (fig. S8), инициирует экспрессию
Grem1 примерно на стдии эмбриогенеза (E) 9.0 (Fig. 4F). Это увеличение GREM1 быстро понижает активность BMP4, это в свою очередь, позволяет увеличиваться SHH, GREM1 и AER-FGF активностям (т.e., установлению SHH/ GREM1/FGF передачи сигналов обратной связи) в комбинации с низкой, но персистирующей активностью BMP4 (Fig. 4F). В частности, эти уравнения позволили симулировать восстановление активности SHH в компаундных мутантных зачатках конечностей (fig. S9). Эти результаты подчеркивают переключение с BMP4-зависимой инициации на SHH-зависимый прогресс передачи морфогенетических сигналов (Fig. 4F). В самом деле, модель без позитивной регуляции Grem1 с помощью BMP4 неспособна к инициации (Fig. 4G), в то время как моделирование без транскрипционного сигнала от SHH всё ещё неспособно активировать передачу морфогенетических сигналов (Fig. 4H). Этот анализ выявляет BMP антагониста GREM1 как критический узел (20), связывающий быстро BMP4/GREM1 инициаторный модуль с более медленной SHH/GREMl/FGF петлей обратной связи.
Мы протестировали предсказанную ранее потребность в BMP4 с помощью Prxl-Cre обусловленной инактивации гипоморфного аллеля Bmp4
hf у Bmp4
Δ/hf эмбрионов. Это приводило к специфической потере экспрессии
Bmp4 в мезенхиме передних конечностей приблизительно на E9.0 (Fig. 5A and fig. S10) (21) и к тяжелому укорочению скелета передних конечностей (Fig. 5B). Эта ранняя потеря
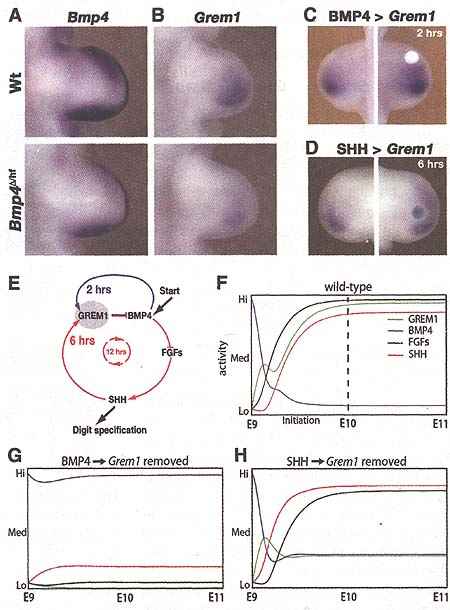 Fig. 4. GREMl-mediated interlinking of a fast GREM1/ BMP4 module with the slower SHH/GREM1/FGF feedback loop. (A and B) Genetic lowering of Bmp4 is compensated by down-regulation of Greml expression at E10.75 (37 somites). (C and D) Differential transcriptional regulation of Grem1 by BMP4 (C) and SHH (D).(C)BAAP4 induces Greml within 2 hours.
(D) SHH induces Greml within 6 hours. (E) Scheme depicting how the GREM1 transcriptional node (shaded gray) interlinks the BMP4/GREM1 module and SHH/GREM1/FGF feedback loop. (F) Computer-aided simulations of the signaling activities in wild-type limb buds. The starting BMP4 activity was defined as high (Hi), whereas GREM1, SHH, and FGF are low (Lo). The initial increase of GREM1 is controlled by BMP4, whereas the second phase is controlled by SHH. Steady-state levels are reached by E10.0 and are characterized by high SHH/GREM1/FGF feedback loop and low BMP4/GREM1 module activities. (G) Disruption of BMP4-mediated up-regulation of Greml. (H) Disruption of SHH-mediated up-regulation of Grem1.
Fig. 4. GREMl-mediated interlinking of a fast GREM1/ BMP4 module with the slower SHH/GREM1/FGF feedback loop. (A and B) Genetic lowering of Bmp4 is compensated by down-regulation of Greml expression at E10.75 (37 somites). (C and D) Differential transcriptional regulation of Grem1 by BMP4 (C) and SHH (D).(C)BAAP4 induces Greml within 2 hours.
(D) SHH induces Greml within 6 hours. (E) Scheme depicting how the GREM1 transcriptional node (shaded gray) interlinks the BMP4/GREM1 module and SHH/GREM1/FGF feedback loop. (F) Computer-aided simulations of the signaling activities in wild-type limb buds. The starting BMP4 activity was defined as high (Hi), whereas GREM1, SHH, and FGF are low (Lo). The initial increase of GREM1 is controlled by BMP4, whereas the second phase is controlled by SHH. Steady-state levels are reached by E10.0 and are characterized by high SHH/GREM1/FGF feedback loop and low BMP4/GREM1 module activities. (G) Disruption of BMP4-mediated up-regulation of Greml. (H) Disruption of SHH-mediated up-regulation of Grem1. Bmp4 нарушает
Grem1 (Fig. 5C), Shh активацию (figs. S10 и SI 1) и образование функционального AER , что определяется по аберрантной или отсутствию экспрессии Fgf8 (Fig. 5D). Предсказываемая временная потребность в BMP4 была изучена путем инактивации в специфические моменты времени с использованием tamoxifen-индуцибельного Cre трансгена (22). Инактивация со ст. E8.75 и нарушает образование AER formation (Fig. 5E), тогда как инактивация со ст. E9.25 не нарушает более образования AER и экспрессии
Shh (Fig. 5F and fig. S10). Однако , экспрессия
Fgf8 была расширена в этих зачатках передних конечностей (Fig. 5F), указывая тем самым, что сохранение низкой активности BMP4/GREM1 модуля необходимо для ограничения длины AER. Это так, потому что передняя экспансия передачи сигналов AER-FGF вызывает полидактилию пальцев (12). Т.о., BMP4 действует
в мезенхиме, чтобы инициировать экспрессию Grem1 и передачу сигналов в эктодерму. чтобы регулировать формирование эктодермы и длину AER. Мезодермальные BMP4 сигналы скорее всего трансдуцируются в AER с помощью BMP рецептора 1А (BMPR1A) т.к. ранняя AER-специфичная инактивация приводит к сходному нарушению образования AER, тогда как более поздняя инактивация нарушает передачу сигналов AER-
Fgf (23,24). Эта ранняя потребность в BMP4 (Fig. 5) возможно была упущена в предыдущих исследованиях, т.к. Bmp4 не инактивируется достаточно рано (15). В мезенхиме зачатка конечности сигналы BMP4 скорее всего трансдуцируются с помощью BMPR1A , т.к. его специфичная для мезенхимы инактивация нарушает позитивную регуляцию Grem1 и развитие дистальных частей конечности (17).
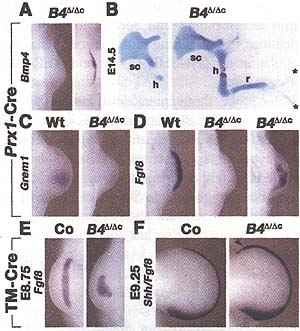 Fig. 5. BMP4 is required during initiation of limb bud development. (A) Detection of Bmp4 transcripts in the mesenchyme (left) and AER (right) of BmpΔ/Δ forelimb buds (26 somites). (B) Skeletal phenotypes of BmpΔ/Δc forelimbs at E14.5 after inactivation of the Bmp4hf allele by the Prxl-Cre transgene. (Left) Truncation distal to scapula (n = 8/14). (Right) Loss of posterior elements in = 6/14). h, humerus; sc, scapula; r, radius; asterisks indicate rudimentary digits. (C and D) Detection of mesenchymal Greml (28 somites, n = 6) and AER-Fgf8 (26 somites) transcripts at E9.75. Note the patchy Fgf8 expression in = 8/10) or loss of Fgf8 expression (n = 2/10). (E) Tamoxifen (TM)-Cre mediated inactivation of Bmp4 by tamoxifen injection at about E8.75, i.e., before initiation of forelimb bud development. Detection of Fgf8 transcripts in forelimb buds at E10.25 (32 somites, n = 6). Control, TM-Cre heterozygous embryo. (F) Detection of Shh and FgfS transcripts in forelimb buds at E11.75 (50 somites) after tamoxifen injection at E9.25, i.e., after initiation of forelimb bud development (n = 4). Arrowhead points to the anterior expansion of FgfS expression in Bmp4Δ/Δc forelimb buds. Control: fBmp4Δc/+4TM-Cre forelimb bud.
Fig. 5. BMP4 is required during initiation of limb bud development. (A) Detection of Bmp4 transcripts in the mesenchyme (left) and AER (right) of BmpΔ/Δ forelimb buds (26 somites). (B) Skeletal phenotypes of BmpΔ/Δc forelimbs at E14.5 after inactivation of the Bmp4hf allele by the Prxl-Cre transgene. (Left) Truncation distal to scapula (n = 8/14). (Right) Loss of posterior elements in = 6/14). h, humerus; sc, scapula; r, radius; asterisks indicate rudimentary digits. (C and D) Detection of mesenchymal Greml (28 somites, n = 6) and AER-Fgf8 (26 somites) transcripts at E9.75. Note the patchy Fgf8 expression in = 8/10) or loss of Fgf8 expression (n = 2/10). (E) Tamoxifen (TM)-Cre mediated inactivation of Bmp4 by tamoxifen injection at about E8.75, i.e., before initiation of forelimb bud development. Detection of Fgf8 transcripts in forelimb buds at E10.25 (32 somites, n = 6). Control, TM-Cre heterozygous embryo. (F) Detection of Shh and FgfS transcripts in forelimb buds at E11.75 (50 somites) after tamoxifen injection at E9.25, i.e., after initiation of forelimb bud development (n = 4). Arrowhead points to the anterior expansion of FgfS expression in Bmp4Δ/Δc forelimb buds. Control: fBmp4Δc/+4TM-Cre forelimb bud.
Наш анализ предоставляет доказательства, что соединение быстрого и само-регулирующегося BMP4/GREM1инициаторного модуля с более медленной SHH/GREM1/FGF петлей обратной связи составляет критический компонент системы формирования паттерна конечностей. Эта система контролирует самоотключающуюся спецификацию качественных особенностей пальцев путем координации противоположных активностей SHH и BMP4. Хотя генетический анализ на мышах не выявил основной роли BMP2 and BMP7 в системе формирования паттерна конечностей, описанной здесь, они, по-видимому, вносят вклад в их защищенность и могут иметь большее отношение к развитию конечностей у др. видов позвоночных (18, 25). Др. интересный аспект петли обратной связи SHH/GREM1/FGF связан с её само-определяющими свойствами, т.к. расширение популяции Shh производных устойчиво к экспрессии Grem1, это в конечном итоге нарушает передачу сигналов e-m обратной связи и развитие autopod (18, 26). Эта устойчивость вызывается активацией ингибирующей FGF/GREM1 петли обратной связи у Shh производных (27). Моделирование показывает, что система передачи сигналов в конечностях прогрессирует само-регуляторным способом от BMP4-зависимой инициации посредством SHH-зависимой спецификации пальцев и роста (фаза умножения) до FGF-индуцируемого завершения (fig. SI2). Это происходит из-за дифференциального воздействия сигнальной трансдукции BMP4, SHH и FGF на экспрессию Grem1 с течением времени. Наконец. наш анализ показывает, как изменчивость может быть компенсирована с помощью т.наз. распределенной выносливости (28) , обусловленной взаимосвязанностью между различными сигнальными путями, а не просто за счет компенсаций внутри путей. Во время эволюции тетрапод тонкая настройка сигнальных взаимодействий, описанная здесь, может вносить вклад в оформление и стабилизацию пятипалости autopod (15).
Сайт создан в системе
uCoz  Fig. 1. Genetic reduction of BMP4 preferentially restores Gremi-deficient forelimb buds. Alcian blue and alizarin red stained skeletal preparations of mouse forelimbs at E14.5. Digit identities are indicated by numbers 1 (thumb, anterior) to 5 (little finger, posterior). Fused digits 2 and 3 are indicated as "2/3," digits with unclear anterior identity (digit 2 or 3) as "a," and hypoplastic digits with an asterisk. Question marks indicate digits with unknown identity, a hallmark of Greml-deficient limbs, r, radius; u, ulna; r/u, fused radius and ulna. (A) Wt, wild-type; 6remlAIA, Grem1 deficient; Grem1Δ/ΔBmp2Δ/+and Grem1Δ/ΔBmp7Δ/+embryos heterozygous for Bmp2 or Bmp7, respectively. (B) Allelic series to reduce the Bmp4 gene dosage in a stepwise manner in Grem1Δ/Δ forelimbs using both the hypomorphic Bmp4hf and loss-of-function Bmp4Δ alleles. The activity of the Bmp4hf allele is reduced to slightly less than 50% (fig. S1). Digit identities were determined using morphological criteria in combination with carpal elements and Sox9 expression (fig. S3). Digits with restored identity are indicated in red. All panels are oriented anterior to the top and posterior to the bottom.
Fig. 1. Genetic reduction of BMP4 preferentially restores Gremi-deficient forelimb buds. Alcian blue and alizarin red stained skeletal preparations of mouse forelimbs at E14.5. Digit identities are indicated by numbers 1 (thumb, anterior) to 5 (little finger, posterior). Fused digits 2 and 3 are indicated as "2/3," digits with unclear anterior identity (digit 2 or 3) as "a," and hypoplastic digits with an asterisk. Question marks indicate digits with unknown identity, a hallmark of Greml-deficient limbs, r, radius; u, ulna; r/u, fused radius and ulna. (A) Wt, wild-type; 6remlAIA, Grem1 deficient; Grem1Δ/ΔBmp2Δ/+and Grem1Δ/ΔBmp7Δ/+embryos heterozygous for Bmp2 or Bmp7, respectively. (B) Allelic series to reduce the Bmp4 gene dosage in a stepwise manner in Grem1Δ/Δ forelimbs using both the hypomorphic Bmp4hf and loss-of-function Bmp4Δ alleles. The activity of the Bmp4hf allele is reduced to slightly less than 50% (fig. S1). Digit identities were determined using morphological criteria in combination with carpal elements and Sox9 expression (fig. S3). Digits with restored identity are indicated in red. All panels are oriented anterior to the top and posterior to the bottom.  Fig. 2. Restoration of signaling in Grem1Δ/ΔBmp4Δ/hf limb buds. (A) Detection of Msx2 transcripts by in situ hybridization in wild-type, Grem1Δ/Δ and Grem1Δ/ΔBmp4Δ/hf (G1Δ/ΔB4Δ/hf) forelimb buds (35 somites). Bottom panels show posterior views (dorsal, top; ventral, bottom) of the limb buds in the top panels. (B) Detection of Shh (top, 37 somites) and Fgf8 (bottom, 36 somites) transcripts.
Fig. 2. Restoration of signaling in Grem1Δ/ΔBmp4Δ/hf limb buds. (A) Detection of Msx2 transcripts by in situ hybridization in wild-type, Grem1Δ/Δ and Grem1Δ/ΔBmp4Δ/hf (G1Δ/ΔB4Δ/hf) forelimb buds (35 somites). Bottom panels show posterior views (dorsal, top; ventral, bottom) of the limb buds in the top panels. (B) Detection of Shh (top, 37 somites) and Fgf8 (bottom, 36 somites) transcripts.  Fig. 3. Heterozygosity for Shh is no longer compensated in Grem1Δ/ΔBmp4Δ/hf
and Grem1Δ/ΔBmp4Δ/+ limb buds (ShhΔ/+Grem1Δ/ΔBmp4Δ/hf и
Shh Δ/+Grem1Δ/ΔBmp4Δ/+. Left and middle panels, fore-limb skeletons at E14.5; right panels, QPCR quantification of the Shh, Gli1, and Msx2 transcript levels; bare represent the average of nine limb bud pairs (34 to 38 somites) with SDs. (A) Heterozygosity for Shh (ShhΔ/+)
does not affect digit specification or Gli1 and Msx2 transcription when e-m feedback signaling is intact (B and C) Disruption of e-m feedback signaling renders digit specification and SHH and BMP signal transduction (assessed by Gli1 and Msx2 transcript levels) sensitive to the Shh gene dosage. The genotypes are indicated for Shh (S), Grem1 (G1), and Bmp4 (B4) as follows: G1Δ/ΔB4Δ/hf, Grem1Δ/ΔBmp4Δ/hf; SΔ /+G1Δ/ΔB4Δ/+, ShhΔ/+Grem1Δ/ΔBmp4Δ/+; G1Δ/ΔB4Δ/+, Grem1Δ/ΔBmp4Δ/+; SΔ/+G1Δ/ΔB4Δ/+, ShhΔ/+Grem1Δ/ΔBmp4Δ/+.
Shh transcription is reduced about 30% when one Shh allele is inactivated Error bars ± SD *** , p < 0.001; P<0.01
Fig. 3. Heterozygosity for Shh is no longer compensated in Grem1Δ/ΔBmp4Δ/hf
and Grem1Δ/ΔBmp4Δ/+ limb buds (ShhΔ/+Grem1Δ/ΔBmp4Δ/hf и
Shh Δ/+Grem1Δ/ΔBmp4Δ/+. Left and middle panels, fore-limb skeletons at E14.5; right panels, QPCR quantification of the Shh, Gli1, and Msx2 transcript levels; bare represent the average of nine limb bud pairs (34 to 38 somites) with SDs. (A) Heterozygosity for Shh (ShhΔ/+)
does not affect digit specification or Gli1 and Msx2 transcription when e-m feedback signaling is intact (B and C) Disruption of e-m feedback signaling renders digit specification and SHH and BMP signal transduction (assessed by Gli1 and Msx2 transcript levels) sensitive to the Shh gene dosage. The genotypes are indicated for Shh (S), Grem1 (G1), and Bmp4 (B4) as follows: G1Δ/ΔB4Δ/hf, Grem1Δ/ΔBmp4Δ/hf; SΔ /+G1Δ/ΔB4Δ/+, ShhΔ/+Grem1Δ/ΔBmp4Δ/+; G1Δ/ΔB4Δ/+, Grem1Δ/ΔBmp4Δ/+; SΔ/+G1Δ/ΔB4Δ/+, ShhΔ/+Grem1Δ/ΔBmp4Δ/+.
Shh transcription is reduced about 30% when one Shh allele is inactivated Error bars ± SD *** , p < 0.001; P<0.01  Fig. 4. GREMl-mediated interlinking of a fast GREM1/ BMP4 module with the slower SHH/GREM1/FGF feedback loop. (A and B) Genetic lowering of Bmp4 is compensated by down-regulation of Greml expression at E10.75 (37 somites). (C and D) Differential transcriptional regulation of Grem1 by BMP4 (C) and SHH (D).(C)BAAP4 induces Greml within 2 hours.
(D) SHH induces Greml within 6 hours. (E) Scheme depicting how the GREM1 transcriptional node (shaded gray) interlinks the BMP4/GREM1 module and SHH/GREM1/FGF feedback loop. (F) Computer-aided simulations of the signaling activities in wild-type limb buds. The starting BMP4 activity was defined as high (Hi), whereas GREM1, SHH, and FGF are low (Lo). The initial increase of GREM1 is controlled by BMP4, whereas the second phase is controlled by SHH. Steady-state levels are reached by E10.0 and are characterized by high SHH/GREM1/FGF feedback loop and low BMP4/GREM1 module activities. (G) Disruption of BMP4-mediated up-regulation of Greml. (H) Disruption of SHH-mediated up-regulation of Grem1.
Fig. 4. GREMl-mediated interlinking of a fast GREM1/ BMP4 module with the slower SHH/GREM1/FGF feedback loop. (A and B) Genetic lowering of Bmp4 is compensated by down-regulation of Greml expression at E10.75 (37 somites). (C and D) Differential transcriptional regulation of Grem1 by BMP4 (C) and SHH (D).(C)BAAP4 induces Greml within 2 hours.
(D) SHH induces Greml within 6 hours. (E) Scheme depicting how the GREM1 transcriptional node (shaded gray) interlinks the BMP4/GREM1 module and SHH/GREM1/FGF feedback loop. (F) Computer-aided simulations of the signaling activities in wild-type limb buds. The starting BMP4 activity was defined as high (Hi), whereas GREM1, SHH, and FGF are low (Lo). The initial increase of GREM1 is controlled by BMP4, whereas the second phase is controlled by SHH. Steady-state levels are reached by E10.0 and are characterized by high SHH/GREM1/FGF feedback loop and low BMP4/GREM1 module activities. (G) Disruption of BMP4-mediated up-regulation of Greml. (H) Disruption of SHH-mediated up-regulation of Grem1.  Fig. 5. BMP4 is required during initiation of limb bud development. (A) Detection of Bmp4 transcripts in the mesenchyme (left) and AER (right) of BmpΔ/Δ forelimb buds (26 somites). (B) Skeletal phenotypes of BmpΔ/Δc forelimbs at E14.5 after inactivation of the Bmp4hf allele by the Prxl-Cre transgene. (Left) Truncation distal to scapula (n = 8/14). (Right) Loss of posterior elements in = 6/14). h, humerus; sc, scapula; r, radius; asterisks indicate rudimentary digits. (C and D) Detection of mesenchymal Greml (28 somites, n = 6) and AER-Fgf8 (26 somites) transcripts at E9.75. Note the patchy Fgf8 expression in = 8/10) or loss of Fgf8 expression (n = 2/10). (E) Tamoxifen (TM)-Cre mediated inactivation of Bmp4 by tamoxifen injection at about E8.75, i.e., before initiation of forelimb bud development. Detection of Fgf8 transcripts in forelimb buds at E10.25 (32 somites, n = 6). Control, TM-Cre heterozygous embryo. (F) Detection of Shh and FgfS transcripts in forelimb buds at E11.75 (50 somites) after tamoxifen injection at E9.25, i.e., after initiation of forelimb bud development (n = 4). Arrowhead points to the anterior expansion of FgfS expression in Bmp4Δ/Δc forelimb buds. Control: fBmp4Δc/+4TM-Cre forelimb bud.
Fig. 5. BMP4 is required during initiation of limb bud development. (A) Detection of Bmp4 transcripts in the mesenchyme (left) and AER (right) of BmpΔ/Δ forelimb buds (26 somites). (B) Skeletal phenotypes of BmpΔ/Δc forelimbs at E14.5 after inactivation of the Bmp4hf allele by the Prxl-Cre transgene. (Left) Truncation distal to scapula (n = 8/14). (Right) Loss of posterior elements in = 6/14). h, humerus; sc, scapula; r, radius; asterisks indicate rudimentary digits. (C and D) Detection of mesenchymal Greml (28 somites, n = 6) and AER-Fgf8 (26 somites) transcripts at E9.75. Note the patchy Fgf8 expression in = 8/10) or loss of Fgf8 expression (n = 2/10). (E) Tamoxifen (TM)-Cre mediated inactivation of Bmp4 by tamoxifen injection at about E8.75, i.e., before initiation of forelimb bud development. Detection of Fgf8 transcripts in forelimb buds at E10.25 (32 somites, n = 6). Control, TM-Cre heterozygous embryo. (F) Detection of Shh and FgfS transcripts in forelimb buds at E11.75 (50 somites) after tamoxifen injection at E9.25, i.e., after initiation of forelimb bud development (n = 4). Arrowhead points to the anterior expansion of FgfS expression in Bmp4Δ/Δc forelimb buds. Control: fBmp4Δc/+4TM-Cre forelimb bud.