Конечности позвоночных являются прекрасной моделью для изучения генетического контроля процессов развития (Capdevila and Izpisua Belmonte. 2001, Tickle, 2002). Мезодермально-эктодермальные взаимодействия, клеточная миграция и формирование паттерна, которые происходят во время формирования конечности, используют сигнальные молекулы и транскрипционные факторы, которые также оперируют во время развития др. структур и органов. Выяснение сети регуляторных генов, участвующих в росте конечности д. предоставить важную информацию о процессах развития. Зачаток конечности возникает из субнабора клеток из недифференцированной латеральной пластинки мезодермы (LPM), покрытой эктодермальной шапочкой, формирует боковые выпячивания от главной передне-задней оси эмбриона. Во время последующего роста клетки внутри зачатка конечности приобретают позиционную информацию и транслируют её в специфические паттерны дифференцированной ткани в отношении трех основных осей конечности. Вдоль прокисимо-дистальной (P-D) оси конечности генерируются три основные сегмента: stylopod (upper arm/leg), zeugopod (lower arm/leg) и autopod (кисть и стопа). Эти элементы возникают последовательно во время роста конечности: элементы, ближайшие к туловищу(проксимальные) формируются первыми, а кончики пальцев, которые расположены на наиболее дистальном конце конечности, являются последними дифференцирующимися хрящевыми элементами (Saunders, 1948, Summerbell et al 1973).
В последней декаде были охарактеризованы молекулярные маркеры, которые предопределяют регионы предшественников основных P-D сегментов в раннем зачатке конечности. Hox гены Hoxall и Hoxa 13 экспрессируются в zeugopod и autopod, соотв. (Yokouchi, t ai , 1991). У эмбрионов кур избыточная экспрессия Hoxa13 ведет к дефектам формирования хрящей zeugopod и к изменению клеточной адгезивности; возникающий в результате фенотип напоминает изменения судеб клеток в направлении хрящей аутопода, образуются более короткие элементы, чем radius и ulna дикого типа из zeugopod (Yokouchi et al., 1995). Во время развития, домены экспрессии Hoxa11 и Hoxa 13 частично перекрываются с таковыми их ортологами кластера Hoxd (Dolle et al., 1989; Nelson et a!., 1996). Двойные мутанты Hoxa13 b Hoxd13 выявляют дефекты в формировании хрящей аутопода, это указывает на аддитивные функции этих двух генов (Fromental-Ramain et at., 1996). Сходным образом, анализ Hoxa11/Hoxd11 двойных мутантных конечностей выявил аддитивные функции для этой пары генов во время развития zeugopod (Davis et al., 1995). Эти данные указывают на то, что Hox функционируют внутри каждого P-D сегмента, это приводит к дополнительным эффектам двух или более генов ортологов, относящихся к разным Hox кластерам. Т.к. Hoxa11 и Hoxa13 являются наилучшими маркерами, доступными для zeugopod и autopod, фенотипы потери их функции не подтверждают их роли в спецификации сегментных характеристик конечности, а скорее в детерминации скорости роста и адекватного перечня дифференцировки для каждого сегмента( Boulet and Capecchi, 2004).
Паттерны экспрессии членов др. гомеобоксного семейства transcription factor (TF), TALE homeobox TFs Meis1 и Meis2(Moskow et al., 1995, Nakamura et al, 1996), определяют наиболее проксимальные сегменты конечности, включая stylopod и более проксимальные регионы. Meis1 и Meis2 экспрессируются в эмбриональном LPM (Cecconi et al., 1997, Mercader et al.. 1999, Oulad-Abdelghani et al., 1997). Во время роста конечности их экспрессия становится ограниченной проксимальной областью мезенхимы и эктодермы зачатка конечности. При избыточной экспрессии во всем зачатке конечности кур, Meis1 и 2 , каждый индуцирует альтерации в формировании zeugopod и autopod (Capdevila et al. 1999, Mercadei et al., 1999). Наблюдаемые дефекты находятся в пределах от проксимализации P-D оси конечности (Mercader et al, 1999) до делеции дистальных сегментов (Capdevila etai, 1999. Mercader etai, 1999). Проксимализация P-D оси конечности в этих исследованиях была очевидна, исходя из нарушенного распределения скелетных элементов, эктодермальных производных, мышц; и паттернов иннервации. На молекулярном уровне экспрессия P-D маркеров Hoxa11 и Hoxa13 сдвигалась дистально в соответствии с измененными P-D качественными особенностями скелетных элементов. Мыши, дефицитные по Meis1,однако не обнаруживали дефектов в формировании стилопода (Azcoitia et ai, 2005, Hisa et ai, 2004), указывая тем самым на функциональное перекрывание между Meis1 и Meis2, это демонстрирует перекрывание экспрессии в зачатке конечности.
Meis транскрипционные факторы осуществляют свои регуляторные активности посредством образования гетеродимеров с др. транскрипционными факторами, включая Hox белки, др. гомеобоксные транскрипционные факторы, такие как engrailed и PDX1, и не-гомеодоменовые транскрипционные факторы, такие как bHLH- и zinc finger-содержащие белки (rev. Mann and Affolfer. 1998). Основными кофакторами для Meis TFs являются члены PBC субкласса TALE гомеобоксных транскрипционных факторов, которые представлены генами Pbx позвоночных и их ортологами extradenticie (exo) у дрозофилы и CEH-20 и CEH-40 у C. Elegans (rev. Biirglin. 1997).
Здесь мы описываем эффекты избыточной экспрессии
Meis1 в дистальных регионах развивающихся конечностей мыши. Наши результаты указывают на то,
Meis1 ингибирует дистальное развитие конечности и способствует проксимализации судеб клеток конечности. Элиминация функции
Pbx1 не устраняет последствий избыточной экспрессии
Meis1, указывая тем самым, что или активность Pbx не нужна для эффектов
Meis1 на развитие дистальных частей конечности или что используется активность др. членов семейства Pbx
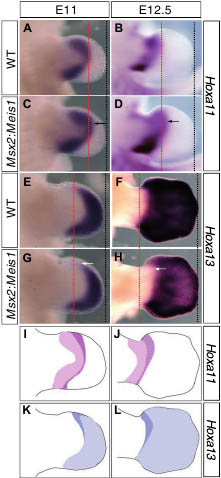 Fig. 6 (Left). Ectopic Meis1 expression leads to a distal shift of Hoxa11 and Hoxa13 expression domains. Wholemount in situ hybridizations of Hoxa11 and Hoxa13 in E11 and E12.5 limb buds. (A-D)
Compared with a wildtype (WT) forelimb (A), the Hoxa11 expression domain in Msx2:Meis1 forelimbs is shifted distally (C, arrow). This distal extension is maintained at later stages of development and is not exclusive to the forelimb, since it is also observed in hindlimb buds at E12.5 (D, arrow). Red dotted lines mark the distal border of the Hoxa11 expression domain in WT limb buds. (E-H) The Hoxa13 expression domain in Msx2:Meis1 limbs is, in contrast, reduced compared with WT littermates. Red dotted lines mark the proximo-anterior Hoxa13 expression limit in WT embryos. Note that this limit is shifted distally in Msx2:Meis1 limbs (white arrows). In all panels, black dotted lines highlight the tip of the limb bud. (I-L) Schematic illustration of the shift in Hoxa11 and Hoxa13 expression domains observed
in the presence of ectopic Meis1 in the distal limb bud. Filled colored areas represent the normal Hoxa11 and Hoxa13 expression domains; striped areas represent Hoxa11/Hoxa13 expression domains in Msx2:Meis1 transgenic limbs. In transgenic limbs the Hoxa11 domain is shifted distally. At the same stages, cells located at the proximal border within the WT Hoxa13 expression domain stop expressing it in the transgenics, thus undergoing a change in proximodistal marker gene expression. The effect is more prominent in the anterior limb bud.
Fig. 6 (Left). Ectopic Meis1 expression leads to a distal shift of Hoxa11 and Hoxa13 expression domains. Wholemount in situ hybridizations of Hoxa11 and Hoxa13 in E11 and E12.5 limb buds. (A-D)
Compared with a wildtype (WT) forelimb (A), the Hoxa11 expression domain in Msx2:Meis1 forelimbs is shifted distally (C, arrow). This distal extension is maintained at later stages of development and is not exclusive to the forelimb, since it is also observed in hindlimb buds at E12.5 (D, arrow). Red dotted lines mark the distal border of the Hoxa11 expression domain in WT limb buds. (E-H) The Hoxa13 expression domain in Msx2:Meis1 limbs is, in contrast, reduced compared with WT littermates. Red dotted lines mark the proximo-anterior Hoxa13 expression limit in WT embryos. Note that this limit is shifted distally in Msx2:Meis1 limbs (white arrows). In all panels, black dotted lines highlight the tip of the limb bud. (I-L) Schematic illustration of the shift in Hoxa11 and Hoxa13 expression domains observed
in the presence of ectopic Meis1 in the distal limb bud. Filled colored areas represent the normal Hoxa11 and Hoxa13 expression domains; striped areas represent Hoxa11/Hoxa13 expression domains in Msx2:Meis1 transgenic limbs. In transgenic limbs the Hoxa11 domain is shifted distally. At the same stages, cells located at the proximal border within the WT Hoxa13 expression domain stop expressing it in the transgenics, thus undergoing a change in proximodistal marker gene expression. The effect is more prominent in the anterior limb bud.
DISCUSSION
Ectopic Meis1 overexpression interferes with distal limb development
Ранее мы показали, что Meis1 является молекулярным маркером стилопода и что эктопическая экспрессия по всему зачатку конечности эмбриона цыпленка ведет к альтерациями элементов зигопода и аутопода, при этом не затрагивается развитие проксимальных частей конечности (Mercarder et al., 1999). Здесь мы выявили сходные эффекты в отношении формирования паттерна скелета, при избыточной экспрессии Meis1 в зачатке конечности мыши. Как и в случае конечности эмбрионов кур, наблюдались дефекты, включая изменения качественных P-D характеристик клеток конечности, как было показано, с помощью измененной экспрессии P-D маркеров и удлинения структур конечности в позиции дистальнее из обычного положения.
Мы наблюдали дистальный сдвиг границы двух маркеров, которая определяет zeugopod и autopod, Hoxa11 и Hoxa13 (Fig. 61-L). Домены экспрессии этих маркеров впервые появляются на задне-дистальной части кончика зачатка конечности и прогрессивно расширяется, смещая границы в более проксимальные позиции. Наши результаты, следовательно, могут показывать только общую задержку развития конечности. Снова в противовес этой возможности мы наблюдали, что время активации Hoxa11 и Hoxa 13 не изменено у трансгенных эмбрионов. Мы поэтому склоняемся в пользу мнения, что эктопический Meis1 изменяет способность клеток дистальных частей конечности участвовать в дистализации. Сдвиг доменов экспрессии первоначально наблюдается через весь зачаток конечности и затрагивает границу проксимальной экспрессии Hoxa1, также как и его дистальную границу, которая совпадает с проксимальными границами экспрессии Hoxa13. На более поздних стадиях, однако, только передние области границы между zeugopod и autopod сохраняют сдвинутые паттерны экспрессии Hoxa11 и Hoxa13, и только вокруг этой области, где мы наблюдали паттерн скелетных конденсаций, сравнимый со сдвигом P-D в скелетных элементах. Избыточная экспрессия Meis1 в зачатках конечностей кур запускала очень сходные отклонения на передней zeugopodal/autopodal границе (Mercader et al., 1999), указывая тем самым, что эта область особенно чувствительна к альтерациям механизмов P-D спецификации. Эта область аутопода является довольно уникальной, т.к. только она экспрессирует один Hox ген, а именно Hoxa13. Палец 1 специфически недоразвит у мыши с одной дозой Hoxa13 и является единственным пальцам, теряющимся при полном отсутствии Hoxa13. Более того, делеция только одной копии полного кластера Hoxa генов специфически удаляет только палец 1 (Fromental-Ramain et al,. 1996. Kmita et al., 2005). Тот факт, что развитие наиболее передней части аутопода отражается в основном на активности одиночного Hox гена, может лежать в основе повышенной чувствительности этого региона к отклонениям паттерна в целом и при избыточной функции Meis1, в частности. Некоторые эффекты избыточной экспрессии Meis1 в дистальной части конечности могут быть фактически объяснены снижением уровней экспрессии Hoxa13 и/или альтерациями в активности белка HoxA13, поскольку Hoxa13(+/-) мыши также обнаруживают слияние пальцев 2 и 3 (Stadler eta!.. 2001), а Hoxa13 дефицитные мыши обнаруживают дистально расширяющуюся экспрессию Hoxa11 в зачатках конечностей (Post and Innis, 1999).
Во время раннего развития конечностей Meis1 и Hoxa11 необходимы для установления взаимно исключающих доменов. Наши результаты т.о., могут отражать физиологическую роль Meis1 в ограничении 5' Hox гена экспрессии в дистальных регионах конечностей, и эта функция Meis1 может оперировать на разных уровнях. Активность Meis/Pbx, как было показано, регулирует транскрипцию Hoxb2 за счет непосредственного модулирования транскрипционной активности Hoxb1 белка в cross-regulatory петле (Jacobs et a!., 1999). Возможно, что сходная регуляторная петля возникает в зачатке конечности, при этом Meis1 непосредственно регулирует белковую и/или транскрипционную активность Hoxa11 и Hoxa13. Предыдущие исследования также показали, что энхансер дистальной части конечности, расположенный значительно выше Hoxd комплекса, управляет экспрессией 5' Hoxd гена в аутоподе во время эмбриогенеза (Spitz etal., 2003). Сходный механизм контроля экспрессии предложен для кластера Hoxa (Lehoczky et at., 2004). Поэтому вторым возможным объяснением является то, что наблюдаемые отклонения в переходе экспрессии Hoxa11 в Hoxa13 могут быть вызваны влиянием активности Meis1 на энхансер дистальной части конечности.
Помимо наблюдаемых отклонений в установлении P-D качественных особенностей конечностей Meis1 трансгенные мыши обнаруживают дефекты в росте и дифференцировке костей. Важно отметить, что во время нормального развития Meis экспрессия подавляется в хондрогенных центрах. Следовательно, альтерации в дифференцировке костей, наблюдаемые после избыточной экспрессии Meis1 могут быть обусловлены непосредственным противодействием этому процессу с помощью активности Meis. Однако, если это имело место, то слудует ожидать увидеть отклонения в формировании кости внутри всех P-D сегментах конечности после избыточной экспрессии Meis1, чего не наблюдается. Избыточная экспрессия Meis1 у кур индуцирует дефекты дифференцировки кости только в скелетных элементах: stylopod остается незатронутым. Это указывает на то, что альтерации в дифференцировке кости происходят в результате неправильной спецификации скелетных элементов скорее, чем в результате интерференции активности Meis с программой оссификации. Результаты, полученные здесь, подтверждают эту гипотезу, т.к. избыточная экспрессия Meis1 у Msx2:Meis1 трансгенных мышей в зачатках конечностей является специфической для недифференцированных клеток, поэтому не существует избыточной экспрессии Meis1 во время дифференцировки скелетных элементов. В этих условиях трансгенные Msx2:Meis1 мыши воспроизводят дефекты специфических для дистальных частей роста и дифференцировки, наблюдаемых у кур. Это указывает на то, что дефекты вызываются альтерациями рано в процессе спецификации, когда клетки всё ещё в недифференцированной области под влиянием AER. Т.о., снабжение измененными позиционными сигналами предшественников первичных хондрогенных центров может приводить к отклонениям программы дифференцировки, которая только становится очевидно во время последующей фазы роста и дифференцировки. Сходные наблюдения описываются после модификации активности Hox генов. 5' Hoxd и 5'Hoxa гены экспрессируются в специфических A-P и P-D позициях почки конечности (Dolle etal.. 1989, Nelson etal., 3, Yokouchi etal., 1991). С началом конденсации хряща экспрессия Hox генов подавляется (Suzuki and Kuriwa,2002). Тем не менее, избыточность или потеря функции Hoxgene ведет к позиционно-специфическим дефектам в дифференцировке кости, указывая тем самым, что ранняя неправильная спецификация ведет к дефектами дифференцировки (Davis and Capecchi, 1996, Fromentai-Ramain et al.. 6. Goff and Tabin, 1997, Morgan etal., 1992, Zakany and oule, 1999).
Неправильная экспрессия Hoxd13 и Hoxd12 в зачатке конечности мешает правильному развитию zeugopodal элементов эмбрионов кур и мышей, соотв. (Goff and Tabin, 1997. Knezevic atal., 1997). Избыточная экспрессия Hoxd13ведет к более коротким тибии и фибуле, избыточность функции Hoxd12 в задней латеральной пластинке мезодермы ведет к hemimelia тибии. Сходным образом неправильная экспрессия др.дистального Hox гена, Hoxa13, также ведет к развитию более коротких zeugopodal элементов (Yokouchi et al.,1995). Возможным объяснением может быть то, что эти Hox гены, которые преимущественно или исключительно экспрессируются в области аутопода, мешают функционировать белкам Hox генов внутри zeugopod, где избыточно экспрессируются. Hoxd13/a13/d12 могут мешать действию др. Hox генов, таких как Hoxd11 и Hoxa11, которые, как было показано, контролируют развитие zeugopod (Davis et al.1995). Принимая во внимание, что избыточная экспрессия Meis1 вызывает zeugopodal дефекты, которые частично напоминают те, что найдены при избыточной экспрессии Hoxd13, Hoxd12 или Hoxa13, но не активирует эти дистальные гены в аутоподе, он может действовать в этом контексте путем интерференции с функцией правильного Hox белка в zeugopod.
В проксимальной части конечности экспрессия
Meis1 обеспечивается с помощью RA, которая, как полагают, является детерминантом качественных особенностей поксимальной части конечности (Mercader et al.. 2000b, Ribes et al.. 2007, Yashiro et al., 2004). Фенотип, получаемый после избыточной экспрессии
Meis1, частично напоминает тератогенные эффекты RA на развитие конечности (Sucov etal., 1995, Yashiro etal.. 2004). Близко родственный ген семейства Meis,
Meis2 (Cecconi et al., 1997, Oulad-Jelghani et al., 1997), ко-экспрессируется с
Meis1 во время развития проксимальной части конечности, он также регулируется с помощью RA и возможно выполняет перекрывающуюся роль с
Meis1. Поэтому мы полагаем, что
Meis1 и Meis2 могут быть важными медиаторами функции RA и тератогенных эффектов во время P-D спецификации конечности.
Meis proteins might act independently of a Pbx cotactor
TALE гомеобоксные белки Meis и Pbx, как было показано, образуют гетеродимеры и действуют как функциональная единица в некоторых видовых и клеточных контекстах. Ядерная локализация этих белков, как было показано, взаимозависима (Abu-Shaar al., 1999, Berthelsen et al., 1999, Capdevila et al., 1999, Mercader et al. 1999. Rieckhof et al.. 1997). У Drosophila. Pbx ортолог EXD транслоцируется в ядро только в присутствии Meis ортолога HTH. У др. видов, однако, роль ядерного транспорта, по-видимому, переключается между Meis и Pbx белками (Maeda et al.. 2002, Prpic e tal., 2003, Vlachakis et al.. 2001 ). Напр., у пауков, exd экспрессируется исключительно в проксимальных частях конечности, тогда как hth экспрессируется по всему придатку; однако, локализуется в ядрах только проксимальных клеток и обнаруживает цитоплазматическую экспрессию в дистальных регионах. Сходным образом во время развития заднего мозга у рыбок данио, Pbx4 регулирует ядерный транспорт Meis3 (Choe etal., 2002). Ранее мы сообщали, что экспрессия в ядре Pbx1 ограничена проксимальным регионом конечностей, которые совпадают с доменом экспрессии Meis (Gonzalez-Crespo et al.. 1998). Дистальный цитоплазматический сигнал, выявляемый с помощью анти-Pbx1 антител, интерпретируется как указание на присутствие цитоплазматического белка Pbx1 в дистальной части конечности. Недавнее исследование, однако, выявило ограничение Pbx1 транскриптов в проксимальных частях конечностей (Capeliini etal., 2006). Это указывает на то, что окрашивание цитоплазматическими антителами для Pbx1 в дистальных частях конечностей являются неспецифическим. Теперь мы протестировали это путем сравнения цитоплазматического окрашивания дистальных частей конечностей у WT и Pbx1-дефицитных эмбрионов на ст. E11.5 и установили, что в самом деле дистальный цитоплазматический сигнал, обнаруживаемый на этой ст. не связан с Pbx1 белком (not shown). Тем не менее, активация ядерных Pbx в дистальной части зачатка конечности, выявляемая с помощью антител к Pbx1, 2 и 3, была описана после эктопической активации PKA (Kilstrup-Nielsen etal., 2003). Чтобы установить, может ли эктопическая активность Meis1 в Msx2:Meis1 трансгенной линии приводить к сходной экспансии в дистальном направлении ядерной экспрессии Pbx в зачатке конечности, мы анализировали изменения в окрашивании антителами к Pbx. Однако, Pbx экспрессия оставалась неизменной, указывая тем самым, что дополнительные сигнальные события, такие как передача сигналов PKA, необходимы для доменов эктопической экспрессии Pbx в дистальных частях конечностей.
Наконец, мы установили, что элиминация Pbx1 не устраняет фенотипа избыточной экспрессии Meis1, указывая тем самым, что Meis1 способен нарушить P-D спецификацию конечности в отсутствие какой-либо функции Pbx или, что эктопический Meis1 рекрутирует др. Pbx белки, чтобы продуцировать этот фенотип избыточной экспрессии. Др. Pbx гены экспрессируются в развивающихся конечностях, включая Pbx2 и Pbx3(Capellini et al., 2006, Di Giacomo et al., 2006). В то время как Pbx3 не экспрессируется во всех регионах конечностей на соотв. ст., Pbx2 экспрессируется по всему зачатку конечности во время фазы спецификации P-D и функционально используется для формирования паттерна как проксимальной, так и дистальной части конечности вместе Pbx1 (Capeliini et al., 2006). Поэтому мы не можем исключить взаимодействия между Pbx2 и Meis1 в генерации фенотипа избыточной экспрессии
Meis1.
Сайт создан в системе
uCoz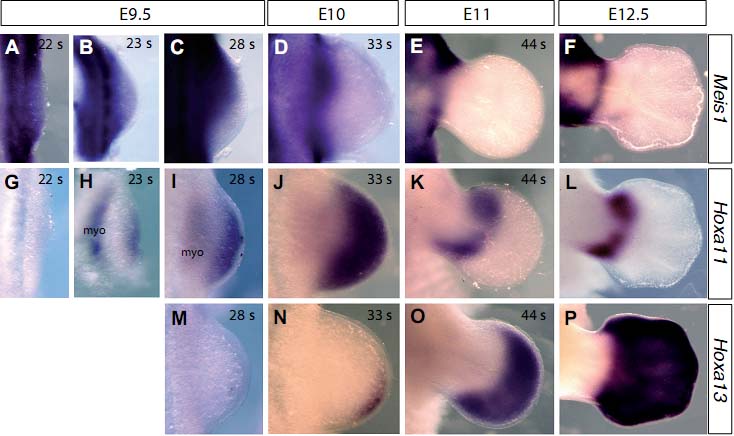 Fig. 1. Comparison of Meis1, Hoxa11 and Hoxa13 expression domains during limb development. Wholemount in situ hybridization with riboprobes for Meis1, Hoxa11 or Hoxa13 as indicated. The figure shows dorsal views of forelimbs (anterior to the top, distal to the right) from stages E9.5, E10, E10.5, E11 and
E12.5. For a more precise staging, somite number (s) was counted for the younger embryos.
(A/G), (B/H), (J/N) and (E/K) are forelimbs from the same embryos, with the images in (G,H,N,E) inverted to enable better comparison of the expression patterns. myo indicates the somite-derived Hoxa11-positive myoblast population migrating into the limb bud.
Fig. 1. Comparison of Meis1, Hoxa11 and Hoxa13 expression domains during limb development. Wholemount in situ hybridization with riboprobes for Meis1, Hoxa11 or Hoxa13 as indicated. The figure shows dorsal views of forelimbs (anterior to the top, distal to the right) from stages E9.5, E10, E10.5, E11 and
E12.5. For a more precise staging, somite number (s) was counted for the younger embryos.
(A/G), (B/H), (J/N) and (E/K) are forelimbs from the same embryos, with the images in (G,H,N,E) inverted to enable better comparison of the expression patterns. myo indicates the somite-derived Hoxa11-positive myoblast population migrating into the limb bud.
 Fig. 6 (Left). Ectopic Meis1 expression leads to a distal shift of Hoxa11 and Hoxa13 expression domains. Wholemount in situ hybridizations of Hoxa11 and Hoxa13 in E11 and E12.5 limb buds. (A-D)
Compared with a wildtype (WT) forelimb (A), the Hoxa11 expression domain in Msx2:Meis1 forelimbs is shifted distally (C, arrow). This distal extension is maintained at later stages of development and is not exclusive to the forelimb, since it is also observed in hindlimb buds at E12.5 (D, arrow). Red dotted lines mark the distal border of the Hoxa11 expression domain in WT limb buds. (E-H) The Hoxa13 expression domain in Msx2:Meis1 limbs is, in contrast, reduced compared with WT littermates. Red dotted lines mark the proximo-anterior Hoxa13 expression limit in WT embryos. Note that this limit is shifted distally in Msx2:Meis1 limbs (white arrows). In all panels, black dotted lines highlight the tip of the limb bud. (I-L) Schematic illustration of the shift in Hoxa11 and Hoxa13 expression domains observed
in the presence of ectopic Meis1 in the distal limb bud. Filled colored areas represent the normal Hoxa11 and Hoxa13 expression domains; striped areas represent Hoxa11/Hoxa13 expression domains in Msx2:Meis1 transgenic limbs. In transgenic limbs the Hoxa11 domain is shifted distally. At the same stages, cells located at the proximal border within the WT Hoxa13 expression domain stop expressing it in the transgenics, thus undergoing a change in proximodistal marker gene expression. The effect is more prominent in the anterior limb bud.
Fig. 6 (Left). Ectopic Meis1 expression leads to a distal shift of Hoxa11 and Hoxa13 expression domains. Wholemount in situ hybridizations of Hoxa11 and Hoxa13 in E11 and E12.5 limb buds. (A-D)
Compared with a wildtype (WT) forelimb (A), the Hoxa11 expression domain in Msx2:Meis1 forelimbs is shifted distally (C, arrow). This distal extension is maintained at later stages of development and is not exclusive to the forelimb, since it is also observed in hindlimb buds at E12.5 (D, arrow). Red dotted lines mark the distal border of the Hoxa11 expression domain in WT limb buds. (E-H) The Hoxa13 expression domain in Msx2:Meis1 limbs is, in contrast, reduced compared with WT littermates. Red dotted lines mark the proximo-anterior Hoxa13 expression limit in WT embryos. Note that this limit is shifted distally in Msx2:Meis1 limbs (white arrows). In all panels, black dotted lines highlight the tip of the limb bud. (I-L) Schematic illustration of the shift in Hoxa11 and Hoxa13 expression domains observed
in the presence of ectopic Meis1 in the distal limb bud. Filled colored areas represent the normal Hoxa11 and Hoxa13 expression domains; striped areas represent Hoxa11/Hoxa13 expression domains in Msx2:Meis1 transgenic limbs. In transgenic limbs the Hoxa11 domain is shifted distally. At the same stages, cells located at the proximal border within the WT Hoxa13 expression domain stop expressing it in the transgenics, thus undergoing a change in proximodistal marker gene expression. The effect is more prominent in the anterior limb bud.