Меланоциты или пигментные клетки представляют собой существенную пропорцию клеток во взрослом эпидермисе с примерно 800 cells/mm3. Меланин, которые продуцируется меланоцитами является основным поставщиком пигментации, он упакован и доставляется в кератиноциты с помощью лизосом-подобных структур, наз. меланосомами. Кожа, как основной барьер к внешним воздействиям связана с меланоцитами, чтобы обеспечить фоторецепцию и терморегуляцию посредством продукции меланина.
Сегодня считается, что предшественники меланоцитов, меланобласты, возникают в нервном гребне neural crest (NC), который индуцируется сигналами Bone morphogenic protein (BMP) и Wnt во время закрытия нервной трубки и проникают в эктодерму почти немедленно, мигрируя в её близи по хорошо известным маршрутам (Dorris, 1938, 1939; DuShane, 1935; Rawles, 1947; Ris, 1941; Twitty, 1936). Сначала они мигрируют дорсо-латерально между дермомиотомом и покрывающей эктодермой, а затем вентрально через развивающийся дермис в свое конечное место предназначения в базальном слое эпидермиса и волосяных фолликулов (Erickson, 1993). Эта гипотеза объясняет, почему neural crest cells (NCCs) приобретают судьбу меланоцитов уже на уровне нервной трубки, вскоре после вычленения NC. Происхождение и стереотипический миграторный путь кожных меланоцитов общепринят и в основном подкрепляется экспериментами с использованием радиографических или трансплантационных перепел-куриц систем, отслеживанием витальных красителей у эмбрионов кур и мыши и генетического таргетинга, чтобы экспрессировать маркеры репортеры с помощью melanoblast- и melanocyte-специфических промоторов у мыши (Bronner and Cohen, 1979; Johnston, 1966; Le Douarin, 1973; Mackenzie et al., 1997; Rawles, 1947; Serbed-zijaet al., 1989,1990; Weston, 1963). Эти исследования описывают появление меланобластов между дермомиотомом и эктодермой. Однако в конечном счете миграция внутри проспективного дермиса в вентральные регионы тела и конечностей не была исследована тщательно, однако наблюдалось, что меланобласты, по-видимому, преждевременно появляются и локализуются, по крайней мере, в конечностях без очевидной дермальной миграции (Fox, 1949). Клональная экспансия меланобластов основателей, которые перемешиваются и диспергируют лишь в ограниченной степени во время миграции под эпидермисом, как полагают, обеспечивает пигментацию покровов (Mintz, 1967) и лежит в основе наблюдения определенных участков пигментации, появляющихся из индивидуальных меланобластов (Huszar et al., 1991; Wilkie et al., 2002).
Рано вычленяющиеся NCCs выбирают вентральный путь миграции и дифференцируются в предшественников нейронов и Schwann cell precursors (SCPs). SCPs определяются как Sox10+ NCC-производные клетки, тесно ассоциированные с проекциями нейронов во время ранних стадий эмбрионального развития, которые способны мигрировать на дальне расстояния вдоль нервов (Jessen and Mirsky, 2005). NCCs, которые приобретают судьбу меланобластов появляются позднее в дорсальной части нервной трубки и мигрируют вдоль дорсо-латерального пути. Различия во времени между этими волнами коррелируют с периодом превращения эпителиальных сомитов в дермамиотом и эти пространственные и временные изменения в присутствии инструктивных сигналов, как полагают, инструктируют поздние NCCs приобретать судьбу меланоцитов. У кур и мышей Wnt1 способствует формированию меланобластов и снижает образование нейронов и глии посредством β-catenin (Dunn et al., 2000; Jin et al., 2001) частично за счет индукции общего мультипотентного NCC/melanocyte SRY-related high-mobility-group domain транскрипционного фактора Sox10 (Aoki et al., 2003; Honore et al., 2003). Как центральный регулятор развития пигментных клеток, microphthalmia-associated transcription factor (Mitf) детерминирует судьбу меланоцитов из мультипотентных NCCs, частично за счет его мощной транскрипционной и клон-специфической регуляции трех основных пигментных энзимов: tyrosinase, Tyrpl и Dct , а также др. пигментных факторов (Steingrimsson et al., 2004). У рыбок данио путь Wnt также способствует детерминации клона меланоцитов за счет непосредственно регуляции транскрипции гена Mitf (Dorsky et al., 2000). В соответствии с источником сигналов Wnt из нервной трубки вскоре после вычленения NC и с современным мнением об источнике и миграции меланобластов, анализ клеток, экспрессирующих Mitf, подтвердил детерминацию NCCs на дорсальной части нервной трубки в присутствии Mitf позитивных клеток, расположенных ниже эктодермы на уровне дермомиотома во время развития (Nakagawa and Takeichi, 1998).
В этом исследовании мы подтвердили ранее описанный источник меланоцитов кожи из вычленяющихся NCCs в дорсальной части нервной трубки и предоставили доказательства, что большое количество меланоцитов продуцируется также нервами, иннервирующими кожу. Клеточным источником этих клеток являются Sox10
+/Krox20
- SCPs туловища вентрального миграторного пути. Мы показали, что миэлинизирующие Krox20
+ Шванновские клетки обычно не дифференцируются в меланоциты, но сохраняют компетентность делать это. Выбор между судьбой SCP и меланоцита в нервах интимно связан с клеточным контактом с нервом и зависит от взаимодействий с Neuregulins и их ЕгbBЗ рецептором, указывая тем самым на двойную роль этой сигнальной системы в развитии нейронов. Кроме того, insulin-like growth factor 1 (IGF1) и platelet-derived growth factor (PDGF) действуют противоположным способом Neuregulins, способствуя поздним волнам дифференцировки, жизнеспособности и экспансии меланоцитов из SCPs.
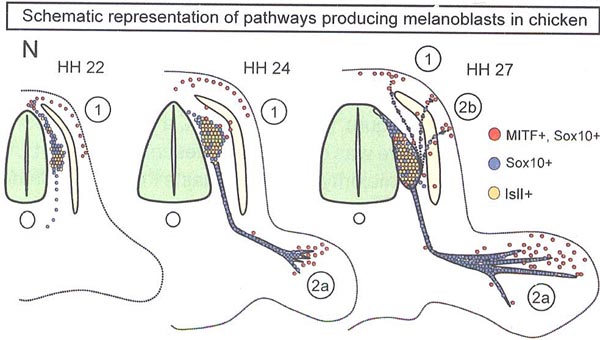 Figure 1. Association of Melanoblasts with Nerves in Chick and Mouse Development
(A-N). (N) Schematic spatiotemporal representation of Mitf+ melanocyte in the chick. (A-M) Solid arrows identify Mitf- cells in location 2a and arrowheads in 1 and 2b. Abbreviations are as follows: NT, neural tube; DRG, dorsal root ganglion; dm, dermamyotome; dr, dorsal ramus; snv, ventral branch of spinal nerve. The scale bars represent 50µm.
Figure 1. Association of Melanoblasts with Nerves in Chick and Mouse Development
(A-N). (N) Schematic spatiotemporal representation of Mitf+ melanocyte in the chick. (A-M) Solid arrows identify Mitf- cells in location 2a and arrowheads in 1 and 2b. Abbreviations are as follows: NT, neural tube; DRG, dorsal root ganglion; dm, dermamyotome; dr, dorsal ramus; snv, ventral branch of spinal nerve. The scale bars represent 50µm.
DISCUSSION
Широко принято, что во время развития NCCs вычленяются из нервной трубки и приобретают судьбу меланоцитов, мигрируя дорсо-латерально, чтобы занять эпидермис и существенно увеличить их количество, составляя 5%-10% от всех клеток эпидермиса у взрослых. Мы предоставили доказательства, что NCCs, мигрирующие вентральным путем, которые ранее рассматривался как вносящий вклад только в глию и нейроны периферической нервной системы, также являются источником меланоцитов.
Nerve-Derived Schwann Cell Precursors as a Cellular Source of Skin Melanocytes
Несколько независимых экспериментов подтвердили, что SCPs вдоль нервов являются клеточным источником меланоцитов. Иммуногистохимический анализ идентифицировал меланобласты, ассоциированы с нервами по времени и в пространстве отлично от дорсолатерального пути. Соответственно отслеживание клеток у эмбрионов кур показало, что GFP
+ перемещающиеся вдоль нервов SCPs начинают экспрессировать
Mitf и
MEBL. Эксперименты по устранению подтвердили, что (J-O) YFP метит клетки потомки, используя Krox20-Cre активирующую линию после перерезки седалищного нерва. Отметим, что YFP
+ меланоциты между мышечными волокнами (J и K), в соединительной ткани и дермисе (L), и в дегенерированной культе седалищного нерва (M-O)
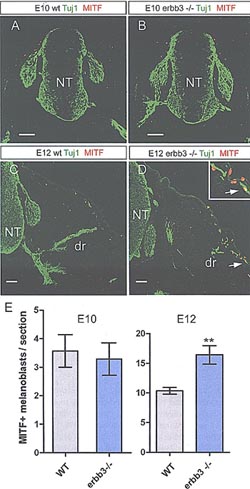 Figure 7. Regulation of SCP versus Melanocyte Fate by Neuregulin Signaling
(A-E) Melanocyte development in еrB3-/- and control mice. (A-D) Mitf and Tuj1 labeling of wild-type and arB3-/- mice at Е10 (A and B) and E12 (C and D). Arrow in the inset (D) points at melanoblast associated to the nerve fiber. (E) Quantification of Mitf+ melanoblast numbers in control and arB3-/- embryos at Е10 and E12 (n = 4 animals/group; error bars represent SEM; Students t test **p < 0.01,). Abbreviations are as follows: DRG, dorsal root ganglion; dr, dorsal ramus; NT, neural tube. The scale bars represent 50µm.
Figure 7. Regulation of SCP versus Melanocyte Fate by Neuregulin Signaling
(A-E) Melanocyte development in еrB3-/- and control mice. (A-D) Mitf and Tuj1 labeling of wild-type and arB3-/- mice at Е10 (A and B) and E12 (C and D). Arrow in the inset (D) points at melanoblast associated to the nerve fiber. (E) Quantification of Mitf+ melanoblast numbers in control and arB3-/- embryos at Е10 and E12 (n = 4 animals/group; error bars represent SEM; Students t test **p < 0.01,). Abbreviations are as follows: DRG, dorsal root ganglion; dr, dorsal ramus; NT, neural tube. The scale bars represent 50µm.
дорсолатерального пути не влияют на количества меланоцитов из GFP меченных клеток, происходящие из вентрального пути, тогда как удаление нервной трубки и DRG вызывает существенное снижение количества идентифицируемых SCPs как клеточного источника меланобластов у эмбрионов кур. Некоторые остаточные нервы оказывались в конечностях ablated эмбрионов, которые могут быть источником небольшого количества оставшихся меланобластов, обнаруживаемых в этом месте. SCPs как источник меланоцитов стали очевидными в экспериментах по axotomization как во время развития, так и у взрослых, у которых потеря контактов с нервами ведет к экспрессии
Mitf, это согласуется с нашим анализом ЕrbBЗ мышей, также обнаруживающих повышенные количества меланобластов. Дальнейшим подтверждением являются данные, показывающие, что гомеобоксный транскрипционный фактор Hmx1, экспрессирующийся только в нейронально детерминированных клетках, но не в меланоцитах, необходим для нейрогенеза, а его отсутствие увеличивает поличество не-нейрональных предшественников. Такое увеличение ведет к заметному повышению количества меланоцитов в коже. Используя PLP-CreERT2 мышей для генетического отслеживания производных PLP
+ SCPs позволило идентифицировать SCPs как клеточный источник меланоцитов во время развития мыши. Эти данные также показывают, что DCT
+/Mitf
+ зрелые пигментные меланоциты происходят из SCPs, по-видимому, в коже у постнатальных животных. Комбинация всех этих результатов вкупе с time-lapse slice культуральными экспериментами подтверждает наше заключение, что SCPs вдоль нервов, иннервирующих кожные ткани являются источником меланоцитов.
Наши находки согласуются и могут объяснить более ранние результаты. В противоположность предположению Mintz's, что немногие меланобласты-основатели обеспечивают окраску шерсти (Mintz, 1967), более недавние данные показывают, что существует огромное количество меланобластов прародителей (Wilkie et al., 2002). Более того, когда одиночные NCCs метили генетически, то меланоциты, возникающие из единственной исходной клетки оказывались локализованными в участках кожи, перемешанные с не меченными клетками. Это указывает на то, что предшественники диспергируются и смешиваются, но заселяют кожу определенного участка (Hus-zar et al., 1991; Wilkie et al., 2002). Вполне возможно, что меланоциты, возникающие из SCPs в кожных нервах могут объяснить наблюдаемые участки пигментации, которые образуются, когда изучаются индивидуальные меченные NCCs. Этот фенотип д. возникать если клеточные деления быстро мигрирующих NCCs ограничен, а экспансия SCP и ряда меланобластов происходит в основном внутри и вокруг нервов, заканчивающихся в специфических кожных местоположениях.
How Is Hmx1 Regulating Neuronal versus Melanocyte Cell Fates in the Ventral Migratory Pathway?
Приобретение судьбы меланобластов интимно связано со временем вычленения
NC. NCCs мигрируют в виде цепочно-подобных структур вместе с симпатическими нейронами, формирующими сначала DRG нейроны, а потом глиальные клетки в течение всего этого периода, т.к. меланоциты зарождаются из последних вычленяющихся из нервной трубки NCCs. Приобретение клетками NCCs судьбы нейронов происходит в основном внутри объединяющихся ганглиев, где Neurogenins (Ngn1 и Ngn2) обеспечивают, тогда как Isl1 и FoxS1 маркируют детерминацию в сенсорную и нейрональную судьбу, соотв. (Zirlinger et al., 2002; Marmigere and Ernfors, 2007; Montelius et al., 2007). Те клетки, которые неспособны инициировать нейрогенез оказываются временно как Sox10+ предшественники и в основном локализуются по границе ганглия, поэтому наз. DRG пограничными клетками (Montelius et al., 2007). Как экспрессия Hmx1 согласуется с нейрогенезом в DRG и с выбором судьбы нейрональных или Sox10+ клеток предшественников? Мы установили, что Hmx1 не экспрессируется в мигрирующих NCCs, но включается в DRG, одновременно с экспрессией lslet-1, а элиминация его экспрессии с помощью RNAi ведет к почти полной потере нейрогенеза. Вместо этого клетки остаются как Sox10+ клетки, расположенные вокруг латеральной поверхности DRG и вскоре после этого могут приобрести экспрессию Mitf. Этот результат указывает на Hmx1 как критический фактор для выбора между нейрональной и не-нейрональной судьбой и открывает также возможность, что он может репрессировать судьбу меланоцитов и поэтому в его отсутствие клетки в наших экспериментах приобретали судьбу меланоцитов. Хотя мы не можем исключить такой возможности, но вполне возможно, что судьба меланоцитов является вторичной по отношению к неспособности к нейрогенезу. Дифференцировка пограничных клеток в меланоциты может быть следствием инструктивных сигналов, детерминирующих эту судьбу в мультипотентных Sox10+ пограничных клетках, или альтернативно может быть следствием самопроизвольной (default) дифференцировки в отсутствие инструктивных сигналов, детерминирующих др. судьбы.
У беспозвоночных хордовых, асцидии urochordate
Ecteinascidia turbinate, NC-подобные клетки дифференцируются только в пигментные клетки. Это указывает на то, что эволюция NCCs начинается с генерации пигментных клеток и они приобретают дополнительные функции, чтобы генерировать весь репертуар типов клеток, происходящих из нервного гребня позвоночных (Jeffery et al., 2004). Это может быть связано с тем, что в NCCs, клон меланоцитов принимает самопроизвольно (default) свою судьбу, а всё разнообразие типов клеток, продуцируемых у позвоночных, является следствием приобретения новых координирующих сигналов, поддерживающих их мультипотентность и инструктурующих их дифференцировку в разные типы клеток.
The Multipotent Schwann Cell Precursor
Ранние эмбриональные нервы строятся исключительно из пучков аксонов и производных NC клеток. Происходящие из NC клетки интимно ассоциированы с возникающими нервами и начинают мигрировать своим путем через ткани тела вдоль нервов, достигая удаленных мишеней. Как только NCCs ассоциируют с аксонами возникающих нервов, они рассматриваются как SCPs и экспрессируют маркеры, такие как cadherin 19, ЕгbBЗ, protein 0 (P0), PLP и обнаруживают др. чувствительность к факторам жизнеспособности по сравнению с NCCs (Jessen and Mirsky, 2005). Мы установили, что эта популяция клеток также может служить источником многих меланоцитов кожи, подтверждая тем самым, что эти клетки обладают характеристиками мультипотетных стволовых клеток. Следовательно, растущие нервы можно рассматривать в качестве ниш для стволовых клеток и клеток предшественников, из которых посредством индуктивного рекрутирования могут генерироваться различного типа клетки. Мы идентифицировали меланоциты в качестве одного из таких типов клеток, NC вносит вклад в многочисленные типы клеток большого количества тканей во время эмбриогенеза. Дальнейшие исследования позволят выяснить роль SCPs нервов в качестве клеточного источника для дифференцированных типов клеток в др. тканях и органах.
Компетентность Krox20
+ миэлинизирующихся Шванновских клеток, происходящих из deafferented взрослых нервов, дифференцироваться в меланоциты в наших экспериментах, скорее всего, является следствием того, что прекращение пролиферации зрелых миэлинизирующихся Шванновских клеток является обратимым и эти клетки могут де-дифференцироваться и повторно вступать в клеточный цикла при повреждении нервов (Stewart et al., 1993; Dupin et al., 2003). Онтогенетический источник меланоцитов из SCPs, компетентность Krox20
+ Шванновских клеток и возможно недифференцированных SCPs, которые могут сохраняться у взрослых, чтобы генерировать меланоциты, могут предоставить информацию относительно многочисленных наблюдаемых нарушений гипо- и гиперпигментации, вызываемых изменениями в количествах меланоцитов и о механизмах репигментации и о ассоциации между нейрологическими заболеваниями и изменениями пигментации кожи. Напр., пациенты с neurofibromatosis type 1, при котором развиваются периферические нервные опухоли, состоящие в основном из Шванновских клеток, и опухолей нервных оболочек, также обнаруживают гиперпигментацию кожи (Fetsch et al., 2000; Weinreb et al., 2007). Недавно, генотоксические стрессы, как было установлено, вызывают истощение melanocyte stem cell (MSC) и необратимое поседение волос из-за их незапланированной дифференцировки (Inomata et al., 2009). Роль SCPs в формировании новых меланоцитов у взрослых, их роль во время связанного с возрастом поседения и влияние генотиксических стрессов на предполагаемый вклад меланоцитов из SCPs у взрослых ещё предстоит установить.
Nerve-SCP Interactions and Soluble Signals Regulating Melanocyte Development
Наши результаты подтверждают, что развитие меланоцитов обладает некоторыми общими сигнальными молекулами с развитием Шванновских клеток. NRG1 играет важную роль как в аксональных сигналах для жизнеспособности, так и в пролиферации SCPs (Jessen and Mirsky, 2005). NRG1, как было установлено, не только сигнал жизнеспособности и пролиферации для SCPs, учитывая непосредственный контакт между нервами и SCPs, который является обязательным условием для передачи сигналов Neuregulin в SCPs, но и, по-видимому, репрессирует судьбу меланоцитов. У erbB3-/- мышей м наблюдали достоверное увеличение меланобластов в и вокруг развивающихся нервов, несмотря на существенную потерю SCPs. Далее, в культурах DRG, содержащих пограничные клетки и в культурах SCP, NRG1 эффективно супрессировал дифференцировку меланоцитов.
Зависимость жизнеспособности SCPs от NRG1 заканчивается с переходом к незрелым Шванновским клеткам, в это время Шванновские клетки продуцируют и реагируют на факторы жизнеспособности IGF1 и PDGF (Meier et al. 1999). Наши результаты показали, что IGF1 и PDGF эффективно обеспечивают дифференцировку SCPs вдоль клона клеток меланоцитов и что передача сигналов IGF/PDGF и передач сигналов Neuregulin могут конкурировать приводя к противоположным результатам. Следовательно, вполне возможно, что глиальные предшественники увеличиваются в количестве, а передача сигналов Neuregulin оказывается ограниченной из-за конкуренции за контакты с нервами. Параллельно с увеличением количества SCPs, дифференцирующихся в незрелые Шванновские клетки, и увеличением уровней IGF1/PDGF, баланс между передачей сигналов Neuregulin и IGF1/PDGF сдвигается в пользу дифференцировки меланоцитов. Сходный механизм может иметь место у взрослых во время повреждений нервов, которые ведут к увеличению экспрессии IGF1/PDGF (Meier et al., 1999) и снижают или завершают потерю происходящей из нервов передачи сигналов Neuregulin.
Сайт создан в системе
uCoz  Figure 1. Association of Melanoblasts with Nerves in Chick and Mouse Development
(A-N). (N) Schematic spatiotemporal representation of Mitf+ melanocyte in the chick. (A-M) Solid arrows identify Mitf- cells in location 2a and arrowheads in 1 and 2b. Abbreviations are as follows: NT, neural tube; DRG, dorsal root ganglion; dm, dermamyotome; dr, dorsal ramus; snv, ventral branch of spinal nerve. The scale bars represent 50µm.
Figure 1. Association of Melanoblasts with Nerves in Chick and Mouse Development
(A-N). (N) Schematic spatiotemporal representation of Mitf+ melanocyte in the chick. (A-M) Solid arrows identify Mitf- cells in location 2a and arrowheads in 1 and 2b. Abbreviations are as follows: NT, neural tube; DRG, dorsal root ganglion; dm, dermamyotome; dr, dorsal ramus; snv, ventral branch of spinal nerve. The scale bars represent 50µm.
 Figure 7. Regulation of SCP versus Melanocyte Fate by Neuregulin Signaling
(A-E) Melanocyte development in еrB3-/- and control mice. (A-D) Mitf and Tuj1 labeling of wild-type and arB3-/- mice at Е10 (A and B) and E12 (C and D). Arrow in the inset (D) points at melanoblast associated to the nerve fiber. (E) Quantification of Mitf+ melanoblast numbers in control and arB3-/- embryos at Е10 and E12 (n = 4 animals/group; error bars represent SEM; Students t test **p < 0.01,). Abbreviations are as follows: DRG, dorsal root ganglion; dr, dorsal ramus; NT, neural tube. The scale bars represent 50µm.
дорсолатерального пути не влияют на количества меланоцитов из GFP меченных клеток, происходящие из вентрального пути, тогда как удаление нервной трубки и DRG вызывает существенное снижение количества идентифицируемых SCPs как клеточного источника меланобластов у эмбрионов кур. Некоторые остаточные нервы оказывались в конечностях ablated эмбрионов, которые могут быть источником небольшого количества оставшихся меланобластов, обнаруживаемых в этом месте. SCPs как источник меланоцитов стали очевидными в экспериментах по axotomization как во время развития, так и у взрослых, у которых потеря контактов с нервами ведет к экспрессии Mitf, это согласуется с нашим анализом ЕrbBЗ мышей, также обнаруживающих повышенные количества меланобластов. Дальнейшим подтверждением являются данные, показывающие, что гомеобоксный транскрипционный фактор Hmx1, экспрессирующийся только в нейронально детерминированных клетках, но не в меланоцитах, необходим для нейрогенеза, а его отсутствие увеличивает поличество не-нейрональных предшественников. Такое увеличение ведет к заметному повышению количества меланоцитов в коже. Используя PLP-CreERT2 мышей для генетического отслеживания производных PLP+ SCPs позволило идентифицировать SCPs как клеточный источник меланоцитов во время развития мыши. Эти данные также показывают, что DCT+/Mitf+ зрелые пигментные меланоциты происходят из SCPs, по-видимому, в коже у постнатальных животных. Комбинация всех этих результатов вкупе с time-lapse slice культуральными экспериментами подтверждает наше заключение, что SCPs вдоль нервов, иннервирующих кожные ткани являются источником меланоцитов.
Figure 7. Regulation of SCP versus Melanocyte Fate by Neuregulin Signaling
(A-E) Melanocyte development in еrB3-/- and control mice. (A-D) Mitf and Tuj1 labeling of wild-type and arB3-/- mice at Е10 (A and B) and E12 (C and D). Arrow in the inset (D) points at melanoblast associated to the nerve fiber. (E) Quantification of Mitf+ melanoblast numbers in control and arB3-/- embryos at Е10 and E12 (n = 4 animals/group; error bars represent SEM; Students t test **p < 0.01,). Abbreviations are as follows: DRG, dorsal root ganglion; dr, dorsal ramus; NT, neural tube. The scale bars represent 50µm.
дорсолатерального пути не влияют на количества меланоцитов из GFP меченных клеток, происходящие из вентрального пути, тогда как удаление нервной трубки и DRG вызывает существенное снижение количества идентифицируемых SCPs как клеточного источника меланобластов у эмбрионов кур. Некоторые остаточные нервы оказывались в конечностях ablated эмбрионов, которые могут быть источником небольшого количества оставшихся меланобластов, обнаруживаемых в этом месте. SCPs как источник меланоцитов стали очевидными в экспериментах по axotomization как во время развития, так и у взрослых, у которых потеря контактов с нервами ведет к экспрессии Mitf, это согласуется с нашим анализом ЕrbBЗ мышей, также обнаруживающих повышенные количества меланобластов. Дальнейшим подтверждением являются данные, показывающие, что гомеобоксный транскрипционный фактор Hmx1, экспрессирующийся только в нейронально детерминированных клетках, но не в меланоцитах, необходим для нейрогенеза, а его отсутствие увеличивает поличество не-нейрональных предшественников. Такое увеличение ведет к заметному повышению количества меланоцитов в коже. Используя PLP-CreERT2 мышей для генетического отслеживания производных PLP+ SCPs позволило идентифицировать SCPs как клеточный источник меланоцитов во время развития мыши. Эти данные также показывают, что DCT+/Mitf+ зрелые пигментные меланоциты происходят из SCPs, по-видимому, в коже у постнатальных животных. Комбинация всех этих результатов вкупе с time-lapse slice культуральными экспериментами подтверждает наше заключение, что SCPs вдоль нервов, иннервирующих кожные ткани являются источником меланоцитов.