Имеется множество доказательств, что передача сигналов посредством активных ретиноидов (метаболитов витамина A) важна для событий формирования раннего паттерна ЦНС позвоночных (rev. (Durston et al., 1998)). Эмбрионы позвоночных проходят через период чувствительности, начинающийся во время гаструляции, когда развивающаяся ЦНС существенно posteriorised в результате воздействия активного ретиноида all-trans-retinoic acid (RA) (Durston et al., 1989; Sive et al., 1990; Avantaggiato et al., 1996). Этот агент воспроизводит действие эндогенного межклеточного сигнала, который формирует паттерн развивающейся ЦНС на этой стадии (Doniach, 1995; Lumsden and Krumlauf, 1996; Durston et al., 1998). Ключевые регуляторные гены, участвующие в формировании паттерна ЦНС, трансактивируются непосредственно в нейроэктодерме за счет специфического связывания retinoic acid receptor (RAR) и retinoid receptor (RXR) гетеродимеров с retinoic acid responsive elements (RAREs) (Marshall et al., 1996). Среди мишеней ретиноидов находятся Hox гены, которые являются критическими для формирования паттерна задней части ЦНС (заднего и спинного мозга). Retinoid-регулируемые Hox гены представлены 3' Hox кластерами (Lumsden and Krumlauf, 1996; Durston et al., 1998; Gavalas and Krumlauf, 2000). Члены Hox paralogue groups (pg) 1-5 активируются с помощью эктопической RA, тогда как члены pg 6-9 нет (Godsave et al., 1998; BelVialar et al., 2002).
Чтобы установить онтогенетические функции ретиноидов, существует поход для проверки поседствий блокирования передачи сигналов ретиноидов. Это оказалось возможным за счёт различных подходов у разных позвоночных, напр.: истощение vitamin A у перепела (Maden et al. , 1996), блокирование RAR/RXR трансактивации за счет эктопической экспрессии доминантно негативных RAR рецепторов у Xenopus (Kolm et al., 1997; Blumberg et al., 1997; van der Wees et al., 1998), блокирование синтеза активных ретиноидов за счет мутаций генов мыши для энзима retinal dehydrogenase 2 ( Raldh2) (Niederreither et al., 1999; Niederreither et al., 2000) или мутаций гена Raldh2 у рыбок данио (Begemann at al., 2001; Grandel et al., 2002), избыточная экспрессия RA catabolising энзима CYP26 у Xenopus и рыбок данио (Hollemann et al., 1998; Kudoh et al., 2002) и использование RAR/RXR синтетических неактивных лигандов, которые конкурентно предупреждают обычное связывание RA у кур и рыбок данио (Dupe and Lumsden, 2001; Hernandez et al., 2007). Все эти исследования открывают общий фенотип, вызываемый потерей передечи сигналов ретиноидов у ранних эмбрионов позвоночных: отсутствие сегментации задней части заднего мозга (ромбомеров (r) 5-8) и трансформация этой ткани в более передние части заднего мозга. Следовательно, передача сигналов ретиноидов существенна для формирования паттерна задней части заднего мозга.
Законсервированный набор retinoid-связанных генов участвует непосредственно в закладке базовой организации заднего мозга позвоночных. Среди них гены для энзимов метаболизма витамина А (Hernandez et al., 2007), а также сеть транскрипционных факторов, которые, по-видимому, образуют границы между и качественные особенности разных ромбомеров (Vesque et al. , 1996; Helmbacher et al., 1998, Theil et al., 1998). Hox гены и их колинеарная экспрессия, по-видимому, выполняют важную роль в регионализации заднего мозга. Они (по крайней мере, наиболее 3' гены каждого кластера) экспрессируются во время очень раннего развития в дорсальной нейроэктодерме гаструлы (Wacker et al., 2004). Во время своей ранней активации Hox транскрипты обнаруживаются не только в нейроэктодерме, но и также даже раньше в мезодерме. Неожиданно было привлечено мало внимания к этой инициальной фазе экспрессии Hox и ещё меньше к экспрессии Hox генов на ст. ранней гаструлы в неорганизованной (пресомитной) мезодерме. Большинство работ, кстати, концентрировалось на более поздней роли Hox генов в формировании паттерна заднего мозга, тогда как мезодерма сама по себе, была изучена значительно позже, как источник сигналов, который формируют паттерн лежащего поверх заднего мозга: гетеротопические трансплантации у эмбрионов птиц продемонстрировали, что морфогены, испускаемые сомитами (включая RA) необходимы для закладки правильного паттерна в соседних ромбомерах (Itasaki et al., 1996; Gould et al., 1998). Несмотря на это эти эксперименты были проведены задолго после гаструляции, во время сомитных стадий и исследовали, может ли ранняя активация Hox генов или передачи сигналов ретиноидов со стадии ранней гаструлы из неорганизованной мезодермы играть роль в формировании паттерна заднего мозга.
C др. стороны, также важно выявить индуктивные события, которые ведут к соответ. Hox экспрессии в ранней мезодерме. В самом деле, неправильная экспрессия Hox генов вызывает гомеотические трансформации в производных мезодермы, таких как изменения качественные особенности позвонков (Ramirez-Solis et al., 1993; Rijli et al., 1995; Subramanian et al., 1995). Интересно, что недавно было показано посредством мутаций в регуляторных регионах как Hoxa-10, так и Hoxa-11, что эти гены специфицируют качественные особенности соотв. позвонков благодаря свой экспрессии в пресомитной мезодерме скорее, чем в сомитах, которые из неё происходят (Carapuco et al., 2005), подчеркивая важность самой ранней фазы экспрессии Hox в мезодерме.
Мы блокировали функцию ретиноидов во время раннего развития Xenopus laevis. Синтетический ретиноид AGN193109 (AGN) был охарактеризован как обладающий высоким сродством антагонист ко всем трем субтипам RAR рецепторов (Agarwal et al., 1996). Мы установили, что добавленный к эмбрионам Xenopus во время гаструляции, AGN вызывает mid-axial/hindbrain фенотипические отклонения: со ст. нейрулы, это напоминает фенотип задней части заднего мозга, получаемый ранее с помощью др. подходов (see above), подтверждая эффективность этого реагента для устранения передачи сигналов ретиноидов. Затем мы исследовали источник этих mid-axial дефектов в ЦНС во время развития Xenopus и установили, что AGN не затрагивает самую раннюю экспрессию Hox генов в (неорганизованной) мезодерме. Vitamin A deficient (VAD) у эмбрионов перепела (лишенных материнской поставки витамина А и поэтому неспособные синтезировать ретиноиды) обнаруживают сходный фенотип. В конце гаструляции обработка с помощью AGN вызывает потерю экспрессии mid-axial генов в нейроэктодерме. На этой ст. и в ранней нейруле дефекты наиболее выражены, чем вызываемые позднее, на ст. поздней нейрулы; к этому времени более ранние фенотипические отклонения частично репарируются, приводя к более локальным дефектам.
Эти результаты указывают на то, что ретиноиды участвуют в обеспечении предачи информации от мезодермы к нейроэктодерме во время гаструляции, что в общем-то соответствует трансформации сигнала в Nieuwkoop's activation-transformation модели формирования паттерна ЦНС (Nieuwkoop, 1952). Чтобы проверить это, мы блокировали функцию ретиноидов в мезодерме гаструлы за счет эктопической экспрессии в мезодермальных клетках (но не в эктодермальных клетках) RA катаболического энзима xCYP26 и RA связывающего белка xCRABP. Это блокирование нейроэктодермальной
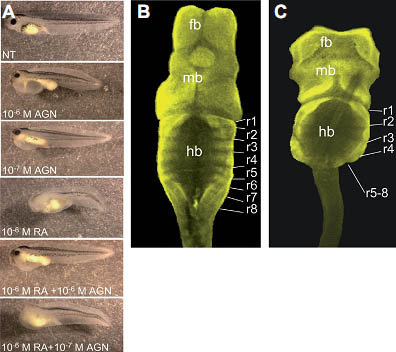 Fig. 1. AGN193109 efficiently depletes retinoid signalling in vivo. (A) The RAR antagonist AGN193109 rescues the RA phenotype. Xenopus laevis embryos incubated in 10-6
M RA show anterior truncations. Embryos incubated in 10-7 M and 10-6 M AGN show a shorter hindbrain area and a large heart oedema with the phenotype being more severe at 10-6 M. When embryos are incubated in equal concentrations (10-6 M) of RA and AGN the resulting phenotype is more like the AGN phenotype. When 10-6 M RA is combined with 10-7 M AGN the phenotype is more like an RA phenotype. NT (control). (B) AGN treatment caused severe brain malformations. CLSM images of stage 45 tadpole brains labelled with Xen1 and 2G9 antibodies. (B) Control embryo, treated with 0.1% DMSO. (C) 10-6 M AGN treated embryos (fb: forebrain; mb: midbrain; hb: hindbrain, rn refer to rhombomere numbers). In AGN treated embryos, the number of rhombomeres was reduced to 4 or 5.
Fig. 1. AGN193109 efficiently depletes retinoid signalling in vivo. (A) The RAR antagonist AGN193109 rescues the RA phenotype. Xenopus laevis embryos incubated in 10-6
M RA show anterior truncations. Embryos incubated in 10-7 M and 10-6 M AGN show a shorter hindbrain area and a large heart oedema with the phenotype being more severe at 10-6 M. When embryos are incubated in equal concentrations (10-6 M) of RA and AGN the resulting phenotype is more like the AGN phenotype. When 10-6 M RA is combined with 10-7 M AGN the phenotype is more like an RA phenotype. NT (control). (B) AGN treatment caused severe brain malformations. CLSM images of stage 45 tadpole brains labelled with Xen1 and 2G9 antibodies. (B) Control embryo, treated with 0.1% DMSO. (C) 10-6 M AGN treated embryos (fb: forebrain; mb: midbrain; hb: hindbrain, rn refer to rhombomere numbers). In AGN treated embryos, the number of rhombomeres was reduced to 4 or 5.
экспрессии заднего мозга (3') Hox генов подтверждает идею, что функция ретиноидов в мезодерме необходима для формирования паттерна соседней нейроэктодермы.
Мы полагаем, что у
Xenopus качественные особенности задней части заднего мозга (r4-8) приобретаются во время гаструляции и что ретиноиды необходимы для формирования корректного паттерна этого региона ЦНС путём регуляции экспрессии Hox генов в специфических ромбомерах (pg 1-5) и что более ранняя экспрессия тех же самых генов в подлежащей неорганизованной мезодерме не затрагивается потерей функции ретиноидов. Т.о., инициация экспрессии Hox, которая происходит в неорганизованной мезодерме во время ранней гаструляции не зависит от RA. Поэтому мы полагаем, что RA действует в качестве вертикального сигнала от этой мезодермы, чтобы инструктировать лежащую поверх проспективную область переднего мозга.
Discussion
Агонист ретиноидов AGN193109 вызывает строгие фенотипические отклонения в ЦНС Xenopus, напоминающие те, что ранее были описаны при использовании др. высоко эффективных подходов к ингибированию передачи сигналов ретиноидов (Maden et al., 1996, Kolm et al., 1997; Blumberg et al., 1997; van der Wees et al., 1998, Hollemann et al., 1998; Niederreither et al., 1999; Niederreither et al., 2000; Begemann at al., 2001; Dupe and Lumsden, 2001; Grandel et al., 2002; Kudoh et al., 2002; Hernandez et al., 2007). Эти фенотипические отклонения в задней части заднего мозга и передней части спинного мозга обнаруживаются в своей дефинитивной форме у эмбрионов на ст. поздней нейрулы. Этот "mid-axial" фенотип возникает во время гаструляции. Обработка AGN во время ст. гаструлы вызывает нарушения уже на стадии гаструлы нейральной экспрессии всех исследованных 3' передних Hox генов (Hoxd-1, Hoxa-1, Hoxb-1, Hoxd-3 и Hoxb-4), тогда как экспрессия более 5' posteriorn Hox генов (Hoxc-6 и Hoxb-9) не затрагивается. Тяжелые изменения генной экспрессии наблюдаются позднее в будущей задней области заднего мозга на ст. ранней нейрулы. Этот ранний дефект является обратным по отношению к тому, что вызывается ранним применением ретиноидов (Conlon and Rossant, 1992; Godsave et al., 1998). Дефект является более обширным, чем наблюдаемый на более поздних стадиях, как в данном исследовании, так и предыдущих исследованиях потери функции ретиноидов. Если это различие обусловлено восстановлением, происходящим на более поздних стадиях, то оно д. быть независимым от передачи сигналов ретиноидов, т.к. воздействия ингибиторов ретиноидов с конца гаструляции до личиночной стадии не могут его предупредить. Ауто- и перекрестная регуляция среди Hox генов скорее всего принимают участие, это отражает вторую Hox фазу формирования осевого паттерна в ЦНС. Было продемонстрировано на курах и мышах, что существует в самом деле вторая фаза регуляции Hox генов, которая стартует вскоре после инициации сомитогенеза и не зависит от ретиноевой кислоты, а скорее от ауто-регуляции и от взаимодействий между Hox генами (Gould et al., 1998).
В наших экспериментах, действительно, не прослеживается экспрессия 3' Hox мРНК (paralogues 1-5) в проспективной области заднего мозга на стадии ранней нейрулы после воздействия антагонистом ретиноидов (области, которая частично восстанавливает свой паттерн на последующих стадиях). Одним из возможных объяснений является то, что HOX белки остаются в области в то время, когда соотв. мРНК исчезают; эти HOX могут быть недостаточны, чтобы активировать ранн.. экспрессию нейральных Hox генов посредством известных цис-действующих HOX чувствительных элементов, поскольку ранняя экспрессия нуждается в активации ретиноидов посредством RAREs (see above). Однако как только чувствительность к ретиноидам заканчивается и RA-независимые ауто-регуляторные и перекрестно-регуляторные элементы принимают на себя нейральную регуляцию 3' Hox генов, то HOX белки продолжают оставаться в регионе и всё ещё могут быть доступны в достаточных количествах, чтобы запустить новую фазу индукции Hox. Др. возможным объяснением является то, что факторы, др. чем HOX белки сами по себе необходимы, чтобы запустить вторую фазу активации Hox в регионе заднего мозга, напр., FGF (Godsave and Durston, 1997) или WNT (McGrew et al., 1997). Если фаза вторичной активации не зависит от HOX белков, то д. появляться остатки в этом регионе, упорядоченное расположение экспрессии Hox, наблюдаемое после частичного восстановления инициальных mid-axial дефектов, д. согласовываться с Hox коллинеарностью. Независимо от объяснения становится очевидным, что во время раннего развития эмбрионы сохраняют предохранительный механизм, используемый во втором раунде упорядоченной активации Hox, что позволяет преодолеть возможный дефицит в окружении витамина А.
Мы отслеживали динамику последствий воздействия ретиноидного антагониста на экспрессию Hox во время гаструляции. Это является в точности периодом, в котором обнаруживаются первые транскрипты у вех изученных позвоночных (Deschamps and Wijgerde, 1993; Gaunt and Strachan, 1996; Wacker et al., 2004). Более того, у Xenopus, экспрессия инициируется в неорганизованной мезодерме до появления лежащей поверх нейроэктодермы. Мы установили, что антагонист ставит под угрозу экспрессию Hox в нейроэктодерме, но не оказывает эффекта на экспрессию в неорганизованной мезодерме. Чтобы подтвердить свои наблюдения и в то же самое время протестировать универсальность этого феномена у позвоночных мы использовали преимущества VAD модельного перепела. Эти эмбрионы лишены эндогенной передачи сигналов ретиноидов и поэтому открывают альтернативный подход к воздействию антагонистом у Xenopus. Анализ целых эмбрионов с помощью гибридизации in situ показал, что ранняя мезодермальная экспрессия двух 3' Hox генов (Hoxb-1 и Hoxb-4) не затронута у VAD эмбрионов, тогда как, поздняя экспрессия в нервной пластинке нарушена; этот фенотип сравним с тем, что наблюдается в нейруле Xenopus. Следовательно, нади доказательства от эмбрионов Xenopus и птиц указывают на то, что регуляция Hox в ранней параксиальной мезодерме отличается от таковой в проспективном заднем мозге и не зависит от передачи сигналов ретиноидов. Природа этой регуляции неясна.
Мы предположили, что возможная ранняя функция передачи сигналов ретиноидов д. обеспечивать перенос информации вдоль A-P оси (и тем самым экспрессию Hox) от мезодермы к нейроэктодерме. Эта идея подтверждается многими данными, включая мезодермальную локализацию RA генерирующего энзима RALDH2 у разных позвоночных (Swindell et al., 1999; Berggren et al., 1999; Haselbeck et al., 1999; Chen et al., 2001; Begemann et al., 2001) вместе с нейральным действием зависимых от ретиноидов энхансеров (Gould et al., 1998). Мы проверяли эту идею путем нокаута передачи сигналов ретиноидов в мезодерме, но не нейральной передачи сигналов ретиноидов путем целенаправленного воздействия на бластомеры мезодермальных предшественников с помощью смеси мРНК для xCYP26 и xCRABP, двух белков, которые обеспечивают деградацию ретиноидов. Воздействие эффективно устраняет раннюю нейральную экспрессию 3' Hox исследованных генов (Hoxa-1 и Hoxb-1), указывая тем самым, что передача сигналов ретиноидов необходима для передачи "vertical" сигнала (соответственно части Nieuwkoop's "transformation" сигнала), генерируемых мезодермой и которые индуцируют 3' Hox гены в нейроэктодерме.
Эксперименты, проведенные на Xenopus показывают, что ретиноидами обуспечиваемый компонент "transformation" сигнала действует до окончания гаструляции и возникает из неорганизованной мезодермы (которая включает проспективную несегментированную параксиальную мезодерму). Однако, эксперименты на эмбрионах птиц подтвердили, что позднее сомитная мезодерма также может передавать сигналы, чтобы формировать паттерн заднего мозга ретиноид-зависимым способом (Itasaki et al., 1997; Gould et al., 1998). Более того, регионализация задней части заднего мозга птиц совпадает с началом сомитогенеза (Nordstrom et al., 2006). Эти временные различия могут быть обусловлены разными характеристиками каждого из видов: у Xenopus мезодерма мигрирует как лист (involution), это может позволить появление раннего и мощного источника сигналов для формирования паттерна лежащей поверх нейроэктодермы во время гаструляции, тогда как cell-by-cell способ миграции мезодермы у эмбрионов птиц менее благоприятен для локального высвобождения морфогена (RA). Мы полагаем, что у Xenopus ретиноиды испускаются из несегментированной неорганизованной мезодермы, чтобы сформировать паттерн лежащей поверх нейроэктодермы во время гаструляционных перемещений, тогда как эмбрионы птиц подвергаются этому процессу позднее после ре-эпителизации мезодермы в сомиты, которые могут представлять мощную передачу сигналов ретиноидов в соседнюю нервную ткань. Эта передача сигналов может непосредственно обеспечивать позиционно специфическими вертикальными инструкциями или может обладать вспомогательной функцией (Gould et al., 1998). Независимо от механизма, способ действия (мезодермы на нейроэктодерму) и природа (RA) сигнала, по-видимому, общи у обоих видов и это хорошо коррелирует с предсказываемыми признаками частичной "transformation" сигнала, которые Nieuwkoop предположил задолго до того для амфибий (Nieuwkoop, 1952).
Сайт создан в системе
uCoz  Fig. 1. AGN193109 efficiently depletes retinoid signalling in vivo. (A) The RAR antagonist AGN193109 rescues the RA phenotype. Xenopus laevis embryos incubated in 10-6
M RA show anterior truncations. Embryos incubated in 10-7 M and 10-6 M AGN show a shorter hindbrain area and a large heart oedema with the phenotype being more severe at 10-6 M. When embryos are incubated in equal concentrations (10-6 M) of RA and AGN the resulting phenotype is more like the AGN phenotype. When 10-6 M RA is combined with 10-7 M AGN the phenotype is more like an RA phenotype. NT (control). (B) AGN treatment caused severe brain malformations. CLSM images of stage 45 tadpole brains labelled with Xen1 and 2G9 antibodies. (B) Control embryo, treated with 0.1% DMSO. (C) 10-6 M AGN treated embryos (fb: forebrain; mb: midbrain; hb: hindbrain, rn refer to rhombomere numbers). In AGN treated embryos, the number of rhombomeres was reduced to 4 or 5.
Fig. 1. AGN193109 efficiently depletes retinoid signalling in vivo. (A) The RAR antagonist AGN193109 rescues the RA phenotype. Xenopus laevis embryos incubated in 10-6
M RA show anterior truncations. Embryos incubated in 10-7 M and 10-6 M AGN show a shorter hindbrain area and a large heart oedema with the phenotype being more severe at 10-6 M. When embryos are incubated in equal concentrations (10-6 M) of RA and AGN the resulting phenotype is more like the AGN phenotype. When 10-6 M RA is combined with 10-7 M AGN the phenotype is more like an RA phenotype. NT (control). (B) AGN treatment caused severe brain malformations. CLSM images of stage 45 tadpole brains labelled with Xen1 and 2G9 antibodies. (B) Control embryo, treated with 0.1% DMSO. (C) 10-6 M AGN treated embryos (fb: forebrain; mb: midbrain; hb: hindbrain, rn refer to rhombomere numbers). In AGN treated embryos, the number of rhombomeres was reduced to 4 or 5.