Помимо доставки транскриптов в специфические регионы, включая синапсы, RBPs также регулируют трансляцию связанных мРНК как во время, так и после их транспорта (reviewed in (13) and (14)). Принимая во внимание важность miRNAs для пост-транскрипционной регуляции, предложена привлекательная модель, согласно которой miRNAs действуют совместно с RBPs, чтобы контролировать локальную трансляцию синаптических РНК. В самом деле, недавние исследования fragile X mental retardation protein (FMRP), который, как известно, соединяется с РНК, подтверждая возможность, что локальное ингибирование трансляции координируется с помощью аппарата процессинга miRNA и RBPs. Fragile X syndrome (FXS), наиболее распространенная наследственная причина умственной отсталости, по-видимому, в первую очередь вызывается транскрипционным молчанием гена
(15, 16). Этот ген кодирует FMRP, который негативно регулирует синтез белков дендритов. В конечном итоге освобождение от FMRP-обусловленного ингибирования трансляции при FXS, как полагают, вмешивается в нормальные морфологические изменения, необходимые для формирования памяти, поскольку нарушение познавательной способности у FXS пациентов тяжелое, индивиды с этим нарушением обычно обнаруживают дефицит оперативной памяти (15). некоторые недавние исследования увязали функцию FMRP с miRNAs.
гомолог FMRP (dFMR1/dFXR), как было установлено, ассоциирует с RISC (17) и взаимодействует с Dicer и miR-2b miRNA в S2 клетках (16, 17), а
активность dFMR1 во время роста личиночных синапсов контролируется, по крайней мере, частично с помощью RISC белка Argonaute 1 (18). Более того, при изучении обонятельного классического conditioning у
, зависимая от синтеза белка long-term memory (LTM) нуждается в присутствии FMRP и в его взаимодействии с Argonaute 1, поскольку избыточный синтез белка ведет к дефектам памяти (19). Эти результаты указывают на то, что FMRP и miRNAs возможно действуют вместе, чтобы ингибировать трансляцию в дендритах. Одной из привлекательных моделей является та, согласно которой miRNAs помогают идентифицировать соответствующие мРНК транскрипты для супрессии с помощью FMRP (18). Однако идентифицированы немногие miRNAs, которые ассоциируют с FMRP, и полное понимание молекулярных основ того, как FMRP/Argonaute 1-обеспечиваемое трансляционное подавление отличается от предыдущих моделей FMRP регуляции, пока не достигнуто.
Хотя ряд miRNAs, как было показано, важен для развития и дифференцировки нейронов (6, 7), мало известно о путях, с помощью которых miRNAs могут управлять инициацией и созреванием синапсов. В 2008 появились доказательства, что let-7, одна из первых открытых miRNAs (1), также может играть роль в развитии у
Drosophila neuromuscular junctions (NMJs) (20, 21). В отсутствие let-7, а также lin-4 гомолога miR-125, созревание абдоминальных NMJ аномально, и это может быть объяснено с помощью неспособности подавлять ген
abrupt (ab) в мышечных клетках (21). Когда
let-7 и
miR-125 одиночные мутанты были сравнены, то
miR-125 мутанты обладали нормальными NMJs, тогда как
let-7 мутанты продолжали обнаруживать серьёзные дефекты с структуре NMJ, демонстрируя, что мутация
let-7 ответственна за этот фенотип (20). Интересно, что члены мышиного let-7 семейства экспрессируются в нейронах и мышцах (22, 23), открывается возможность, что они могут играть консервативную роль в развитии синапсов у млекопитающих. Заметим, что вторичная miRNA, miR-1, была идентифицирована на эту роль поддержания гомеостаза нейромышечных соединений у
C. elegans (24). У животных дикого типа мышцы стенки тела сокращаются в ответ на связывание acetylcholine (ACh) с nicotinic acetylcholine receptors (nAChRs) в нейромышечных соединениях. miR-1 способна модулировать мышечную чувствительность к Ach путем доставки двух рецепторных субъединиц nAChR, unc-29 и unc-63. miR-1 также поставляет MEF-2, транскрипционный фактор, обнаруженный с мышцах
C. elegans, который модулирует RAB-3-зависимую секрецию ACh посредством неизвестного ретроградного сигнального механизма. В конечном итоге авт. предположили, что miR-1 представляет быстрый способ изменения чувствительности к ACh и высвобождается, чтобы поддерживать сбалансированную синаптическую функцию. В будущем было бы интересно не только установить, как miR-1 воспринимает изменения в чувствительности к ACh и трансдуцирует сигналы на unc-29 и unc-63, но и также идентифицировать, как MEF-2 передает сигналы пресинаптическим нейронам, чтобы ограничивать высвобождение ACh с помощью RAB-3. В центральных нейронах форма, размеры и количество постсинаптических структур также д. тонко регулироваться во время развития и в течение всей жизни нейрона. miR-134, специфичная для головного мозга miRNA, обнаруживается вблизи синапсов в дендритах млекопитающих, она контролирует размеры дендритных шипов. Schratt et al. показали, что избыточная экспрессия miR-134 ведет к уменьшению толщины и объема шипов из-за подавления Lim-domain-containing protein kinase 1 (Limk1), и что стимуляция BDNF ведет к высвобождению ингибирования с помощью miR-134 и усилению трансляции
Limk1 (25). Авт. полагают, что miR-134 может быть важной для ограничения трансляции
Limk1 во время её транспорта в синапсы. Неожиданно, miR-134 ассоциирует с полисомными фракциями вследствие обработки BDNF, указывая тем самым, что miR-134 продолжает связывать Limk1 во время белкового синтеза (25). Помимо своих эффектов на регуляцию miR-134, BDNF, как было показано, также запускает активацию транскрипции miR-132 с помощью calcium response element binding protein (CREB), транскрипционного фактора, который контролирует множество клеточных разнообразных адаптивных реакций в нервной системе (26). miR-132 необходима для ингибирования трансляции P250GAP, известного из семейства Rho GTPase-активирующего белка и индукции роста дендритов. Возможно, что miR-132 нацелена непосредственно на P250GAP, поскольку трансфекция мутантной формы P250GAP, содержащей модифицированный сайт мишень для miR-132, ведет к снижению зависимого от активности морфогенеза дендритов. Находка, что активность ведет к ингибированию одной из miRNA и активации др. указывает на то, что регуляция RISC и др. белков необходима для биогенеза miRNA , а на её функцию могут оказывать влияние специфические РНК, с которыми они связаны. Это д. сделать возможной дифференциальную экспрессию разных популяций miRNA мишеней до и во время стимуляции нейронов. Все эти исследования синапсов у
Drosophila, C. elegans и млекопитающих иллюстрируют некоторые важные роли, которые miRNAs в структуре и функции синапсов. В будущем интересно охарактеризовать функции многих др. miRNAs, которые экспрессируются в мышцах или нервной системе. Эти исследования д. преодолеть трудности в исследовании miRNA, включая присутствие множественных копий или родственных семейств генов miRNA, а также отсутствие маркированных фенотипов - или присутствие летальности - у генетических мутантов (4). Более того, они могут санкционировать идентификацию мутаций генов, известных своим взаимодействием с miRNAs. Некоторые исследования, описанные в данном обзоре (19, 26, 27), были заторможены подозреваемыми miRNA мишенями, использующими метод генного нокдауна, наз. RNA interference (RNAi), которая также базируется на функции RISC (28, 29). Потенциально избыточное насыщение путями замалчивания РНК с помощью RNAi д. приводить к фенотипам, которые трудно интерпретировать или которые запутывают дальнейший анализ, как это наблюдалось (30).
MiRNAs and the molecular model of memory
Уже давно было распознано, что новый синтез белков необходим для формироания long-term memories (LTMs) (31). Fig. 2 представляет упрощенную точку зрения на современную молекулярную модель памяти, процесс подробно рассмотрен Hernandez and Abel (32). Короче, долговременное укрепление синаптических соединений между клетками, которое лежит в основе формирования LTM, также известное как long-term potentiation (LTP), проистекает из трансдукции электрической стимуляции на постсинаптической мембране в химические сигналы, включая увеличение внутриклеточных уровней кальция и активацию Ca
2+/calmodulin-зависимой
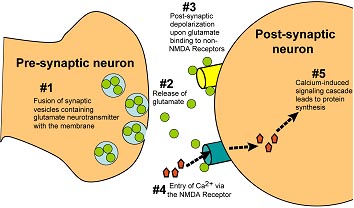 Fig. 2. Long-term memory formation consists of several sequential steps. Following depolarization of the presynaptic neuron, vesicles containing the glutamate neurotransmitter fuse with the presynaptic membrane and glutamate is released (steps 1 and 2). Binding of glutamate to the non-NMDA receptor opens the receptor channel, leading to postsynaptic Na+ influx and membrane depolarization (step 3). Depolarization results in removal of an Mg2+ block in the NMDA receptors, permitting Ca2+
entry into the cell (step 4), CaMKII activation, and ultimately protein synthesis (step 5).
Fig. 2. Long-term memory formation consists of several sequential steps. Following depolarization of the presynaptic neuron, vesicles containing the glutamate neurotransmitter fuse with the presynaptic membrane and glutamate is released (steps 1 and 2). Binding of glutamate to the non-NMDA receptor opens the receptor channel, leading to postsynaptic Na+ influx and membrane depolarization (step 3). Depolarization results in removal of an Mg2+ block in the NMDA receptors, permitting Ca2+
entry into the cell (step 4), CaMKII activation, and ultimately protein synthesis (step 5).
protein kinase II (CaMKII). Эти клеточные изменения в конечном итоге ведут к усилению генной транскрипции и трансляции, включая синтез синаптических белков. Один из факторов, как известно участвующий в контроле локальной трансляции в синапсах, это cytoplasmic polyadenylation element binding protein (CPEB), который соединяется с CPE элементами в 3'UTRs мРНК мишеней и регулирует полиаденилирование. Когда CPEB фосфорилируется во время нейрональной активности, то cleavage and polyadenylation specificity factor (CPSF) рекрутируется на мРНК мишень и вызывает ингибирование трансляции (33).
Поразительно, делеция CPEB или удаление его сайта фосфорилирования приводит к разрушению локального трансляционного контроля и к дефектам формирования памяти и/или синаптическим изменениям, ассоциированными с LTP. Для детального обсуждения регуляции CPEB, а также др. известных механизмов локального трансляционного контроля см. (34). Интересно, что 3'UTR у CaMKII содержит сайты связывания для CPEB, CPSF и miRNAs в тесной близи (35), это делает возможным, что фосфорилирование CPEB и запуск с помощью miRNA ингибирования могут действовать перекрывающе, гарантируя усиление активности CaMKII вследствие стимуляции нейронов. Находки на
Drosophila согласуются с этой гипотезой. Авт. наблюдали, что в ответ на активность процессинг miRNA нарушается благодаря избирательной деградации RBP и RISC компонента Armitage, приводя к усилению нахождения синаптических целей и трансляции CaMKII (36). Более того, Schratt et al. показали, что репрессия Limk1 с помощью индивидуальной miRNA, miR-134, также устраняется после активации synaptoneurosomes крыс с помощью BDNF (25). Однако данные указывают также на то, что процессинг и регуляция miRNA не всегда ингибируются во время LTP. Транскрипция miR-132 усиливается вследствие воздействия BDNF (26), а Lugli et al. получили доказательства, что увеличение внутриклеточного Ca
2+ после постсинаптической стимуляции активирует calpain protease, это в свою очередь ведет к высвобождению активированных Dicer и eIF2c, известных компонентов RISC, из PSD (11). Если аппарат процессинга miRNA может быть деградирован в некоторых случаях и активирован в др., то перекрывание miRNA, CPEB и CPF сайтов в CaMKII 3'UTR д. создавать способ независимой регуляции CaMKII в отношении др. CPE-содержащих мРНК. Исследование этой возможности не только важно, чтобы оценить физиологическое значение этих цис-регуляторных элементов, но и также для дальнейшего выяснения локальных изменений в трансляции индивидуальных мРНК как во время. так и после активности нейронов. С идентификацией дополнительных синаптических miRNAs и их мишеней станет возможным определение, функционируют ли они совместно с CPEB или играют противоположную роль во время формирования памяти. До проведения этих экспериментов важно различать, обусловлены ли фенотипические отклонения Dicer и др. известных компонентов RISC исключительно их ролями в биогенезе miRNA, или эти белки могут также регулировать независимые процессы во время синаптической пластичности. Недавнее исследование Berdnik et al. говорит в пользу последней возможности. У
Drosophila авт. наблюдали, что как pasha, так и Dicer-1 необходимы для нормального морфогенеза обонятельных проекций нейронов (37). Интересно, что мутации стержневых компонентов RISC
AGO-1 и AGO-2 не приводят к заметным дефектам. Поскольку это может быть обусловлено персистенцией белка из родительских клеток или возможностью, что
AGO1 аллель скорее гипоморфен, чем , чем настоящий нулевой аллель, альтернативное объяснение в том. что pasha иDicer-1 играют жизненно важную роль в нейральном развитии, которое не связано с функцией в RISC.
CONCLUSIONS
In this review, we have presented pioneering work that reveals a new role for miRNAs in synaptic development and function. These studies not only demonstrate that miRNA-mediated inhibition is important for maintaining homeostasis at the neuromuscular junction, but they also show that release of this inhibition can be an important part of synaptic plasticity in the central nervous system. Protein synthesis has long been identified as essential for the formation of long-term memories, and it is therefore exciting, but not entirely surprising, that miRNAs are involved in this process. This is a field that has developed quickly, and with the identification of numerous brain-specific miRNAs in recent years (23), it promises to continue to yield exciting discoveries in the near future.
Сайт создан в системе
uCoz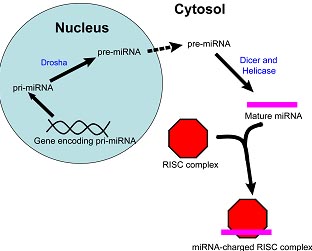 Fig. 1. A simplified diagram of miRNA biogenesis, beginning with miRNA transcription in the nucleus and concluding with the loading of the mature miRNA into RISC in the cytoplasm.
По большей части, мРНК не диффундируют свободно по всей клетке, а направляются в специфические места с помощью ribonucleoprotein (RNP) комплексов, которые часто являются частью крупных РНК транспортирующих гранул (for an excellent recent review of mRNA localization, see (9)). Как результат, miRNA-обеспечиваемая регуляция д. не только зависеть от комплементарности последовательностей с мРНК мишенями, но и также от того, локализованы ли они в том же самом клеточном пространстве и в то же самое время. Если зрелые miRNAs присутствуют в теле клетки, напр., то они скорее всего регулируют отличный (и, скорее всего, боле крупный) пул транскриптов, чем когда они обнаруживаются в индивидуальных синапсах. Более того, поскольку miRNAs часто действуют комбинаторно, подобно транскрипционным факторам, поэтому набор зрелых miRNAs в определенном месте будет влиять, какие транскрипты будут служить целью и до какой степени они будут подавлены (10). Многие механизмы, по-видимому, контролируют какие специфические мРНК и miRNAs будут ко-локализоваться в нейроне. Мало того, зрелые miRNAs будут соединяться с мРНК до их распознавания с помощью RNA binding proteins (RBPs) для транспорта. Т.к. и miRNAs и RBPs, как известно, распознают мРНК транскрипты посредством cis-localization элементов в своих 3'UTRs, то вполне возможно. что связывание miRNA/ RISC комплекса одним сайтом будет стерически препятствовать распознаванию соседнего регуляторного сайта с помощью RBPs, приводя к удержанию и мРНК и зрелых miRNA в определенном клеточном компартменте. Поочередно cis-действующие метки локализации д. будут представлять или pre-miRNA или зрелые miRNA последовательности и приводить к независимому транспорту miRNAs в синапсы. Возможность, что pre-miRNAs будет расщепляться в синапсах, чтобы давать зрелые miRNAs, подтверждается находками, что аппарат процессинга miRNA локализуется не только в теле клетки. Иммуноокрашивание показало, что и Dicer и Argonaute белок eiF2c, стрежневой компонент RISC, в дендритных шипах (spines) (11), в месте положения большинства возбуждающих синапсов зрелой нервной системы млекопитающих (reviewed in (12)). Более того, Dicer и Argonaute, по-видимому, обогащены в post-synaptic densities (PSDs), толстых и электрон-плотных регионах пост-синаптической мембраны (11).
Fig. 1. A simplified diagram of miRNA biogenesis, beginning with miRNA transcription in the nucleus and concluding with the loading of the mature miRNA into RISC in the cytoplasm.
По большей части, мРНК не диффундируют свободно по всей клетке, а направляются в специфические места с помощью ribonucleoprotein (RNP) комплексов, которые часто являются частью крупных РНК транспортирующих гранул (for an excellent recent review of mRNA localization, see (9)). Как результат, miRNA-обеспечиваемая регуляция д. не только зависеть от комплементарности последовательностей с мРНК мишенями, но и также от того, локализованы ли они в том же самом клеточном пространстве и в то же самое время. Если зрелые miRNAs присутствуют в теле клетки, напр., то они скорее всего регулируют отличный (и, скорее всего, боле крупный) пул транскриптов, чем когда они обнаруживаются в индивидуальных синапсах. Более того, поскольку miRNAs часто действуют комбинаторно, подобно транскрипционным факторам, поэтому набор зрелых miRNAs в определенном месте будет влиять, какие транскрипты будут служить целью и до какой степени они будут подавлены (10). Многие механизмы, по-видимому, контролируют какие специфические мРНК и miRNAs будут ко-локализоваться в нейроне. Мало того, зрелые miRNAs будут соединяться с мРНК до их распознавания с помощью RNA binding proteins (RBPs) для транспорта. Т.к. и miRNAs и RBPs, как известно, распознают мРНК транскрипты посредством cis-localization элементов в своих 3'UTRs, то вполне возможно. что связывание miRNA/ RISC комплекса одним сайтом будет стерически препятствовать распознаванию соседнего регуляторного сайта с помощью RBPs, приводя к удержанию и мРНК и зрелых miRNA в определенном клеточном компартменте. Поочередно cis-действующие метки локализации д. будут представлять или pre-miRNA или зрелые miRNA последовательности и приводить к независимому транспорту miRNAs в синапсы. Возможность, что pre-miRNAs будет расщепляться в синапсах, чтобы давать зрелые miRNAs, подтверждается находками, что аппарат процессинга miRNA локализуется не только в теле клетки. Иммуноокрашивание показало, что и Dicer и Argonaute белок eiF2c, стрежневой компонент RISC, в дендритных шипах (spines) (11), в месте положения большинства возбуждающих синапсов зрелой нервной системы млекопитающих (reviewed in (12)). Более того, Dicer и Argonaute, по-видимому, обогащены в post-synaptic densities (PSDs), толстых и электрон-плотных регионах пост-синаптической мембраны (11).  Fig. 2. Long-term memory formation consists of several sequential steps. Following depolarization of the presynaptic neuron, vesicles containing the glutamate neurotransmitter fuse with the presynaptic membrane and glutamate is released (steps 1 and 2). Binding of glutamate to the non-NMDA receptor opens the receptor channel, leading to postsynaptic Na+ influx and membrane depolarization (step 3). Depolarization results in removal of an Mg2+ block in the NMDA receptors, permitting Ca2+
entry into the cell (step 4), CaMKII activation, and ultimately protein synthesis (step 5).
protein kinase II (CaMKII). Эти клеточные изменения в конечном итоге ведут к усилению генной транскрипции и трансляции, включая синтез синаптических белков. Один из факторов, как известно участвующий в контроле локальной трансляции в синапсах, это cytoplasmic polyadenylation element binding protein (CPEB), который соединяется с CPE элементами в 3'UTRs мРНК мишеней и регулирует полиаденилирование. Когда CPEB фосфорилируется во время нейрональной активности, то cleavage and polyadenylation specificity factor (CPSF) рекрутируется на мРНК мишень и вызывает ингибирование трансляции (33).
Fig. 2. Long-term memory formation consists of several sequential steps. Following depolarization of the presynaptic neuron, vesicles containing the glutamate neurotransmitter fuse with the presynaptic membrane and glutamate is released (steps 1 and 2). Binding of glutamate to the non-NMDA receptor opens the receptor channel, leading to postsynaptic Na+ influx and membrane depolarization (step 3). Depolarization results in removal of an Mg2+ block in the NMDA receptors, permitting Ca2+
entry into the cell (step 4), CaMKII activation, and ultimately protein synthesis (step 5).
protein kinase II (CaMKII). Эти клеточные изменения в конечном итоге ведут к усилению генной транскрипции и трансляции, включая синтез синаптических белков. Один из факторов, как известно участвующий в контроле локальной трансляции в синапсах, это cytoplasmic polyadenylation element binding protein (CPEB), который соединяется с CPE элементами в 3'UTRs мРНК мишеней и регулирует полиаденилирование. Когда CPEB фосфорилируется во время нейрональной активности, то cleavage and polyadenylation specificity factor (CPSF) рекрутируется на мРНК мишень и вызывает ингибирование трансляции (33).