Генез ограничивающих мембран способен избирательно разделять биохимические реакции от внешней среды, скорее всего, является одним из самых ранних и наиболее важных событий при переходе от абиотического к биотическому миру во время эволюции жизни ена Земле (1). Несмотря на фундаментальную роль клеточных мембран в определении клеток и органелл, наше понимание того, как липиды, ключевые молекулярные элементы структуры мембран, перемещаются внутри и между мембранами прокариот и эукариот остается рудиментарным.
Основными структурными липидами клеточных мембран исследуемых организмов, таких как грам-отрицательные бактерии (Escherichia coli), дрожжи (Saecharomyces cerevisiae), насекомые {Drosophila melanogaster), рыбы (Danio rerio), и млекопитающие (Mus sp, Rattus sp, и Homo sapiens), являются glycerophospholipids. Растения (Arabidopsis thaliana) также содержат существенное дополнение glycerophospholipids, но их основными структурными липидами являются glycosyldiacylglyсerols, возможно вследствие эволюционной адаптации к ограничениям средовых фосфатов. Кроме того, эукариоты содержат стеролы и sphingolipids в качестве структурных липидов, которые в большинстве случаев многочисленны в плазматических мембранах. У E. coli, phosphatidylethanolamine (PtdEtn) является доминирующим структурным липидом, в меньших количествах cardiolipin (Ptd2Gro) и phosphatidylglycerol (PtdCro). У большинства эукариот, phosphatidylcholine (PtdCho) является доминирующим структурным липидом, в меньших количествах PtdEtn, phosphatidylinositol (Ptdlns), phosphatidylserine (PtdSer) и Ptd2Gro. Sphingolipids являются минорными составляющими в общем репертуаре клеточных липидов, но заметно обогащены в компартменте плазматической мембраны. Обогащение стеролами плазматических мембран идет параллельно с обогащением sphingolipid. Классы Sphingolipid у эукариот могут быть в широком смысле подразделены на phospho-sphingolipids, такие как sphingomyelin (CerPCho) у млекопитающих и inositol sphingolipids (CerPIns-X) у дрожжей и растений, и glycosphingolipids [e.g., glucosyiceramide (GlcCer), содержащие большой набор mono-, di- и сложных oligosaccharides, присутствующих у млекопитающих и растений. Крупный размер липидома (lipidome) наиболее полно оценен с помощью современной техники масс спектрометрии, позволяющей почти полностью определять количества уникальных видов липидов (2). Хотя количество уникальных молекулярных видов липидов в данном организме может показаться изумительным, биохимическая структура почти всегда связана с биологической функцией и этот максимум не д. ограничиваться только рассмотрением белков, нуклеиновых кислот и углеводов.
MECHANISTIC CONSIDERATIONS OF TRANSPORT PROCESSES
Два фундаментальных способа транспорта клеточных липидов могут быть подразделены между внутримембранными и межмембранными процессами. Концептуально наипростейшей формой внутримембранного транспорта является перемещение липидов из одного полу-листка мембранного бислоя на противоположный полу-листок, как показано на Рис. 1. Классическим примером этого феномена является перемещение через двойной слой фосфолипидов между наружным и внутренним листками плазматической мембраны прокариот и эукариот. В отсутствие реципрокного обмена липидами между листками мембраны трансмембранное перемещение липидов д. вызывать усадку одного листка и увеличение др., тем самым д. изменяться кривизна в закрытой мембранной системе. Связь простого перемещения трансмембранных липидов с биосинтезом молекул липидов может позволять сбалансированный рост обоих листков бислоя в условиях, когда половина вновь синтезированных молекул становится предметом транспорта через двойной слой. Для любой мембранной системы кинетический баланс между реципрокным и net transbilayer перемещением липидов и синтезом липидов д. иметь выраженное влияние как ка кривизну, так и состав листков бислоя.
Внутримембранное перемещение липидов может принимать более сложный характер, как это происходит, когда липиды транспортируются между донорским и акцепторным листками бислоя и быстро удаляются с последнего. Суммарное воздействие процесса быстрого удаления ведет к утечке липидов с внутреннего листка мембраны во внемембранный компартмент. Обе transbilayer транспортная ступень и ступень утечки могут потенциально возникать, по крайней мере, двумя разными способами. первый маршрут это прямой перенос липидов на внемембранные акцепторы при отсутствии времени пребывания на противоположном листке до переноса на экзогенный акцептор. Др. уровень сложности возникает, когда липид, пересекающий бислой, происходит от экзогенного донора. Множественные маршруты транспорта возможны и при одном крайнем маршруте передвижения липидов происходит инсерция в один листок при достаточном времени пребывания в этом положении, что сопровождается transbilayer перемещением и значительным временем пребывания во втором листке.
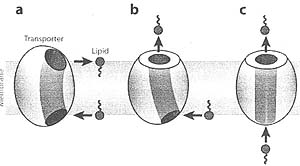 Figure 1
Intramembrane lipid transport processes. Intramembrane lipid transport can occur by multiple routes, (a) The lipid undergoes transbilayer movement with entry into the transporter from one leaflet and exit from the transporter into the opposing leaflet. This type of transport is often characterized by significant residence rime of the lipid in both leaflets of the membrane bilayer. (/;) The lipid enters the transporter from one leaflet but exits the transporter to an exogenous acceptor distinct from the opposing leaflet. The net effect of this transport mode is to efflux the lipid from the membrane after residence in only one of the membrane leaflets, (t) The lipid enters the transporter from an exogenous donor, which could be either a carrier protein ot a membrane separate from the membrane harboring the transporter. This latter mechanism can occur without residence of the lipid in either leaflet of the bilayer and is similar to transport mechanisms for ions and solutes. Multiple combinations of the routes shown in a, h, and ' are also possible.
Figure 1
Intramembrane lipid transport processes. Intramembrane lipid transport can occur by multiple routes, (a) The lipid undergoes transbilayer movement with entry into the transporter from one leaflet and exit from the transporter into the opposing leaflet. This type of transport is often characterized by significant residence rime of the lipid in both leaflets of the membrane bilayer. (/;) The lipid enters the transporter from one leaflet but exits the transporter to an exogenous acceptor distinct from the opposing leaflet. The net effect of this transport mode is to efflux the lipid from the membrane after residence in only one of the membrane leaflets, (t) The lipid enters the transporter from an exogenous donor, which could be either a carrier protein ot a membrane separate from the membrane harboring the transporter. This latter mechanism can occur without residence of the lipid in either leaflet of the bilayer and is similar to transport mechanisms for ions and solutes. Multiple combinations of the routes shown in a, h, and ' are also possible.
Во втором крайнем случае липиды могут вступать в транспортный канал и проходить через бислой без какого-либо времени пребывания в любом из листков (see Figure I). Этот последний механизм наиболее типичный путь, представляющий вступление и транспорт субстрата, для ионных и растворимых транспортеров и ионных каналов. Между двумя крайностями возможны множественные перестановки, такие как время пребывания только в одном из двух бислоёв. Заметим, что одним из фундаментальных отличий между transbilayer транспортерами ионов и растворов и transbilayer транспортерами липидов является способность липидов располагаться в любом или обоих листках бислоя, который они пересекают. Это фундаментальное отличие ставит важные вопросы о структуре мест входа и выхода субстрата в транспортной молекуле, которая д. диктовать, будет ли липидный субстрат располагаться на той же самой мембране или на оппозитной мембране.
Процессы межмембранного транспорта липидов являются основными путями, используемыми в новом биогенезе мембран и органелл у прокариот и эукариот. Все эти процессы., кстати, предполагают отсутствие непрерывности между компартментами донорских и акцепторных мембран, это неизбежно влечет участие белковых компонентов как существенных элементов аппарата транспорта (3). Сегодня имеются доказательства для транспорта липидов между органеллами посредством как везикулярного, так и не везикулярного пути. Везикулярный способ в основном следует каноническими путями для транспорта мембранных белков между эндоплазматическим ретикулемом, аппаратом Гольджи и плазматической мембраной (4). Множественные эндоцитические пути также участвуют в перераспределении липидов с плазматической мембраны на множественные внутриклеточные компартменты (5, 6). Хотя мы интуитивно представляли, что липиды предопределяют структуру везикулярных мембран, которые разносят мембранные и секреторные белки между разными органеллами, четкие генетические и фармакологические доказательства показали, что арест переноса мембранных и секреторных белков оказывает незначительный эффект на транспорт phospholipids, sterols и субнаборов из sphingolipids в системах эукариот (7-16). Генетические и биохимические исследования выявили природу этих путей транспорта липидов, независимых от пузырьков. которые, по-видимому, более исконные, чем пути транспорта белков, поэтому они АТФ независимы и не используют малые GTPases в качестве переключателей для контроля процессов.
Несколько моделей не везикулярного липидного транспорта описывают сборку белковых и липидных комплексов на донорских и/или акцепторных мембранах, которые регулируют и катализируют липидный транспорт, как показано на рис. 2. Один способ
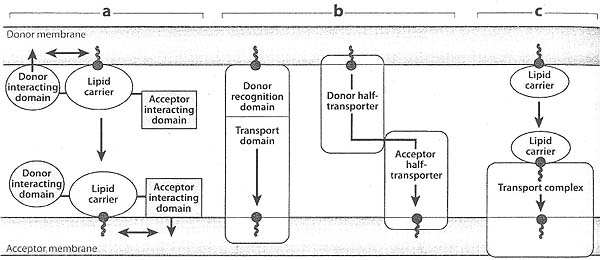 Figure 2
Mechanisms for intermembrane transport. Three types of nonvesicular transport are depicted, (a) The first type utilizes a soluble lipul carrier, which contains interaction domains tor donor and acceptor membranes, and a lipid-binding domain for cargo. The interaction domains specifically target the molecule to either a donor or an acceptor membrane, tor cargo loading and unloading, respectively. The membrane attachment by the interaction domains and lipid loading or unloading are anticipated to be mutually influential (double arrmzs), such that the interaction domains would be expected to increase or decrease the affinity of the carrier domain for cargo. Likewise, the binding or release of cargo to a given membrane is anticipated to alter die affinity of the interaction domains. (Ј) In the second type of transport, a transport protein or complex that is integral to an acceptor membrane probes a donor membrane for the correct lipid and binds and transports the lipid. The interaction of the transporter with the donor membrane is dictated by both the protein and lipid environments of the donor membrane. A variation of this second mode of transport is the presence of two partial transporters on the donor and acceptor membranes that dock with each other to form a competent transporter, (c) The third mode of transport combines the first two and utilizes a soluble lipid carrier that is recognized by a transport complex, which conveys the lipid from the carrier to the membrane.
Figure 2
Mechanisms for intermembrane transport. Three types of nonvesicular transport are depicted, (a) The first type utilizes a soluble lipul carrier, which contains interaction domains tor donor and acceptor membranes, and a lipid-binding domain for cargo. The interaction domains specifically target the molecule to either a donor or an acceptor membrane, tor cargo loading and unloading, respectively. The membrane attachment by the interaction domains and lipid loading or unloading are anticipated to be mutually influential (double arrmzs), such that the interaction domains would be expected to increase or decrease the affinity of the carrier domain for cargo. Likewise, the binding or release of cargo to a given membrane is anticipated to alter die affinity of the interaction domains. (Ј) In the second type of transport, a transport protein or complex that is integral to an acceptor membrane probes a donor membrane for the correct lipid and binds and transports the lipid. The interaction of the transporter with the donor membrane is dictated by both the protein and lipid environments of the donor membrane. A variation of this second mode of transport is the presence of two partial transporters on the donor and acceptor membranes that dock with each other to form a competent transporter, (c) The third mode of transport combines the first two and utilizes a soluble lipid carrier that is recognized by a transport complex, which conveys the lipid from the carrier to the membrane.
Не везикулярного транспорта использует растворимые белки переносчики липидов, которые содержат захватывающие домены для донорских и акцепторных мембран и циркулируют между мембранами (13). Чтобы инициировать цикл носитель соединяется с донором и забирает его липидный груз. затем носитель диффундирует к акцепторной мембране, присоединяется и высвобождает липидный груз. Высвобождение носителя и его диффузия обратно к донорской мембране инициирует цикл повторно. Второй способ не везикулярного транспорта липидов собирает зрелые транспортные комплексы между донорской и акцепторной зонами в месте соединения двух мембран (17). Транспортные комплексы избирательно перемещают специфические phospholipids между мембранами. Третий способ не везикулярного транспорта использует растворимые переносчики липидов которые отлавливаются с помощью ассоциированных с мембранами receptor/transporter комплексов (18). После отлавливания носитель переносит свое содержимое на транспортер для инсерции в органеллы.
Роль растворимых и диффундирующих переносчиков липидов в процессе не везикулярного транспорта липидов базруется на пионерских работах Wirtz & Zilversmit (19, 20). Они описали растворимые lipid transfer/exchange белки, которые выполняли эквивалентный обмен липидов между популяциями синтетических липидных пузырьков или между пузырьками и органеллами или между различными органеллами. Этот процесс обмена прослеживался с помощью радиомеченного донорского компартмента (напр., липосом или микросом) и не меченного акцепторного компартмента (e.g., липосом или митохондрий), которые были разделены дифференциальным центрифугированием или с помощью методов affinity capture. Основным недостатком модели простых белков липидного обмена была общая неспособность белков влиять на суммарный перенос больших количеств липидов между компартментами мембран in vitro. Теперь идентифицированы члены этих семейств белков липидных транспортеров, которые регулируются с помощью межбелковых взаимодействий, белок-липидных взаимодействий и фосфорилирования, каждый из которых функционирует, чтобы найти растворимые носители для распознавания органелл, загрузки и разгрузки груза и суммарного переноса липидных молекул (13,15,21-25).
INTRAMEMBRANE LIPID TRANSPORT
4 основных семейства внутримембранных липидных транспортеров используются в современных исследованиях, это P-type ATPases, ABC transporters, scramblases и Niemann-Pick type C (NPС) семейства белков. Доступность информации о последовательностях геномной ДНК способствовала быстрой идентификации гомологов и ортологов исторических членов основателей этих семейств и стимулировала быструю экспансию их характеристик и генетического устранения. Такой reverse генетический анализ, понятно, привел к пробелам в определении биохимических функций генных продуктов, которые нуждаются в определении. как генетические повреждения ответственны за физиологические дефекты, наблюдаемые на клеточном и организменном уровне.
P-type ATPase
Название P-type ATPase происходит от промежуточных образований фосфорилированных энзимов, которые возникают в схеме реакции транспортеров (26). Na+/K+ ATPase является прототипическим членом семейства транспортеров (27). Характерной особенностью этого семейства транспортеров является чувствительность к ortho-vanadate и sulfhydryl модифицирующим реагентам (28). Генетически P-type ATPase семейство связано с транспортом катионов у прокариот и эукариот. Группа P4 генов и белков, ассоциированная с транспортом липидов, обнаруживает очень высокую степень дивергенции от др. членов семейства. Операционно P-type ATPases участвуют в транспорте прежде всего (1°)-anunogylycerophospholipids, PtdSer и PtdEtn, но не quaternary (4°)-aminophospholipid, PtdCho (29, 30). Эксперименты с короткой acyl цепочкой или spin-меченными или флюоресцентными производными 1°-aminophospholipids демонстрируют избирательность, базирующуюся на 1°-amine группе. Экстракты из клеточных мембран эритроцитов демонстрируют, что отщепление АТФ строго зависит от добавления 1°-aminophospholipids (28). P-type ATPase из хромаффинных клеток надпочечника (ATPase II, ATP8A1) были очищены и воспроизведены в пузырьках и затем было показано, что они обладают PtdSer-зависимой ATPase активностью (31, 32). Информация о последовательностях из очищенной ATPase впоследствии была использована для идентификации ортолога дрожжей, который предварительно был назван DRS2 (defective in ribosome synthesis 2) при независимом генетическом скрининге (33). Делеция гена DRS2 дает смешанные результаты в отношении измерения перемещения через бислой флюоресцентного аналога фосфолипида, NBD-PtdSer, в дрожжевых клетках (34). Однако независимое исследование процесса транспорта белков у дрожжей выявило роль гена DRS2 и его гомолога NEO1 (neomycin resistance) (35, 36). Идентификация дополнительных дрожжевых гомологов помимо DRS2 и NEO генов привела к названию нового семейства генов, обозначающим DRS2 и NEO1 семейство (DM7), состоящее из DNF1, DNF2, and DNF3, которые кодируют P-type ATPases.
Проверка линий с делециями DNF1, DNF2 и DNF3 генов (i.e., dnf1Δ, dnf2Δ, and dnf3Δ мутантов ) позволила более конкретно определить роль кодируемых белков в транспорте через бислой aminoglycerophospholipids (see Figure 3). Одним из методов измерения транспорта липидов через бислой плазматической мембраны дрожжей является отслеживание движения флюоресцентных aminoglycerophospholipids NBD-PulSer, NBD-PtdEm и NBD-PtdCho через плазматическую мембрану. Дрожжи, обладающие мутациями dnf1Δ и dnf2Δ, выявили заметные дефекты в трансмембранном транспорте NBD-PtdSer, NBD-PtdEtn и NBD-PtdCho, согласующиеся с ролью генных продуктов в качестве липидных транспортеров через плазматическую мембрану (37). Однако транспорт PtdCho, по-видимому, является свойством. которое отличает P-type ATPases дрожжевых плазматических мембран от их аналогов у млекопитающих, которые были избирательными в отношении 1°-aminoglycerophospholipids. Мутации dnf1Δ and dnf2Δ также заметно меняют эндоцитоз, указывая тем самым, что асимметрия плазматической мембраны играет существенную роль в формировании эндосом, вообще-то путем изменения биофизических свойств бислоя в отношении изгиба мембраны (35, 37, 38).
Два исследования также касались гена
LEM1 в движении через бислой aminoglycerophospholipids плазматической мембраны (39, 40). The LEM1 обозначение происходит
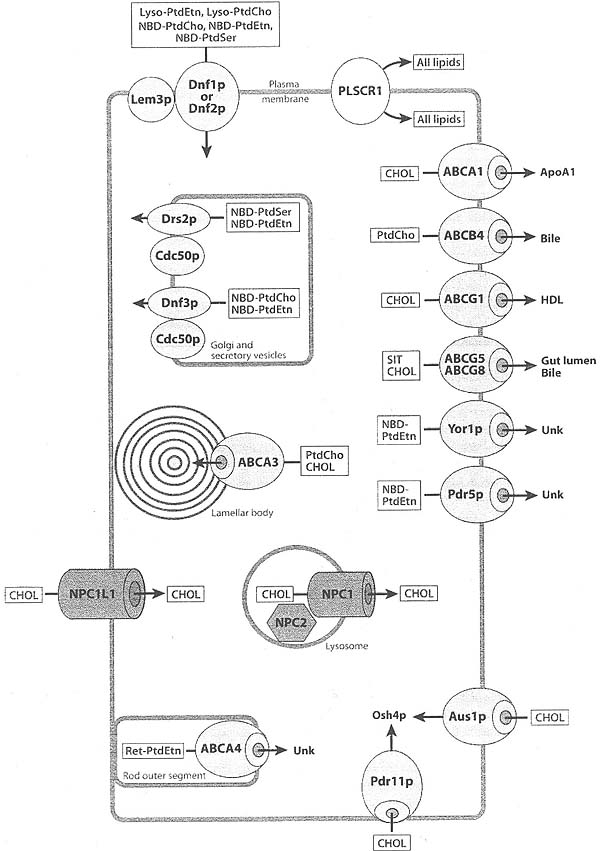 Figure 3
Summary of intratnembrane transporters. A schematic summary of the locations and substrates for P-type ATPases, ATP-Binding Cassette (ABC) transporters, scramblases (PLSCR1), and N'iemann-Pick (N'PC) family proteins. The transport effected by the "Defective in ribosome synthesis - and Neomycin resistance 1 family" (Dnf) of proteins is from the exoplasinic to the cytoplasmic leaflet of die bilayers. The Drs and Dnf proteins require accessor)' proteins, identified in independent genetic screens as functioning in the cell division cycle (Cdc50p), or as a glucocorticoid ligand effector modulator (Lem3p). The lipid transport by ABC family proteins results in export of the lipid from the membrane harboring the transporter to apolipoprotein Al (ApoAl), or high-density lipoprotein (HDL) particles, or hydrophobic environments such as bile, or the interior of the lipid storage organelle known as the lamellar body. Lipid transport to the intracellular oxysterol-binding protein homolog 4 (Osb+p) also occurs. The designation L'nk indicates that the acceptor for the exported lipid is unknown. Among the ABC transporters shown are those described by less obvious acronyms derived from genetic screens defining yeast oligomycin resistance (Yorlp), pleiotropic drug resistance (Pdrllp, Pdr5p), and the auxotrophic uptake of sterols (Auslp). The lipids transported by the different classes of transporters include lyso-phrisphatidylethanolarnine (lyso-PtdEtn), lyso-phosphatidyicholine (lyso-PtdCho), phosphatidylcholine (PtdCho), phosphatidylsenne (PtdSer), phosphutidylethanolamine (PtdEtn), the N-retinylidene derivative of phosphatidylethanolainine (Ret-PtdEtn), cholesterol (C'HOL). and sitosterol (SIT). Fluorescent analogs of the lipids harboring die niuohen/ovadiazolc (XBD-.I fluorochrome are also substrates for mam of the transporters, as depicted. This figure is a composite of lipid transport events described for both yeast and mammalian cells, and also includes specialized functions restricted to cells of the mtesnne. liver, lung, and eye.
Figure 3
Summary of intratnembrane transporters. A schematic summary of the locations and substrates for P-type ATPases, ATP-Binding Cassette (ABC) transporters, scramblases (PLSCR1), and N'iemann-Pick (N'PC) family proteins. The transport effected by the "Defective in ribosome synthesis - and Neomycin resistance 1 family" (Dnf) of proteins is from the exoplasinic to the cytoplasmic leaflet of die bilayers. The Drs and Dnf proteins require accessor)' proteins, identified in independent genetic screens as functioning in the cell division cycle (Cdc50p), or as a glucocorticoid ligand effector modulator (Lem3p). The lipid transport by ABC family proteins results in export of the lipid from the membrane harboring the transporter to apolipoprotein Al (ApoAl), or high-density lipoprotein (HDL) particles, or hydrophobic environments such as bile, or the interior of the lipid storage organelle known as the lamellar body. Lipid transport to the intracellular oxysterol-binding protein homolog 4 (Osb+p) also occurs. The designation L'nk indicates that the acceptor for the exported lipid is unknown. Among the ABC transporters shown are those described by less obvious acronyms derived from genetic screens defining yeast oligomycin resistance (Yorlp), pleiotropic drug resistance (Pdrllp, Pdr5p), and the auxotrophic uptake of sterols (Auslp). The lipids transported by the different classes of transporters include lyso-phrisphatidylethanolarnine (lyso-PtdEtn), lyso-phosphatidyicholine (lyso-PtdCho), phosphatidylcholine (PtdCho), phosphatidylsenne (PtdSer), phosphutidylethanolamine (PtdEtn), the N-retinylidene derivative of phosphatidylethanolainine (Ret-PtdEtn), cholesterol (C'HOL). and sitosterol (SIT). Fluorescent analogs of the lipids harboring die niuohen/ovadiazolc (XBD-.I fluorochrome are also substrates for mam of the transporters, as depicted. This figure is a composite of lipid transport events described for both yeast and mammalian cells, and also includes specialized functions restricted to cells of the mtesnne. liver, lung, and eye.
более ранних генетических исследований, в которых ген был идентифицирован как
ligand
effector
modulator глюкокортикоидов. Первоначально взаимоотношение между LEM3 и DNF генами и белками было непонятно. Однако белки Lem3p и Dnf1p и Dnf2p обнаружили взаимодействие др с др. в формировании зрелых транспортеров в плазматической мембране (41). Современная модель предполагает, что Lem3p действует прежде всего как молекулярный шаперон, который важен для собственно направления Dnf1p и Dnf2p на плазматическую мембрану. Хотя детали неполные, но предполагается, что Dnf1p and Dnf2p взаимодействуют независимо с Lem3p и выполняют свои функции транспортировки фосфолипидов независимо. Особенно интересна находка, что Iem3Δ мутанты дефектны в отношении переноса через бислой NBD-PtdEtn и NBD-PulCho, но не NBD-PtdSer плазматической мембраны (40, 42). Эти находки указывают на то, что белки, иные чем Lem3p, Dnf1p и Dnf2p могут участвовать в транспорте NBD-PtdSer на плазматической мембране.
Недавняя работа открыла новые перспективы в отношении P-type ATPases на плазматической мембране дрожжей. Генетический скрининг по lyso-PtdEtn транспорту у дрожжей открыл DNF1, DNF2 и LEM3 в качестве основных генов, кодирующих эти транспортеры (43). Прохождение радиоактивного lyso-PtdEtn через плазматическую мембрану составляет 7 nmole/h/107 на клетку. Эта скорость превосходит те, что необходима для объяснения всего синтеза PtdEtn и PtdCho, необходимых для удвоения клеток при 30° C. Транспорт lyso-PtdEtn метаболически связан с вновь описанным семейством acyltransferases, которые быстро синтезируют PtdEtn, используемый в биогенезе мембран, и далее метаболизируют в PtdCho (44). Транспортер Dnflp объясняет приблизительно 30%, а Dnf2p объясняет приблизительно 70% транспорта lyso-PtdEtn. Двойные dnf1Δ dnf2Δ мутантны сохраняют остаточный транспорт lyso-PtdEtn приблизительно на 20% от такового в клетках дикого типа, это указывает на участие продукта третьего гена в транспорте липидов. предполагается, что Lem3p действует независимо от Dnf1p и Dnt2. Мутанты lem3Δ сохраняют примерно 15% от транспорта lyso-PtdEtn по сравнению с клетками дикого типа, это согласуется с существованием третьего транспортера этого липида в плазматической мембране.
Lyso-PtdCho также транспортируется поперек плазматической мембраны дрожжей со скоростью, достаточной, чтобы обеспечить весь PtdCho, необходимый для удвоения клетки (45). Транспорт lyso-PtdCho также метаболически связан с acyltransferase, которая быстро синтезирует PtdCho (45). Dnf1p объясняет лишь 10% транспорта lyso-PtdCho, тогда как Dnf2p объясняет 70% транспорта. Двойные dnf1Δ dnf2Δ мутанты всё ещё сохраняют 20% транспорта от уровня транспорта lyso-PtdCho дикого типа, это также подтверждает идею третьего транспортера для этого липида, присутствующего в плазматической мембране. Мутант lem3Δ почти не обнаруживает транспортной lyso-PtdCho активности, указывая тем самым, что третьим транспортером lyso-PtdCho также может быть Lem3p как шаперон для достижения плазматической мембраны.
Расширение исследований транспорта lysophospholipid на lyso-PtdSer, lyso-Ptdlns и Iyso-PtdGro привело к негативным результатам, указывающим на отсутствие транспортеров для этих липидо у дрожжей. Дальнейшие эксперименты со средними- и короткими-цепочными формами PtdSer также не предоставили доказательств транспортеров для этих липидов у дрожжей. Эти находки ставят вопрос о том, как Dnf1p и Dnf2p м. распознавать bona fide биологические субстраты, lyso-PtdEtn и lyso-PtdCho, и их аналоги, XBD-PtdEtn и NBD-PtdCho, но только аналогичную форму NBD-PtdSer. Более того эксперименты с мутантами lem3Δ не согласуются с Dnf1p/Lem3p и Dnf2p/Lem3p комплексами, участвующими в транспорте через бислой PtdSer (39,40). Хотя XBD-lipid аналоги в целом обладают многими признаками нативных липидов, Elvington с сотр. продемонстрировали, что аналоги с разными флюорецентными репортерными группами могут сортироваться и транспортироваться внутриклеточно явно др. путями (46). Итак, эти данные подчеркивают важные расхождения в нашем понимании роли Dnf1p, Dnf2p и Lem3p в транспорте PtdSer в плазматической мембране.
Гены DRS2 и DNF3 участвуют в транспорте липидов в аппарате Гольджи (35, 36, 47). Ген DRS2 и кодируемый им белок, Drs2p, были исследованы детально. Drs2p играет роль в установлении и поддержании асимметрии aminogiycerophospholipid в мембранах trans-Golgi network (TGN). Drs2p транслоцирует XBD-PtdSer и XBD-PtdEtn, хотя последний может транслоцироваться со значительно более медленной скоростью (38). Эта липидная асимметрия важна для регуляции мембран и сортировки грузовых белков в органелле, а температуро-чувствительные аллели drs2(ts) соотв. теряют способность формировать секреторные пузырьки и транслоцировать XBD-PtdSer поперек мембраны после сдвига к непермиссивной температуре (48). Парадоксально. хотя функция Drs2p необходима для элементов сортинга белков в TGN, присутствие PtdSer не обязательно (48). Т.о., создание асимметричного (лицом к цитозолю) распределения PtdSer в Golgi не является механистически необходимым для сортировки белков. Всё ещё неясно, необходимо ли асимметричное распределение PtdEtn для процесса сортировки белков. Post-Golgi секреторные пузырьки содержат и Drs2p и Dnf3p и эти пузырьки могут транслоцировать NBD-PtdSer, XBD-PtdEtn и XBD-PtdCho (47). Dnf3p является основным вкладчиком в транслокацию XBD-PtdEtn и NBD-PtdCho. Подобно тому, как это наблюдается для Dnf1p и Dnf2p, транспортеры Drs2p и Dnf3p нуждаются в "chaperone" кофакторе для корректной логализации в Golgi, и эта функция обеспечивается с помощью белка Cdc50p (41).
Ортологи млекопитающих DNF семейства, которые были изучены, это ATP8A1 и ATP8B1. Интерес к ATP8A1 был привлечен демонстрацией, что активность ATPase может стимулироваться с помощью PtdSer (31, 32). Информация о последовательностях ATP8A1, очищенного от хромаффинных гранул, была первоначально использована для связи последовательностей гена
DRS2 дрожжей с транспортом 1°-aminoglycerophospholipid (33). У очищенного ATP8A1 ATPase активность в основном зависит от присутствия PtdSer (49). ATP8B1 был идентифицирован в исследованиях по генетическому сцеплению, изучающих прогрессивный семейный внутрипеченочный cholestasis и злокачественный повторяющийся внутрипеченочный cholestasis (50). ATPase локализуется на мембранах желчных протоков в печени крыс (51). Гетерологичная экспрессия ATP8B1 человека вместе с CDC50A человека привела к локализации на плазматической мембране белка и к 2-5-кратному увеличению транслокации XBD-PtdSer (52). В согласии с исследованиями генов
DRS2, DNF3 и
CDC50 у дрожжей, экспрессия ATP8B1 человека, без его CDC50 аналога ведет к провокации ATPase в эндоплазматическом ретикулеме. Получение линий мышей с нулевым аллелем
ATP8B1 дает животных с мембранами желчных протоков, которые характеризуются как повышенной чувствительностью к гидрофобных желчным солям, так и нарушением транспорта желчных солей (53). Желчь таких животных содержит PtdSer, это указывает на то, что плазматические мембраны канальцев гепатоцитов теряют как свою асимметрию, так и резистентность к дефектам детергентов из солей желчи. Нарушения структуры плазматических мембран, как полагают, меняют функцию транспортера желчных солей ABCB11, это ведет к внутриклеточному накоплению желчных солей, и возникновению cholestasis.
ABC Transporters
ABC транспортеры составляют второе молекулярное семейство, которое участвует во внутримембранном транспорте липидов. В отличие от P-type ATPases, которые транспортируют липиды поперек бислоя, чтобы регулировать структуру или физические свойства разных листков, многие ABC транспортеры, по-видимому, функционируют прежде всего, чтобы перемещать липиды через бислои для экспорта из мембраны (see Figure 3). Ген MsbA из
E. coli кодирет ABC транспортер, который участвует в транслокации незрелого lipopolysaccharide (Ra-LPS) между внутренним и наружным листками бактериальной внутренней мембраны(54. 55)(see Figure 4). Транспортер MsbA действует как гомодимер, его кристаллическая структура выявлена в двух конформациях (56).
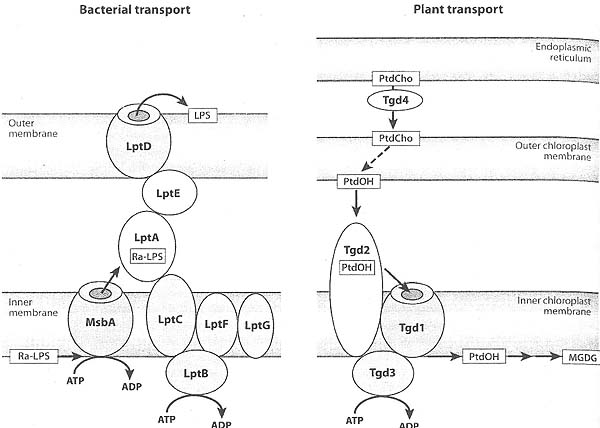 Figure 4
Features of bacterial and plant lipid transport complexes. Bacterial transport ot lipupolysaccharide (LPS) between the inner and outer membrane requires the action of the ATP-dependent LI'S transporter, MsbA, to translocate an immature form of I .PS (Ra-LPS) across the inner membrane. The combined action of tile LPS transport proteins (Lpt) LptA. LptB, LptG, LptF, and LptG femes the LPS to the outer membrane. At the outer membrane, LptD and LptF, assimilate and translocate tile LPS to the outer leaflet of the membrane. Chloroplast import of lipid for the synthesis of tnonogalactosyi diacylglycerol (MGDG) and digalaetosyl diacylglycerol (DGDG) utilizes the proteins, Tgdl as a permease. Tgd2 as an outer-membrane binding protein, and Tgd3 as an ATPase for transport of precursor lipids into die organelle. The Tgd aeronvin derives from the phenotype of the corresponding mutant strains, which accumulate trigalactosyl diacylglcyerols. The source ot the diacylglycerol backbone ol MGDG and DGDG derives from phosphatide acid (I'tdOl I) originating in the outer chloroplast membrane. One source of this PtdOl 1 may be phosphatidylcholine (PtdCho) synthesized in the endoplasmic reticulum. The Tgd4 protein has rccentl) been implicated in the transpoi: ol PrdCliu between the endoplasmic reticulum and chloroplast outer membrane.
Figure 4
Features of bacterial and plant lipid transport complexes. Bacterial transport ot lipupolysaccharide (LPS) between the inner and outer membrane requires the action of the ATP-dependent LI'S transporter, MsbA, to translocate an immature form of I .PS (Ra-LPS) across the inner membrane. The combined action of tile LPS transport proteins (Lpt) LptA. LptB, LptG, LptF, and LptG femes the LPS to the outer membrane. At the outer membrane, LptD and LptF, assimilate and translocate tile LPS to the outer leaflet of the membrane. Chloroplast import of lipid for the synthesis of tnonogalactosyi diacylglycerol (MGDG) and digalaetosyl diacylglycerol (DGDG) utilizes the proteins, Tgdl as a permease. Tgd2 as an outer-membrane binding protein, and Tgd3 as an ATPase for transport of precursor lipids into die organelle. The Tgd aeronvin derives from the phenotype of the corresponding mutant strains, which accumulate trigalactosyl diacylglcyerols. The source ot the diacylglycerol backbone ol MGDG and DGDG derives from phosphatide acid (I'tdOl I) originating in the outer chloroplast membrane. One source of this PtdOl 1 may be phosphatidylcholine (PtdCho) synthesized in the endoplasmic reticulum. The Tgd4 protein has rccentl) been implicated in the transpoi: ol PrdCliu between the endoplasmic reticulum and chloroplast outer membrane.
Каждый мономер содержит нуклотид-связывающий домен и полу-канальный компартмент. В отсутствие нуклеотидов конформация полу-канала открыта в цитозоль и компартменты внутреннего листка делают возможным доступ к субстрату. В этой открытой конформации нуклеотид-связывающие домены, локализованные в цитозоле, широко разделены. Связывание субстрата предшествует индукции взаимодействий между полу-каналами, которые формируют полный канал и закрывают доступ каналу в цитозоль и ко внутреннему листку и односременно способствуют ассоциации двух нуклеотид-связывающих доменов др. с др. Связывание АТФ позволяет белку дополнительно изменить конформацию, которая открывает канал в экзоплазматический компартмент, позволяя субстрату экспортироваться в наружный листок внутренней мембраны или периплазмы. Эта модель раскрывает механизм, как субстрат получает довольно свободный доступ к незрелому каналу из листка внутренней мембраны. Кроме того, субстрат сам по себе является активным компонентом транспортной реакции, поскольку он играет важную роль в индуции образования канала, который перемещает его поперек бислоя.
У дрожжей пара членов семейства ABC участвует в экспорте NBD-PtdEtn из клетки (see Figure 3). Ген YOR1 (yeast olivomycin resistance 1) и PDR5 (gleiotropic drug resistance 5) облегчают удаление NBD-PtdEtn из клеток и являются важными факторами, которые снижают накопление NBD-PtdEm в клетках, где этот аналог используется как зонд для отслеживания внутриклеточного трафика липидов (57). Кстати, отсутствуют данные, связывающие Yor1p или Pdr5p с эндогенными реакциями липидного транспорта и эти находки указывают на то, что эти ABC белки распознают N'BD-PtdEtn как ксенобиотик и экспортируют аналог как часть процесса детоксификации.
Дополнительная пара ABC транспортеров у дрожжей необходима для поглощения холестерола. Эти белки, Aus1p (ABC транспортер для поглощения sterols) и Pdr11p (pleiotropic drug resistance 11), локализованы на плазматической мембране, а кодирующие их гены, AUS1 и PDR11, существенно активируются на генетических фонах, которые способствуют потреблению стеролов (58). Транспортеры могут использовать cholesterol, sitosterol, 7-dehydrocholesterol и ergosterol в качестве субстратов (16). Действие Aus1p и Pdr11p га стеролы нуждается в постоянном синтезе steryl ester в эндоплазматическом ретикулеме, указывая тем самым, что накопление неэфиризированного cholesterol отключает транспортную активность белков. Механизм связи между транспортерами в плазматической мембране и эндоплазматическом ретикулеме пока неясен.
Всё увеличивающееся количество транспортеров ABC у млекопитающих участвует в экспорте липидов с плазматической мембраны на разнообразные экзогенные клеточные акцепторы (see Figure 3). Ген ABCA1 кодирует транспортер, участвующий в экспорте cholesterol из клеток на apolipoprotein A1. Сходство в первичной структуре между ABCA1 и ABCA7 указывает на то, что два белка обладают перекрывающимися функциями (59). Мутации в ABCA1 у человека вызывают hypoalphalipoproteinemia и болезнь Tangier, характеризующиеся дефектами обратного транспорта cholesterol из внепеченочных тканей обратно в печень (60, 61). Генетические повреждения ABCA1 нарушают транспорт cholesterol из клеток на apolipoprotein A1 (apoA1). Механизм, с помощью которого осуществляется этот транспорт cholesterol не до конца ясен. Согласно одной модели apoA1 стыкуется с ABCA1, и cholesterol и phosphatidylcholine переносятся конкурентно на внеклеточный акцепторный белок, который подвергается созреванию, чтобы сформировать зарождающиеся HDL частицы (62). Эта модель прямого переноса, по-видимому, является простейшим взаимодействием среди белковых и липидных участников этого процесса. Некоторые исследования предоставили доказательства, что процесс транспорта может осуществляться в два этапа, на первой ступени транслоцируются cholesterol и phospholipid через плазматическую мембрану, а на второй ступени липиды загружаются на apoA1. Первая ступень не обнаруживает потребности в apoA1 и объясняет наблюдения, что клетки с избыточной экспрессией ABCA1 имеют больше поверхностного cholesterol, доступного для зондов, таких как methyl-β-cyclodextrin или cholesterol oxidase, чем их изогенные аналоги (63, 64). В согласии с элементами этой модели то, что очищенные препараты ABCA1 в очистных micelles обнаруживают повышенную активность ATPase в присутствии phospholipids, при этом PtdCho и SM обнаруживают наивысший стимулирующий эффект (приблизительно в 5 раз), а PtdSer и PtdEtn обнаруживают достоверный, но более низкий эффект (приблизительно вдвое) (65). Однако cholesterol и др. стеролы не увеличивают активности ATPase в присутствии phospholipids.
Альтернативная модель механизма ABCA1-индуцированного оттока cholesterol предполагает транслокацию phospholipids на сайт ATPase, это вызывает создание зачатков внешних мембран, которые локально увеличивают связывание apoA1 и последующий перенос phospholipids и cholesterol на белковый акцептор (66. 67). Эта модель непрямого переноса базируется на ряде экспериментальных наблюдений, она предсказывает три основные ступени процесса оттока стеролов. На первой ступени присутствие apoA1 способствует стабилизации ABCA1 в плазматической мембране за счет индукции фосфорилирования и снижения оборота. Эта стабилизация транспортера усиливает транслокацию phospholipid, это в локальных условиях вызывает доставку избытка phospholipid на наружный листок плазматической мембраны. На второй ступени локальное накопление на наружном листке phospholipid индуцирует образование направленных наружу зачатков. Доказательства для таких зачатков (buds) обнаруживаются на микроснимках, которые также обнаруживают ко-локализацию антител к ABCA1. Наивысшая степень изгиба этих зачатков способствует связыванию apoA1, который обладает наивысшим сродством к этим доменам скорее, чем к более плоски доменам. На третьей ступени apoA1 выделяет избыток липидов и формирует растворимые дискообразные частицы, типичные для apoA1, которые комплексуются с липидами. Тестирование и уточнение обеих моделей важно для понимания того, насколько важны субнаборы ABC транспортеров, оперирующих транспортом стеролов и являются ли стеролы подлинными субстратами для некоторых из транспортеров.
Генетические и цитологические доказательства идентифицировали ABCA3 в качестве транспортера, участвующего в созревании ламеллярных телец, специализированных органелл для хранения и секреции системы богатого липидами легочного сурфактанта (68-70). Легочный сурфактант является внеклеточным липидным и белковым комплексом, который выстилает регионы лёгких, обменивающиеся газами, и действует, чтобы снизить поверхностное напряжение в конце респираторного цикла. Инактивирующие мутации в ABCA3 у человека или внесенные мышам вызывают гибель вскоре после рождения вследствие недостаточности сурфактанта (71,72). ABCA3 локализуется в ограничивающей мембране ламеллярных телец и некоторые доказательства указываеют а то, что он транспортирует cholesterol и phosphatidylcholine в эти органеллы. Дефекты в ABCA3 ведут к аномалиям ламеллярных телец с заметным снижением содержания липидов.
Белок ABCA4 выполняет специализированную роль по удалению retinylidene-PtdEtn (retinaldehyde добавляет первичный амин из PtdEtn), генерируемого во время визуального цикла, с наружных сегментов палочек и колбочек, присутствующих в фоторецепторах глаз (73). ATPase активность транспортера стимулируется с помощью retinylidene-PtdFtn, который соединяется с белком с очевидным Kd из 2-5 µM (73). Retinylidene-PtdEtn, генерируемый в просветном листке мембран наружного сегмента диска палочек, транслоцируется через мембрану для удаления или катаболизма. Неспособность выполнять ступень экспорта, катализируемую с помощью ABCA4 ведет к накоплению retinylidene-PtdEtn внутри диска и генерации предшественников lipofuscin. По мере реструктуирования диска они фагоцитируются с помощью пигментного эпителия сетчатки. Диски, содержащие высокие концентрации предшественников lipofuscin токсичны для эпителиальных клеток и выщывают клеточную гибель. Наиболее выраженные дефекты ABCA4 ведут к макулярной дистрофии Stargardt (74). Многие незначительные дефекты в ABCA4, ассоциированные с мутациями, вносят вклад в связанную с возрастом макулярную дистрофию (75), ведущую причину слепоты у стариков индустриальных стран.
Исторически ABCB4 был первым ABC транспортером, участвующим в транспорте phospholipid (76). Исследования на мышах с нулевыми аллеями белок ABCB4 обнаруживал основную роль транспортера в поставке PtdCho в желчь (77). Эта находка привела к заключению, что ABCB4 действует как PtdCho экспортирующая транслоказа в мембранах желчных канальцев. У человека дисфункция ABCB4 ведет к внутрипеченочному cholestasis (78). В некоторых случаях во всём остальном молчащие аллели ABCB4 обнаруживают свои фенотипические отклонения во время беременности (79). Механизм транспорта PtdCho остается неопределенным из-за топологии липидов, вступающих и покидающих транспортер. Транслокация PtdCho с помощью ABCB4 in vivo чувствительна к присутствию внеклеточных солей желчи, указывая тем самым, что необходимы экзогенные акцепторы для стимуляции и/или нормального функционирования процесса транслокации липидов (80).
ABCG1 участвует в метаболизме легочных стеролов согласно исследованиям на мышах с нулевыми аллелями гена. Молодые мыши с делециями ABCG1 не способны обнаруживать явный фенотип, но с возрастом у животных развивается прогрессирующий легочный lipidosis, с накоплением phospholipids и sterols во внеклеточном альвеолярном компартменте легких (81). Альвеолярные макрофаги становятся гипертрофичными и обнаруживают крупные липидные включения и фенотип усиливается диетой богатой жиром и с высоким содержанием холестерола. Этот фенотип макрофагов сопровождается повышенной экспрессией про-воспалительных цитокинов и инфильтрацией лимфоцитов (82, 83). ABCG1, как полагают, прежде всего, уводит стеролы из макрофагов легких, печени и селезенки. Причина драматического легочного фенотипа неясна, но очевидно, что макрофаги ведут к его превращению в про-воспалительный фенотип. Трансплантация ABCG1 нулевым мышам дикого типа костного мозга мышей устраняет воспалительную программу и восстанавливает нормальный статус легких (83). Костный мозг предоставляет предшественников макрофагов, которые постоянно пополняют легкие клетками. которые дифференцируются в альвеолярные макрофаги. Эти последние находки идентифицируют альвеолярные макрофаги как критические, регулирующие гомеостаз липидов, чья дисфункция ведет к неожиданному воспалению. Сходство в структуре между ABCG1 и ABCG4 указывает на то, что два белка дуплицируют функцию транспорта стерола в разных тканях (84).
ABCG5/G8 функционируют как гетеродимер в экспорте растительных стеролов и cholesterol из энтероцитов и гепатоцитов (85). В кишечнике действие этого транспортера редуцирует потребление sitosterol и cholesterol. В печени транспортер облегчает экспорт стеролов в желчь для элиминации в кал. Дефекты в ABCG5 или ABCG8 вызывают sitosterolemia и hypercholesterolemia. Как мономерные, так и гетеромерные формы ABCG5 и ABCG8 были очищены до гомогенности и восстановлены в липосомах (86, 87). Димер ABCG5/G8 обладает ATPase активностью, которая не стимулируется с помощью phospholipid. Как и у ABCA1, ATPase активность очищенных ABCG5/G8 слабо ингибируется при добавлении sterol. Восстановление очищенного белка в протеолипосомы показывает, что он способен транспортировать cholesterol и растительные стеролы из донорской популяции phospholipid/radiolabeled-sterol липосом. Транспорт АТФ зависим и чувствителен к ингибированию с помощью vanadate. Как и в случае с ABCA1, реконституция ABCG5/G8 является важным успехом в понимании того, как функционирует семейство ABC транспортеров. Метод, предложенный для восстановления ABCG5/G8 использует экзогенный донорский компартмент для предоставления субстрата для транслокации, а результаты согласуются с распознаванием транспортером субстрата, присутствующего в бислоях, отличных от таковых, в которых располагается белок. Эта последняя ситуация может быть экстраполирована на процессы
in vivo, где стерол, предназначенный для транспорта, презентируется для ABCG5/G8 или с помощью растворимого белка носителя или тесно примыкающей мембраной.
Scramblases
Изучение перемещения липидов через бислой в эритроцитах предоставило доказательства существования транспортеров, которые независимы от P-type ATPases и ABC белков. описанных выше (88). Независимо от P-типа ATPases, которые функционируют с 1°-aminoglycerophospholipids, класс АТФ-независимых транспортеров нуждается в повышенных уровнях внутриклеточного Ca2+ (88). Член основатель этого семейства, phospholipid scramblase 1 (PLSCR1), был охарактеризован как транспортер без какой-либо фосфолипидной специфичности, с эффектом на перемещение липидов через бислой, который устраняет асимметричное распределение липидов через плазматическую мембрану (89). У млекопитающих идентифицированы 4 родственных PLSCR гена (90). PLSCR1 обладает низкой активностью в покоящихся клетках, но в клетках, активируемых с помощью различных условий (напр., проапоптических лигандов, или индукторов апоптоза или повышенным током Ca2+), транспортеры активируются, чтобы катализировать коллапс (или scrambling) асимметрии липидов поперек плоскости бислоя. Потеря асимметрии плазматической мембраной при воздействии PtdSer в наружном листке плазматической мембраны, которая служит в качестве сигнала для распознавания и захвата с помощью фагоцитарных клеток (91). PLSCR1 содержит в первичной последовательности мотивы для Cys-palmitoylation, EF hand домен для for связывания Ca2+, сайт protein kinase C6 фосфорилирования и одиночный трансмембранный домен (92). Олигонуклеотиды связывающие мотивы и неканонический сигнал ядерной локализации также присутствуют в белке (92). Помимо его присутствия на плазматической мембране PLSCR1 был обнаружен также в ядре, где он взаимодействует с промотором для inositol trisphosphate рецептора (93). Делеция гена PLSCR1 не дает очевидного фенотипического отклонения транспорта липидов у мышей (94). Эти наблюдения привели некоторых исследователей к вопросу о роли белка в регуляции асимметрии липидов плазматических мембран (92). Кроме того, структура белка необычная для молекул с предполагаемой функцией транспортировки липидов, поскольку она содержит только один трансмембранный домен и короткий экзоплазматический сегмент. Однако делеция ортолога PLSCR1 , SCRM1, у C. elegans давала линии с дефектами очистки апоптических зародышевых клеток, которые также обнаруживали дефекты в экспрессии PtdSer на клеточной поверхности (95, 96). Более того исследования на C. elegans показали, что второй белок, WWH-1, который действует как фактор, индуцирующий апоптоз, генетически взаимодействует с белком SCRM1. Исследования по физическому взаимодействию продемонстрировали прямое связывание между рекомбинантными белками WAH-1 и SCRM1. Восстановление SCRA11 в липосомы продуцирует низкие уровни NBD-PtdSer scrambling, который увеличивается почти в 10 раз после добавления WAH-1. Эти находки с использованием C. elegans gпреоставлют новое и строгое подтверждение функции по транслокации липидов scramblase белков. Эти данные в дальнейшем подтвердили, что PLSCR1 может действовать или регулироваться внутри мультибелковых комплексов. Необходима детальная информация о взаимодействиях SCRM1 и WAH-1 и эффектах на конформацию и олигомеризацию белков и транспортную функцию для понимания семейства scramblase.
Дополнительный член семейства scramblase, PLSCR3, располагается на митохондриях и участвует в процессах транслокации липидов в органеллы, связанные с апоптозом (92). Избыточная экспрессия PLSCR3 увеличивает чувствительность клеток к индукции апоптоза с помощью TNFα и родственных лигандов (97, 98). Напротив, ингибирование экспрессии
PLSCR3 делает клетки, резистентными к апоптозу, индуцируемому с помощью тех же самых лигандов. Действие PLSCR3 является Ca
2+ зависимым и увеличивает воздействие cardiolipin на внешний аспект митохондриальной мембраны, который способствует рекрутированию проапоптических белков Bid, Bax и Bak, которые индуцируют вытекание cytochrome c из органелл и активацию caspase.
Niemann-Pick Type C Family Proteins
NPC ,болезнь храктеризуется накоплением cholesterol в лизосомах и эндосомах. Болезнь является следствием мутаций в двух генах , NPC1 и NPC2, которые необходимы для экспорта из лизосом холестерола, высвобождаемого с помощью LDL пути (99). Механизмы, с помощью которых эти белки работают, недостаточно изучены. Продукт гена NPC1 является мембранным белком, обнаруживаемым в лизосомах; он содержит 13 трансмембранных доменов и 3 крупных гидрофильных домена, которые располагаются внутри просвета органеллы (1OO). Внутри трансмембранных доменов находится 5-helix sterol-sensing домен, который обнаруживается в др. белках, участвующих в синтезе cholesterol, регуляция его транскрипции или передаче морфогенетических сигналов. Белок NPC1 человека связывает cholesterol и ряд оксистеролов, содержащих замены в cholesterol iso-octyl боковой цепи (напр., 25-hydroxy cholesterol) (101). Соединение с oxysterols оказалось неожиданным и функция этого взаимодействия неизвестна. Соединение NPC1 с cholesterol происходит с ниpким сродством (~130 nM), чем соединение с oxysterols (~10 nM). Сайт связывания для cholesterol был картирован на гидрофильном N-конце зрелого белка (аминокислоты 24-264), который располагается в просвете лизосом (102). The N-конец NPC1, который высоко консервативен среди видов позвоночных и содержит 18 Cys остатков сильно гликозилирован. Epitope-нагруженные версии N конца NPC1, продуцируемые в клетках млекопитающих, были очищены до гомогенности и связывали oxysterols и cholesterol со сродством. сравнимым для интактного белка. N конец спонтанно димеризуется и эта форма связывает стеролы. Стоихометрия связывания была вычислена как 1 молекула стерола : 4 мономера NPC1 (102). Гипоморфный аллель XPC 1 с Q79A с мутацией на N-конце лишен обнаружимого связывания oxysterol, но сохраняет низкие уровни связывания cholesterol. Когда белок NPC1 (Q79A) экспрессируется в CHO клетках, лишенных эндогенного NPC1, то гетерологичный белок восстанавливает функцию NPC1 и супрессирует фенотип накопления cholesterol, показывая, что связывание oxysterol не является существенной активностью для транспорта cholesterol (102).
Вредные мутации гена NPC2 появляются с частотой ~5% от таковой для гена NPC1 , но фенотипы почти идентичны (99). Этот результат указывает на то, что продукт гена NPC2 работает вместе с продуктом гена NPC1 в процессе экспорта холестерола из лизосом. В противоположность NPC1, белок NPC2 растворим и сортируется в лизосомы с помощью внутриклеточных и внеклеточных путей посредством mannose 6 phosphate рецепторов (103). Белок NPC2 связывает cholesterol, и эта загрузка липида может быть отслежена по снижению прирожденной флюоресценции триптофана (104). Перенос cholesterol на акцепторные мембраны или белки также может быть отслежен по измерению увеличения прирожденной флюоресценции триптофана, которое сопровождает уход липидов с сайта связывания. И загрузка и разгрузка cholesterol происходит с высокими скоростями, если или донорская или акцепторная мембраны содержат lysobisphosphatidic кислоту, липид, которым богаты эндосомы и лизосомы. Кристаллическая структура белка NPC2, полученная в отсутствии и присутствии связанного cholesterol sulfate лиганда, показывает, что ненагруженный белок лишен гидрофобной полости достаточного размера, чтобы соответствовать холестеролу (105). Однако после введения лиганда, белок подвергается существенным конформационным изменениям, позволяющим вхождение и sandwiching стерола в карман между двумя β-слоями. Недавние подсчеты сродства NPC2 для холестерола дали значения Kd ~15O nM. Мономерный белок связывает холестерол, но не связывает любой из oxysterols, распознаваемых с помощью NPC1.
NPC1-подобный белок, NPC1L1, который также участвует в трансмембранном транспорте холестерола, располагается на плазматических мембранах энтероцитов (на щеточной кайме) и гепатоцитов (в желчных канальцах) (106). В энтероцитах белок транспортирует пищевые стеролы для упаковки в chylomicrons. В гепатоцитах белок, как полагают, облегчает восстановление свободного холестерола из желчи. N конец NPC1L1 высоко гомологичен N-терминальной области NPC1, который недавно был идентифицирован как cholesrerol-связывающий сайт. Белок NPC1L1 также содержит 5-трансмембранную спиральную область с доменом, распознающим стерол, который участвует в непосредственной связи холестерола (107). NPC1L1 связывает и ezetimibe, который ингибирует транспорт холестерола в энтероциты. Сайт связывания для ezetimibe был недавно идентифицирован во внеклеточном гидрофильном домене белка (108). Предложены две разные модели способа действия. Одна модель идентифицирует гомологию между членами семейства NPC1 и прокариотической permease, которая функционирует в удалении липофильных соединений (109). Эта модель говорит в пользу функции белка permease-типа в облегчении потребления клетками холестерола. Вторая модель говорит в пользу того, что cholesterol, связанный с NPC1L1 участвует в эндоцитозе (110). Это последнее исследование экспериментально показало, что холестерол способствует эндоцитозу NPC1L1 и что ингибирование эндоцитоза блокирует транспорт холестерола в клетки. экспрессирующие белок. Более того, лекарство ezetimibe, которое блокирует связывание cholesterol с NPC1L1, также ингибирует эндоцитоз белка. Концептуально permease-типа модель более простая, но исследования по реконституции показывают, что эта активность отсутствует. Модель ограничения эндоцитоза это ограничение скорости тока холестерола в клетки и величины рециклинга NPC1L1, который ответственен за эжту скорость. Если стоихометрия NPC1L1 связывания холестерола одна и та же, как недавно установленная для NPC1 (described above), то это буде, по-видимому, неэффективным и энергетически дорогим. чтобы помещать холестерол в клетки с помощью эндоцитоза. Напротив, если NPC1L1 действует кооперативно с др. мембранными белками, чтобы продуцировать стероловые агрегаты, которые должны эндоцитозироваться, то эффективность модели эндоцитоза будет усовершенствована.
INTERMEMBRANE TRANSPORT PROCESSES
Эндоплазматический ретикулем располагается как центральный мембранный hub для синтеза липидов у эукариот и перенос липидов радиирует прочь от этого локуса, чтобы предоставить структурные липиды и предшественники липидов для вторичных синтетических систем в др. органеллах. Эндоплазматический ретикулем выполняет простую роль у растительных эукариот, но специализированные мембраны пластид (напр., хлоропластов) растений являются также более автономными в снабжении необходимых структурных липидов для этих органелл. У грамм-негативных растений внутренняя мембрана является центром синтеза большинства структурных липидов, но он аже предоставляет и предшественники липидов, которые подвергаются вторичному метаболизму для генерации основных липидных структурных компонентов наружных мембран.
Bacterial Lipopolysaccharide Transport
Как было описано выше, незрелая форма lipopolysaccharide (Ra-LPS) синтезируется на внутреннем листке бактериальной внутренней мембраны изатем транслоцируется на наружный листок этой мембраны благодаря действию MsbA (54. 55). Затем Ra-LPS д, подвергаться созреванию, чтобы быть транспортированными через периплазматическое пространство на наружную мембрану (see Figure 4). После прибытия на внутренний листок наружной мембраны LPS д. пересечь этот мембранный компартмент, чтобы достичь наконец наружного листка наружной мембраны, где они, как полагают. составляют единственный липидный компонент. Транзит Ra-LPS и его созревающих промежуточных образований зависит от действия компонентов белковых комплексов внутренней и наружной мембраны, также как и периплазматических белков. Компоненты этого транспортного комплекса состоят из белков LptA, LptB, LptC, LptD, LptE, LptF и LptG (111-114). Почти все эти компоненты выполняют сходную функцию, т.к. арест экспрессии любого из вышеупомянутых Lpt компонентов дает тот же самый фенотип, характеризующийся арестом клеточного роста, накоплением мультиламеллярных мембранных структур в периплазме, неспособностью накапливать зрелые LPS на наружной мембране и накоплением аномальных форм LPS, модифицированных с помощью colanic кислоты. Компонент LptA располагается в периплазме и является кандидатом на роль растворимого LPS-связывающего белка. Кристаллическая структура LptA, в присутствие Ra-LPS, была установлена и представлена новой складкой, представленной 16 антипараллельными β-нитями, которые открыты на своих концах и скручены на 90° (115). Белковые мономеры уложены в стопку с расположением голова-хвост и образуют линейные октамеры в присутствии LPS. Молекула LptB является цитоплазматическим белком, который содержит нуклеотид-связывающий домен для комплекса LptC, LptF и LptG, белков внутренней мембраны, которые, как полагают, взаимодействуют с Ra-LPS после того как транслоцируются поперек внутренней мембраны. Одна модель полагает, что LptC, LptF и LptG связаны с гидролизом АТФ, затрагиваемым LptB в качестве энергетической движущей силы для удаления LPS из бислоя. LptB, LptC, LptE и LptG обладают характеристиками многосоставных ABC транспортеров. После экстракции бислоя компонент LptA может действовать как переносчик для транспорта LPS на компоненты LptE и LptD, присутствующие в наружной мембране. Хотя LptA может быть найден как растворимый белок, он может быть принужден за счет белковых взаимодействий располагаться на адгезивных сайтах мембраны, которые действуют, чтобы закрепить на ней белковые комплексы или внутренней- или наружной мембраны. Эти типы белковых взаимодействий могут диктовать специфические детали загрузки и разгрузки грузов, которые смогут задавать как направленность транспорта, так и ограничение диффузии LptA. Эта бактериальная система предоставляет важную картину невезикулярного межмембраннго транспорта с участием сборки белковых комплексов между донорской и акцепторной мембраной.
Lipid Transport Within and to the Chloroplast
Monogalactosyl- and digalactosvl-diacylgly-cerol (MGDG and DGDG) are two prominent plant lipids synthesized in chloroplasts (116) . The pathway for their synthesis includes transport of phospholipid from the endoplasmic reticulum (F.R) to the outer chloroplast membrane and subsequent transport of phospholipid from the outer to the inner membrane where AIGDG and DGDG are synthesized (see Figure 4). Arabidopsis strains defective in these transport pathways accumulate trigalactosyl-diaeylglycerols (TGDGs) and triacylglycerols as a consequence of" secondary metabolism (117) . This TGDG accumulation phenotype has been used as a screen for identifying genes involved in chloroplast lipid transport. Four TGDG mutant strains (tgdl, tgd2, tgd3, and Tgd4) have been isolated and their corresponding genes identified and cloned (117-121). The TGDl. TGD2, and TGD3 genes encode proteins that are part of a multipartite ABC transport system associated with the inner chloroplast membrane. The TGD1 protein encodes a permease subunit, the TGD2 encodes a PtdOH-binding protein, and the TGD3 encodes an ATPase subunit. In the current model, PtdOH present in the inner leaflet of the outer chloroplast membrane is recognized by TGD2. This binding reaction may also result in the transfer of the PtdOH to the permease subunit tor translocation across the inner membrane. The TGD3 subunit provides the energy for inter- and/or transmembrane movement of the PtdOH. Subsequent to transport, the PtdOH is thought to be metabolized via a PtdOH-phosphatase to yield the diacylglycerol moieties for MGDG and DGDG synthesis. Although the TGD2 interaction with PtdOH is well defined, it is possible that the PtdOH acts only as a docking signal for the complex, which transports another lipid across the membrane. The arrangement ofTGD 1, TGD2, and TGD3 components provides an important example of an acceptor membrane complex that can interact with a donor membrane and combine both inter- and intramembrane transport events.
Recently a candidate gene for the transfer of phospholipid from the FR to the chloroplast has been identified and assigned as TGD4 (121). The TGD4-eneoded protein is an integral membrane protein associated with the FR. The tgJ4 mutants accumulate PtdCho and are defective in transporting PtdCho between the FR and the chloroplast in vitro. The diacylglycerol moiety of the PtdCho is metabolized to MGDG by the chloroplast in the in vitro reaction. Still unclear is whether the PtdCho is metabolized to PtdOH at the outer chloroplast membrane, or if Other metabolic processes occur to produce the diacylglycerol moiety of MGDG.
Ceramide Transport
Многисленные phospholipids и sphingolipids синтезируются в ER многих эукариот и экспортируются в качестве предшественников для будущего метаболизма др. липидов или как путь конечного продукта. Лишь немногие гены известны, которые участвуют в этих транспортных процессах, многие ещё предстоит выяснить. Сегодня компоненты, участвующие в транспорте ceramide, хорошо известны в любой системе (see Figure 5). Ceramide синтезируются в ER и транспортируются в аппарат Гольджи, где они метаболизируются в CerPCho, glucosylceramide (GlcCer) и др. более сложные sphingolipids у животных эукариот и в CerPIns-X у дрожжей. Линии клеток млекопитающих, дефектные по синтезу CerPCho, были использованы для идентификации кДНК/гена, ответственного за транспорт ceramide, названных CERT (122). Белок растворим и содержит 4 домена, которые регулируют его функцию: N-терминальный pleckstrin homology (PH) домен, тандемных фенилаланинов в acidic tract (FFAT) домен, sterol acute regulatory protein-related lipid transfer (START) домен и serine-rich phosphorylation (SR) домен (13, 25). Исследования in vitro продемонстрировали, что домен START один достаточен для эффективного обмена Cer между мембранными популяциями способом, сходным с тем, что описан для классических белков переносчиков липидов. Домен PH участвует в распознавании Ptdlns-4P и доставляет белок в Golgi. Домен FFAT соединяется с интегральным ER белком, VAP (21). Фосфорилированный домен SR редуцирует взаимодействия белка с органеллами и усиливает цитозольную локализацию белка in vivo, тогда как дефосфорилированный SR домен усиливает связывание CERT с Golgi и ER (24). Фосфорилирование CERT, которое блокирует связывание с Golgi, а также связывание ceramide и транспортные функции, способствуют аутоингибирующим взаимодействиям между START и PH доменами. Casein kinase 1 является потенциальной протеин киназой для фосфорилирования CERT. Protein phosphatase 2Cε (PP2Cε), как было установлено, изменяет активность и локализацию CERT, способствуя Golgi-ассоциированной форме. Белок PP2Cε является интегральным мембранным белком ER, который также ассоциирует с VAP (24).
Сегодня две модели были проверены, чтобы полнее установить роль мембраны и белковых взаимодействий в функции CERT. В sequential-diffusion модели, растворимый CERT соединяется с VAP в ER и приобретает свой Cer груз. В результате приобретения груза CERT диссоциирует от ER и диффундирует в Golgi, где он распознает Ptdlns-4P и соединяется. После соединения CERT высвобождает липидный груз и затем диссоциирует от мембраны. чтобы начать цикл снова. Эффективность sequential модели д. увеличиваться за счет концентрации переноса липидов в регионах, где ER и Golgi находятся в тесном противостоянии др. с др. CERT и его
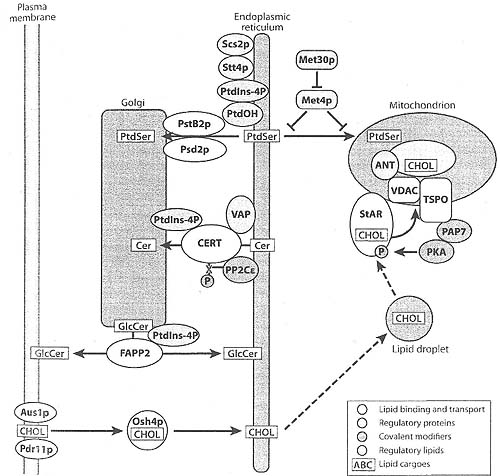 Figure 5
Intermembrane lipid transport processes. The major components involved in nonvesicular interorganelle lipid traffic iti yeast and mammalian cells are summarized. Phosphatide lserine (PtdSer! is transported to mitochondria under the regulation of a ubiquitin ligase (Met30p) and a transcription factor (Met4p), which appear to control endoplasmic reticulum (ERVmitochondrial interactions. PtdSer transport to the Golgi is regulated by the lipids phosphatidic acid (PtdOH) and phosphaudylinositol-4phosphate i Ptdlns-4P), and die endoplasmic reticulum (ER) tethering protein (Scs2p). a phospliaudvlinositol-4kinase (Stt4p), a phospholipid-binding protein (PstB2p), and a phosphatidylserine decarboxylase (Psd2p). that cooperate in forming a mature transport complex with the ER. The ceramide (Cer) transporter (CERT) catalyzes movement of ceramide between the ER and Golgi. Cer transport is regulated by protein-protein interactions involving CERT, a vesicle-associated protein (VAP). and a protein phosphatase (PP2C*) as well as by protein-lipid interactions between CERT and Ptdlns-4P. CERT dephosphorylation is catalyzed by PP2Ct. Glucosylceramide (GlcCer) is transported by the Ptdlns-4P adaptor protein (FAPP2). and the process is regulated by FAPP2/Ptdlns-4P interactions. In yeast, cholesterol (CIIOL) transport at the plasma membrane utilizes the ABC transporters responsible tor die auxotrophic uptake ot sterols (Ausl p) and pleiotropic drug resistance (Pdrl lp). The oxysterol-binding protein horaolog, Osh4p, functions as a sterol-binding protein and can facilitate the transfer of exogenous cholesterol to the ER for esteriheation. Mitochondrial import of cholesterol in hormonally responsive tissues utilizes die steroidogenic acute regulatory (StAR) protein to transport cholesterol from lipid droplets and other sources to the mitochondria. At the mitochondria StAR is phosphorylated by protein kinase A (PKA), which is part ot a multiprotein complex including the sterol transporter composed ot the translocator protein (TSPO) and the voltage-dependent anion channel (VDAC). PAP7 is a linker protein that tethers PKA to the complex. The adenine nucleotide transporter (ANT) is an inner mitochondrial membrane protein that associates "ith VDAC and promotes its localization at contact sites between the outer and inner membranes. When recruited to the complex, StAR transfers its cholesterol cargo to TSPO for subsequent import into the mitochondria.
Figure 5
Intermembrane lipid transport processes. The major components involved in nonvesicular interorganelle lipid traffic iti yeast and mammalian cells are summarized. Phosphatide lserine (PtdSer! is transported to mitochondria under the regulation of a ubiquitin ligase (Met30p) and a transcription factor (Met4p), which appear to control endoplasmic reticulum (ERVmitochondrial interactions. PtdSer transport to the Golgi is regulated by the lipids phosphatidic acid (PtdOH) and phosphaudylinositol-4phosphate i Ptdlns-4P), and die endoplasmic reticulum (ER) tethering protein (Scs2p). a phospliaudvlinositol-4kinase (Stt4p), a phospholipid-binding protein (PstB2p), and a phosphatidylserine decarboxylase (Psd2p). that cooperate in forming a mature transport complex with the ER. The ceramide (Cer) transporter (CERT) catalyzes movement of ceramide between the ER and Golgi. Cer transport is regulated by protein-protein interactions involving CERT, a vesicle-associated protein (VAP). and a protein phosphatase (PP2C*) as well as by protein-lipid interactions between CERT and Ptdlns-4P. CERT dephosphorylation is catalyzed by PP2Ct. Glucosylceramide (GlcCer) is transported by the Ptdlns-4P adaptor protein (FAPP2). and the process is regulated by FAPP2/Ptdlns-4P interactions. In yeast, cholesterol (CIIOL) transport at the plasma membrane utilizes the ABC transporters responsible tor die auxotrophic uptake ot sterols (Ausl p) and pleiotropic drug resistance (Pdrl lp). The oxysterol-binding protein horaolog, Osh4p, functions as a sterol-binding protein and can facilitate the transfer of exogenous cholesterol to the ER for esteriheation. Mitochondrial import of cholesterol in hormonally responsive tissues utilizes die steroidogenic acute regulatory (StAR) protein to transport cholesterol from lipid droplets and other sources to the mitochondria. At the mitochondria StAR is phosphorylated by protein kinase A (PKA), which is part ot a multiprotein complex including the sterol transporter composed ot the translocator protein (TSPO) and the voltage-dependent anion channel (VDAC). PAP7 is a linker protein that tethers PKA to the complex. The adenine nucleotide transporter (ANT) is an inner mitochondrial membrane protein that associates "ith VDAC and promotes its localization at contact sites between the outer and inner membranes. When recruited to the complex, StAR transfers its cholesterol cargo to TSPO for subsequent import into the mitochondria.
родственные компоненты не нуждаются в медиаторах мембранных контактов, но могут концентрироваться или оптимально функционировать в этих местах. Наложенной на этот цикл переноса Cer является регуляция фосфорилирования и дефосфорилирования CERT с помощью киназ и PPC2ε, которые возможно сами себя регулируют с помощью факторов, которые оценивают как уровни содержимого ceramide, так и содержимого sphingomyelin в разных мембранах и активируются/инактивируются в ответ на эти параметры. Др. модель предполагает, что CERT может быть одновременно связан как с ER (за счет взаимодействия FFAT/VAP) так и с Golgi (за счет PH/Ptdlns-4P взаимодействия) в зонах противостояния или контакта мембран. В этих последних условиях Cer переносится между мембранами за счет конформационного зажатия START домена между донорским и акцепторным компартментами без отделения CERT от любой из мембран. Во второй модели, связывание Golgi и загрузка и перенос Cer являются предметами регуляции с помощью фосфорилирования и дефосфорилирования. В актином состоянии CERT д. быть дефосфорилирован и связан с обеими органеллами. В неактивном состоянии CERT д. быть фосфорилирован и растворен или прикреплен только к ER компартменту. Сегодня недостаточно данных, чтобы с определенностью выбрать транспортный механизм sequential или tethered модели. Однако модель закрепления, которая нуждается в одновременной связи CERT с донором ER и акцептором Golgi, д. предоставлять достаточную конформационную свободу для белка, чтобы соединяться и экстрагировать Cer из одной мембраны и откладывать липид на отделенной мембране.
Glucosylceramide Transport
Пул Cer, расположенный в Golgi также используется дл синтеза GlcCer, который служит в качестве предшественника для многих более сложных glycosphingolipids (напр., gangliosides). В противоположность CerPCho и сложным glycosphingolipids, которые синтезируются в просвете Golgi, GlcCer синтезируется на цитозольной поверхности trans-Golgi (15). Хотя перемещение через бислой NBD-GlcCer может происходить в Golgi, естественная форма GlcCer, по-видимому, не транслоцируется через мембрану в существенном количестве. Т.о., путь, с помощью которого GlcCer усиливает доступ к сложным glycosphingolipid синтетическим энзимам, исторически оказался трудным для понимания. Недавняя работа показала, что растворимый белок, который взаимодействует с ARF и Ptdlns-4P, и наз. four-phosphate adaptor protein (FAPP2), также действует как и GlcCer-связывающий и переносящий белок (1 5, 22). FAPP2 может проникать в Golgi посредством своего PtdIns-4P-связывающего домена и приобретать субстрат GlcCer. Затем FAPP2 действует как растворимый носитель и транспортер GlcCer в плазматическую мембрану и ER. Неясно, какие сигналы, если таковые есть, направляют нагруженный грузом FAPP2 в плазматическую мембрану и ER. В ER неспецифическая липид транслоцирующая активность (123) (для которой неизвестны ни специфические гены или белки) вставляет липиды в просвет органелл. Такая сортировка GlcCer в просвет ER создает пул, который д. в конечном итоге получить доступ к энзимам синтеза сложных glycosphingolipid в просвете Golgi.
Phosphatidylserine Transport
PtdSer синтезируется в ER эукариот и транспортируется во множественные органеллы (see Figure 5). Транспорт PtdSer в митохондрии клеток млекопитающих и в митохондрии и Golgi дрожжей может быть отслежен с помощью измерения превращения липида в PtdEtn, за счет PtdSer decarboxylases (Psd1p и Psd2p), которая располагается в этих органеллах (124). Для простоты маршрут транспорта PtdSer в митохондрии был назван PSTA путь, а транспорт PtdSer в Golgi был назван PSTB путь (17). Биохимические и морфологические данные идентифицировали специализированный субдомен ER, названный mitochondria-associated membrane (MAM), в качестве проксимального донора PtdSer для митохондрий. MAM соотв. образом слипается с митохондриями и обогащен энзимом PtdSer synthase сравнимым по массе в ER (125). Генетический и биохимический анализ у дрожжей выявил участие двух генов в регуляции транспорта PtdSer в митохондрии, MET30 и MET4 (12). Ген MET30 кодирует субъединицу распознавания субстрата (Met30p) многокомпонентной ubiquitin ligase, а инактивирующие мутации (pstA1 or met30) ингибируют перенос синтезируемого PtdSer между MAM и митохондриями. Мутанты pstA1 обнаруживают дефекты в MAM в качестве компартмента донора и в митохондриях в качестве акцепторного компартмента. Исследования по реконструкции показали, что MAM из pstA1 линий не может эффективно переносить PtdSer в митохондрии дикого типа, а MAM из линий дикого типа не может эффективно переносить PtdSer в pstA1 митохондрии (12). Эти результаты указывают на то, что MET30 регулирует факторы, которые затрагивают как MAM, так и митохондрии. Основным субстратом для ubiquitination, направляемым с помощью Met30p, является транскрипционный фактор Met4p (126). Убиквитинирование Met4p инактивирует этот транскрипционный фактор и усиливает перенос PtdSer на митохондрии, где активация Met4p ингибирует перенос PtdSer на митохондрии. Механизм, с помощью которого Met4p негативно регулирует транспорт липида, неизвестен, но полагают, что он участвует в регуляции ER и контакте с митохондриями.
У дрожжей PtdSer также транспортируется из ER в Golgi, который является местом нахождения Psd2p (124). Генетический скрининг и биохимический анализ идентифицировал три гена в качестве регуляторов или участников транспорта PtdSer на Psd2p. Эти гены кодируют PtdIns-4-kinase, Stt4p, белок липидного обмена, PstB2p, и PtdSer decarboxylase, Psd2p (127-129). Линии, обладающие мутациями в Stt4p, которые снижают активность Ptdlns-4-kinase, дефектны по транспорту PtdSer на Psd2p (127). Хотя Stt4p преимущественно ассоциирует с плазматической мембраной благодаря взаимодействию с супрессорным 4 kinase белком, Sfk1p (130), субпопуляция энзима обнаруживается в ER. Stt4p был также обнаружен с помощью протеомного скрининга ассоциированным с белковым комплексом в ER, который включает интегральный мембранный белок Scs2p (suppressor of choline sensitivity) (131). Ses2p является дрожжевым ортологом белка VAP который участвует в транспорте Cer, как описывалось выше. Хотя пул Ptdlns-4P у дрожжей происходит из Stt4p , но демонстрируется только в плазматической мембране, минимальная ассоциация Stt4p с ER и ассоциация с Scs2p может вносить вклад в небольшой временный пул Ptdlns-4P в этой органелле. Наипростейшая модель участия Stt4p и Ptdlns-4P в транспорте PtdSer связана с использованием пула липидов в ER.
Белок PstB2p был идентифицирован в др. генетическом скрининге как гомолог Sec14p homolog, Sfh4p и как ген резистентности к плейотропным лекарствам Pdr17p (132, 133). В контексте данной работы мы используем терминологию PstB2p, чтобы обсудить транспорт липидов по пути PSTB. PstB2p принадлежит семейству белков переносчиков phospholipid, xmv членом основателем у дрожжей является Sec14p. Белок является амфитропным, обладающим как растворимой, так и мембран-связанной формой. PstB2p генетически, биохимически и механистически участвует в транспорте PtdSerна Psd2p при использовании метода пермеабилизированными клетками и изолированными органеллами. Однако в классическом методе белков переносчиков липидов PstB2p участвует только в связывании и переносе Ptdlns и не использует PtdSer в качестве липидного субстрата (128). Эти данные строго указывают на то, что в соотв. с органеллами PstB2p действует как субкомпартмент мултипротеинового комплекса, который вляет на транспорт PtdSer между донорской и акцепторной мембранами. Путем использования различных комбинаций ER и Golgi мембран от линий, обладающими или дикого типа или мутантным pstB2 аллелем, местом действия PstB2p оказалась акцепторная мембрана (11). Т.о. Golgi мембраны, содержащие связанный PstB2p, оказываются компетентными транспортными акцепторами PtdSer, но те же самые мембраны, лишенные PstB2p не способны действовать в качестве акцепторов липидов.
Анализ первичных последовательностей демонстрирует, что Psd2p содержит C2 домен (134). C2 были впервые идентифицированы в protein kinase C как Ca2+ и phospholipid-связывающие домены. Делеция домена C2 из Psd2p (Psd2-(C2Δ)p) не существенно изменяет каталитическую активность энзима (129). Однако мембраны Golgi , содержащие Psd2-(C2Δ)p, являются несостоятельными акцепторами для транспорта PtdSer, даже если энзим избыточно экспрессируется в 10 раз. Этот процесс транспорта может быть обойден при использовании by using NBD-PtdSer в качестве субстрата, который спонтанно вставляется в мембраны Golgi, липид при этом эффективно декарбоксилируется. Эти находки указывают на то, что C2 домен в Psd2p играет роль в процессе транспорта. Поскольку C2 домен и PstB2p оба располагаются в мембранах Golgi, то существующая модель предполагает, что они работают совместно, чтобы сформировать часть мультибелкового транспортного комплекса, который облегчает перемещение PtdSer из ER в Golgi.
Транспорт PtdSer на место расположения Psd2p был также реконструирован с использованием липосом в качестве мембран доноров (23). Неожиданно оптимальный транспорт и decarboxylation требовали, чтобы липосомы состояли почти исключительно из PtdSer. Липосомы, содержащие менее 10% PtdCho в дополнение к PtdSer переносят последний липид приблизительно с с половинной скоростью по сравнению с чистыми PtdSer пузырьками, а более высокие концентрации PtdCho могут полностью супрессировать транспорт. Реакция транспорта чувствительна также к радиусу изгиба липосом и благоприятствует более крупным липосомам с относительно уплощенной геометрией (~400 nm). Хотя PtdCho ингибирует транспорт PtdSer, но PtdOH стимулирует перенос, а Ptdlns-4P оказывается пермиссивным для переноса. Эти исследования с липосомами подтверждают, что оптимальный транспорт PtdSer может происходить из микродоменов, сильно обогащенных PtdSer вместе с PtdOH и Ptdlns-4P. Механизм, с помощью которого такие домены могут формироваться в нативном ER, неизвестны, но могут выполняться с помощью ER белков, которые осуществляют функцию загона (corralling) анионных липидов. Такие corralling функции могут регулироваться метаболическими условиями, которые способствуют увеличению концентрации анионных липидов или за счет взаимодействий акцепторных мембран с донором, который передает сигнал о готовности преобразовывать транспортируемые липиды, а заодно и включать corralling функции. Важно, что исследования с липосомными донорами воспроизводят потребность в интактном C2 домене в Psd2p, и в присутствии PstB2p в акцепторных мембранах, чтобы происходит транспорт.
Cholesterol Transport
Информация о генах и белках, контролирующих не везикулярный транспорт стерола между органеллами получена в исследованиях транспорта холестерола из плазматической мембраны в ER для синтеза холестероловых эфиров и импорта холестерола в митохондрии для синтеза стероидных гормонов ( Figure 5). Транспорт холестерола между плазматической мембраной и ER можно отслеживать на интактных дрожжах, следя за превращением экзогенно добавляемого холестерола в eholesteryl эфир (16). Дрожжевые ортологи (Osh белки) oxysterol-связывающего белка млекопитающих составляют семейство из 7 белков (Osh 1-7) (135). Делеция всех 7 OSH генов летальна, но любой из 7 может поддерживать рост клеток. Osh4p был кристаллизован и было показано, что связывает холестерол в гидрофобной полости, прикрытой гибкой крышкой (136). Линии дрожжей с делецией всех OSH генов за исключением 0SH4 компетентны потреблять экзогенный холестерол и эфиризировать его. Если чувствительный к температуре аллель osb4(ts) используется вместо аллеля дикого типа на OSH-делетированном фоне, то транспорт холестерола сравним с таковым при аллеле дикого типа при пермиссивной температуре, но частично нарушен при непермиссивной температуре (16). In vitro Osh4p может обменивать холестерол между донорскими и акцепторными липосомами и обнаруживает также активность связывать PtdSer и Ptdlns4.5P2. Включение Ptdlns4.5P2 в липосомы увеличивает скорость транспорта холестерола между липосомами, подтверждая, что сродство и эффективность экстракции стерола для липосом увеличивается за счет анионных липидов. Истощение уровня PtdIns4,5P2 in vivo также заметно снижает транспорт холестерола из плазматической мембарны в ER, демонстрируя, что in vitro свойства Osh4p характеризуют транспорт липида in vivo. Помимо Osh4p, имеются также доказательства, что Osh3p и Osh5p могут вносить вклад в транспорт холестерола in vivo.
Во многих эукариотических клетках содержание холестерола митохондриями относительно низкое, но в клетках, продуцирующих стероидные гормоны, существует специализированный транспортный аппарат для импорта липидов в митохондрии для метаболизма в pregnenolone, который является важным предшественником для всех стероидных гормонов. В ответ на разнообразные стероидогенные гормональные стимулы присутствующие в липидных капельках steryl esters в стероид-продуцирующих клетках гидролизуются, чтобы продуцировать холестрол, который мобилизуется для транспорта в и импорта в митохондрии (137, 138). Эти гормональные стимулы также ведут к быстрой транскрипции и трансляции steroidogenic acute regulatory (StAR) белка, который связывает холестерол своим С концом и направляет его на наружную митохондриальную мембрану с помощью своей N-терминальной последовательности. также в ответ на гормональное воздействие шунтирующий белок, PAP7, рекрутируется их аппарата Golgi на наружную митохондриальную мембрану, где он связывает находящийся там translocator protein (TSPO) (18, 139). PAP7 связывает protein kinase A регуляторную субъединицу RIα и затем закрепляет protein kinase A на комплексе, где он фосфорилирует StAR. Фосфорилирование StAR не обязательно для транспорта холестерола, но оно увеличивает скорость процесса (140). TSPO является холестерол-связывающим белком с высоким сродством и он соединяется с voltage-dependent anion channel (VDAC), чтобы сформировать транспортный комплекс на месте контакта внутренней-/наружной-мембраны для перемещения холестерола в митохондрии. VDAC ассоциирует также с транспортером аденинового нуклеотида, присутствующего на внутренней мембране. Холестерол переносится из StAR на TSPO/VDAC комплекс и импортируется в митохондрии. Гормональная инициация процесса сборки растворимого носителя холестерола, StAR, и обоих транспортных комплексов и комплекса фосфорилирования необходима для максимальной эффективности транспорта. Механизм, с помощью которого StAR приобретает холестерол или из липидных капелек или пула свободного холестерола мембран, пока неизвестен, хотя дополнительные растворимые переносчики стерола могут облегчать загрузку StAR липидами.
SUMMARY
1. Numerous lipids are transported within and between membranes by nonvesicular processes.
2. Intramembrane lipid transport processes utilize P-type ATPases. ABC transporters, seramblases, and Niemann-Pick type C family proteins.
3. Intermembrane lipid transport occurs by both vesicular and nonvesicular mechanisms. Nonvesicular mechanisms are now knou n for transport of phospholipids, sphingolipids. and sterols.
4. A growing number of genes and proteins .ire being identified as participants in nonvesicular lipid transport. CERT, EAPP2, Osh4p. StAR, and NPC2 act as soluble iiptd carriers. Psd2p and PstB2p at the Golgi; TSPO and VDAC at the mitochondria; Tgd1, Tgd2, and Tgd3 at the chloroplast inner membrane; and LptD and LptE ai die bacterial outer membrane form transport complexes on acceptor membranes that interact with donor membranes or soluble lipid carriers.
5. In addition lo protein-protein interactions, protein lipid interactions involving polyphos-phoinositides, phosphatide acid, and other acidic lipids play a role in docking soluble lipid carriers to membranes. These same lipid motifs also play a role in docking membrane-bound transport complexes between membranes.
6. Phosphorylation of lipid carriers (CERT and StAR), and probably other posttranslational modifications, plavs a role in regulating nonvesicular lipid transport processes.
FUTURE ISSUES
1. The number of genes curremh implicated in nonvesicular lipid traffic is thought to be a minor fraction of die total number involved in the processes. The development of genetic screens and mutant strains ol all model organisms to fill this gap in our knowledge is an important priority for the tield of membrane biogenesis.
2. The mechanisms ot action ol numerous intramembrane transporters are poorly understood. Clear definition ot the biological substrates that are transported and their sites of entry and exit from transporters is needed. In many cases, diese issues will only be resolved by purification and biochemical reconstitution ot the transporters, and physical measurements of lipid interactions with the proteins.
3. The further dissection of the chloroplast lipid transport problem will benefit from the development of a robust ER to chloroplast lipid transport assay system.
4. The regulation of ceramide transport to the Golgi is now well understood up to the level of phosphorylation and dephosphorylation of CERT. Information about how the kinases and phosphatases are turned on and off in response to membrane lipid composition is now needed.
5. The paradigms for regulation of CERT by lipids, proteins, and phosphorylation need to be extended to other known and related lipid transfer proteins to determine if thev are similarly modified and regulated.
6. Protein interaction repertoires for the Psd2p and PstB2p involved in PtdSer transport to the Golgi need to be elucidated to identify other structural components of the transport complex that forms between the membranes.
Сайт создан в системе
uCoz  Figure 1
Intramembrane lipid transport processes. Intramembrane lipid transport can occur by multiple routes, (a) The lipid undergoes transbilayer movement with entry into the transporter from one leaflet and exit from the transporter into the opposing leaflet. This type of transport is often characterized by significant residence rime of the lipid in both leaflets of the membrane bilayer. (/;) The lipid enters the transporter from one leaflet but exits the transporter to an exogenous acceptor distinct from the opposing leaflet. The net effect of this transport mode is to efflux the lipid from the membrane after residence in only one of the membrane leaflets, (t) The lipid enters the transporter from an exogenous donor, which could be either a carrier protein ot a membrane separate from the membrane harboring the transporter. This latter mechanism can occur without residence of the lipid in either leaflet of the bilayer and is similar to transport mechanisms for ions and solutes. Multiple combinations of the routes shown in a, h, and ' are also possible.
Figure 1
Intramembrane lipid transport processes. Intramembrane lipid transport can occur by multiple routes, (a) The lipid undergoes transbilayer movement with entry into the transporter from one leaflet and exit from the transporter into the opposing leaflet. This type of transport is often characterized by significant residence rime of the lipid in both leaflets of the membrane bilayer. (/;) The lipid enters the transporter from one leaflet but exits the transporter to an exogenous acceptor distinct from the opposing leaflet. The net effect of this transport mode is to efflux the lipid from the membrane after residence in only one of the membrane leaflets, (t) The lipid enters the transporter from an exogenous donor, which could be either a carrier protein ot a membrane separate from the membrane harboring the transporter. This latter mechanism can occur without residence of the lipid in either leaflet of the bilayer and is similar to transport mechanisms for ions and solutes. Multiple combinations of the routes shown in a, h, and ' are also possible. 


