Базируясь на этих наблюдениях, мы предположили, что транскрипция необходима для функциональной активности цис-регуляторных геномных регионов в BX-C и для последующей инициации экспрессии Hox генов (Fig. 2) (Akbari et al., 2006). Межгенная транскрипция, как полагают, активирует экспрессию Hox генов согласно последовательной модели. В этой модели продукция не-генных транскриптов с iab регионов раскрывает окружение хроматина, позволяя белкам затем соединяться с их сайтами распознавания в BX-C (Fig. 2B) (Cook, 2003). Т.о., транскрипционные факторы могут соединяться с сайтами в энхансерах, таких как те, что в IAB5 (Fig. 2B) и IAB2 (Casares and Sanchez-Herrero, 1995, Shimell et al., 1994) (see (Maeda and Karch, 2006) for a review). Транскрипционные факторы, соединяющиеся с энхансерами, могут затем взаимодействовать с Abd-B промотором, чтобы активировать транскрипцию Abd-B гена (Fig. 2D).
После инициации экспрессии Hox гена в BX-C, не-генная транскрипция продолжает оставаться важной для динамической регуляции Hox генов. Один из механизмов контроля это transcriptional interference (TI), первоначально названная "promoter occlusion", где процесс транскрипции одной регуляторной последовательности предупреждает последующую инициацию транскрипции, элонгацию или преждевременное завершение соседнего гена мишени и тем самым приводит к репрессии этого гена мишени (Adyha and Gottesman, 1982, Mazo et al., 2007).
В BX-C, геномный регион bxd располагается между Ubx и abd-A транскрипционными единицами (see Fig. 1), и содержит maintenance element (ME), который регулирует Ubx (Chan et al., 1994, Cumberledge et al., 1990, Lipshitz et al., 1987, Muller and Bienz, 1991, Tillib et al., 1999). Несколько ncRNAs, как было установлено, транскрибируются посредством bxd ME (Cumberledge et al., 1990, Sanchez-Herrero and Akam, 1989). Доказательства для sense-TI в этом регионе получены с помощью делеций в промоторах bxd ncRNAs, которые ведут к эктопической экспрессии Ubx в эмбриональных доменах, где ncRNAs обычно экспрессируются (Petruk et al., 2006). Поскольку инъекции dsRNA, чтобы устранить bxd ncRNAs, не влияют на паттерн экспрессии Ubx (Petruk et al., 2006), то процесс не-генной транскрипции сам по себе, как полагают, имеет более значительное функциональное значение, чем продукты РНК. Однако эндогенные ncRNAs остаются локализованными в ядре, это может в принципе не позволять dsRNA модулировать стабильность ncRNAs в этом эксперименте. Предыдущие исследования показали, что транскрипция bxd ncRNAs позитивно регулирует экспрессию Ubx в крыловых имагинальных дисках и, что bxd транскрипты способны рекрутировать Ash1, эпигенетический активатор, способный метилировать лизиновые остатки в гистонах (Sanchez-Elsner et al., 2006). Тот факт, что Ash1 и Ash1-управляемые паттерны метилирования гистонов наблюдаются на bxd MEs после транскрипции bxd и, что Ash1 , как было установлено
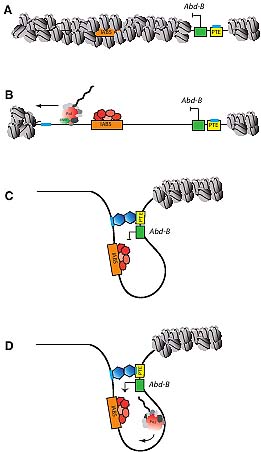 Fig. 2. Model for activation of Abd-B gene expression by sequential
transcription and promoter-enhancer tethering. A model for events
occurring in the presumptive 5th
abdominal segment of the developing
Drosophila embryo, where the promoter tethering element (PTE) facili-
tates interactions between the IAB5 enhancer and the Abd-B promoter:
(A) Prior to the activation of the Hox genes, the regulatory sequences 3'
of the Abd-B gene are in an inactive chromatin configuration. (B)
Intergenic transcription early in embryonic development by RNA poly-
merase II (Pol) (red circle) and associated chromatin modifying enzymes
(CME) (green circle) facilitates the opening of the chromatin at the
regulatory regions in the BX-C, enabling transcription factors (red/peach
polygons) to bind to enhancer modules, such as IAB5 (orange box). (C)
Homo-dimeric interactions between a protein factor (blue hexagon)
bound at conserved sequences (blue line) within the PTE (yellow box)
and a region close to IAB5 facilitate promoter-enhancer interactions. The
chromatin loop configuration formed by these specific interactions
brings the IAB5 enhancer and associated transcription factors to the
Abd-B promoter (green box). (D) The localized high concentration of
transcription factors in the chromatin loop upregulates expression of
Abd-B by interacting with the basal transcriptional machinery, including
RNA polymerase II.
Fig. 2. Model for activation of Abd-B gene expression by sequential
transcription and promoter-enhancer tethering. A model for events
occurring in the presumptive 5th
abdominal segment of the developing
Drosophila embryo, where the promoter tethering element (PTE) facili-
tates interactions between the IAB5 enhancer and the Abd-B promoter:
(A) Prior to the activation of the Hox genes, the regulatory sequences 3'
of the Abd-B gene are in an inactive chromatin configuration. (B)
Intergenic transcription early in embryonic development by RNA poly-
merase II (Pol) (red circle) and associated chromatin modifying enzymes
(CME) (green circle) facilitates the opening of the chromatin at the
regulatory regions in the BX-C, enabling transcription factors (red/peach
polygons) to bind to enhancer modules, such as IAB5 (orange box). (C)
Homo-dimeric interactions between a protein factor (blue hexagon)
bound at conserved sequences (blue line) within the PTE (yellow box)
and a region close to IAB5 facilitate promoter-enhancer interactions. The
chromatin loop configuration formed by these specific interactions
brings the IAB5 enhancer and associated transcription factors to the
Abd-B promoter (green box). (D) The localized high concentration of
transcription factors in the chromatin loop upregulates expression of
Abd-B by interacting with the basal transcriptional machinery, including
RNA polymerase II.
способен связывать bxd РНК транскрипты, указывает на то, что bxd транскрипты могут фактически выполнять важные функциональные роли (Sanchez-Elsner et al., 2006). Кажущиеся расхождения в регуляторной активности bxd ncRNAs, открытые в этих исследованиях, рассмотрены недавно детально (Lempradl and Ringrose, 2008). Авт. обзора отмечают, что важно тщательное наблюдение за временем развития при изучении этих ncRNAs (Lempradl and Ringrose, 2008). Petruk et al. отмечают, что замалчивание Ubx с помощью bxd ncRNAs является временным феноменом, вообще-то функционирующим только во время раннего развития, как в случае предполагаемого замалчивания abd-A с помощью iab ncRNAs (Petruk et al., 2006).
In vitro исследования Callen et al. показали, что транскрипция посредством bxd регуляторной последовательности не прямо предупреждает RNA polymerase II (Pol II) от соединения с промотором гена мишени, Ubx, а снижает способность открытой формы Pol II очищать промотор мишень (Callen et al., 2004). Тем не менее точный механизм TI на гене
Ubx остается неизвестным. Предупреждает ли присутствие Pol II на bxd регуляторном регионе рекрутирование комплекса инициации транскрипции на Ubx мишень промотор? Напротив, рекрутирование Pol II на регуляторный регион bxd может предупреждать транскрипционную элонгацию за счет смещения комплекса элонгации на мишени Ubx промотора (Mazo et al., 2007).
Communication between cis-regulatory modules facilitates higher order chromatin structures in the bithorax complex
Первый задокументированный пример динамичного, дально-действующего физического взаимодействия между дистальным регуляторным модулем in vivo был представлен в исследовании BX-C (Cleard et al., 2006). Идентификация Dam methylase была использована для выявления физических взаимодействий между Fab-7 insulator и Abd-B промотором в тканях взрослых голов, где Abd-B не экспрессируется (Celniker and Drewell, 2007, Cleard et al., 2006). Недавно мы идентифицировали дальнейшие взаимодействия между промотором Abd-B и др. CRMs в BX-C. В 255 bp promoter tethering element (PTE), расположенный на 40 bp выше точки старта транскрипции Abd-B, специфически управляет взаимодействиями между IAB5 энхансером и промотором Abd-B при трансгенном подходе (Akbari et al., 2008). Более того, этот подход продемонстрировал, что PTE способен позволить энхансерам обходить мешающие инсуляторы, чтобы активировать дистальные промоторные последовательности (Akbari et al., 2007). Чтобы оценить эту молекулярную активность мы предположили, что PTE облегчает образование петли хроматина в BX-C, которая делает возможным стабильное взаимодействие между Abd-B промотором и энхансерами с 3' iab регуляторных регионов (Fig. 2C). Этот молекулярный мостик может быть обеспечен за счёт гомодимеризующихся белков, которые соединяются с законсервированным гексамерным мотивом внутри PTE и сближают с IAB энхансерами в BX-C (Fig. 2D) (Akbari et al., 2007).
Недавний in vivo анализ трехмерных структур хроматина в Drosophila BX-C подтвердил некоторые физические взаимодействия между негомологичными CRMs, которые могут беспечить активированное или репрессированное стояние транскрипции (Lanzuolo et al.,
2007). Chromatin Conformation Capture (3C) позволяет дедуцировать устройство хроматина BX-C с помощью количественного PCR (qPCR) анализа частот событий поперечного связывания. 3C
на хроматине, приготовленном от 5-8 ч эмбрионов, показал многочисленные физические взаимодействия между abd-A промотором и (1) всеми основными генетическими последовательностями, которые, как известно, связывают белки PcG в BX-C (напр. PREs и insulators), (2) Ubx и Abd-B промоторами и (3) 3' концом всех Hox генов в BX-C (see Fig. 1) (Lanzuolo et al., 2007). Однако in vivo функция этих ассоциаций остается неясной, т.к. эти исследования не позволяют различать между разными пространственными регуляторными доменами в эмбрионе, которые могут обладать разным устройством хроматина, который может быть динамическим по природе.
Визуализация положения в ядре дифференциально транскрибируемых BX-C локусов относительно Polycomb тел стало недавно возможно благодаря применению технологии fluorescence in situ hybridization (FISH) и FISH-Immunostaining (FISH-I). FISH и FISH-I у 5-8 ч эмбрионов показали, что известные PREs в bxd и Fab-7 регионах (see Fig. 1) ко-локализуются с крыпными телами Polycomb в 80% ядер из передней области эмбриона (Lanzuolo et al., 2007). Эти ядра локализуются в эмбриональных доменах, где BX-C Hox гены репрессированы. Напротив, у 80% из задних ядер, где Hox гены активно транскрибируются, bxd ко-локализуется с Polycomb телом, но Fab-7 в основном обнаруживается далеко от этого домена (Lanzuolo et al., 2007). Поскольку только 2D FISH был применен к эмбрионам данные по ко-локализации необходимо интерпретировать с осторожностью. Однако эти данные указывают на то, что негомологичные CRMs могут физически взаимодействовать и ассоциировать с Polycomb телами для того, чтобы содействовать альтернативным высокого порядка структурам хроматина, это ведет к транскрипционно репрессированным или активным состояниям. В свете этих данных образование окружения хроматина, которое содержит субъядерные компартменты молчания, может быть основным механизмом, посредством которого осуществляется регуляция экспрессии Hox генов с помощью CRMs (Lanzuolo et al., 2007).
В некоторых линиях Drosophila личиночных клеток S2, Ubx, abd-A и Abd-B транскрипционно репрессированы, представляя собой полное замалчивание BX-C (Breiling et al., 2004). 3C приготовленный хроматин из этих S2 клеток показал, что промоторы Ubx, abd-A и Abd-B строго взаимодействуют с PREs. Напротив, в Drosophila S3 клетках Abd-B транскрибируется, тогда как, abd-A и Ubx остаются молчащими (Breiling et al., 2004). 3C приготовленный хроматин из S3 клеток показал, что происходит потеря Fab-7 взаимодействий с большинством регионов BX-C, включая Abd-Bγ и B/C промоторы, и поддержание взаимодействий с менее активным Abd-B промотором A (Lanzuolo et al., 2007). Эти данные согласуются с результатами анализа Dam methylation репортера в BX-C (Cleard et al., 2006), где низкие уровни Dam метилирования были обнаружены в регионе Abd-B промотора из абдоминальной ткани, где Abd-B транскрипционно активен, по сравнению с тканями головы взрослых, где он не транскрибируется (Celniker and Drewell, 2007).
Добавление double-stranded RNA (dsRNA) против Polycomb (Pc) ведет к потере связывания PC тел с PREs и к последующей дерепрессии Hox генов в S2 клетках (Lanzuolo et al., 2007). 3C анализ после dsRNA нокдауна PC также подтверждает нарушение физических ассоциаций между дистальными PREs и активными Abd-B, abd-A и Ubx промоторами (Lanzuolo et al., 2007). Эти результаты указывают на то, что нарушение взаимодействий между этими дистальными CRMs вызывает дерепрессию Hox генов. Кроме того, dsRNA нокдаун PC приводит к слабой транскрипционной активности на PREs (Lanzuolo et al., 2007). Функциональная активность этих эктопических PRE транскриптов сегодня неясна. Однако существует возможность, что эта слабая не-генная транскрипция посредством PREs может быть просто следствием нарушения физических ассоциаций между дистальными PREs и промоторами Hox генов.
S2 или S3 клетки, произошедшие з неизвестной ткани на личиночных стадиях развития, могут не иметь сравнимой трехмерной структуры хроматина во взрослых тканях. Это ограничение подрывает использование базирующихся на клетках подходов для изучения окружения хроматина и физических взаимодействий между CRMs в BX-C во время развития. Кроме того, эти исследования подчеркивают общую трудность интерпретации как 3C, так и 2D FISH экспериментов, в одном случае из-за высокой частоты случайных поперечных связей в окружении неконденсированного хроматина, а в др. из-за осложнений, возникающих из-за разных динамических пространственных регуляторных доменов внутри эмбрионов. В будущих исследованиях необходимо более критически выбирать экспериментальную технику, которая способна различить между важными функциональными взаимодействиями и временными взаимодействиями. Изучение таких событий в разных регуляторных доменах эмбриона также очень важно. Расшифровка, как трехмерная структура хроматина обеспечивает альернативные состояния транскрипции посредством физических ассоциаций между CRMsв BX-C является технически трудно выполнимой задачей, которая может быть лучше всего достигнута посредством осторожного применения нескольких параллельных техник. 3D FISH в комбинации с Forster resonance energy transfer (FRET), физической техникой для определения молекулярной ко-локализации с высокой точностью, может быть использована для получения более полной и аккуратной картины взаимодействий белок-ДНК, которые обеспечивают динамическую трехмерную структуру хроматина.
Functional role for RNAi pathway components in silencing at the bithorax complex?
Недавние исследования подчеркнули интригующие случаи, в которых компоненты аппарата RNAi взаимодействуют с белками polycomb group proteins (PcGs) на CRMs в BX-C (Grimaud et al.,
2006). Путь RNAi, запускаемый благодаря присутствию double stranded RNA (dsRNA), генерирует короткие РНК, которые м. посредством множественных механизмов непосредственно репрессировать гомологичные гены посредством молчания генов (Hammond, 2005). На ступени инициации пути RNAi длинная dsRNA превращается в small interfering RNAs (siRNAs). На эффекторной ступени siRNAs включаются в RNA-induced silencing complex (RISC) (Hammond et al.,
2000, Zamore et al., 2000). MicroRNAs (miRNAs), stem-loop РНК структуры, которые формируются из естественно возникших РНК транскриптов, также экстенсивно используют белковые компоненты пути RNAi, чтобы вызывать эффект замалчивания активности (Jackson and Standart, 2007, Kim, 2005). Недавнее исследование в BX-C (Grimaud et al., 2006) было сконцентрировано на специфической роли факторов, которые используются в этих механизмах молчания с помощью малых РНК, включая Dicer-2 (Dcr-2), члена семейства RNase III, который видоизменяет dsRNA в siRNAs (Bernstein et al., 2001, Lee et al., 2004, Liu et al., 2003, Pham et al., 2004, Zamore et al., 2000), и Argonaute1 (AGO1), который играет роль в miRNA-обеспечиваемом молчании генов (for review of argonaute proteins see (Hutvagner and Simard, 2008)). В противовес miRNAs, Piwi-associated RNAs (piRNAs), последнее добавление к миру малых РНК, являются ассоциированными с повторами siRNAs видоизменяющиеся независимо от Dicer и Drosha, чья функция предупреждает распространение активных транспозонов в зародышевой линии (Aravin et al., 2003, Hartig et al., 2007). Функциональная роль белковых факторов пути piRNA в BX-C также была исследована (Grimaud et al., 2006). В частности исследована потребность в PIWI, белка семейства argonaute, который участвует в формировании гетерохроматина и процессинге piRNA (Brennecke et al., 2007, Gunawardane et al., 2007, Pal-Bhadra et al., 2004, Saito et al., 2006, Sarot et al., 2004) и Aubergine (Aub), белка семейства argonaute, который участвует в процессинге piRNA и поддержании молчащего состояния (Aravin et al., 2004, Brennecke et al., 2007, Carmell et al., 2002, Gunawardane et al., 2007, Harris and MacDonald, 2001, Vagin et al., 2006).
Чтобы понять роль этих компонентов RNAi в поддержании дальнодействующих контактов хроматина, трансгенные копии фрагментов в 3.6 kb, содержащие Fab-7 insulator и PRE вносили в Х хромосому (Fab-X), близко к эндогенному гену scalloped (sd) (Bantignies et al., 2003, Grimaud et al., 2006). После интеграции эктопическая последовательность Fab-X индуцировала PcG-зависимое молчание соседнего гена sd (Bantignies et al., 2003, Grimaud et al., 2006). У эмбрионров, несущих мутации, затрагивающие dcr-2, ago1, piwi или aub, не наблюдалось эффекта физических взаимодействий между Fab-7 и Hox генами в BX-C, или
Fab-X и sd на Х хромосоме (Grimaud et al., 2006). Однако в третьем личиночном возрасте личинки, несущие те же самые мутации компонентов RNAi, обнаруживали потерю физических взаимодействий как с эндогенных, так и с эктопических Fab-7 CRMs. Следовательно, очевидно, что поскольку эти RNAi компоненты не нужны во время раннего эмбрионального развития для функционального становления этих взаимодействий, они могут возможно играть роль в поддержании взаимодействий CRM на более поздних стадиях развития (Fig. 3) (Grimaud et al.,
2006). Эти данные указывают на то, что RNAi компоненты могут, следовательно, участвовать в поддержании на длинные расстояния Fab-7 репрессивных взаимодействий с последовательностями мишенями в BX-C, такими как промотор Abd-B (Fig. 3D), как это было идентифицировано в параллельных исследованиях (Cleard et al., 2006). Однако необходимо подчеркнуть, что ни одна из RNAi мутаций не вызывала трансформаций сегментов, это д. указывать на нарушение экспрессии Hox генов (Grimaud et al., 2006).
Исследование молекулярных механизмов, ответственных за дальнодействующие CRM взаимодействия в BX-C, также недавно подчеркнули роль polycomb repressive complex 1 (PRC1).
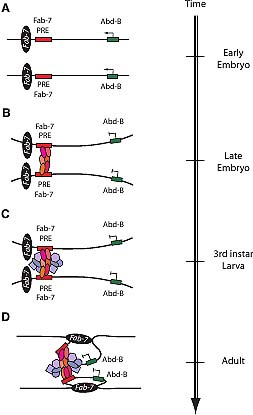 Fig. 3. Fab-7 cis-regulatory modules (CRMs) modulate long-distance
repressive interactions at the Abd-B gene. (A) The 3' Fab-7 regulatory
region that controls Abd-B expression is shown in an open chromatin
formation early in embryonic development when Abd-B (green box) is
transcribed. During this embryonic stage no PcG proteins are bound to
the PRE (red box) located just upstream of Fab-7 boundary (black ellipse).
(B) In late embryonic development, a repressive complex is formed as
PcG proteins (red shaded ellipses) bind to the PRE and silence transcrip-
tion of Abd-B (Zink and Paro, 1995), a process in which the RNAi
machinery is not involved (Grimaud et al., 2006). This repressive complex
does not form in tissues in the posterior end of the embryo where Abd-
B is expressed. (C) Upon reaching larval developmental stages in RNAi
protein mutants, there is a loss of long range chromosome interactions
of the Fab-7 PRE element (Grimaud et al., 2006) This suggests that
protein components of the RNAi machinery (blue shaded polygons),
which co-localize with the PcG proteins, are necessary to maintain the
repressed state of Abd-B (Grimaud et al., 2006, Lei and Corces, 2006). (D)
In adults, as a further step to maintain the repressed state of Abd-B in the
head region of the fly, Fab-7 interacts with a region 1.6 kb 5' of Abd-B
which facilitates a chromatin loop configuration that brings Abd-B in
closer vicinity with the repressive complex containing the PcG and RNAi
proteins (Cleard et al., 2006).
Fig. 3. Fab-7 cis-regulatory modules (CRMs) modulate long-distance
repressive interactions at the Abd-B gene. (A) The 3' Fab-7 regulatory
region that controls Abd-B expression is shown in an open chromatin
formation early in embryonic development when Abd-B (green box) is
transcribed. During this embryonic stage no PcG proteins are bound to
the PRE (red box) located just upstream of Fab-7 boundary (black ellipse).
(B) In late embryonic development, a repressive complex is formed as
PcG proteins (red shaded ellipses) bind to the PRE and silence transcrip-
tion of Abd-B (Zink and Paro, 1995), a process in which the RNAi
machinery is not involved (Grimaud et al., 2006). This repressive complex
does not form in tissues in the posterior end of the embryo where Abd-
B is expressed. (C) Upon reaching larval developmental stages in RNAi
protein mutants, there is a loss of long range chromosome interactions
of the Fab-7 PRE element (Grimaud et al., 2006) This suggests that
protein components of the RNAi machinery (blue shaded polygons),
which co-localize with the PcG proteins, are necessary to maintain the
repressed state of Abd-B (Grimaud et al., 2006, Lei and Corces, 2006). (D)
In adults, as a further step to maintain the repressed state of Abd-B in the
head region of the fly, Fab-7 interacts with a region 1.6 kb 5' of Abd-B
which facilitates a chromatin loop configuration that brings Abd-B in
closer vicinity with the repressive complex containing the PcG and RNAi
proteins (Cleard et al., 2006).
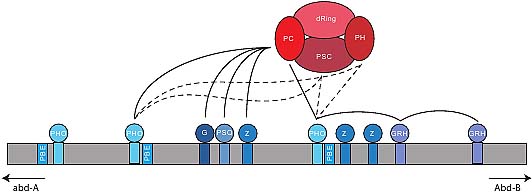
Fig. 4. Polycomb repressive complex 1 (PRC1) recruitment to Fab-7 polycomb response element (PRE). An approximately 408 bp section from the Fab-7 minimal PRE of the bithorax complex is able to recruit the PRC1 complex (Blastyбk et al., 2006). The binding sites (blue boxes) for specific DNA binding factors; Pleiohomeotic (PHO), GAGA factor/Pipsqueak (G/PSQ), Zeste (Z) and Grainyhead (GRH) are spread throughout the Fab-7 DNA element. Components of the PRC1 core complex (PCC); polycomb (PC), polyhomeotic (PH), posterior sex combs (PSC) and dRING are indicated by red ellipses. Solid lines represent characterized interactions and cooperative binding to the DNA sites (see (Bantignies and Cavalli, 2006) for detailed description). Dashed lines represent proposed interactions (see detailed description in text). (Figure adapted from (Bantignies and Cavalli, 2006)).
PRC1 core complex (PCC) состоит из 4-х компонентов: polycomb (PC), polyhomeotic (PH), posterior sex combs (PSC) и dRing, но PRC1 в целом содержи и дополнительные белки (Shao et al., 1999). Pleiohomeotic (PHO), сиквенс-специфический ДНК-связывающий член PcG (Brown et al., 1998), является существенным для PRC1, чтобы формировать комплекс с ДНК мишенью (Brown et al., 1998, Fritsch et al., 1999). Исследования с двойным иммуномечением выявили ко-локализацию polyhomeotic (PH), компонента polycomb repressive complex 1 (PRC1), с Dcr-2, PIWI и AGO1 в личиночных ядрах, указывающей, что RNAi компоненты физически проксимальнее к PcG ядерным телам в клетке (Fig. 3) (Grimaud et al., 2006). Более того, FISH-I осуществленный на политенных хромосомах личинок с мутациями для
piwi, dcr-2 и ago1 выявил снижение дальнодействующих взаимодействий между PcG-зависимыми молчащими регионами в BX-C и ANT-C (Grimaud et al., 2006). Эти исследования указывают на то, что белковые компоненты аппарата RNAi и PcG факторы могут играть комбинаторную роль в дальнодействующих ядерных взаимодействиях эндогенных Hox генов мишеней (Fig. 3), хотя корреляция с транскрипционной активностью Hox генов ещё не была функционально протестирована. Однако сходные наблюдения недавно сделаны с gypsy insulator (Lei and Corces, 2006). У мух, несущих мутации для Piwi или AGO2, функция gypsy insulator снижена, указывая тем самым, что эти два RNAi компонента могут оказаться критическими для функции разных типов CRMs (Lei and Corces, 2006).
Alternate mechanism for the recruitment of polycomb group proteins to polycomb response elements in the bithorax complex
Современная модель для молекулярного рекрутирования белков PcG на PREs заключается с том, что Polycomb (PC) гомеодомен из PRC1 распознает специфическую эпигенетическую метку в хроматине (Fig. 4). Метка, как полагают, обусловлена каталитической активностью polycomb repressive complex 2 (PRC2), который tri-methylates лизин 27 гистона H3 (H3K27me3) (Cao and Zhang, 2004, Czermin et al., 2002, Kuzmichev et al., 2002, Levine et al., 2004, Muller et al., 2002, Shao et al., 1999, Wang et al., 2004). Предыдущие исследования по поперечным связям ДНК показали, что PHO и PC сильно связываются с ДНК (Fig 4.) (Mohd-Sarip et al., 2005). Напротив, Posterior Sex Combs (PSC)
или PH соединяется с ДНК очень слабо, хотя авт. не делали различий между сродством связывания этих двух белков (Mohd-Sarip et al., 2005). В отсутствии др. PCC субъединиц PC не соединяется столь эффективно с PHO и ДНК, как показано с помощью снижения ДНК footprint (Mohd-Sarip et al., 2005). Эти данные указывают на то, что др. факторы в PCC кооперативно участвуют в связывании ДНК. FISH-I на политенных хромосомах личинок третьего возраста, несущих
piwi мутации, выявили потерю связывания PC с Fab-X (Grimaud et al., 2006). Однако, PH, др. компонент PRC1, всё ещё связывает Fab-X PRE у этих мутантов (Grimaud et al., 2006), указывая тем самым, что PC и PH связывание может быть не связанным и, что современная модель рекрутирования не универсальна (Fig. 4). Эти наблюдения указывают на то, что имеет множество мощных молекулярных механизмов для рекрутирования PRC1 комплекса на эндогенные PREs, такие как Fab-7 PRE, в BX-C (Fig 4). Дополнительные субъединицы PRC1, особенно PH или PSC, помогут оценить альтернативные молекулярные методы рекрутирования белков PcG (Fig. 4). Поэтому будущие исследования д. исследовать специфические роли PSC и PH во взаимодействиях PcG белков с ДНК.
Functional miRNAs in the bithorax complex regulate Hox gene expression
Недавние доказательства также показали на участие РНК продуктов не-генной транскрипции в прямой регуляции соседних Hox генов. Aravin et al. охарактеризовали несколько клонов microRNA (miRNA) с различных стадий развивающегося эмбриона
Drosophila
(Aravin et al., 2003). В часности они обнаружили две miRNAs, расположенные в iab-4 регионе BX-C, которые они обозначили как mir-iab-4-5p и mir-iab-4-3p (see Fig. 5). Эти miRNAs происходят из первичного транскрипта, pri-mir-iab-4, ранее обозначаемого как iab-4 (Cumberledge et al., 1990), который является результатом транскрипции анти-смыслового iab-4 локуса относительно Hox генов
в BX-C (Fig. 5). Ориентация miRNAs подтверждена результатами секвенирования (Aravin et al., 2003, Ruby et al., 2007, Stark et al., 2007). Транскрипт pri-mir-iab-4 расщепляется с помощью Drosha (Lee et al., 2003), чтобы сформировать pre-mir-iab-4, который превращается в зрелую miRNA с помощью Dicer (Hutvagner et al., 2001). В общем, только одна нить pre-miRNA становится функционально активной зрелой miRNA (Aravin et al., 2003). В случае mir-iab-4-5p/-3p (которые вместе формируют одну pre-miRNA) (Fig. 5), по-видимому, mir-iab-4-5p оказывается функционально активной (Bender, 2008, Ronshaugen et al., 2005, Stark et al., 2008, Tyler et al., 2008). Детальное исследование mir-iab-4-5p показало, что это непосредственный репрессор Ubx (Ronshaugen et al., 2005). Три более ранних исследования (Bender, 2008, Stark et al., 2008, Tyler et al., 2008) подтвердили роль mir-iab-4-5p как репрессора Ubx и показали, что транскрипция с противоположной к mir-iab-4 нити ДНК (т.e. смысловой по отношению к Hox генам в the BX-C) таже дает функционально активную miRNA (Fig. 5), которая обозначена как mir-iab-8
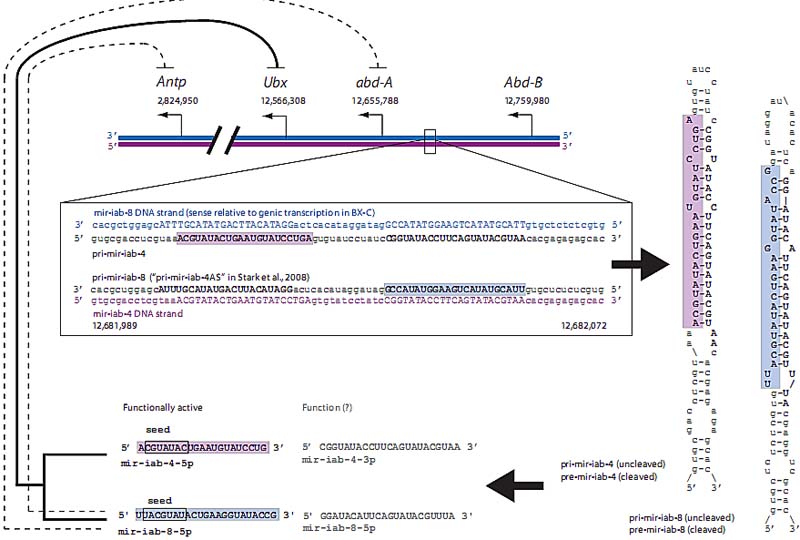 Fig. 5. Non-genic transcription produces two functionally distinct miRNAs at the iab-4 locus in the bithorax complex (BX-C). Transcription start sites of genes are indicated by leftward arrows. In Drosophila melanogaster, sense transcription of all the Hox genes, with the exception of
Deformed, is toward the centrosome (not shown) on chromosome 3R. During embryonic development both sense (purple) and anti-sense (blue) mir-iab-4 transcripts, shown complementary to the DNA sequences in the central box, are synthesized at the iab-4 locus (solid box). Note that the sense direction of mir-iab-4 is opposite to that of the Hox genes in the BX-C. The primary transcripts are cleaved by Drosha to form the "hairpin" RNAs pre-mir-iab-4/-8, the 2-D structures of which are shown on the right. The hairpins are then processed by Dicer to form the mature, functionally active miRNAs: mir-iab-4-5p (shaded purple background) and mir-iab-8-5p (shaded blue background). The seed sequences within the miRNAs are indicated with solid boxes. The two functional miRNA products repress target genes in the ANT-C and BX-C (top). The thick line for Ubx indicates functional repression which is removed in flies homozygous for a deletion of mir-iab-4/-8 (Bender, 2008), and the dashed lines indicate putative targets as identified either by ectopic expression of mir-iab-4/-8 or by bioinformatic analysis (Stark et al., 2008, Tyler et al., 2008). It is likely that mir-iab-4 and not mir-iab-8 represses Ubx in vivo, based on the more anterior expression of mir-iab-4 (Bender, 2008, Stark et al., 2008, Tyler et al., 2008), although both mir-iab-4 and mir-iab-8 are shown to repress Ubx when ectopically expressed (Ronshaugen et al., 2005, Stark et al., 2008, Tyler et al., 2008). It is not known if the alternate strands of the hairpins are processed into functionally active miRNAs. Genomic coordinates refer to the base-pair positions in the Drosophila melanogaster genome sequence on chromosome 3R.
Fig. 5. Non-genic transcription produces two functionally distinct miRNAs at the iab-4 locus in the bithorax complex (BX-C). Transcription start sites of genes are indicated by leftward arrows. In Drosophila melanogaster, sense transcription of all the Hox genes, with the exception of
Deformed, is toward the centrosome (not shown) on chromosome 3R. During embryonic development both sense (purple) and anti-sense (blue) mir-iab-4 transcripts, shown complementary to the DNA sequences in the central box, are synthesized at the iab-4 locus (solid box). Note that the sense direction of mir-iab-4 is opposite to that of the Hox genes in the BX-C. The primary transcripts are cleaved by Drosha to form the "hairpin" RNAs pre-mir-iab-4/-8, the 2-D structures of which are shown on the right. The hairpins are then processed by Dicer to form the mature, functionally active miRNAs: mir-iab-4-5p (shaded purple background) and mir-iab-8-5p (shaded blue background). The seed sequences within the miRNAs are indicated with solid boxes. The two functional miRNA products repress target genes in the ANT-C and BX-C (top). The thick line for Ubx indicates functional repression which is removed in flies homozygous for a deletion of mir-iab-4/-8 (Bender, 2008), and the dashed lines indicate putative targets as identified either by ectopic expression of mir-iab-4/-8 or by bioinformatic analysis (Stark et al., 2008, Tyler et al., 2008). It is likely that mir-iab-4 and not mir-iab-8 represses Ubx in vivo, based on the more anterior expression of mir-iab-4 (Bender, 2008, Stark et al., 2008, Tyler et al., 2008), although both mir-iab-4 and mir-iab-8 are shown to repress Ubx when ectopically expressed (Ronshaugen et al., 2005, Stark et al., 2008, Tyler et al., 2008). It is not known if the alternate strands of the hairpins are processed into functionally active miRNAs. Genomic coordinates refer to the base-pair positions in the Drosophila melanogaster genome sequence on chromosome 3R.
Bender (2008) и Tyler et al. (2008), соотв., и как mir-iab-4AS Stark et al. (2008). Название mir-iab-8
означает предполагаемое происхождение транскрипта с iab-8 локуса (Bender, 2008). Хотя такое происхождение не было убедительно показано в наших собственных исследованиях (Bae et al., 2002), мы тем не менее обозначили транскрипт как mir-iab-8 , поскольку это делает ясным направление транскрипции. Как и в случае mir-iab-4, его 5' плечо pre-mir-iab-8, которое, по-видимому, становится функционально активной зрелой miRNA (Fig. 5) (Bender, 2008, Stark et al., 2008, Tyler et al., 2008). Эктопическая экспрессия mir-iab-8-5p вызывает репрессию как Ubx, так и abd-A, и эта репрессия более сильная, чем таковая. вызываемая эктопической экспрессией mir-iab-4-5p (Stark et al., 2008, Tyler et al., 2008). Имеются также некоторые косвенные доказательства (базирующиеся в основном на исследованиях по эволюционной консервации), что mir-iab-8-5p может быть репрессором Antennapedia (Antp) (Stark et al., 2008, Tyler et al., 2008). Однако, единственные функциональные данные, полученные с гомозиготной делецией обеих mir-iab-4/-8 (Bender, 2008), которые указывают, что одна или обе эти miRNAs репрессируют Ubx. Не обнаруживается эффект на экспрессию
abd-A, Abd-B или Antp вследствие делеции (Bender, 2008), это противоречит доказательствам, что эктопическая экспрессия mir-iab-4 вызывает репрессию abd-A (Stark et al., 2008, Tyler et al., 2008). Единственная возможность, что microRNAs способны репрессировать транскрипцию abd-A (и даже Antp), но обычно не экспрессируются в правильном пространственном домене во время развития.
Т.о., смысловая и анти-смысловая не-генная транскрипция в iab-4 хромосомном регионе могут играть функционально отличные роли. Первичные miRNAs, возникающие из смыслового и антисмыслового транскриптов, принимают несколько отличные конформации и в результате зрелые miRNAs имеют разные последовательности начального заполнения, которые поэтому распознают разные последовательности мРНК мишеней (Stark et al., 2008, Tyler et al., 2008). Более того, пространственные домены смысловых и антисмысловых транскриптов не перекрываются по времени в iab-4 регионе развивающегося эмбриона (Bae et al., 2002, Drewell et al., 2002, Stark et al., 2008, Tyler et al., 2008), в дальнейшем было подтверждено, что транскрипция с оппозитной нити ДНК в этом регионе может выполнять функционально иную роль. При обсуждении
Drosophila mir-307 и у млекопитающих mir-338, Tyler et al. предположили, что двойственность смысловой и антисмысловой транскрипции может быть фактически широко распространенным феноменом, позволяющим разным функциональным miRNAs продуцироваться с одиночного локуса (Tyler et al., 2008). Хотя сегодня имеется немного примеров анти-смысловой транскрипции miRNAs, биоинформационный анализ показал, что большая фракция miRNA локусов теоретически способна продуцировать смысловые и антисмысловые miRNAs (Tyler et al., 2008). Вся mir-iab-4 последовательность, также как известные и предполагаемые последовательности мишени для функционально активных miRNAs, показывают чрезвычайно высокую консервацию последовательностей у
Drosophila, москитов, пчел и жуков (Bender, 2008, Stark et al., 2008, Tyler et al., 2008). Эволюционная консервация этих путей miRNA указывает на то, что это может быть важным функциональным компонентом в регуляции экспрессии генов Hox в BX-C.
Summary
The results from recent studies in the BX-C strongly indicate
that non-genic transcription plays a crucial role in both the
establishment and maintenance of the specific temporal and
spatial patterns of Hox gene expression during development.
Non-genic transcription is required for the selective activation of
specific CRMs, most likely by either preventing or facilitating
binding of transcription factors or by directly recruiting chromatin-
modifying factors. Moreover, PcG proteins, protein components
of the RNAi pathway and the basal transcriptional machinery act
synergistically in the modification and maintenance of distinct
chromatin structures, some of which regulate long distance inter-
actions between CRMs that are capable of modulating Hox gene
expression. Non-genic transcription also produces functional
ncRNAs, including miRNAs, which can fine tune the expression
levels of the neighboring Hox target genes. Thus, non-genic
transcription is a critical component in the rich molecular toolbox
responsible for the regulation of the Hox genes. Future detailed
studies will enable us to more fully comprehend these distinct
functional roles embedded in the dark matter of the genome.
Сайт создан в системе
uCoz 

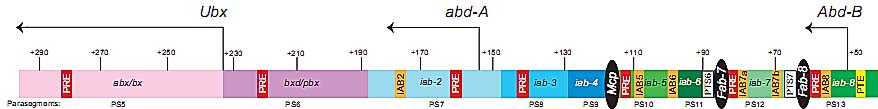
 Fig. 2. Model for activation of Abd-B gene expression by sequential
transcription and promoter-enhancer tethering. A model for events
occurring in the presumptive 5th
abdominal segment of the developing
Drosophila embryo, where the promoter tethering element (PTE) facili-
tates interactions between the IAB5 enhancer and the Abd-B promoter:
(A) Prior to the activation of the Hox genes, the regulatory sequences 3'
of the Abd-B gene are in an inactive chromatin configuration. (B)
Intergenic transcription early in embryonic development by RNA poly-
merase II (Pol) (red circle) and associated chromatin modifying enzymes
(CME) (green circle) facilitates the opening of the chromatin at the
regulatory regions in the BX-C, enabling transcription factors (red/peach
polygons) to bind to enhancer modules, such as IAB5 (orange box). (C)
Homo-dimeric interactions between a protein factor (blue hexagon)
bound at conserved sequences (blue line) within the PTE (yellow box)
and a region close to IAB5 facilitate promoter-enhancer interactions. The
chromatin loop configuration formed by these specific interactions
brings the IAB5 enhancer and associated transcription factors to the
Abd-B promoter (green box). (D) The localized high concentration of
transcription factors in the chromatin loop upregulates expression of
Abd-B by interacting with the basal transcriptional machinery, including
RNA polymerase II.
Fig. 2. Model for activation of Abd-B gene expression by sequential
transcription and promoter-enhancer tethering. A model for events
occurring in the presumptive 5th
abdominal segment of the developing
Drosophila embryo, where the promoter tethering element (PTE) facili-
tates interactions between the IAB5 enhancer and the Abd-B promoter:
(A) Prior to the activation of the Hox genes, the regulatory sequences 3'
of the Abd-B gene are in an inactive chromatin configuration. (B)
Intergenic transcription early in embryonic development by RNA poly-
merase II (Pol) (red circle) and associated chromatin modifying enzymes
(CME) (green circle) facilitates the opening of the chromatin at the
regulatory regions in the BX-C, enabling transcription factors (red/peach
polygons) to bind to enhancer modules, such as IAB5 (orange box). (C)
Homo-dimeric interactions between a protein factor (blue hexagon)
bound at conserved sequences (blue line) within the PTE (yellow box)
and a region close to IAB5 facilitate promoter-enhancer interactions. The
chromatin loop configuration formed by these specific interactions
brings the IAB5 enhancer and associated transcription factors to the
Abd-B promoter (green box). (D) The localized high concentration of
transcription factors in the chromatin loop upregulates expression of
Abd-B by interacting with the basal transcriptional machinery, including
RNA polymerase II.
 Fig. 3. Fab-7 cis-regulatory modules (CRMs) modulate long-distance
repressive interactions at the Abd-B gene. (A) The 3' Fab-7 regulatory
region that controls Abd-B expression is shown in an open chromatin
formation early in embryonic development when Abd-B (green box) is
transcribed. During this embryonic stage no PcG proteins are bound to
the PRE (red box) located just upstream of Fab-7 boundary (black ellipse).
(B) In late embryonic development, a repressive complex is formed as
PcG proteins (red shaded ellipses) bind to the PRE and silence transcrip-
tion of Abd-B (Zink and Paro, 1995), a process in which the RNAi
machinery is not involved (Grimaud et al., 2006). This repressive complex
does not form in tissues in the posterior end of the embryo where Abd-
B is expressed. (C) Upon reaching larval developmental stages in RNAi
protein mutants, there is a loss of long range chromosome interactions
of the Fab-7 PRE element (Grimaud et al., 2006) This suggests that
protein components of the RNAi machinery (blue shaded polygons),
which co-localize with the PcG proteins, are necessary to maintain the
repressed state of Abd-B (Grimaud et al., 2006, Lei and Corces, 2006). (D)
In adults, as a further step to maintain the repressed state of Abd-B in the
head region of the fly, Fab-7 interacts with a region 1.6 kb 5' of Abd-B
which facilitates a chromatin loop configuration that brings Abd-B in
closer vicinity with the repressive complex containing the PcG and RNAi
proteins (Cleard et al., 2006).
Fig. 3. Fab-7 cis-regulatory modules (CRMs) modulate long-distance
repressive interactions at the Abd-B gene. (A) The 3' Fab-7 regulatory
region that controls Abd-B expression is shown in an open chromatin
formation early in embryonic development when Abd-B (green box) is
transcribed. During this embryonic stage no PcG proteins are bound to
the PRE (red box) located just upstream of Fab-7 boundary (black ellipse).
(B) In late embryonic development, a repressive complex is formed as
PcG proteins (red shaded ellipses) bind to the PRE and silence transcrip-
tion of Abd-B (Zink and Paro, 1995), a process in which the RNAi
machinery is not involved (Grimaud et al., 2006). This repressive complex
does not form in tissues in the posterior end of the embryo where Abd-
B is expressed. (C) Upon reaching larval developmental stages in RNAi
protein mutants, there is a loss of long range chromosome interactions
of the Fab-7 PRE element (Grimaud et al., 2006) This suggests that
protein components of the RNAi machinery (blue shaded polygons),
which co-localize with the PcG proteins, are necessary to maintain the
repressed state of Abd-B (Grimaud et al., 2006, Lei and Corces, 2006). (D)
In adults, as a further step to maintain the repressed state of Abd-B in the
head region of the fly, Fab-7 interacts with a region 1.6 kb 5' of Abd-B
which facilitates a chromatin loop configuration that brings Abd-B in
closer vicinity with the repressive complex containing the PcG and RNAi
proteins (Cleard et al., 2006).
