В эволюционной истории живых организмов мы знаем, что новшества в молекулярных системах появляются в ключевые моменты времени и они играют преобразующую роль в основных эволюционных переходах на древе жизни.
Примером такой новейшей молекулярной системы является базирующаяся на phosphotyrosine (pTyr) передача сигналов. Эта молекулярная система для передачи клеточной регуляторной информации, как было установлено, появилась сравнительно недавно в истории жизни ~600 миллионов лет тому назад, непосредственно перед появлением многоклеточных организмов (King et al., 2003; Pincus et al., 2008; Manning et al., 2008). Система pTyr передачи сигналов мтала существенной частью биологии метазоа. Напр., передача сигналов pTyr играет центральную роль в путях межклеточных коммуникаций, включая те, что регулируют пролиферацию, дифференцировку, адгезию, реакцию на гормоны и иммунную защиту (Hunter, 2009).
У современных метазоа передача сигналов pTyr обеспечивается с помощью инструментария из трех разных функциональных модулей: tyrosine kinases
(TyrK) фосфорилируют специфические мишени остатки тирозина, phosphotyrosine phosphatases (PTP) удаляют фосфаты, а Src Homology 2 (SH2) домены распознают модификации recognize the modifications (Pawson 1995). Итак эти три модуля формируют инструментарий "writer," "eraser" и "reader", который является общим многим разнообразным платформам процессинга клеточной информации (Figure 1A). Богатый набор разнообразных и сложных регуляторных схем может быть достигнут благодаря динамическому взаимодействию этих трех модулярных функций (Pawson et al., 1993; Pawson, 1995; Bhattacharyya et al., 2006; Kholodenko, 2006). Комбинация этих модулей может приводить к функциям высокого порядка (Figure 1B). Напр., существуют несколько белков, содержащих комбинацию SH2 и киназного доменов, которые генерируют позитивную обратную связь (фосфорилирование тирозиновых сайтов ведет к SH2-обеспечиваемому рекрутированию киназ и последующему более обширному фосфорилированию) (Pawson, 2004). Сходным образом комбинации SH2-phosphatase доменов может генерировать негативную обратную связь (Tonks and Neel, 2001).
Состоящий из трех частей инструментарий передачи сигналов pTyr стаит классический вопрос эволюционной биологии: как возникают сложные, взаимозависимые системы? Очевидно, почему новая система, заключающая в себе пишущий, стирающий и считывающий инструментарий, чрезвычайно полезна. Но, учитывая их взаимозависимость, как могут эти индивидуальные компоненты возникать в ступенчато-образно в соответствии с эволюционным процессом? Белки, которые связывают или удаляют посттрансляционные модификации, д. выглядеть бесполезными без энзимов, генерирующих модификации и, в принципе, не д. предоставлять преимущества в приспособленности, ведущие сохранению и распространению. pTyr сигнальная платформа представляет случай для рассмотрения вероятных ступенчато-образных путей эволюции системы из многих частей.
Здесь мы реконструируем возможную историю эволюции передачи сигналов pTyr. Эта реконструкция базируется на недавнем секвенировании геномов ряда организмов, которые произошли ка кдо, так и после появления метазоа из одноклеточных эукариотических предшественников (King et al., 2008). Геномные последовательности choanoflagellate, Monosiga brevicollis, особенно впечатляющие, т.к. choanoflagellates как полагают, являются одними из ближайших родственников одноклеточных метазоа. Мы предлагаем модель того, как эта состоящая из трех частей сигнальная система могла развиться ступенчатым образом. Мы полагаем, что как только сформировалась полностью трехчастная система, она быстро была приобретена последующими клонами, поскольку она могла генерировать новое регуляторное поведение без существенных перекрестных интерференций с существующими регуляторными circuits. Обсуждается также возможная роль этой новой системы коммуникаций в облегчении преобразующего эволюционного сдвига к многоклеточности.
Мы описываем три возможные стадии появления современного инструментария передачи сигналов pTyr, каждая представлена существующим модельным организмом (Figure 2). Мы не можем претендовать на определение точного пути эволюции, а скорее сконцентрируемся на идентификации доминантных классов стабильных промежуточных образований, которые могут существовать на широком эволюционном ландшафте.
PTPs in a Pre-Tyrosine Kinase World
Что появилось первым, TyrK, PTP или SH2 домены? Анализ последовательностей указывает на то, что это были PTP домены. Геном простых одноклеточных эукариот, подобных почкующимся дрожжам Saccharomyces cerevisiae не обнаруживают TyrK белков и только один белок с proto-SH2 доменом, но имеют массу PTP белков (Pincus et al., 2008) (Figure 2, Stage 1). Большинство грибов имеют не более пяти PTP белков и некоторые из них обладают tyrosine phosphatase активностью. Мы обозначили одиночный предположительный "SH2" домен дрожжей, обнаруженный внутри гена Spt6, как proto-SH2 домен, поскольку он не обнаруживает связывания pTyr binding (домен был описан как обнаруживающий phospho-Ser/Thr связывание; Dengl et al., 2009). Поэтому функционально он не может рассматриваться как "reader" домен, который является частью pTyr регуляторной системы. Эти наблюдения подтверждают простую модель: первой ступенью в эволюции сигнального аппарата pTyr из трех частей было, скорее всего, появление функциональной tyrosine phosphatase. Но почему были должны возникнуть PTPs в мире pre-tyrosine киназ? Каково функциональное использование и каковы преимущества для жизнеспособности связаны с этим доменом стирания у организмов, лишенных домена записи?
Ответ может заключаться в том факте, что некоторые Ser/Thr kinase домены, которые более древние, чем tyrosine kinases (датировка очень близка к моменту возникновения эукариот), могут выполнять спорадическое, но функционально важного фосфорилирование тирозинов. Анализ фосфо-аимнокислот у дрожжей выявил небольшую, но существенную популяцию pTyr (Schieven et al., 1986). Более того, определенные события, такие как активация mitogen-activated protein kinases (MAPKs) и ингибирование киназы клеточного цикла Cdk1, как известно, участвуют в фосфорилировании остатков тирозина (для активации, МАРК д. быть фосфорилирована с помощью вышестоящей Ser/Thr kinase как по Thr, так и Tyr остатку внутри своей активационной петли; Cdk1 фосфорилируется по Tyr14 с помощью ингибирующей киназы Wee1). Эти модификации тирозинов безусловно не распознавались с помощью SH2 доменов, но они оказывали прямые аллостерические эффекты в белках, в которых они появлялись. Т.о., PTP домены могли обеспечивать преимущества для жизнеспособности путем негативной модуляции этих редких, но функционаьно важных событиф фосфорилирования. В согласии с этой моделью, белки PTP2 и PTP3 у дрожжей безусловно играют функционально важную роль в подавлении MAPK-обеспечиваемой передачи сигналов в ответ на феромоны или изменения осмотических свойств, объясняя тем самым свои преимущества для жизнеспособности (Pincus et al., 2008). Кроме того, PTPs могут играть генеральную роль в buffering против случайных вредных беспризорных фосфорилирований функционально важных тирозинов.
Откуда произошли эти PTPs? PTPs скорее всего возникли из общего родоначальника, родственного фосфатазам с двойной специфичностью, которые обнаруживаются в большинстве одноклеточных эукариот (Kennelly, 2001; Alonso et al., 2004). Фосфатазы двойной специфичности являются каталитическими доменами, которые могут дефосфорилировать pSer/Thr и pTyr субстраты. Каталитические домены PTP и фосфатаз с двойной специфичностью отличаются, но эволюционно родственны. Они обладают общей складкой и стержневым каталитическим мотивом HC(X)5R, в котором промежуточный phosphocysteine энзим генерируется во время катализа, (иногда домены фосфатазы с двойной специфичностью и классические PTP, которые действуют только на pTyr). Домены фосфатаз с двойной специфичностью обладают более мелким активным сайтом, чем классические PTPs, это может объяснить, почему они могут дефосфорилировать или Tyr или Thr/Ser остатки. В некоторых клонах, фосфатазы двойной специфичности оказываются функционально более дивергированными, давая членов, которые могут действовать на липидные субстраты, такие как phosphoinositide phosphatases PTEN и myotubularins (Alonso et al., 2004). Т.о., PTPs, по-видимому, возникают из некоего смешанного класса мультифункциональных фосфатаз.
Несмотря на присутствие PTP белков у грибов, имеются существенные различия
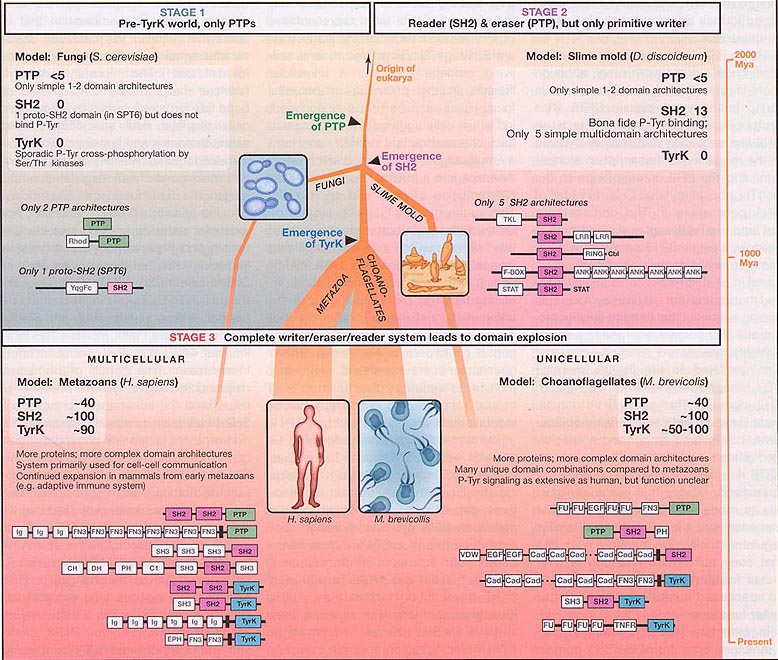 Figure 2. Evolution of pTyr Signaling
Shown is a possible path for the emergence of phosphotyrosine (pTyr) signaling. We postulate three successive stages, each represented by what is observed iFn a modern organism. The thickness of the tree reflects the approximate degree of usage of pTyr signaling (thicker lines mean more usage). Stage 1 (exemplified by the budding yeast Saccharomyces cerevisiae) reflects the situation in early eukaryotes, in which PTPs emerged but were limited in number and complexity. They were most likely used to reverse or process sporadic cross-phosphorylation of tyrosine residues by Se^hr kinases. S. cerevisiae has fewer than five PTP proteins and no functional SH2 or TyrK domains. Stage 2 reflects systems in which functional SH2 domains emerged that were able to bind to pTyr motifs. Together with Se^hr kinases with increased cross-reactivity for Tyr (such as tyrosine kinase-like or dual specificity Ser/Thr kinases), these systems may reflect the most primitive of pTyr writer/reader/eraser systems. However, the lack of a dedicated Tyr kinase may have limited the utility and expansion of this toolkit. This stage is potentially represented by the slime mold, Dictyostelium discoideum. Stage 3 reflects systems that evolved after the emergence of the modern TyrK domain. We postulate that the full writer/reader/eraser system was of so much greater utility that its use expanded dramatically. This likely resulted in many more proteins in these families, as well as much more complex, multidomain architectures than those seen in the earlier stages. This stage is represented by both the multicellular metazoan and unicellular choanoflagellate lineages.
Figure 2. Evolution of pTyr Signaling
Shown is a possible path for the emergence of phosphotyrosine (pTyr) signaling. We postulate three successive stages, each represented by what is observed iFn a modern organism. The thickness of the tree reflects the approximate degree of usage of pTyr signaling (thicker lines mean more usage). Stage 1 (exemplified by the budding yeast Saccharomyces cerevisiae) reflects the situation in early eukaryotes, in which PTPs emerged but were limited in number and complexity. They were most likely used to reverse or process sporadic cross-phosphorylation of tyrosine residues by Se^hr kinases. S. cerevisiae has fewer than five PTP proteins and no functional SH2 or TyrK domains. Stage 2 reflects systems in which functional SH2 domains emerged that were able to bind to pTyr motifs. Together with Se^hr kinases with increased cross-reactivity for Tyr (such as tyrosine kinase-like or dual specificity Ser/Thr kinases), these systems may reflect the most primitive of pTyr writer/reader/eraser systems. However, the lack of a dedicated Tyr kinase may have limited the utility and expansion of this toolkit. This stage is potentially represented by the slime mold, Dictyostelium discoideum. Stage 3 reflects systems that evolved after the emergence of the modern TyrK domain. We postulate that the full writer/reader/eraser system was of so much greater utility that its use expanded dramatically. This likely resulted in many more proteins in these families, as well as much more complex, multidomain architectures than those seen in the earlier stages. This stage is represented by both the multicellular metazoan and unicellular choanoflagellate lineages.
между этими белками и теми. что обнаружены у метазоа (Figure 2). Напр., имеется значительно меньше PTPs у грибов (~5/геном против ~40/геном у метазоа) и они существенно менее сложны по архитектуре доменов (Pincus et al., 2008). PTP белки метазоа стремятся стать крупными мультидоменовыми белками, в которых модуль PTP функционально был рекомбинирован с многими др. сигнальными модулями. Напротив, у грибов PTP домены принадлежат или простым одно-доменовым белкам или находится в комбинации с одиночным rhodanase-подобным доменом (предположительно регуляторным доменом, который гомологичен классу серу переносящих энзимов; Bordo and Bork, 2002). Т.о., PTP белки грибов очень просты (с одним или двумя доменами) и лишены комбинаторной сложности PTP белков метазоа. Простота и низкие количества PTPs у дрожжей указывают на то, что у ранних одноклеточных эукариот PTP домены обладают до известной степени ограниченной функциональной пригодностью, особенно если сравнивать с их широким и сложным использованием у метазоа.
В отличие от PTPs, неизвестны pTyr-связывающие SH2 домены у грибов, хотя существует один четкий гомологичный домен в дрожжевом белке SPT6. Этот белок, который содержит домен с SH2-подобной последовательностью и складку, он участвует в регуляции транскрипционной элонгации, а SH2 соединяется с Ser/Thr фосфорилированного C-терминального хвоста RNA polymerase II. Домен не соединяется с pTyr (Dengl et al 2009). Интересно, что одиночный ортолог SPT6 с той же самой общей доменовой архитектурой, обнаруживается у всех эукариот, включая все грибы и метазоа (но не у прокариот). Эта находка указывает на то, что у ранних эукариот возникает proto-SH2 домен для осуществления высоко специализированной функции - функции, которая не связана с гибкой модулярной функцией распознавания pTyr современного SH2 домена. Этот proto-SH2 домен скорее всего не "считывает" pTyr модификации, а вместо этого распознает специализированные родственные модификации. Т.о., хотя SPT6 скорее всего представляет собой ранний родоначальник или родственник, давший в конечном итоге современные SH2 домены, он не может рассматриваться как функциональная часть pTyr регуляторного инструмента. Мы полагаем, что ранние эукариоты обладали только функцией стирания pTyr (обеспечиваемой с помощью PTPs) без специализированных комплементарных функций считывания и записи.
Итак, PTP домен и структурный родоначальник SH2 домена, по-видимому, возникают у ранних одноклеточных эукариот, но скорее всего обладают исходными функциями, которые не связаны непосредственно с их более поздними функциями в современной pTyr регуляторной системе. Эти компоненты могли наделить ограниченными, но благоприятными для жизнеспособности преимуществами даже в отсутствие специализированного тирозин киназного домена.
Toward a Write/Read/Erase System
Мы полагаем, что proto-SH2 домен (скорее всего гомолог дрожжевого Spt6 белка) у одноклеточных организмов приобрел новую и функционально благоприятную способность связываться с pTyr-содержащими пептидными мотивами. Слизистая плеснь Dictyostelium discoideum имеет простейший репертуар bona fide pTyr-связывающих SH2 доменов и может рассматриваться как живой представитель этого второго эволюционного шага (Figure 2, Stage 2). Dictyostelium это живущая в почве амеба, которая имеет одноклеточный стиль жизни в присутствии бактериальной пищи. Однако при истощении пищи индивидуальные клетки агрегируют в ответ на хемоаттрактант cAMP, чтобы сформировать многоклеточную структуру, которая затем развивается в плодовое тело посредством дифференцировки клеток ножки и спор. Рудиментарная pTyr-SH2 система у Dictyostelium важна для аспектов процесса этой дифференцировки, включая внутриклеточные реакции на cAMP и морфоген differentiation inducing factor (DIF) (который индуцирует дифференцировку клеток предножки), а также для регуляции транскрипции в ответ на гиперосмотический стресс. Эти наблюдения согласуются с ранней передачей сигналов pTyr-SH2 , играющей роль в клеточных реакциях на изменения внешнесредовых условий.
Геном Dictyostelium специфицирует 13 белков с SH2 доменами (а также одиночный гомолог Spt6). Кластер из этих 13 белков состоит 5 основных доменов, два из которых являются гомологами SH2 белков метазоа. Отметим, что Dictyostelium четыре STAT (signal transducers and activators of transcription) белка, которые очень сходны со STAT транскрипционными факторами метазоа (Kay, 1997; Kawata et al., 1997). Напр., все они имеют SH2 домен, находящийся рядом с ДНК-связывающей областью; они индуцибельно фосфорилируются по тирозиновым остаткам в ответ на стресс или внеклеточную сигнальную молекулу DIF; они подвергаются pTyr/SH2-обеспечиваемой димеризации и затем транслоцируются в ядро, чтобы регулировать экспрессию специфических генов. Dictyostelium обладает также ортологом E3 ubiquitin ligase СЫ млекопитающих, которая использует SH2 и Ring домены, чтобы связать pTyr сигналы с аппаратом ubiquitination (Langenick et al., 2008). Остальные три домена архитектуры Dictyostelium SH2 белков отличаются от тех, что найдены у др. секвенированных организмов. Белок LrrB имеет SH2 домен, сцепленный с повторяющимся доменом, богатым лейцином (Sugden et al., 2010), тогда как FbxB белок содержит F-box, сопровождаемый SH2 domain и ankyrin повторами. Кроме того, Shk белки имеют протеин киназный домен, сопровождаемый SH2 доменом, комбинация доменов, которая в чем-то сходна с цитоплазматическими тирозин киназами метазоа, типа Src (Monia-kis et al., 2001). Каталитический домен Shk, однако, лишен мотивов, характерных для настоящих тирозин киназ и биохимически располагает двойной специфичностью по отношению к serine/threonine и tyrosine остаткам.
В самом деле, Dictyostelium отличается от метазоа и choanoflagellates тем. что его геном не кодирует какой-либо современной тирозин-специфической протеин киназой. Напр., STAT белки метазоа обычно фосфорилируются с помощью Janus tyrosine kinases (JAKs), но JAKs отсутствуют у Dictyostelium (Kay, 1997). Это указывает на возможность, что сигнальные белки, содержащие SH2 домены, такие как STATs, используются до современных тирозин киназ, с которыми ассоциированы у метазоа. Качественные особенности киназы, ответственной за фосфорилирование тирозина STAT, и последующее образование SH2-связывающих сайтов, остаются неизвестными.
Как же контролируется фосфорилирование тирозина в белках Dictyostelium, таких как STATs? Пока генетический анализ не выявил соотв. специфическую киназу и было предположено, что в противовес STATs млекопитающих могут существовать базовые конституитивные фосфорилирования сайтов тирозина Dictyostelium STAT, которые регулируются с помощью изменений активности PTP в ответ на внеклеточные сигналы (Langenick et al., 2008). Одна из PTPs у Dictyostelium, PTP3, соединяется и дефосфорилирует STATс, блокируя тем самым SH2-обеспечиваемую димеризацию и накопление STATc в ядре. Передача сигналов, индуцируемая с помощью морфогена DIF, по-видимому, передает сигналы с помощью ингибирования активности PTP3 и последующего усиления фосфорилирования тирозина STATc и STATc-зависимой генной экспрессии.
Хотя Dictyostelium лешен настоящих тирозин киназ, примечательно, что его геном обнаруживают существенную экспансию количества предположительно протеин киназ двойной специфичности (имеется ~70, также известных как tyrosine kinase-подобных или TKL киназ) (Manning et al., 2008). Этот набор включает Shk каталитический домен, описанный выше. Маловероятно, что какая-либо из этих киназ стала предшественником современных тирозин киназ. Однако возможно, что они представляют собой первую эволюционную форму функции "записи" прототипической pTyr трехсоставной регуляторной системы. Объединение SH2 домена и домена киназы двойной специфичности, как найдено в белках Shk, может быть ранним примером сцепления модулей "считывания" и "записи" для приобретения более сложных функций, таких как позитивная обратная связь. Тем не менее, ограниченная функциональность киназ двойной специфичности для осуществления фосфорилирования тирозина, может иметь ограниченную способность в этой ранней системе. Это может объяснить очень слабую экспансию передачи сигналов pTyr в организмах, таких как Dictyostelium.
Эти наблюдения рисуют следующую картину передачи сигналов
Dictyostelium pTyr и расширение ранней фазы ранней эволюции pTyr коммуникаций. SH2 домены приобретают pTyr-связывающую активность и обнаруживают несколько разных комбинаций с др. типами сигнальных доменов. Среди них STAT и Cbl белки одинаковы с метазоа, тогда как LrrB, FbxB и Shk белки уникальны для
Dictyostelium. Но нет настоящих современных киназ, а динамический контроль фосфорилирования тирозина может сначала регулироваться с помощью PTPs. Однако функционально важная для агрегации и дифференцировки сигнальная pTyr система не приобрела ещё повсеместного влияния, обнаруживаемого у
M. brevicollis и метазоа, вообще-то из-за отсутствия эффективных тирозин кинахз.
Dicytostelium имеет эффективные считывание и стирание pTyr, но записывание плохо развито.
Invention of TyrK and Expansion of the pTyr Toolkit
Современный анализ показывает, что современные тирозин киназы возникают до эволюции метазоа. Помимо metazoans, канонические тирозин киназы обнаруживаются только у choanoflagellates, которые, по-видимому, самые близкие из известных одноклеточных родственников метазоа (King et al., 2008). Отсутствие существенных количеств таких тирозин киназ в любой др. ветви жизни указывает, что этот новый каталитический домен использовался недавним общим родоначальником choanoflagellates и metazoans, скорее всего как ветвь более старых Ser/Thr киназ. Некоторые бактерии имеют специализированные тирозин киназы (BY kinases), но они напоминают P loop NTPases (nucleotide triphosphatases) и структурно неродственны тирозин киназам эукариот (Lee and Jia, 2009). Поэтому вполне возможно, что BY киназы возникли независимо от тирозин киназ метазоа и оперируют др. способом.
Новый эукариотический tyrosine kinase домен появился благодаря игре изменяющих инноваций (Figure 2, Stage 3). Общее количество тирозин киназных белков у видов choanoflagellate и metazoan варьирует в пределах 30-150 на геном (Pincus et al., 2008; Manning et al., 2008). Среди секвенированных геномов имеется поразительное отсутствие видов лишь с небольшим количеством TyrK белков. Этот внезапный прыжок типа всё-или-ничего в отношении количества TyrK белков указывает на их важность, как только они появились, то подверглись быстрой экспансии и последующему сохранению.
Это вообще-то довольно удивительное наблюдение возникновения TyrK домена и его быстрого распространения коррелирует со столь же быстрой экспансией PTP и SH2 доменов в тех же самых геномах (Pincus et al., 2008). Хотя грибы и Dictyostelium имеют ~5 PTP белков, metazoans и choanoflagellates имеют уже 30-40 на геном. Сходным образом, Dictyostelium имеет приблизительно десять SH2 домен-содержащих белков (грибы не имеют), тогда как metazoans и choanoflagellates имеют ~100 каждый. Т.о., PTP и SH2 белки обнаруживают примерно 10-кратное увеличение в количестве на геном после возникновения TyrK домена. Более того, белки, содержащие SH2 и PTP домены становятся боле сложными и разнообразными (Jin et al., 2009). Напр., у дрожжей и Dictyostelium SH2 и PTP белки обычно более простые, имеют один или два домена. Однако в ветвях, которые имеют современные TyrK белки, SH2 и PTP белки почти всегда представлены 3-10 доменами.
Эти наблюдения согласуются со след. моделью. Чем значительно эффективнее TyrK домен- или функция "записи" - тем более драматично увеличивается функциональное использование предсуществовавших PTP (eraser) и SH2 (reader) доменов. Поскольку трехсоставной инструментарий - каталитический домен, чтобы генерировать pTyr, домен взаимодействия, чтобы связывать эти pTyr сайты и энзим для их дефосфорилирования -этот набор доменов д. использоваться, чтобы кодировать и осуществлять значительно более широкий и разнообразный спектр регуляторных функций, то это д. приводить к последующей экспансии полного набора. Хотя PTP и SH2 домены используются более простыми организмами, их значительно больший функциональный потенциал не проявляется вплоть до появления TyrK домена.
Быстрая экспансия сигнального аппарата pTyr у родоначальника choanoflagellates и животных напоминает как технологии расширяются квантовыми скачками, особенно в ситуациях с вовлечением зависимых от них технологий. Напр., ценность лазера расширилась драматически после более позднего изобретения комплементарной технологии волоконной оптики. Эти взаимозависимые технологии позволили лазерам перепрофилироваться и быстро вытеснить электрическую передачу через медные провода в качестве основы глобальных коммуникаций (Alwayn, 2004). Т.о., хотя лазеры имеют уникальную применимость их основное применение расширилось с введением комплементарных технологий. Экспансия молекулярных компонентов в биологии очень сходна. Функции инструментария записи, считывания и стирания стали использоваться в полную меру только, когда все компоненты оказались в наличии. Т.о., общим для любой системы этого типа является квантовая "всё-или-ничего" экспансия только когда добавляется финальный кусочек инструментария.
Applying the New pTyr Toolkit to Different Functions
Хотя ветви choanoflagellate и metazoan обнаруживают огромную экспансию трехсоставного pTyr регуляторного аппарата, способы, с помощью которого эти компоненты используются, по-видимому, совершенно различны. Если один проверят типы доменов, которые появляются совместно с TyrK, SH2 или PTP доменами, др. обнаруживает множество разных комбинаций, которые уникальны для каждой ветви (Pincus et al., 2008; Manning et al., 2008). Эти различия в комбинациях доменов предполагают разные функции для белков, содержащих эти домены в ветви choanoflagellate и metazoan (Li et al., 2009). Исходя из того, что эволюция новых TyrK, SH2 и PTP белков происходит за счет рекомбинации с новыми добавочными доменами (Jin et al., 2009; Pei-sajovich et al., 2010), это наблюдение также подразумевает, что полный сигнальный инструментарий возникает только непосредственно перед дивергенцией metazoans и choanoflagellates (т.e., незадолго перед эволюцией многоклеточности метазоа) и что многие дивергентные экспансии этих семейств доменов происходят после расщепления ветвей.
Т.о, более ранние предположения, что передача сигналов pTyr используется только у metazoan для межклеточных коммуникаций, неверны. Choanoflagellates не образуют сложных и устойчивых межклеточных организаций по сравнению с метазоа, поэтому не удивительно, что они имеют сравнимые (если не более высокие) количества pTyr сигнальных белков (Manning et al., 2008). Секвенирование др. организмов, которые появляются близко к возникновению метазоа, уже производится. Предварительные данные также обнаруживают большие количества pTyr сигнальных белков у др. одноклеточных родственников metazoans. Поэтому может быть вполне разумным мнение, что сигнальные pTyr системы новаторские, но также системы, перерабатывающие общую информацию, которые могут потенциально использоваться для передачи многих разных типов информации.
Orthogonal Signaling: A Platform for Biological Innovation
Когда трехсоставная pTyr система появилась впервые, она представляла собой новую платформу, с которой передается информация, которая была ортогональной по отношению к предсуществующей сигнальной системе. Поскольку она базируется на разных ковалентных модификациях, то д. были собираться новые регуляторные петли (circuits) с этими компонентами без существенного перекрестного взаимовлияния с предсуществующими сетями. Т.о., этот совершенно новый сигнальный аппарат возможно обладал высоким кодирующим потенциалом для драматического возникновения новых функций, таких как те, что необходимы для многоклеточности. Одна из возможных проблем вызывается тем, что экспансия новой pTyr сигнальной системы может приводить к избыточности общего фосфорилирования тирозиновых остатков по всему протеому. Известно, что организмы, использующие передачу сигналов pTyr, могут получать простое решение этой проблемы-уменьшение содержания тирозина в белках в протеоме, что обнаруживается и коррелирует экспансию тирозин киназ (Tan et al., 2009).
Новая ортогональная сигнальная система, подобная pTyr сигнальной платформе может выглядеть аналогично вновь открытой области в спектре телекоммуикаций. Новые частоты предоставляют возможность для переноса больших количеств информации из-за малой интерференции с существующими коммуникациями. Благодаря этому ценному высоко кодирующему потенциалу образуется чрезвычайное давление , чтобы быстро заполнять эту область спектра. Более того, точный тип информации, передаваемой с помощью каждой области спектра гибок-напр., одна и та же область спектра может быть переуступлена разным функциям в разных странах. Мы полагаем, что новая система передачи сигналов pTyr, которая возникла прежде, чем метазоа получили сходные новые возможности для передачи большей информации. Эта система в исходном положении начинает быстро эксплуатироваться, хотя способ использования, по-видимому, отличался в двух ветвях (metazoans и choanoflagellates), которые появились после возникновение полного инструментария.
Можно предположить, что возникновение новой сигнальной системы с высоким кодирующим потенциалом может играть ключевую роль в появлении новых, сложных биологических функций, таких как многоклеточность метазоа. Такие крупномасштабные эволюционные инновации могут быть необходимы и совпадать с инновациями в базовых молекулярных компонентах (King, 2004; Rokas, 2008).
В самом деле, мы предполагаем, что передача сигналов pTyr может представлять собой более общую модель генерации многокомпонентных биологических систем с вовлечением сначала ограниченного ступенчато-образного развития элементов, которые имеют рудиментарное биологическое использование, сопровождаемое взрывообразным распространением, как только все компоненты зрелой системы окажутся на своём месте. Исследование этой концепции и дальнейший анализ эволюции передачи сигналов pTyr, сопровождаемый увеличением информации по последовательностям, касающейся одноклеточных и многоклеточных эукариот (Srivastava et al., 2010), без сомнения, приподнесёт сюрпризы, сродни открытию мощной передачи сигналов pTyr у M. brevicollis. Более того, станет доступной геномная информация, касающаяся др. основных эволюционных переходов, было бы интересно посмотреть, эти инновации также будут ассоциированы с взрывообразой экспансией нового молекулярного инструментария.
Ключевой точкой здесь является то, что специфическое появление pTyr инструментария может оказаться несущественным для эволюции многоклеточности, а скорее какое-то количество новых ортогональных сигнальных инструментариев с тем же самым высоким кодирующим потенциалом будет выполнять сходную роль. Др. аналог распространенности новой молекулярной информации может , в принципе, быть способным служить в качестве субстрата для драматических фенотипических инноваций. В этом контексте растения начинают экстенсивно использовать фосфорилирование белков и имеют многочисленные трансмембранные рецепторные Ser/Thr киназы, но они лишены обычных тирозин киназ, указывая тем самым, что базирующаяся на pTyr передача сигналов является не только механизмом передачи информации, с помощью которой организмы приобрели многоклеточность.
Is pTyr Signaling Saturated?
Насколько pTyr сигнальная система насыщена? Доступен ли всё ещё кодирующий потенциал, который может быть использован для эволюции новых путей и поведений? Трудно ответить на эти вопросы. Однако тот факт, что появляются новые pTyr сигнальные белки, ассоциированные с более прогрессивными процессами, такими как адаптивный иммунитет, указывает на то, что всё ещё имеется некоторый остаточный кодирующий потенциал в системе уже в эволюции млекопитающих. История эволюции, реконструированная здесь ставит многие вопросы. Существуют ли новые регуляторные инструментарии, используемые сейчас или в будущем? Станут ли эти новые инструментарии субстратом, необходимым для следующей крупной эволюционной инновации?
Важность новых молекулярных инструментариев, напротив, также очень важна в возникающей области синтетической биологии, целью которой является создание клеточных систем с новыми функциями. Основным ограничением является, как строить такие новые функции надежным способом, которые бы перекрестно не вмешивались бы неожиданным образом в существующие системы (Lim, 2010). Сможем ли мы разработать новые синтетические молекулярные сигнальные средства обращения, которые будут ортогональными по отношению к существующим естественным системам и будут ли эти системы драматически облегчать нашу способность надёжно и предсказуемо наделять клетки новаторскими новыми функциями?
Conclusions
Current data suggest that PTP and SH2 domains evolved before modern TyrK domains, most likely to process pTyr modifications sporadically catalyzed by Se^hr kinases. However, the PTP and SH2 domain protein families did not expand dramatically until the emergence of an efficient TyrK. We postulate that only with the complete toolkit of writer (TyrK), reader (SH2), and eraser (PTP) domains, was the full encoding potential of this system unleashed, leading to rapid expansion and elaboration of these domain families. This type of explosive increase in component usage may prove to be common to all multipart molecular systems. The emergence of the modern TyrK maps just prior to the split between metazoans and choanoflagellates. These two lineages appear to have used this new molecular communication system in distinct ways—multicellular metazoans used it for cell-cell coordination, whereas unicellular choanoflagellates used it for distinct but as yet uncharacterized functions.
Thus, we are able to reconstruct a plausible model by which the pTyr signaling machinery could have evolved in a relatively simple stepwise manner into what today is a complex and highly interdependent system. In this model, evolution is opportunistic and forward looking, borrowing, and repurposing machinery that pre-exists. The first simple PTP proteins likely arose from the more ancient Ser/Thr phosphatase family and may have been maintained initially as a way to reverse the unavoidable occasional tyrosine phosphorylation event catalyzed by a SenThr kinase. In some cases, like the MAPKs, which are present in all eukaryotes, these tyrosine phosphorylation events appear to have become exploited and fixed as actual parts of signal transmission, alongside Ser/Thr phosphorylation events. SH2 domains also likely arose from a pre-existing fold in the SPT6 protein, which is found in all eukaryotes but has no pTyr binding activity. But this fold, once co-opted for this function, began to expand, most likely because of its ability to contribute to a wider range of modular signaling events. But the full utility of these components was only unleashed upon the emergence of the modern TyrK domain, which led to the highly expanded three-part system. One cannot help but wonder what other simple pieces of molecular machinery may be lying around in today's biological systems, of limited utility now, but awaiting the emergence of some as yet unknown complementary component that will generate a complete toolkit that will help to drive future evolutionary innovation.
Сайт создан в системе
uCoz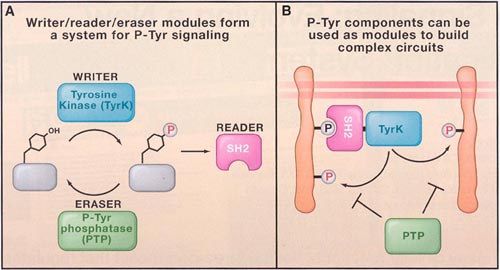 Fig. 1. The Writer, Reader, Eraser pTyr Toolkit. (A) in pTyr signaling, the tyrosine kinase (TyrK), Src Homology 2 (SH2), and phosphotyrosine phosphatase (ЗЕЗ) damains form a highly interdependet signalling platform. This platform serves as the writer, reader, and eraser nodukes, Respectively, for processing pTyr marks.
(B) Components of pTyr signalling can be used to build complex circuits. Foe exemple, recruitment of an SH2-TyrK protein to an initiating pTyr site can lead to amplification of tirosine phosphorylation through a positive feedback loop.
очень спекулятивна. Напр., мы не может исключить ни более сложные пути, участвующие в цикле эволюционных приобретений и потерь компонентов, ни возможность того, что сходные компоненты в разных линиях имели независимое происхождение. Тем не мене эта модель может предоставить пригодный каркас для последующих исследований происхождения передачи сигналов pTyr и происхождения аналогичных мультикомпонентных сигнальных платформ.
Fig. 1. The Writer, Reader, Eraser pTyr Toolkit. (A) in pTyr signaling, the tyrosine kinase (TyrK), Src Homology 2 (SH2), and phosphotyrosine phosphatase (ЗЕЗ) damains form a highly interdependet signalling platform. This platform serves as the writer, reader, and eraser nodukes, Respectively, for processing pTyr marks.
(B) Components of pTyr signalling can be used to build complex circuits. Foe exemple, recruitment of an SH2-TyrK protein to an initiating pTyr site can lead to amplification of tirosine phosphorylation through a positive feedback loop.
очень спекулятивна. Напр., мы не может исключить ни более сложные пути, участвующие в цикле эволюционных приобретений и потерь компонентов, ни возможность того, что сходные компоненты в разных линиях имели независимое происхождение. Тем не мене эта модель может предоставить пригодный каркас для последующих исследований происхождения передачи сигналов pTyr и происхождения аналогичных мультикомпонентных сигнальных платформ.  Figure 2. Evolution of pTyr Signaling
Shown is a possible path for the emergence of phosphotyrosine (pTyr) signaling. We postulate three successive stages, each represented by what is observed iFn a modern organism. The thickness of the tree reflects the approximate degree of usage of pTyr signaling (thicker lines mean more usage). Stage 1 (exemplified by the budding yeast Saccharomyces cerevisiae) reflects the situation in early eukaryotes, in which PTPs emerged but were limited in number and complexity. They were most likely used to reverse or process sporadic cross-phosphorylation of tyrosine residues by Se^hr kinases. S. cerevisiae has fewer than five PTP proteins and no functional SH2 or TyrK domains. Stage 2 reflects systems in which functional SH2 domains emerged that were able to bind to pTyr motifs. Together with Se^hr kinases with increased cross-reactivity for Tyr (such as tyrosine kinase-like or dual specificity Ser/Thr kinases), these systems may reflect the most primitive of pTyr writer/reader/eraser systems. However, the lack of a dedicated Tyr kinase may have limited the utility and expansion of this toolkit. This stage is potentially represented by the slime mold, Dictyostelium discoideum. Stage 3 reflects systems that evolved after the emergence of the modern TyrK domain. We postulate that the full writer/reader/eraser system was of so much greater utility that its use expanded dramatically. This likely resulted in many more proteins in these families, as well as much more complex, multidomain architectures than those seen in the earlier stages. This stage is represented by both the multicellular metazoan and unicellular choanoflagellate lineages.
между этими белками и теми. что обнаружены у метазоа (Figure 2). Напр., имеется значительно меньше PTPs у грибов (~5/геном против ~40/геном у метазоа) и они существенно менее сложны по архитектуре доменов (Pincus et al., 2008). PTP белки метазоа стремятся стать крупными мультидоменовыми белками, в которых модуль PTP функционально был рекомбинирован с многими др. сигнальными модулями. Напротив, у грибов PTP домены принадлежат или простым одно-доменовым белкам или находится в комбинации с одиночным rhodanase-подобным доменом (предположительно регуляторным доменом, который гомологичен классу серу переносящих энзимов; Bordo and Bork, 2002). Т.о., PTP белки грибов очень просты (с одним или двумя доменами) и лишены комбинаторной сложности PTP белков метазоа. Простота и низкие количества PTPs у дрожжей указывают на то, что у ранних одноклеточных эукариот PTP домены обладают до известной степени ограниченной функциональной пригодностью, особенно если сравнивать с их широким и сложным использованием у метазоа.
Figure 2. Evolution of pTyr Signaling
Shown is a possible path for the emergence of phosphotyrosine (pTyr) signaling. We postulate three successive stages, each represented by what is observed iFn a modern organism. The thickness of the tree reflects the approximate degree of usage of pTyr signaling (thicker lines mean more usage). Stage 1 (exemplified by the budding yeast Saccharomyces cerevisiae) reflects the situation in early eukaryotes, in which PTPs emerged but were limited in number and complexity. They were most likely used to reverse or process sporadic cross-phosphorylation of tyrosine residues by Se^hr kinases. S. cerevisiae has fewer than five PTP proteins and no functional SH2 or TyrK domains. Stage 2 reflects systems in which functional SH2 domains emerged that were able to bind to pTyr motifs. Together with Se^hr kinases with increased cross-reactivity for Tyr (such as tyrosine kinase-like or dual specificity Ser/Thr kinases), these systems may reflect the most primitive of pTyr writer/reader/eraser systems. However, the lack of a dedicated Tyr kinase may have limited the utility and expansion of this toolkit. This stage is potentially represented by the slime mold, Dictyostelium discoideum. Stage 3 reflects systems that evolved after the emergence of the modern TyrK domain. We postulate that the full writer/reader/eraser system was of so much greater utility that its use expanded dramatically. This likely resulted in many more proteins in these families, as well as much more complex, multidomain architectures than those seen in the earlier stages. This stage is represented by both the multicellular metazoan and unicellular choanoflagellate lineages.
между этими белками и теми. что обнаружены у метазоа (Figure 2). Напр., имеется значительно меньше PTPs у грибов (~5/геном против ~40/геном у метазоа) и они существенно менее сложны по архитектуре доменов (Pincus et al., 2008). PTP белки метазоа стремятся стать крупными мультидоменовыми белками, в которых модуль PTP функционально был рекомбинирован с многими др. сигнальными модулями. Напротив, у грибов PTP домены принадлежат или простым одно-доменовым белкам или находится в комбинации с одиночным rhodanase-подобным доменом (предположительно регуляторным доменом, который гомологичен классу серу переносящих энзимов; Bordo and Bork, 2002). Т.о., PTP белки грибов очень просты (с одним или двумя доменами) и лишены комбинаторной сложности PTP белков метазоа. Простота и низкие количества PTPs у дрожжей указывают на то, что у ранних одноклеточных эукариот PTP домены обладают до известной степени ограниченной функциональной пригодностью, особенно если сравнивать с их широким и сложным использованием у метазоа.