Доказательства четко показывают, что 11β-HSD1 и 11β-HSD2 дифференциально экспрессируются в плодных мембранах и плаценте человека. Плацента с её высоким кровоснабжением в основном экспрессирует 11β-HSD2 со строгой оксидативной активностью, тогда как её лишенный сосудов аналог, плодные оболочки, в основном экспрессирует 11β-HSD1 со строгой восстановительной (reductive) активностью в терминах метаболизма глюкокортикоидов (Fig. 1). Этот паттерн распределения 11β-HSD1 и 2 в плаценте и плодных оболочках человека не только согласуется с критической ролью 11β-HSD2 в качестве барьера прохождению глюкокортикоидов в плаценту, но и также указывает на то, что безсосудистые плодные мембраны являются метаболически активной тканью, которая ведет себя отлично от плаценты. Исследования показали, что уровень экспрессии и восстановительной активности 11β-HSD1 в плодных оболочках возрастает со сроком беременности (Tanswell et al. 1977; Alfaidy et al. 2003), это совпадает с увеличением уровня кортизола в амниотической жидкости и кровообращении плода (Blankstein et al., 1980), это указывает на то, что 11β-HSD1 в плодных мембранах является, скорее всего, источником кортизола для плодного компартмента во время беременности.
Chorioamnionitis является наиболее широко распространенным типом инфекции при преждевременных родах, особенно при преждевременном разрыве плодных оболочек, и считается основной причиной преждевременных родов (Smaill, 1996). Инфекция мембран ведет к активации макрофагов в этих тканях. Активированные макрофаги затем высвобождают провоспалительные цитокины, такие как IL-1b и TNFa и активируют локальные стромальные клетки, которые затем высвобождают провоспалительные цитокины (Smaill, 1996). IL-1b и TNFa являются ключевыми факторами в индуцированных инфекцией преждевременных родах (Bowen et al., 2002). Они стимулируют синтез простагландинов в плодных мембранах, а также увеличивают продукцию эстрогена и CRH в плаценте (Nestler, 1993; Petraglia et al., 1990). Сообщалось, что IL1b и TNFa индуцируют экспрессию 11β-HSD1 в яичниках, почках, жировой ткани и остеобластах (Cooper et al., 2001; Escher et al., 1997; Tomlinson et al., 2001; Yong et al., 2002). Мы установили, что IL-1b и TNFa индуцируют экспрессию 11β-HSD1 в фибробластах, происходящих из плодных оболочек человека (Li et al., 2006; Sun et al., 2003). Недавно было установлено, что IL-1β и TNFα используют CCAAT консенсусную последовательность в промоторе 11βHSD1? чтобы активировать его экспрессию (Yang et al., 2009; Ignatova et al., 2009).
Анализ промотора гена 11b-HSD1 человека выявил предположительно glucocorticoid response element (GRE) и несколько CCAAT консенсусных последовательностей (Tannin et al., 1991). Глюкокортикоиды активируют экспрессию 11b-HSD1 в ряде тканей и типов клеток (Tomlinson et al., 2004) и мы продемонстрировали, что глюкокортикоиды индуцируют экспрессию 11b-HSD1 в фибробластах и клетках трофобластов, происходящих из плодных мембран человека в концентрациях, легко достигаемых в конце беременности (Sun and Myatt 2003; Li et al. 2006; Yang et al. 2007). Мы установили, что эта индукция экспрессии 11β-HSD1 с помощью глюкокортикоидов опосредуется с помощью GR осуществляемого транскрипционного процесса и обеспечивается CCAAT консенсусной последовательностью и GRE, существующим в промоторном регионе, ответственном за индукцию 11β-HSD1 с помощью глюкокортикоидов (Yang et al., 2007).
Хорошо известно, что глюкокортикоиды эффективно супрессируют активацию иммунных клеток, индуцируемую с помощью провоспалительных цитокинов с помощью двух механизмов (McKay et al., 1999). Глюкокортикоиды инактивируют функцию провоспалительного цитокинового медиатора nuclear factor-κB (NF-κB) за счет индукции экспрессии ингибирующего IκB (McKay et al., 1999). Этот дополнительный ингибирующий IκB удерживает NFκB в его неактивной форме в цитоплазме (McKay et al., 1999). Кроме того, потенциал связывания активированных ядерных GR комплексов с ядерным NFκB может удерживать последний от связывания с соотв. чувствительными элементами ДНК и вносить вклад в стероидами обеспечиваемую иммуносупрессию (McKay et al., 1999). Однако мы нашли комбинацию глюкокортикоидов и провоспалительных цитокинов, индуцирующих в дальнейшем экспрессию 11β-HSD1 мРНК в фибробластах амниона и хориональных трофобластах, это явно противоречит противоположным эффектам глюкокортикоидов и провоспалительных цитокинов в месте воспаления. Синергичная индукция экспрессии 11β-HSD1 в плодных оболочках человека с помощью глюкокортикоидов и провоспалительных цитокинов (Sun et al. 2002; Sun and Myatt 2003; Li et al. 2006) может т.о., формировать петлю в терминах регенерации кортизола. Как результат, д. становиться всё больше и больше биологически активных глюкокортикоидов, формируемых плодными мембранами, и диффундирующих в амниотическую жидкость в конце беременности, особенно, когда плод подвергается действию инфекции и высокого уровня глюкокортикоидов. Повышенная регенерация кортизола д. не только обеспечивать само-разрешающийся (self-resolving) механизм контроля воспаления, но и также может способствовать созреванию органов плода и инициировать роды, чтобы защитить плод от вредных эффектов инфекции. Этот паттерн регенерации кортизола в плодных мембранах может быть одним из механизмов прямой связи по цепи, участвующих в созревании и родах.
Networks of glucocorticoids, surfactant protein A and prostaglandins in human fetal membranes
Хотя специфические механизмы, инициирующие роды могут варьировать среди разных видов, глюкокортикоиды считаются факторами, синхронизирующими созревание плода с запуском механизмов родов почти у всех изученных видов (Jenkin et al., 2004). Глюкокортикоиды ускоряют созревание легких путем усиления синтеза surfactant в клетках легочных альвеол (Gonzales et al., 1986; Snyder et al., 1981). Во время развития плода альвеолярные клетки type II легких плода в конечном счете синтезируют и высвобождают сурфактант в легочный секрет (Van Golde et al., 1988), который периодически выбрасывается в амниотическую жидкость (Pryhuber et al., 1991; Snyder et al., 1988). Surfactant является сложной смесью составляющих фосфолипидов, неполярных липидов и белков (Van Golde et al. 1988; Floros and Phelps 1997). Одним из наиболее многочисленных apoproteins, специфически ассоциированных с легочным сурфактантом является surfactant protein A (SP-A) (Floros et al., 1997). Концентрация SP-A в амниотической жидкости увеличивается драматически в третьем триместре беременности, от менее чем 3µg/ml на 30-31 неделе до более чем 24 µg /ml на 40-41 неделе (Snyder et al. 1988; Pryhuber et al. 1991). Фосфолипид, содержащийся в сурфактанте, является источником arachidonic кислоты, которая может быть использована амнионом для синтеза простагландина (Lopez Bernal et al., 1989; Newman et al., 1993). Кроме того. сообщалось. что SP-A играет важную роль в регуляции иммунной функции в легких плода, включая стимуляцию экспрессии противовоспалительных цитокинов и активацию Toll-like receptors (TLR) (Crouch et al., 2001). SP-A, как было показано. соединяется с TLR2 и TLR4 (Guillot et al., 2002; Murakami et al., 2002), приводя к активации NFβB. недавно Condon et al., предоставили прямые доказательства, подчеркивающие роль SP-A как ключевой связи между созреванием плода и инициацией родов у мышей (Condon et al., 2004), т.к. инъекция SP-A в амниотическую жидкость мыши вызывала преждевременные роды, которые блокировались инъекцией NFβB ингибитора SN50. Эти находки указывают на то, что prostaglandin-синтезирующие энзимы в плодных мембранах являются возможными мишенями для SP-A.
Как SP-A, так и др. apoproteins, такие как SP-B и SP-D присутствуют в амниотическом эпителии и chorio-decidual слоях (Miyamura et al., 1994). Поскольку высокие уровни сурфактантных белков присутствуют в амниотической жидкости в поздней беременности, то адсорбция или абсорбция сурфактантных белков на или в плодные мембраны происходит скорее всего. Адсорбция SP-B на амниотический эпителий человека продемонстрирована Newman et al., (Newman et al., 1991) . Хотя SP-A, как сообщалось, является гидрофильным скорее, чем гидрофобным в отличие от др. сурфактантных белков (Hawgood et al., 1990), эти наблюдения открывают возможность абсорбции или адсорбции SP-A в плодные мембраны скорее, чем локального синтеза. Несмотря на эти возможности мы нашли, что SP-A белок и мРНК присутствуют в амниотических эпителиальных клетках, фибробластах и хориональных трофобластах (Sun et al., 2006a), подтверждая существование локального синтеза SP-A во всех этих трех типах клеток плодных мембран. Однако, потребление SP-A из амниотической жидкости клетками плодных мембран не может быть в целом исключено, поскольку наиболее интенсивное окрашивание белка SP-A наблюдается в амниотическом эпителии, особенно на апикальной части мембраны, обращенной к амниотической жидкости, но экспрессия мРНК SP-A в амниотических эпителиальных клетках, по-видимому, самая низкая из трех типов исследованных клеток.
Исследования на животных и человеке показывают, что кортизол играет важную роль в регуляции синтеза surfactant в легких плода (Gonzales et al., 1986; Mendelson et al., 1986; Snyder et al., 1981). Мы получили доказательства синтеза de novo SP-A в плодных мембранах (Sun et al., 2006a). В согласии с индукцией экспрессии SP-A кортизолом в легких плода, мы нашли, что экспрессия SP-A в плодных мембранах также стимулируется кортизолом в физиологических рамках, достигаемых в амниотической жидкости на поздней беременности (Sun et al., 2006a), это указывает на то, что кортизол, происходящий в результате действия 11β-HSD1 в плодных мембранах может быть важным для индукции экспрессии SP-A как в легких плода, так и плодных оболочках.
Как ранее было установлено плодные мембраны человека являются основным источником prostaglandins (PGE2 и PGF2α) в конце беременности с активацией синтеза простагландина в мембранах плода человека, являющимся одним из ключевых событий, ведущих к родам в срок и досрочно (Challis et al. 1997; Gibb 1998). Цитозольный PLA
2 и PGHS-2, по-видимому, являются двумя энзимами, катализирующими скорость-ограничивающие ступени синтеза PG (Irvine 1982; Kniss 1999). Мы продемонстрировали, что apoprotein компонент сурфактанта, SP-A, дозово-зависимо стимулирует PGHS-2, но не экспрессию cPLA
2 и mPGES в хориональных трофобластах (Sun et al., 2006a). Как следствие повышенной экспрессии
PGHS-2, PGE2, высвобождаемый из хориональных трофобластов, также дозово-зависимо увеличивается с помощью SP-A (Sun et al., 2006a). Базируясь на этих находках, мы полагаем, что вместе с SP-A, происходящим из легких плода, посредством амниотической жидкости, SP-A, синтезируемый локально в плодых мембранах, может участвовать в инициации родов путем стимулирования синтеза prostaglandin в плодных оболочках в конце беременности, это может параллельно увеличивать экспрессию 11β-HSD1 в плодных оболочках и соотв. драматически повышать уровень кортизола в амниотической жидкости в третьем триместре.
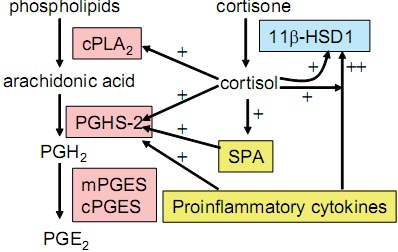 Fig. 2. Regulation of prostaglandin synthesis in fetal membranes. A positive feedback loop is present in the fetal membranes involving stimulation of cortisol and prostaglandin production to promote fetal maturation and initiate parturition.
Fig. 2. Regulation of prostaglandin synthesis in fetal membranes. A positive feedback loop is present in the fetal membranes involving stimulation of cortisol and prostaglandin production to promote fetal maturation and initiate parturition.
Плодные оболочки, по-видимому, является критическим местом интеграции передачи сигналов для созревания плода и начала родов. Глюкокортикоиды, как было установлено, стимулируют продукцию PG в амнионе. Этот феномен считается связанным со стимуляцией экспрессии cPLA
2 и PGHS-2 с помощью GCs, особенно в амниотических фибробластах, которые являются основным типом клеток, продуцирующих PGs в плодных оболочках. Это находится в заметном контрасте с его известным ингибирующим действием на индукцию продукции PG с помощью провоспалительных цитокинов. Эти парадоксальные эффекты GCs, как полагают. являются частью feed forward петель, запускающих роды. Под действием глюкокортикоидов формируется большинство PG. Prostaglandins в свою очередь стимулируют активность 11β-HSD1 в плодных оболочках, приводя тем самым к большей регенерации кортизола из кортизона в плодных мембранах. Глюкокортикоиды, необходимы для созревания органов плода , необходимы для жизни
ex utero после родов. Экспрессия 11β-HSD1 амниотическими фибробластами может поддерживать активный кортизол в увеличенных концентрациях в течение всей беременности для достижения этого. Кортизол
per se участвует в feed forward петле, стимулирующей экспрессию 11β-HSD1.
Summary
Taking all these results together, we propose that a positive feedback loop involving glucocorticoids, proinflammatory cytokines, prostaglandins, SP-A and 11β-HSD1 is formed locally in human fetal membranes towards term or in preterm labor (Fig. 2). This positive feedback loop would produce abundant biologically active glucocorticoids and PGs in fetal membranes or amniotic fluid, which would ultimately promote fetal organ maturation and initiate parturition.
Сайт создан в системе
uCoz
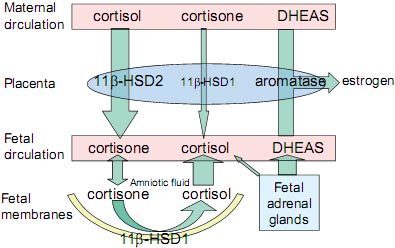 Fig. 1. Interconversion of glucocorticoids in placenta and fetal membranes. The differential expression of 11?-hydroxysteroid dehydrogenase (HSD) isoforms in placenta and fetal membranes regulates the metabolism and transport of active cortisol and inactive cortisone between maternal and fetal circulations.
Fig. 1. Interconversion of glucocorticoids in placenta and fetal membranes. The differential expression of 11?-hydroxysteroid dehydrogenase (HSD) isoforms in placenta and fetal membranes regulates the metabolism and transport of active cortisol and inactive cortisone between maternal and fetal circulations.  Fig. 2. Regulation of prostaglandin synthesis in fetal membranes. A positive feedback loop is present in the fetal membranes involving stimulation of cortisol and prostaglandin production to promote fetal maturation and initiate parturition.
Fig. 2. Regulation of prostaglandin synthesis in fetal membranes. A positive feedback loop is present in the fetal membranes involving stimulation of cortisol and prostaglandin production to promote fetal maturation and initiate parturition.