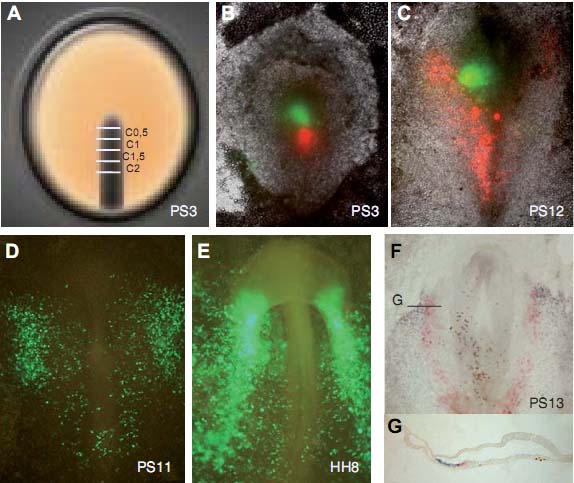
As in our previous fate maps, some cells from the head mesenchyme, blood vessels, ventral and dorsal aortae, and endoderm or mesoderm not involved in heart structures, were also observed in our experimental embryos.
The state of commitment of precardiac cells located at the level of different segments of the primitive streak was studied by their transplantation into host embryos at different positions. We also studied the possible role of the rostral tip of the primitive streak as a potential regulatory mechanism in cardiogenesis.
Grafts of the rostral tip of the primitive streak into HFR As can be seen in Fig. 8, the rostral tip of donor embryos at stage PS3 transplanted to HFR of a host embryo at stage PS11 gave rise a few hours later to an area of loss of expression of the early cardiac marker cNkx-2.5 at the level of the HFR in the host embryo (Fig. 8B). On the contrary, the Hensen’s node of donor embryos at stage PS8 transplanted to HFR (PS11) induced an increased area of expression of this marker (Fig. 8D).
Discussion
Одним из основных вопросов процесса кардиального развития является вопрос происхождения и поведения прекардиальных клеток до формирования органа. Известно (Lopez-Sanchez et al., 2001), что они обнаружимы уже на инициальных стадиях гаструляции (PS1) на уровне эпибласта и позднее во время их инвагинации через первичную полоску. Детальные карты судеб были сконструированы как для проспективных мезодермальных, так и энтодермальных клеток (Schoenwolf et al., 1992; Sawada and Aoyama, 1999; Lawson and Schoenwolf, 2003; Kimura et al., 2006; Chapman et al ., 2007), однако они не были сфокусированы на происхождении и замещении проспективных кардиальных клеток во время развития сердца. Хотя разные исследователи (Fishman and Chien, 1997; Ehrman and Yutzey, 1999; Redkar et al., 2001) внесли вклад в конструирование карты судеб прекардиальных клеток, всё ещё оставались некоторые аспекты, нуждающиеся в объяснении, такие как корреляция между положение прекардиальных клеток на уровне первичной полоски с их расположением на уровне HFR (или PCF), и их финальной позицией в примитивной сердечной трубке. В настоящем исследовании мы провели детальный анализ происхождения, расположения и перемещения прекардиальных клеток вплоть до момента, когда их судьба детерминировалась к формированию структуры HFR, эндокардиальных трубок и наконец, примитивной сердечной трубки. Наши результаты показали. что наиболее ростральный регион первичной полоски, за исключением Гензеновского узелка, мигрирует билатерально в ростро-латеральном направлении, чтобы сформировать часть преимущественно энтодермального слоя, включая AEndoC. Клетки первичной полоски, расположенные непосредственно каудальнее этого региона. следуют параллельно, но в более латеральном направлении и составляют MesoPC, которые позднее становятся прекардиальной спланхнической мезодермой. Это может быть очень важным аспектом, принимая во внимание кардиогенез, т.к. было предположено (Schultheiss et al., 1995, 1997; Ehrman and Yutzey, 1999) , что the AEndoC индуцируют инициацию кардиогенеза, действуя на MesoPC. Было предположено, что клетки, которые инвагинируют на уровне наиболее ростральных сегментов первичной полоски играют роль и на более поздних стадиях в индукции и регуляции дифференцировки клеток, которые инвагинируют через каудальные сегменты и которые формируют слои, характерные для структур примитивной сердечной трубки (Fig. 9). Ранее нами было установлено (Schoenwolf et al., 1992; Garcia-Martinez and Schoenwolf, 1993), что наиболее ростральные клетки первичной полоски в основном формируют артериальный полюс сердечной трубки, а более каудальные в основном венозный полюс и что даже на ст. PS8 некоторые клетки Гензеновского узелка способны формировать часть эндокарда артериального полюса (Schoenwolf et al., 1992; Kirby et al., 2003). По результатом большой группы техник, использованных в данном исследовании, подтверждена гипотеза, что клетки первичной полоски состоят из двух групп разного значения. Одна группа клеток, расположенная преимущественно в более ростральной области первичной полоски (C05-C1), может быть охарактеризована по своей проспективной способности индукции и регуляции (AEndoC) второй группы клеток. Эта вторая группа, расположенная преимущественно в более каудальных сегментах (C1.5-C2.5), предназначена сформировать и дифференцировать MesoPC, чтобы создать прекардиальную спланхническую мезодерму и затем слои примитивной сердечной трубки (Fig. 9).
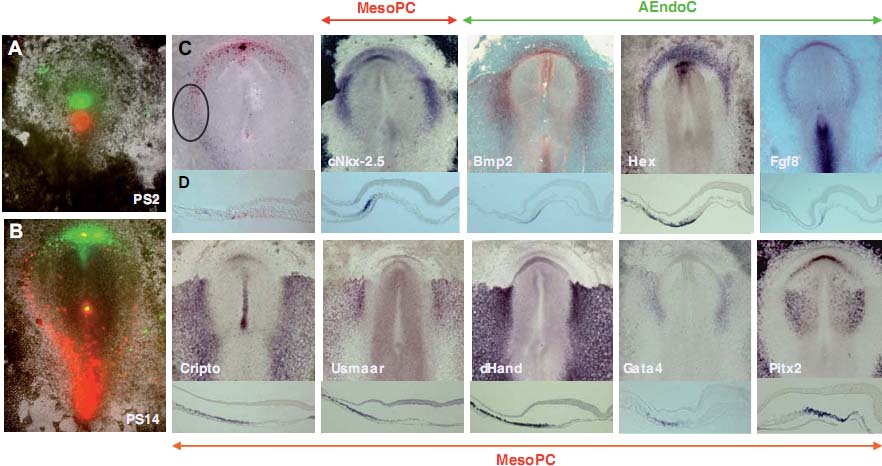
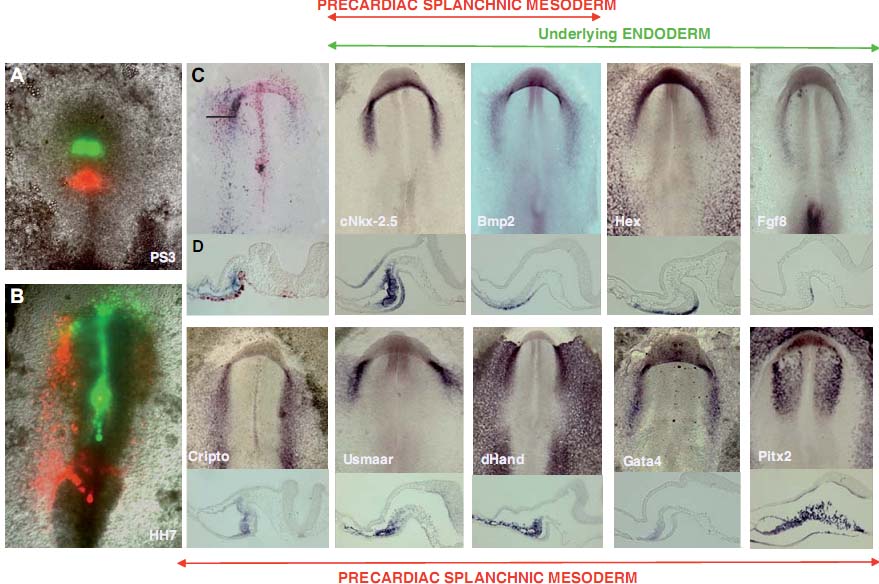
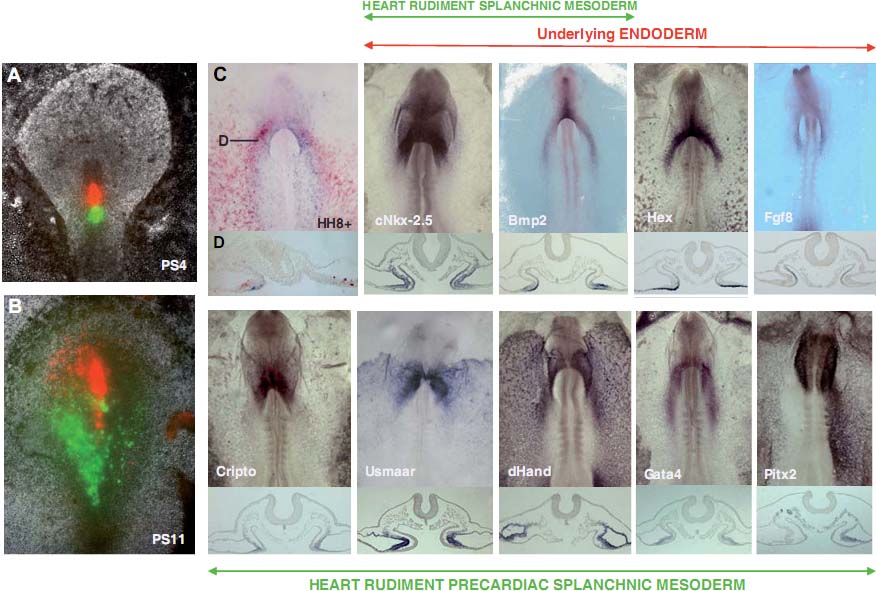
Разные исследователи (Fishman and Chien, 1997; Ehrman and Yutzey, 1999; Redkar et al., 2001) пытались установить конфигурацию и расположение клеток, составляющих HFR, и ограничить эту область, используя технику DiI crystal имплантаций и DiI инъекций. В результате появились доказательства расхождений между этими исследованиями в отношении границ и организации прекардиальных клеток в HFR, т.к. отсутствуют четкие анатомические границы, определяющие этот регион. В попытке внести вклад в понимание процесса образования, разграничения и миграции клеток в HFR, мы здесь описали исследование картирования судеб прекардиальных клеток первичной полоски вместе с детальным анализом экспрессии разных специфических генов сердца или интимно связанных с его развитием. Наши результаты показали, что прекардиальные клетки от их местоположения в первичной полоске до их расположения в примитивной сердечной трубке, и клетки интимно связанные с ними (AEndoC), характеризуются присутствием иерархическоео паттерна экспрессии разных генов. Экспрессия
Bmp2, который считается индуктором кардиогенеза (Lough et al., 1996; Schultheiss et al., 1997; Andree et al., 1998; Schlange et al., 2000; Alsan and Schultheiss, 2002; Lopez-Sanchez et al., 2002) начинается в AEndoC, которые считаются первой группой клеток, прибывших из ростральных сайтов первичной полоски, а спустя несколько часов обнаруживается как в прекардиальной спланхнической мезодерме, так и в подлежащей энтодерме. Однако самый ранний кардиальный маркёр cNkx-2.5 (Schultheiss et al., 1995) впервые экспрессируется на уровне MesoPC, чти клетки происходят из более каудальных сегментов первичной полоски, что сопровождается позднее экспрессией на уровне MesoPC и AEndoC одновременно. С точки зрения этих данных и анализа генной экспрессии на уровне первичной полоски на этих стадиях (PS1- 14, Lopez-Sanchez et al., 2005), нами была высказана гипотеза, что вторая группа клеток первичной полоски (проспективные MesoPC) регулируется первой группой (проспективные AEndoC), которая, в свою очередь, регулируется при посредстве рострального кончика Гензеновского узелка (Fig. 9). Более того, этот процесс инициации регуляции кардиогенеза д. контролироваться генами, экспрессия которых необходима на уровне AEndoC, такими как
Fgf8 (Alsan and Schultheiss, 2002) и
Hex (Zhang et al., 2004), тогда как др. гены. такие как
Cripto (Colas and Schoenwolf, 2000),
Usmaar (Colas et al., 2000),
dHand (Srivastava et al., 1995),
GATA4, GATA4-5-6
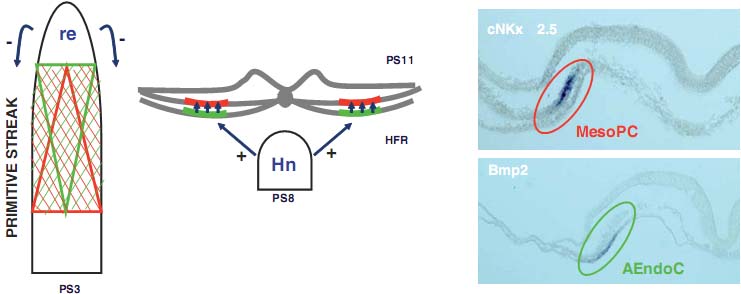 Fig. 9. A model of the significance of primitive streak precardiac cells. The precardiac cells of the primitive streak are distributed into two groups with different significance. The group of cells located in the more rostral sites of the primitive streak, with a decreasing gradient towards more caudal sites (green triangle), is regulated by the rostral end (re), and is responsible for the formation of the endoderm layer (green line) characterized by the expression of specific genes, such as the initial expression of Bmp2 (green ellipse). The second group is located in more caudal sites of the primitive streak, with a decreasing gradient towards the more rostral sites (red triangle). This group will be responsible for the formation of the MesoPC (red line), differentiating subsequently to form the precardiac splanchnic mesoderm and primitive heart tube. It is regulated by the cells of the previous group, and expresses specific genes, such as the initial expression of cNkx-2.5 (red ellipse). At later stages, the Hensen's node (Hn) regulates the cell differentiation of the HFR.
Fig. 9. A model of the significance of primitive streak precardiac cells. The precardiac cells of the primitive streak are distributed into two groups with different significance. The group of cells located in the more rostral sites of the primitive streak, with a decreasing gradient towards more caudal sites (green triangle), is regulated by the rostral end (re), and is responsible for the formation of the endoderm layer (green line) characterized by the expression of specific genes, such as the initial expression of Bmp2 (green ellipse). The second group is located in more caudal sites of the primitive streak, with a decreasing gradient towards the more rostral sites (red triangle). This group will be responsible for the formation of the MesoPC (red line), differentiating subsequently to form the precardiac splanchnic mesoderm and primitive heart tube. It is regulated by the cells of the previous group, and expresses specific genes, such as the initial expression of cNkx-2.5 (red ellipse). At later stages, the Hensen's node (Hn) regulates the cell differentiation of the HFR.
(Laverriere et al., 1994; Jiang et al., 1998) и
Pitx2 (Piedra et al., 1998), д. регулироваться, чтобы экспрессироваться в MesoPC и поддерживать свою экспрессию в ходе дифференцировки этих клеток в направлении спланхнической мезодермы и примитивных эндокардиальных трубок. Некоторые др. необходимы на более поздних фазах кардиального морфогенеза, включая
AMHC1 (Yutzey et al. , 1994; Somi et al., 2006),
VMHC1 (Bisaha and Bader, 1991; Somi et al., 2006),
Tbx1, (Huynh et al., 2007) и
Tbx5 (Bruneau et al., 1999; Plageman and Yutzey, 2004).
Итак эти данные показывают, что потенциал клеток первичной полоски дифференцироваться в направлении сердца д. зависеть не только от их собственных пространственно-временных характеристик, но и также от индуктивных и/или регуляторных факторов, с которыми они поддерживают интимные взаимоотношения. По этой причине, в данной работе мы анализировали следующие два аспекта: детерминация прекардиальных клеток первичной полоски и их регуляторные механизмы. Наши результаты показали, что наиболее ростральные прекардиальные клетки первичной полоски, трансплантированные в серп зародышевых клеток, способны давать энтодерма-подобный слой, сопровождаемый близко родственной тканью, которая экспрессирует самый ранний кардиальный маркер cNkx-2.5, тогда как более каудальные клетки обладали способностью дифференцировки и экспрессии cNkx-2.5, а также маркеров кардиальных секторов, AMHC1 и VMHC1. Эти данные указывают на то, что прекардиальные клетки первичной полоски уже обладают информацией о своей судьбе в отношении кардиогенеза и подтверждают гипотезу, предложенную выше (Fig. 9). Тем не менее, если прекардиальные клетки первичной полоски гомотипически или гетеротипически трансплантировать в пресомитные сайты первичной полоски, то они теряют свою способность мигрировать в направлении сердца и экспрессии ими специфических кардиальных генов (и vice versa). Эти данные подтверждают гипотезу, что на уровне первичной полоски существуют факторы, которые детерминируют механизмы становления регуляции перемещения и дифференцировки её клеток, со способностью модифицировать их инициальную информацию. В своей попытке получить новые данные относительно возможных факторов, участвующих в этом процессе индукции и регуляции, мы оказались способны продемонстрировать участие рострального кончика первичной полоски, показав. то этот конец на стадии PS2-5 первичной полоски негативно регулирует экспрессию генов, участвующих в инициации кардиогенеза. Свойства Гензеновского узелка на поздних стадиях с разными морфологическими и молекулярными характеристиками (Lopez-Sanchez et al., 2005), необходимы для начала этого процесса. Эти находки подтверждают наши более ранние результаты (Lopez-Sanchez et al., 2002) о способности Гензеновского узелка обеспечивать индукцию процесса кардиогенеза.
Исследования по картированию судеб и анализ способности к дифференцировке и/или индукции клеток первичной полоски недостаточны, чтобы иметь полное представление о факторах, которые детерминируют процесс кардиогенеза и кардиального морфогенеза. Необходим также экспериментальный анализ молекулярных факторов, которые регулируют MesoPC и AEndoC, которые возникают на уровне первичной полоски.
Сайт создан в системе
uCoz