Карциномы являются злокачественными раками эпителиального происхождения, они возникают во многих органах, таких как печень, легкие, молочные железы, толстая кишка, простата, яичники, поджелудочная железа и пищевод. Согласно American Cancer Society, по крайней мере, 80% от всех раков являются карциномами. Поэтому понимание биологии эпителиальных клеток не только предоставляет информацию о механизмах, которые регулируют ранние события рака и ступени, которые регулируют прогрессирование рака, но и также помогает развитию новых стратегий для диагностики и лечения злокачественности.
Эпителиальные органы поляризованы как на уровне ткани, так и клеточном уровне. На тканевом уровне эпителиальные клетки образуют многоклеточные структуры и осуществляют нормальные физиологические функции, такие как направленная секреция молока в просвет, свойство обозначаемое как тканевая полярности. На клеточном уровне эпителиальные клетки имеют асимметричное распределение цитоплазматических и мембранных белков, чтобы регулировать клеточную структуру и передавать сигналы, это собственно и обозначается как клеточная полярность. Тканевая и клеточная полярность теряются рано во время неопластических процессов, это используется патологами для выявления рака [1 ]. Существует несколько типов клеточной полярности. Клетки, выстилающие структуры протоков, обладают апикально-базальной полярностью, при которой белки асимметрично распределяются вдоль апикально-базальной оси [ 2 ]; поля клеток в ткани обладают planar cell polarity (PCP), которая означает способность клеток быть ориентированными в предетерминированном направлении [ 3 ]; мигрирующие клетки обладают полярностью фронт-тыл при этом белки асимметрично распределяются вдоль оси миграции и, наконец, клетки предшественники обнаруживают асимметричные клеточные деления, что собственно облегчает генерацию двух дочерних клеток с разными клеточными судьбами [4 ]. Т.о., способность клеток к асимметричному распределению белков играет важную роль во время различных физиологических событий. Мы рассмотрим связанные с раком изменения в генной экспрессии и паттернах локализации белков полярности.
Polarity proteins
Исследования на модельных организмах, таких как дрожжи, черви и мухи привело к идентификации ряда белков, которые регулируют различные аспекты клеточной полярности, сюда входят каркасные молекулы, киназы и GTPases (for review see [ 5 ]). Белки полярности функционируют как мультипротеиновые комплексы, которые прежде всего регулируют генерацию асимметрии внутри клетки. В эпителиальных клетках с апикально-базальной полярностью белки полярности асимметрично распределяются вдоль апикально-базальной оси (see Figure 1 for localizations of several polarity proteins). Напр., члены комплекса полярности Crumbs (Crumbs/Protein associated with Lin seven 1(Pals1) /Pals1- associated tight junction protein (PATJ)) и Partitioning defective (Par) polarity complex (Par 3/Par6/ atypical protein kinase C (aPKC)) располагаются в апикальном кортексе (for the review of those proteins, see [ 6 ]), тогда как члены комплекса полярности Scribble (Scribble/Discs large (Dlg) /Lethal giant Larvae (Lgl)) локализуются в базолатеральных регионах клетки [ 7 - 10 ].
Crumbs являются трансмембранными белками, которые связывают PDZ домены Pals1 и PATJ посредством C-терминального ERL1 мотива. Pals1 является членом семейства ассоциированных с мембраной гуанилат киназ ( membrane - assoc iated guanylate kinase (MAGUK)), которая имеет PDZ домен,два L27 домена, SH3 домен и guanylate kinase домен. PATJ имеет 10 PDZ доменов и один L27N домен. Par3 и Par6 взаимодействуют др. с др. посредством своих PDZ доменов. Par3, посредством aPKC и Par6, может также взаимодействовать с комплексом Crumbs (see [ 11 ] for a detailed
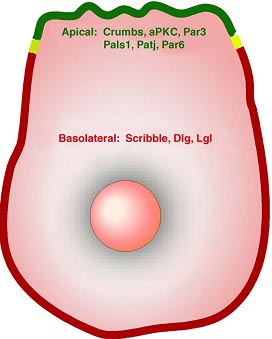 Рис. 1
Spatial distribution of polarity regulators in epithelial cells polarized along the apical- basal axis.
Рис. 1
Spatial distribution of polarity regulators in epithelial cells polarized along the apical- basal axis.
review ). Существуют две aPKC изоформы у млекопитающих: PKC
ξ и PKC
λ/L . Две изоформы имеют 72% сходство последовательностей и на сегодня функциональные различия между двумя изоформами изучены недостаточно. Киназные активности aPKC являются независимыми от кальция и негативно регулируются с помощью множественных белков, включая Prostate androgen response-4 (Par-4) белок, а также ингибирующий PKCξ II белок [12 ].
Scribble, Dlg и Lgl были идентифицированы у Drosophila как опухолевые репрессоры и их роль в карциномах млекопитающих начинает выявляться [ 9,13,14]. Scribble является членом семейства LAP с повторами, богатыми лейцином, и PDZ доменами, тогда как Dlg является членом семейства MAGUK. содержащего PDZ домены. Lgl не содержит PDZ доменов, но имеет WD40 домены, которые, как полагают, обеспечивают взаимодействия с фосфорилированными serine и tyrosine [15]. Planar cell polarity (PCP ) является ортогональной по отношению к апикально-базальной полярности. Стержневые белки PCP у млекопитающих включают мембранные белки Frizzled, Vang и Celsr1, а также цитоплазматические белки Dishevelled и Prickle [ 3 ]. У позвоночных известны лишь немногие события, чётко связанные с PCP, такие как конвергентное удлинение и нейруляция во время эмбрионального развития и ориентация стереоцилий в улитке внутреннего уха.
Белки апикальной полярности могут перекрестно регулировать белки базо-латеральной полярности во время установление и поддержания клеточной полярности. Lgl является субстратом для aPKC и его клеточная локализация регулируется с помощью aPKCs в нормальных эпителиях и карциномных тканях [ 16,17 ]. С др. стороны, Scribble необходим, чтобы ограничивать апикальные белки, такие как Crumbs апикальным регионом эпителия Drosophila [18 ]. Локализация Lgl также регулируется с помощью PCP пути, нокдаун Dishevelled неправильно локализует Lgl из клеточной мембраны и подавляет уровни белка Lgl protein в эмбриональной эктодерме Xenopus [ 19 ].
Данные белок полярности может регулировать разные типы клеточной полярности. Напр., Scribble используется во всех типах клеточной полярности, описанных выше [ 18,20 - 24 ]. Эти общие компоненты в разных путях полярности, а также взаимная зависимость разных комплексов полярности подчеркивает тот факт, что необходим тщательный выбор модельных систем для изучения роли белков полярности, поскольку многие белки полярности скорее всего функционируют контекст-специфическим способом.
Alteration of polarity proteins in carcinoma
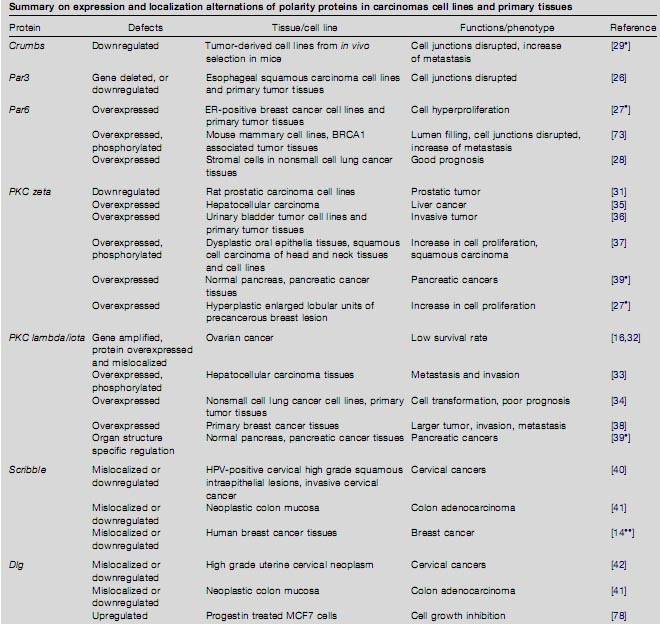
Тканевая трансформация при раке часто ассоциирует с потерей клетками и тканями полярности, но механизмы этого неизвестны. Наиболее вероятно, что процесс трансформации использует альтерации экспрессии генов полярности и/или субклеточной локализации их белков, приводящих к функциональной инактивации путей полярности [25 ]. Имеется достаточно доказательств, демонстрирующих, что альтерации генов белков полярности часто наблюдаются при карциномах (see Table 1 for summary).
Члены комплексов апикальной полярности изменены при многих раках. Ген
Par3 делетирован в 15% первичных esophageal squamous cell carcinoma (ESCC), а уровни мРНК подавлены в 23 из 33 ESCC опухолевых тканях по сравнению с нормой [ 26 ]. Уровни мРНК Par6β позитивно регулируются в ER-позитивных первичных опухолях грудии в ER-позитивных клеточных линиях опухолей груди [27]. В nonsmall cell lung cancers (NSCLCs), Par6 экспрессируется на высоком уровне в стромальных клетках и коррелирует с хорошим прогнозом [ 28 ]. Подавление Crumbs3 необходимо для трансформации и туморогенеза иммортализованных baby rat kidney (BRK ) клеток, а повторная экспрессия Crumbs восстанавливает полярность и ингибирует инвазию клеток BRK cells [29], демонстрируя, что потеря Crumbs3 причинно связана с процессом трансформации. Попытки секвенирования ракового генома, скорее всего, идентифицируют дополнительные, ассоциированные с раком генетические альтерации в белках полярности. Напр., анализ данных, полученных при секвенировании транскриптома, показывает присутствие нового слияния между фактом транскрипции или ZNF 667 и белком полярности
Table 1. Sum mary o n e xpression and localization a lternations of polarity prote ins in carcin omas cell lines and primary tissues
Par6β [ 30]. Тщательный анализ данных, генерированных в результате усилий по созданию атласа ракового генома, скорее всего идентифицирует новые генетические альтерации, ассоциированные с белками полярности. Скорее всего, что aPKC изоформы будут играть специфические для типов клеток роли при раке. В нечувствительных к андрогену линиях рака простаты крыс, PKC мРНК подавляется [ 31 ], тогда как при раке печени человека, раке яичников и nonsmall клеточном реке легких уровни мРНК PKC
λ/L позитивно регулируются [ 32 - 34 ]. Высокие уровни PKC
ξ белков обнаруживаются при гепатоцеллюлярных карциномах, переходных карциномах мочевого пузыря , диспластического ротового эпителия и сквамозно-клеточных карциномах головы и шеи [ 35 - 37 ]. PKC
λ/LL из апикальной мембраны коррелирует с инвазивностью болезни [ 38 ]. Ген PKC
L умножается , а белок неправильно локализуется в раке оварий [16,32 ]. Атипические PKC также обнаруживают внутриопухолевую гетерогенность. Напр., PKC
ξ избыточно экспрессируется как при minor ductal, так и ampullary раке поджелудочной железы, тогда как PKC
L избыточно экспрессируется только в крупных протоках ductal раков и ampullary раков, но подавляется в minor протоках. Более того, в строме PKC
ξ, но не PKC
L? экспрессируется избыточно [ 39]. Всё это указывает на то, что роль, выполняемая белками полярности в прогрессировании опухолей скорее всего контекст зависима.
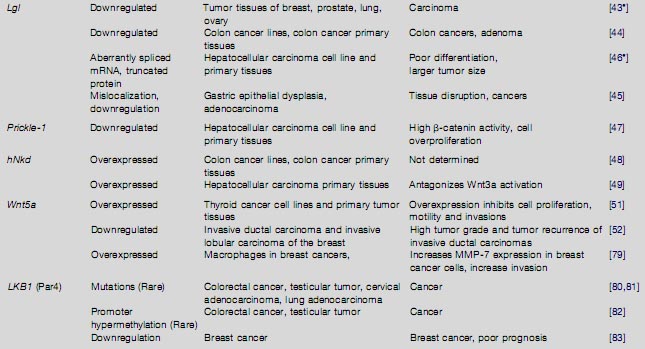
Члены комплексов базолатеральной полярности также изменены на уровне локализации белков при раках. Уровни мРНК повышены в 37.5% и редуцированы в 53.1% случаев рака груди по сравнению с нормальными тканями, и белки неправильно локализованы почти в 50% DCIS повреждений [14]. При HPV-позитивных шеечных high-grade сквамозных внутриэпителиальных повреждениях и инвазивных раках, уровни белков Scribble снижены, а субклеточное распределение нарушено [ 40 ]. При карциномах толстой кишки Scribble неправильно локализуется и экспрессия подавлена в плохо дифференцированных аденокарциномах [ 41 ]. Уровни экспрессии Dlg и базо-латеральная локализация изменены при раках толстой кишки, high-grade premalignant шеечных неоплазиях и инвазивных сквамозных карциномах [ 41,42 ]. Lgl -1 транскрипты теряются в опухолевых тканях груди (76% ), простаты (53%), лёгких (63% ), яичников(50%), и карциномах колона (75%) [ 43]. Повторная экспрессия Lgl-1 в 293 клетках увеличивала клеточную адгезию [ 44 ], указывая тем самым, что потеря Lgl-1 причинно связана с потерей клеточной адгезии. Lgl2 или негативен или в основном цитоплазматический при карциномах желудка [45 ]. В дополнение к изменениям в уровнях мРНК, белки полярности также могут регулироваться с помощью альтернативного сплайсинга. Lu et al. сообщили, что аберрантный сплайсинг Lgl-1 транскриптов наблюдается при гепатоцеллюлярных карциномах [46] и коррелирует с присутствием крупных опухолей.
Члены PCP комплекса также меняются при раках человека. В некоторых линиях клеток печеночноклеточных карцином и в первичных опухолях, уровень мРНК Prickle-1 снижается и коррелирует с повышенной экспрессией Dishevelled и β-catenin [47 ]. Человеческий гомолог Drosophila Naked Cuticle (hNkd) , антагонист канонической передачи сигналов Wnt, избыточно экспрессируется в 72% первичных опухолей толстой кишки [48 ] и во всех 23 проанализированных выборках печеночноклеочной карциномы [49 ]. Wnt5a , регулятор PCP [50 ], избыточно экспрессируется в линиях клеток thyroid карциномы и опухолевых тканях [ 51 ]? но теряется в 44% инвазивных ductal carcinomas (IDC) и в 24% invasive lobular carcinomas (ILC ) груди [52 ]. Более того, при IDC, но не ILC, потеря Wnt5a коррелирует с higher grade раком, а также с повторным появлением опухоли.
Эти данные демонстрируют. что функции белков полярности регулируются на многих уровнях. Они амплифицируются или избыточно экспрессируются, делетируются или обнаруживают пониженную экспрессию, обнаруживают альтернативный сплайсинг мРНК или неправильную локализацию белка. Т.о., помимо оценки геномных альтераций и изменений в экспрессии, необходим мониторинг изменений в субклеточной локализации важных компонентов с целью анализа изменений белков полярности при раке.
Cell polarity proteins as regulators of cancer relevant cell biological processes
В этом разделе мы обсудим, как пути полярности могут также регулировать множественные биологические процессы, связанные с инициацией и прогрессированием опухолей (see Figure 2 ), помимо их известной роли в биогенезе клеточных соединений.
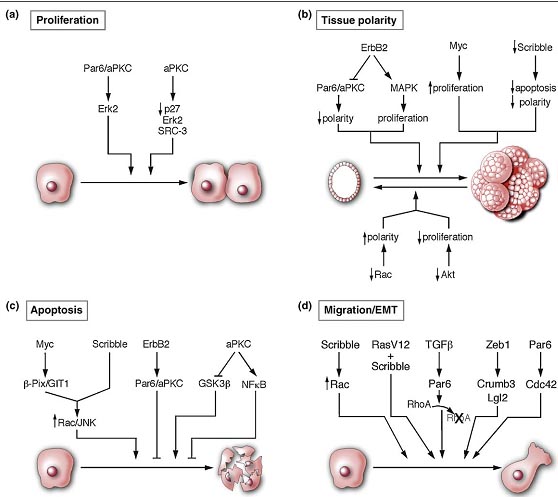 Emerging roles for polarity proteins. (a ) Polarity pathways regulate cell proliferation [27,54,55]. (b) Polarity pathways regulate apoptosis [14,59,62]. (c) Polarity proteins regulate tissue polarity [58,63,64,66,68,77]. (d) Polarity pathways regulate cell migration and EMT [13,71,72,73,75].
Emerging roles for polarity proteins. (a ) Polarity pathways regulate cell proliferation [27,54,55]. (b) Polarity pathways regulate apoptosis [14,59,62]. (c) Polarity proteins regulate tissue polarity [58,63,64,66,68,77]. (d) Polarity pathways regulate cell migration and EMT [13,71,72,73,75].
Proliferation
Увеличиваются доказательства, подтверждающие, что белки полярности могут также функционировать как регуляторы клеточной пролиферации. Qiu et al. установили, что Par6 обеспечивает взаимодействие между Rac1/Cdc4 2 и PKCξ [ 53]. Par6 and PKCξ необходимы для Rac1 и Cdc4 2, но не для Raf, индуцированной трансформации клеток NIH 3T3. Мы показали. что избыточная экспрессия Par6 индуцирует независимую от ростового фактора пролиферацию клеток молочного эпителия человека за счет устойчивой активации Mitogen activated protein kinase (MAPK) независимым от домена aPKC и Cdc42/Racbinding способом [ 27]. Более того, подавление регуляции aPKC в MCF-7 клеточной линии рака груди ингибирует клеточную пролиферацию, демонстрируя, что Par6/ aPKC модуль, скорее всего, является важным регулятором клеточной пролиферации как в не туморогенных, так и происходящих из опухоли эпителиальных клеток молочных желез. Атипические PKCs могут регулировать ход клеточного цикла за счет множественных механизмов: PKCξ необходим для индуцированного эстрогеном ядерного транспорта Erk2 и деградации p27 [ 54 ]. aPKC может также способствовать опухолевому росту путем стабилизации Steroid receptor coactivator 3 (SRC- 3), известного регулятора клеточной пролиферации [55 ]. Фосфорилирование SRC-3 белка с помощью PKCξ стабилизирует белок за счёт ингибирования взаимодействия между SRC-3 и C8 субъединицей 20s протеосом [55 ].
Scribble, Dlg и Lgl? как было показано, регулируют переход G1 - S при скрининге генетических супрессоров новых регуляторов G1- S перехода у дрозофилы [ 56]. Экспрессия PCP гена Prickle1 ингибирует рост клеток гепатоцеллюлярной карциномы, способствуя деградации Dishevelled 3, позитивного регулятора передачи сигналов Wnt [ 47 ]. Однако необходимы дальнейшие исследования, чтобы понять, могут ли белки полярности непосредственно регулировать клеточный цикл.
Apoptosis
Избегание апоптоза является критической ступенью во время прогрессирования рака [ 57 ]. Недавно мы описали новую роль Scribble в качестве регулятора апоптоза в эпителиальных клетках млекопитающих. Как подавление Scribble, так и неправильная локализация Scribble вне межклеточных соединений ингибирует формирование просвета во время трехмерного (3D) морфогенеза эпителиальных клеток молочных желез и во время Myc-индуцированной трансформации и туморогенеза. Т.о., собственно локализация Scribble в межклеточных соединениях является критической для нормального морфогенеза и для устойчивости к Myc-индуцированной трансформации [ 14]. Однако клональный анализ клеток, лишенных Scribble в глазных имагинальных дисках дрозофилы, демонстрирует, что потеря Scribble запускает JNK-зависимую клеточную гибель [ 56]. Хотя эти результаты кажутся противоречащими, они могут быть объяснены различиями в клеточно автономных (in mammalian studies) в противовес неавтономным (Drosophila clonal studie s) эффектам потери Scribble. Эти наблюдения подчеркивают необходимость в лучшем понимании взаимоотношений между Scribble и регуляцией клеточной гибели.
Атипические PKC также регулируют апоптоз в эпителиальных клетках. Мы описали, что Par6/aPKC комплекс необходим для ErbB2-индуцированного подавления клеточной гибели [ 58] в MCF10A клеток. Ингибирование aPKC существенно усиливает апоптоз во время 3D морфогенеза кист из MDCK клеток путём активации GSK3β [ 59]. Атипичная PKC может ингибировать апоптоз путем активации пути NFkB или за счет фосфорилирования и активирования IKKβ kinase или фосфорилирования RelA субъединицы NFkB, чтобы активировать транскрипцию [ 60,61 ]. Атипическая PKC может также действовать ниже др. белка Prostate Apoptosis Response-4 (Par-4, отличного от Partitioning Defective белков, которые регулируют полярность эпителиальных клеток), чтобы регулировать апоптоз [ 62 ]. Par-4 соединяется и ингибирует активность aPKC приводя к низкой активации NFkB. Потеря Par-4 ведет к активации aPKC и усилению экспрессии ингибитора апоптоза , XIAP, мишени NFkB. Т.о., белки полярности являются новым классом регуляторов апоптоза при раке.
Tissue polarity
Изменения в размерах клеток, форме клеток и клеточной организации в 3D пространстве ткани ведут к потере тканевой полярности и, как известно, к появляются очень рано и усиливаются во время прогрессирования карцином. Гомотипические взаимодействия между эпителиальными клетками и гетеротипические взаимодействия между эпителиальными и стромальными типами клеток и взаимодействия с окружающим внеклеточным матриксом могут влиять на способность эпителиальных клеток организовываться в 3D пространстве и приобретать тканевую полярность. Молекулярные механизмы, которые регулируют становление нормальной тканевой полярности, и того. как они нарушаются при раке, только начинают проясняться. Культуральные условия, при которых эпителиальные клетки растут на 3D матриксе, подвергаясь морфогенезу и формируя кисты или ацинусы, являются пригодными платформами для понимания, как эпителиальные клетки приобретают тканевую полярность и как она теряется в карциномах. Некоторые исследования идентифицировали критические роли для клеточных соединений и взаимодействия клетка-матрикс во время 3D морфогенеза эпителиальных структур [6,63,64 ]). Кроме того, белки полярности Crumbs, PATJ, Par3, Par6, aPKC, Cdc4 2 и Scribble , как было продемонстрировано, регулируют нормальный морфогенез эпителия и становление тканевой полярности (for details please see [ 59,65,66]). Точные механизмы, с помощью которых пути клеточной полярности помогают регулировать 3D тканевую организацию и полярность остаются неясными.
Механизмы, с помощью которых cogenic события вызывают нарушение поляризованных, 3D организованных эпителиальных структур, только начинаем понимать. Здесь снова использование эпителиальных клеток, растущих в 3D матриксе, начинает давать новую информацию, которая не очевидна при использовании традиционных клеточных культуральных платформ. Напр., в 3D культуральных условиях нормальный эпителий молочных желез формирует структуры с нормальной тканевой полярностью и контролем роста, тогда как происходящие из опухолей клетки растут как дезорганизованная масса без видимой тканевой полярности и контроля роста [67]. Мы продемонстрировали, что онкоген ErbB2 нуждается во взаимодействии с белками клеточной полярности Par6/aPKC, чтобы нарушить тканевую полярность ацинусов, происходящих из нормального эпителия молочных желез [ 58]. Взаимодействие с Par6/aPKC необходимо для способности ErbB2 разрушать апикально-базальную полярность, но не нужно для ErbB2-индуцируемой клеточной пролиферации [ 58]. Различная роль для полярности и пролиферации также верна, когда она пытается восстановить тканевую полярность в линиях клеток, происходящих из опухолей. Ингибирование как Rac-обеспечиваемой регуляции клеточной полярности, так и Akt-обеспечиваемой клеточной пролиферации необходимо, чтобы заставить клетки, происходящие из рака груди, формировать нормальный ацинус-подобные структуры в 3D матриксе [68]. Всё это демонстрирует, что пути полярности являются критическими регуляторами потери тканевой полярности, наблюдаемой в карциномах. Возможно, что необходим более глубокий анализ механизмов, с помощью которых пути клеточной и тканевой полярности нарушаются при раке и того как они кооперируют с онкогенами, чтобы трансформировать поляризованный эпителий, позволит идентифицировать новые диагностические и терапевтические стратегии.
Cell migration and epithelial -mesenchymal transition
Белки полярности являются регуляторами фронт-тыл полярности мигрирующих клеток. Напр., Par6 необходим для ориентации микротрубочки-организующих центров по отношению к ведущему краю мигрирующих астроцитов [ 69 ]. Некоторые белки полярности, включая Par3, Par6, aPKC, Scribble, Dlg и Lgl. локализуются на ведущем крае мигрирующих клеток и играют критические роли во время направленной миграции (for a detailed review see [ 70]).
Потеря эпителиальных характеристик и приобретение мезенхимных свойств часто ассоциирует с метастатической прогрессией. Миграция/инвазия клеток всегда ассоциирует с драматическими изменениями в архитектуре клеток, указывая тем самым. что белки клеточной полярности скорее всего играют важные роли во время этого процесса. В соответствии с этим мнением генетический скрининг у Drosophila идентифицировал мутации в некоторых белках полярности, включая Scribble, Dlg, Lgl, Baz и Cdc4 2, которые кооперировали с RasV12, чтобы способствовать инвазии и метастазированию [ 71]. Роль, выполняемая белками полярности во время epithelial to mesenchymal transition (EMT) и инвазии эпителия молочных желез начинает выясняться. Белок полярности Par6 играет критическую роль во время TGFβ-индуцированного EMT. TGFβ type II рецептор фосфорилирует Par6, чтобы способствовать сборке белкового комплекса, содержащего Par6, Smurf1 (ubiquitin ligase) и RhoA, для обеспечения локальной деградации RhoA [ 72]. Фосфорилирование Par6 и взаимодействие с Smurf 1 необходимы для TGFβ-индуцированного нарушения плотных соединений и миграции/инвазии NMuMG клеток в культуре и in vivo [ 72,73 ], демонстрируя тем самым критическую роль белка полярности Par6 в метастазировании рака груди.
Транскрипционные регуляторы EMT нарушают белки полярности. В грудных и колоректальных раковых клетках репрессор транскрипции ZEB1 ингибирует экспрессию белков полярности Crumbs, Lgl2 и PATJ, чтобы индуцировать мезенхимные фенотипы [ 74], а повторная экспрессия Lgl2 восстанавливает полярность эпителиальных клеток и ингибирует инвазии и метастазы [ 75] в этих клетках. Помимо рака груди и колона потеря Lgl2 ассоциирует также с EMT в клетках производных меланом, а восстановление Lgl2 восстанавливает полярность эпителиальных клеток и блокирует миграцию клеток [ 76 ]. Эти исследования идентифицировали белки полярности как важные регуляторы процесса EMT в клетках, происходящих из многих органов.
Conclusion and perspective
We have a ttempted t o summarize the changes o f polarity protein observed in human carcinomas. As outlined above, polarity proteins are not only t argets of genetic and epigenetic changes b ut also regulated a t the level of subcellular localization. These ?ndings highlight the need for analyzing subcellular localization, in addition to gene expression changes, when studying polarity proteins in carcinoma. There is an emerging body of evidence implicating polarity proteins as regulators of multiple cell biological properties in addition to cell junction biogenesis. Thus, it is critical t o use appropriate biological context for understanding the consequences of polarity protein alterations in cancer. A better and deeper analysis o f changes i n polarity proteins and the pathways they regulate is likely to identify a new class of biomarkers and drug targets for diagnosing and controlling cancer.
Сайт создан в системе
uCoz Рис. 1
Spatial distribution of polarity regulators in epithelial cells polarized along the apical- basal axis.
Рис. 1
Spatial distribution of polarity regulators in epithelial cells polarized along the apical- basal axis. 

 Emerging roles for polarity proteins. (a ) Polarity pathways regulate cell proliferation [27,54,55]. (b) Polarity pathways regulate apoptosis [14,59,62]. (c) Polarity proteins regulate tissue polarity [58,63,64,66,68,77]. (d) Polarity pathways regulate cell migration and EMT [13,71,72,73,75].
Emerging roles for polarity proteins. (a ) Polarity pathways regulate cell proliferation [27,54,55]. (b) Polarity pathways regulate apoptosis [14,59,62]. (c) Polarity proteins regulate tissue polarity [58,63,64,66,68,77]. (d) Polarity pathways regulate cell migration and EMT [13,71,72,73,75].