Многочисленные исследования демонстрируют, что большинство онтогенетически важных индуцируемых лигандами сигнальных путей регулирует пролиферацию клеток в сетчатке. Напр., Wnt (Kubo et al., 2003; Denayer et al., 2008), BMP (Murali et al., 2005), TGF-beta (Lillien and Cepko. 1992; Anchan and Reh, 1995), Shh (Agathocleous et al., 2007; Wall et al., 2009), FGF (Lillien and Cepko, 1992; McCabe et al., 1999) и Notch (Ohnuma et al., 2002; Wall et al., 2009) пути регулируют пролиферацию клеток предшественников или ретинальных стволовых клеток. Эти пути действуют на всех стадиях в процессе перехода молчащих ретинальных стволовых клеток в высоко пролиферативные ретинобласты и постмитотически детерминированные клетки. Также множество др. внутренних и внешних онтогенетических факторов регулируют клеточный цикл (Cremisi et al., 2003; Ohnuma and Harris, 2003; Martins and Pearson, 2008). Хотя детальные молекулярные механизмы, связанные с регуляцией клеточного цикла ещё не установлены, растут доказательства, указывающие на то, что эта координация является ключом к достижению собственно развития сетчатки.
В последнюю декаду проделано большое количество исследований, внесших вклад в наше знание роли регуляции клеточного цикла в детерминацию судеб ретинальных клеток (Fig. 2, zone 4). Ретинальные нейроны и глиальные клетки образуются последовательно в консервативной последовательности у позвоночных. Ганглиолярные клетки сетчатки являются первым типом клеток, возникающим у всех позвоночных. Амакринные клетки, горизонтальные интернейроны и колбочковые и палочковидные фоторецепторы генерируются затем в последовательности, которая слегка варьирует у разных видов, тогда как биполярные клетки и Мёллерова глия являются последними типами дифференцирующихся клеток. Все дифференцированные нейроны являются постмитотическими, хотя клетки Мёллеровой глии всё ещё сохраняют пролиферативный потенциал (Fischer and Reh, 2003).
Чтобы продуцировать постмитотические нейроны, клетки предшественники д. выйти из клеточного цикла своевременно. Какова роль финального клеточного деления в детерминации судьбы нервных клеток? В 1991, проведено важное исследование Prof. McConnell's на развивающемся неокортексе (McConnell and Kaznowski, 1991). Нейральные предшественники от молодых животных были мечены [
3H] thymidine и затем трансплантированы на разных фазах клеточного цикла более старым животным. Было показано, что трансплантированные клетки в S фазе клеточного цикла оказывались в кортикальном слое 2/3 хозяина вместо слоя 6, который должен был быть их естественной судьбой. Это указывает на то, что трансплантированные клетки получают детерминирующие сигналы о принадлежности о определенному слою во время своего финального клеточного цикла. Важность финального клеточного деления в спецификации судеб клеток продемонстрирована и некоторыми др. находками (see also the following reviews: Cremisi et al., 2003; Ohnuma and Harris, 2003; Malicki, 2004; Baye and Link, 2008; Farkas and Huttner, 2008; Zhong and Chia, 2008).
WHAT ARE THE POTENTIAL MECHANISMS BY WHICH THE LAST CELL DIVISION AFFECTS CELL FATE?
(1) Экспрессия некоторых детерминант судеб ретинальных/нейральных клеток может быть активирована во время финального клеточного цикла, как это описывается в случае Ath5 and Prox1, которые включаются в G2 фазе в ретинальных предшественниках (Dyer et al., 2003; Matter-Sadzinski et al., 2005; Poggi et al., 2005). Также было показано, что стабильность факторов нейральной детерминации тонко регулируется в соответствии с фазой клеточного цикла (Cisneros et al., 2008). (2) Экспрессия детерминантов судеб ретинальных клеток перекрывается с активацией ингибиторов клеточного цикла (таких как CDKIs) и с подавлением активаторов клеточного цикла (таких как cyclins и CDKs) (Ohnuma et al., 2002). (3) Детерминанты клеточных судеб могут подавлять клеточный цикл и тем самым влиять на время последнего клеточного деления. У рыбок данио, Ath5 является важным для детерминации клеток ретинальных ганглиев, первой ступени ретиногенеза клеточных клонов. Интересно, что делеция Ath5 вызывает пропуски времени выхода из клеточного цикла и полностью нарушает образование клеток ганглиев (Kay et al., 2001). В др. случаях избыточная экспрессия пронейральных генов, таких как Xath5, NeuroD и neurogenin, индуцирует арест клеточного цикла и влияет на детерминацию судьбы клеток (Kanekar et al., 1997; Farah et al., 2000; Ochocinska and Hitchcock, 2009). (4) Было продемонстрировано, что форсированная индукция активации клеточного цикла с помощью избыточной экспрессии активаторов клеточного цикла ингибирует детерминацию клеточных судеб, тогда как ингибирование клеточного цикла усиливает детерминацию судеб клеток в ретиногенезе Xenopus и в нейрогенезе мыши (Ohnuma et al., 2002; Calegari and Huttner, 2003). CDKIs играют важную роль в детерминации судеб клеток помимо их активности ингибировать клеточный цикл (Ohnuma et al., 1999; Carruthers et al., 2003; Vernon et al., 2003). Детальные механизмы активности CDKI будут описаны в след. разделах. (5) Недавние исследования продемонстрировали, что динамика interkinetic ядерной миграции (Fig. 3A) и симметрия делений (Fig. 3B) вносят существенный вклад в детерминацию судеб ретинальных/нейральных клеток. В нейроэпителии сетчатки тела клеток делящихся ретинобластов вытянуты от апикальной к базальной стороне. Во время G1, S и G2 фаз клеточного цикла ядра динамически перемещаются в удлиненных телах в apico/basal направлении, движение известно как interkinetic миграция ядра (Fig. 3A). По направлению к M фазе ядра мигрируют на апикальную сторону, делятся и затем перемещаются базально после чего продолжают этот процесс вплоть до их финального клеточного деления. Недавний анализ группы Professor Harris's использовали эту модель, чтобы показать, что за исключением небольшой пропорции апикальное расположение предшествует митозу, интеркинетическая миграция ядра скорее стохастическое событие в сетчатке рыбок данио (Norden et al., 2009). Используя time-lapse съёмку, Baye and Link исследовали взаимоотношения между расположением ядер в интерфазе клеточного цикла и предназначением клеток после последующих делений (Baye and Link, 2007). Они установили, что нейроэпителиальные клетки с более значительными базальными миграциями ядер в финальном клеточном цикле продуцируют постмитотические нейроны, тогда как клетки с более апикальными миграциями скорее всего будут продолжать делиться. Эти наблюдения указывают на то, что во время интеркинетической миграции ядра клетки предшественники по разному экспозируют внешние факторы детерминации, что может влиять на их судьбу. Эта идея в дальнейшем была подтверждена с помощью новых наблюдений на мутантах рыбок данио (Del Bene et al., 2008). Мутация moks309 у рыбок данио вызывает увеличение клеток ретинальных ганглиев за счёт биполярных и Muller глиальных клеток. Эта мутация является nonsense мутацией в гене Dynactin-1, который регулирует перемещения ядра. Del Bene et al. (2008) установили, что ядра мутантных клеток moks309 мигрируют дальше к базальной стороне нейроэпителия, где они накапливаются. Эти ядра в меньшей степени подвергаются активности Notch, которая имеет градиент с высокими значениями на апикальной и низкими на базальной стороне. Поскольку активность Notch, как было установлено, задерживает детерминацию судеб ретинальных клеток (Austin et al., 1995; Dorsky et al., 1997; Ohnuma et al., 2002), то воздействие низких уровней активности Notch повышает вероятность продукции ранних типов клеток, таких как клетки ретинальных ганглиев. В соответствии с этим белок ядерной оболочки, Syne2a, регулирует положение ядра и влияет на детерминацию судеб ретинальных клеток (Tsujikawa et al., 2007). Др. механизм, с помощью которого динамика клеточных делений может оказывать влияние на судьбы клеток, это симметрия делений, т.е. корреляция оси и исхода клеточного деления (Fig. 3B). На апикальной стороне нейроэпителия клетки делятся в основном двумя разными способами. Некоторые клетки делятся при этом их митотическое веретно ориентировано параллельно плоскости нейроэпителия (горизонтальное деление), тогда как др. клетки делятся с веретенами ориентированными перпендикулярно плоскости нейроэпителия (вертикальное деление). Вертикальное деление также называют асимметричным делением, а горизонтальное - симметричным. Если детерминанты клеточных судеб распределены не униформно, тогда асимметричное деление может приводить к индукции двух разных типов клеток. В сетчатке млекопитающих такие вертикальные деления, по-видимому, довольно незначительные по сравнению горизонтальными, хотя соотношение зависит от ст. развития. Однако некоторые клетки делтся с митотическим веретеном, ориентированным под случайными углами к горизонтальной или вертикальной оси. В недавних исследованиях было показано, что такие малые вариации в углах делений могут обеспечивать в значительной степени асимметричное распределение детерминантов (Kosodo et al., 2004). Эта концепция асимметричных делений активно исследовалась у низших организмов, таких как Drosophila melanogastеr и Caenorhabditis elegans (Yu et al., 2006; Siller and Doe, 2009). У позвоночных эта концепция впервые была продемонстрироана Chenn and McConnell (1995) при развитии коры). С помощью наблюдений за живыми организмами они показали, что горизонтальные деления стремятся дать две дочерние клетки, которые остаются нейроэпителиальными клетками в статусе пролиферации, тогда как вертикальные делдения дают дифференцирующиеся клетки. В сетчатке крыс горизонтальное финальное деление имеет тенденцию давать клетки одного и того же типа, тогда как вертикальное деление продуцирует дочерние клетки с разными судьбами (Cayouette and Raff, 2003). В сетчатке рыбок данио верикальные деления отсутствуют. Однако ориентация относительно оси центр-периферия созадает др. систему асимметрии делений (окружностные и радиальные деления) (Das et al., 2003). 3D-time lapse анализ рыбок данио с ath5 промотором, индуцирующим экспрессию GFP, показал, что окружностные деления обнаруживают тенденцию давать асимметричные или разные судьбы, тогда как радиальные деления обнаруживают тенденцию давать симметричные или одинаковые судьбы (Das et al., 2003; Poggi et al., 2005). В нейрогенезе Drosophila идентифицированы многие компоненты асимметричных делений, которые регулируют клеточную полярность(Yu et al., 2006; Siller and Doe, 2009). Также компоненты клеточного цикла, такие как cdc2, как известно, также влияют на тип клеточных делений (Tio et al., 2001; Prokopenko and Chia, 2005). Недавние исследования продемонстрировали, что сходный молекулярный механизм регулирует асимметричные деления в сетчатке позвоночных и клетках нейральных предшественников (Malicki, 2004; Zigman et al., 2005). Напр., Zigman et al. (2005) показали, что нокаут мышей inscuteable ингибирует горизонтальные деления и активирует вертикальные пролиферативные деления в сетчатке (for more information, see recent reviews: Zhong and Chia, 2008: Siller and Doe, 2009). Кроме того некоторые транскрипционные факторы, такие как Emx2 и Pax6, которые регулируют детерминацию клеточных судеб, как было установлено, влияют на клеточную динамику, хотя лежащие в основе этого механизмы неизвестны (Gotz et al., 1998; Hems et al., 2001, 2002; Estivill-Torrus et al., 2002).
Хотя мы описали важность финального клеточного деления в детерминации судеб клеток сетчатки и нейральных клеток, большое количество исследований также показало, что регуляция клеточного цикла в финальном делении не является абсолютным фактором в детерминации клеточной судьбы. В классических экспериментах с использованием сетчатки лягушек Harris and Hartenstein (1991) показали, что фармакологически индуцируемый арест клеточного цикла не предупреждает продукции всех типов клеток сетчатки. Также недавний детальные анализ клеточных клонов в коре показал, что судьбы нейральных клеток в основном внутренне (intrinsically) детерминированы до финального деления (Qian et al., 1998; Shen et al., 2006). Было показано, что у рыбок данио незрелые горизонтальные клетки делятся, чтобы продуцировать больше горизонтальных клеток в физиологических условиях (Godinho et al., 2007). Более того, клетки Muller глии всё ещё сохраняют свой пролиферативный потенциал после ретиногенеза и они могут функционировать как стволовые клетки сетчатки у цыплят (Fischer and Reh, 2003). Более того, некоторые исследования показали, что передача сигналов FGF не обеспечивает координации регуляции клеточного цикла и FGF-обеспечиваемой детерминации клеточных судеб (McCabe et al., 1999; Martinez-Morales et al., 2005). Следовательно, хотя координация финального клеточного цикла не является абсолютно необходимой для детерминации клеточных судеб в сетчатке, abyfmysq клеточный цикл вносит важный вклад с детерминацию собственно судеб клеток сетчатки.
ROLE OF CDKIs IN CELL-CYCLE REGULATION
Как упоминалось выше, детерминанты клеточных судеб регулируют клеточный цикл, тогда как молекулярный аппарат и клеточная динамика клеточного цикла также находятся под влиянием решений по детерминации судеб, указывая на важность двунаправленной координации. Однако детальные молекулярные механизмы координации всё ещё неизвестны. Здесь мы опишем роль CDKIs в координации клеточного цикла и детерминации клеточных судеб в сетчатке. Используя систему эмбриональной сетчатки Xenopus, чтобы выяснить лежащие в основе механизмы детерминации поздних клеток, мы идентифицировали p27Xic1, члена семейства Xenopus Cip/Kip CDKI в качестве координатора клеточного цикла и детерминации клеточных судеб в сетчатке (Ohnuma et al., 1999). Три члена семейства Cip/Kip CDKI идентифицированы у позвоночных (Santamaria and Ortega, 2006; Bes-son et al., 2008). В 1993, первый член, p2lCip1, был идентифицирован в системе млекопитающих 4 независимыми группами, это сопровождалось идентификацией p27Kip1 и p57Kip2. Амфибии также имеют 3-х членов, p27Xic1, p16Xic2 и p17Xic3, но они несколько меньше, чем белки у млекопитающих (Daniels et al., 2004). Как показано на Figure 4A, каждый член семейства CDKI имеет консервативный CDK/cyclin-связывающий домен на своей N-терминальной половине и член-специфическую последовательность на С-терминальной половине (Ohnuma et al., 1999; Daniels et al., 2004). Посредством прямого взаимодействия с CDK/cyclin комплексом CDKIs негативно регулируют клеточную пролиферацию в основном в G1 фазе. Также, p21Cip1 посредством взаимодействия на C-конце с активатором S-фазы, PCNA, ингибирует дальнейший ход S-фазы.
У амфибий, p27Xic1 экспрессируется на наиболее высоком уровне из трех членов CDKI во время ретиногенеза (Daniels et al., 2004). Как ранее было показано, сетчатка амфибий и рыб имеет CMZ, где нейро/глиогенез прогрессирует с периферии к центру в ходе всей жизни животного. Эксперссия p27Xic1 в CMZ совпадает по времени с выходом из клеточного цикла в сетчатке
Xenopus. Избыточная экспрессия p27Xic1 активирует выход из клеточного цикла, тогда как делеция p27Xic1 задерживает выход из клеточного цикла, указывая тем самым, что p27Xic1 является ключевым белком, которые регулирует выход из клеточного цикла в сетчатке. Это подтверждено в исследованиях сетчатки рыбок данио (Kay et al., 2001). В случае сетчатки млекопитающих три CDKIs также экспрессируются (Dyer and Cepko, 2001a; Cunningham et al., 2002) и участвуют в выходе из клеточного цикла. Эти наблюдения согласуются с ролью CDKIs в нейрогенезе неокортекса, в котором p27Kip1 контролирует выход из клеточного цикла в делящемся эпителии желудочков (Tarui etal.,2005).
ROLE OF CDKIs IN CELL FATE DETERMINATION
Наши исследования показали, что избыточная экспрессия p27Xic1 в клетках предшественниках сетчатки драматически увеличивает долю клеток Muller глии за счёт биполярных нейронов, тогда как её подавление уменьшает процент глии (Ohnuma et al., 1999). Глиогенная активность p27Xic1 обеспечивается с помощью его N-терминальной половины, где расположен CDK/cyclin-связывающий домен, но не зависит от активности ингибирования клеточного цикла. И др. исследования показали, что благодаря функциональному взаимодействию с пронейральными генами и путём Notch, p27Xic1 активирует нейрогенез в предшественниках сетчатки и нейронов (Ohnuma et al., 2002; Vernon et al., 2006). Это было подтверждено группами Philpott и Papalopulu, которые установили, что p27Xic1 антисмысловые morpholino полностью ингибируют первичный нейрогенез (Carruthers et al., 2003; Vernon et al., 2003). Нейрогенная активность p27Xic1 также зависит от его N-конца независимо от клеточного цикла. Сходным образом, p57Kip2, CDKI млекопитающих, влияет на спецификацию амакринных нейронов (Dyer and Cepko, 2001c). Эти наблюдения показывают, что CDKIs регулируют как глиогенез, так и нейрогенез контекст-зависимым способом. Дальнейшее подтверждение идеи найдено в предшественниках сетчатки мыши, лишенных Math5, детерминанта ганглиолярных клеток сетчатки, которые усиливали активность p27Kip1 и индуцировали дифференцировку в клетки Muller глии (Le et al., 2006). Сходные детерминирующие активности CDKIs описаны в др. онтогенетических событиях, таких как детерминация судеб мышц и кератиноцитов (Rey-naud et al., 2000; Devgan et al., 2005). Итак, все наблюдения показывают, что CDKIs способны регулировать детерминацию клеточных судеб в сетчатке помимо своей ингибирующей активности клеточного цикла.
Как же CDKIs детерминируют регуляцию клеточного цикла? Исследования группы Philpott's показали. что p27Xic1 активирует первичный нейрогенез у
Xenopus путем стабилизации bHLH транскрипционного фактора, neurogenin (Vernon et al., 2003). В сетчатке избыточная ко-экспрессия
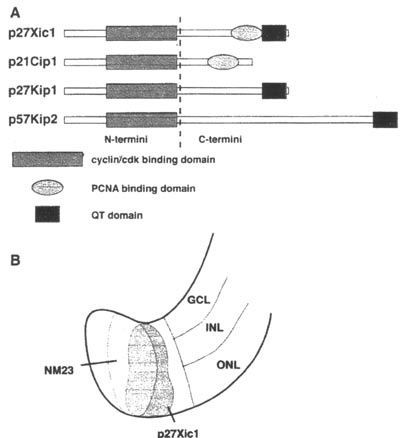 Fig. 4. Structure of CDKIs and expression of CDKI and NM23 in retina. A: The Kip/Cip CDKI family members have a conserved cyclin/CDK-binding domain at the N-termini and homologue-specific sequences at the C-termini. B: In Xenopus CMZ, p27Xic1 is expressed in the cells undergoing cell-fate determination. The expression of NM23-X3 and X4 starts slightly more peripheral than p27Xic1 but overlaps with p27Xic1 at the more central side. This is probably important for inhibition of early cell-cycle exit and early gliogenesis in retinal lineage.
Fig. 4. Structure of CDKIs and expression of CDKI and NM23 in retina. A: The Kip/Cip CDKI family members have a conserved cyclin/CDK-binding domain at the N-termini and homologue-specific sequences at the C-termini. B: In Xenopus CMZ, p27Xic1 is expressed in the cells undergoing cell-fate determination. The expression of NM23-X3 and X4 starts slightly more peripheral than p27Xic1 but overlaps with p27Xic1 at the more central side. This is probably important for inhibition of early cell-cycle exit and early gliogenesis in retinal lineage.
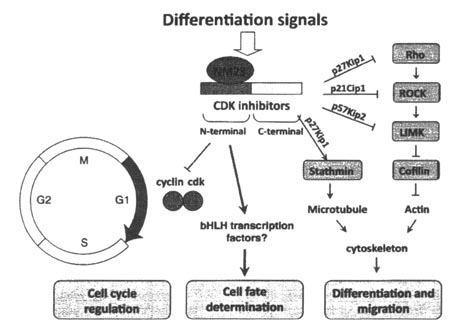 Fig. 5. CDKIs co-ordinate cell-cycle arrest, cell-fate determination, and differentiation in neural development. CDKIs are induced by multiple differentiation factors. CDKIs interact with multiple components and regulate three major activities. They bind CDK/cyclin complexes at their N-termini. Also, the N-termini regulate cell-fate determination. On the other hand, the C-termini bind to cytoskeletal regulators. This interaction influences neural differentiation and migration. NM23 also interacts with CDKIs and is likely to influence these three activities of CDKIs.
Fig. 5. CDKIs co-ordinate cell-cycle arrest, cell-fate determination, and differentiation in neural development. CDKIs are induced by multiple differentiation factors. CDKIs interact with multiple components and regulate three major activities. They bind CDK/cyclin complexes at their N-termini. Also, the N-termini regulate cell-fate determination. On the other hand, the C-termini bind to cytoskeletal regulators. This interaction influences neural differentiation and migration. NM23 also interacts with CDKIs and is likely to influence these three activities of CDKIs.
p27Xic1 c Ath5, др. bHLH белком усиливает детерминацию ганглиолярных клеток сетчатки (Ohnuma et al., 2002). Также в коре, p27Kip1 взаимодействует с Neurogenin-2 (Nguyen et al., 2006) и это взаимодействие, обеспечивающее стабилизацию влияет на нейральную дифференцировку. Более того, p57Kip1 активирует миогенез благодаря непосредственному взаимодействию с MyoD, мышце-специфическим bHLH транскрипционным фактором (Reynaud et al., 2000), тогда как CDKIs непосредственно взаимодействуют с генеральными транскрипционными регуляторами, такми как E2F, cMyc, STAT3 и p300/CBP (Delavaine and La Thangue, 1999; Coqueret and Gascan, 2000; Kitaura et al., 2000; Snowden et al., 2000; Devgan et al., 2005). Эти наблюдения указывают на то, что такое прямое взаимодействие с fate-specific регуляторами транскрипции скорее всего объясняет CDKI-обеспечиваемую детерминацию клеточных судеб в сетчатке.
Хотя исследования, упомянутые выше, указывают на то, что CDKIs могут влиять на детерминацию клеточных судеб независимо от их ингибирующей клеточный цикл активности, CDKIs скорее всего косвенно влияют на детерминацию клеточной судьбы посредством ингибирования CDK активности, поскольку молекулярный аппарат клеточного цикла и клеточной динамики могут влиять не детерминацию клеточных судеб и преимущественно регулируются с помощью активностей CDK и комплексов циклина. Для подтверждения этой идеи Calegari and Huttner (2003) изучали эффект olomoucine, химического ингибитора CDK, на пролиферацию и дифференцировку нейроэпителия телэнцефалона. Они установили, что воздействие olomoucine вызывает преждевременный нейрогенез в ассоциации с ингибированием пролиферации. Кроме того, некоторые компоненты в онтогенетически важных сигнальных путях регулируются с помощью CDK-обеспеиваемого фосфорилирования (Deed et al., 1997; Hara et al., 1997; Zhang et al.. 2000; Barnes et al., 2001; Kim et al., 2004; Baughn et al., 2009), подтверждая, что CDKIs могут регулировать эти процессы путем регуляции активностей CDK.
ROLE OF CDKIs IN NEURAL DIFFERENTIATION AND CELL MIGRATION
Помимо своей детерминирующей судьбы клеток активности, CDKIs, как было установлено, регулируют цитоскелет за счет непосредственного взаимодействия с регуляторами цитоскелета, на их C-терминальных половинах (Besson et al., 2008; Frank and Tsai, 2009). p21Cip1 регулирует динамику актина посредством взаимодействия с Rho kinase/ ROCK (Lee and Helfman, 2004), тогда как p57Kip2 ингибирует LIM kinase за счёт своей непосредственным взаимодействием обеспечиваемой транслокации p57Kip2 в ядро (Yokoo et al., 2003). Also, p27Kip1 соединяется непосредственно с RhoA и регулирует миграцию клеток (Besson et al., 2004; Nguyen et al., 2006). Динамика актина регулируется с помощью пути Rho pathway, в котором ROCK, RhoA и LIM kinase функционируют последовательно (Fig. 5), а взаимодействия CDKIs с компонентами пути Rho потенциируют нейральную дифференцировку и миграцию нервных клеток. Более того, RhoA , как сообщалось, влияет на ротацию веретена во время клеточного деления нейроэпителиальных клеток (Roszko et al., 2006), указывая тем самым, что CDKIs могут вносить вклад в детерминацию клеточных судеб путем регуляции симметричных/асимметричных делений. Более того, p27Kip1 также взаимодействует с Stathmin, регулятором микротрубочек (Baldas-sarre et al., 2005), указывая, что CDKIs регулируют цитоскелет с помощью как микротубулярных, так и актиновых путей. Помимо роли CDKIs в нейральном развитии, миграция раковых клеток регулируется динамикой цитоскелета. В самом деле, была показана роль CDKIs в качестве регуляторов миграции раковых клеток (Besson et al., 2008).
Хотя CDKIs не были распознаны как ингибиторы клеточного цикла, недавние наблюдения, упомянутые выше, заставляют пересмотреть роль CDKIs' . Процесс продукции постмитотических нейронов и глиальных клеток нуждается в аресте клеточного цикла, детерминации клеточной судьбы и дифференцировке. Эти процессы запускаются как с помощью внешних, так и внутренних механизмов и многие внешние факторы, такие как Wnt (Castelo-Branco et al., 2003), shh (Ohta et al.. 2005; Cayuso et al., 2006), TGF-beta (Misumi et al., 2008), BMP (Nakamura et al., 2003), FGF (Li and DiCicco-Bloom, 2004), and Notch (Devgan et al., 2005) , как известно, вызывают арест клеточного цикла путем индукции экспрессии CDKI. Как уже упоминалось, CDKIs обладают более, чем двумя активностями, это детерминация клеточных судеб и дифференцировка. Интересно, что исследования нокаута CDKIs показали, что CDKIs не существенны для хода клеточного цикла. Эти наблюдения чётко демонстрируют ключевую роль CDKIs в качестве координаторов трёх основных онтогенетических процессов ареста клеточного цикла, детерминации клеточной судьбы и дифференцировки/миграции в ответ на их индукцию факторами дифференцировки.
REGULATORY MECHANISMS OF CDKIs' ACTIVITIES ON CELL-CYCLE ARREST, CELL-FATE DETERMINATION, AND DIFFERENTIATION/MIGRATION
CDKIs играют главные роли в регуляции клеточного цикла, детерминации клеточной судьбы и дифференцировке/миграции. При детерминации судеб нейральных/ретинальных клеток CDKIs используют две противоположные активности: активацию нейрогенеза и активацию глиогенеза контекст-зависимым способом. Как CDKIs координируют эти три основные активности и как влияет клеточный контекст на выбор между нейрогенезом и глиогенезом? В сетчатке Xenopus избыточная коэкспрессия p27Xic1 с пронейральными генами, такими как Xath5, активирует нейрогенез, хотя сольная избыточная экспрессия p27Xic1 активирует глиогенез (Ohnuma et al., 1999, 2002). Это наблюдалось также и у мышей (Le et al., 2006), и указывает, что важна доступность факторов нейральной детерминации при определении судеб клеток. Однако мало известно о молекулярном механизме, лежащем в основе CDKI-обеспечиваемой координации этих активностей.
Наш поиск белков, которые взаимодействуют с p27Xic1 выявил NM23-X4 в качестве партнера по связыванию (Mochizuki et al., 2009). NM23-X4 является у Xenopus членом семейства NM23, которое высоко консервативно от микроорганизмов до высших позвоночных. У позвоночнх, семейство состоит из 9-10 членов (Bilitou et al., 2009). Номенклатура этих белков включает NM23 и видовое окончание,так, напр., человеческие ортологи, NM23-H2 (human), а NM23-Z3 (zebrafish). Мы идентифицировали ортологов 8 Xenopus семейства NM23. В ретиногенезе Xenopus retinogenesis NM23-X3 и X4 экспрессируются на высоком уровне на периферии CMZ сетчатки Xenopus и экспрессия перекрывается с p27Xic1 на центральной стороне (Fig. 4B), тогда как др. члены, такие как NM23-X1, экспрессируются неспецифически в CMZ.
Все члены семейства NM23 непосредственно соединяются с N-терминальным регионоа p27Xic1, хотя NM23-X3 и X4 обнаруживают более высокое сродство к CDKIs. Члены семейства NM23 ингибируют p27Xic1-обеспечиваемый глиогенез (и усиливают нейрогенез) благодаря непосредственному взаимодействию белков. Некоторые активности членов семейства NM23, как сообщалось, включают nucleotide diphosphate kinase (NDPK, which converts ADP or GDP to ATP or GTP) и histidine-dependent protein kinase активности (Wagner and Vu, 1995; Hartsough et al., 2002; Snvastava et al., 2006). Чтобы выяснить молекулярные механизмы, получали мутантов по важным остаткам (S150 and HI48) из NM23-X4 для protein kinase и NDP kinase. Интересно, что эти мутанты обнаруживали отсутствие способности ингибировать p27Xic1-обеспечиваемый глиогенез (Mochizuki et al., 2009). Далее, мутационный анализ NM23-X4 и p27Xic1 выявил, что прямое соединение NM23 с N-концами CDKIs абсолютно необходимо для ингибирования активности CDKI's. Эти наблюдения показали, что любая из NM23 киназных активностей важна для их функции, но общее уменьшение уровня ГТФ или АТФ с помощью NDP киназной активности вряд ли является механизмом.
Помимо эффекта на клеточную судьбу, NM23-X4 способен ингибировать p27Xic1-обеспечиваемый арест клеточного цикла при ретиногенезе (Mochizuki et al., 2009). Поскольку NM23-X4-связывающий регион в CDKIs перекрывается с CDK/cyclin-связывающим сайтом на N-концах CDKIs, то ингибирование активности по ингибированию клеточного цикла скорее всего обусловливается конкуренцией связывания NM23 с CDK/cyclin сайтом связывания. Поскольку нейрогенез происходит до глиогенеза в клоне сетчатки, то наше исследование показывает, что NM23-X4 помогает задерживать глиогенез и ингибирует преждевременный глиогенез при последовательной продукции ретинальных нейронов и глиальных клеток путем ингибирования детерминации судеб глиальных клеток и активации клеточного цикла.
Др. аспектом взаимодействия между CDKI и NM23 является супрессия раковых метастазов. Так, NM23-H1 был первоначально идентифицирован как "cancer metastasis suppressor" (Steeg et al., 1988; Rosengard et al., 1989) , а активные исследования продемонстрировали, что NM23-H1 участвует в миграции клеток при многих типах раковых опухолей (Ouatas et al., 2003), однако механизмы этой супрессии до конца не установлены. Поскольку CDKIs, как было установлено, действуют как активаторы миграции клеток, даже раковых (Baldassarre et al., 2005), то возможно, что члены семейства NM23 могут влиять на CDKI-обеспечиваемую. клеточную миграцию путем их взаимодействия с N-терминальными регионами CDKIs.
CLOSING REMARKS
Over the last decade, many molecular mechanisms of the co-ordination of cell cycle with retinal developmental processes have been elucidated. However, many questions still remain. For example, during eyecup formation, retinal precursor cells actively divide. We need to know how cell-cycle down-regulation is correctly timed in these cells in such a way as to form eyes of the correct size. Cellular dynamics such as asymmetric division and interkinetic nuclear migration influence cell-fate determination. We need to know how the undifferentiated cells know whether to continue to divide or to differentiate to postmitotic neurons. CDKIs influence both neural and glial cell-fate determination. We need to know how precursor cells process CDKIs' activity to create two opposite outcomes. Retinal precursor cells produce all retinal neurons and glial cells in a sequential retinal cell lineage. The progression of the retinal lineage is associated with cell division. In fly neurogenesis, cell division has an important role in the progression of neural lineage (Grosskorten-haus et al., 2005). We need to know whether or not cell division is important for the progression of retinal lineage, and if so, what cell-cycle mechanism functions to ensure the proper progression of retinal cell lineage. In the next decade, molecular mechanisms underlying these aspects will be determined to answer these questions.
Сайт создан в системе
uCoz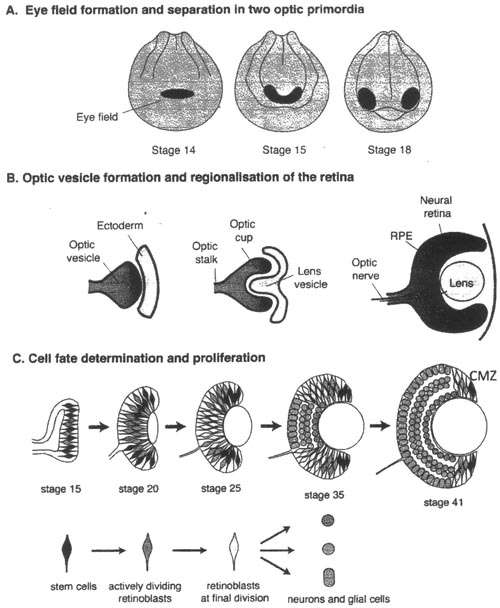 Fig. 1. Retinal development. The three major developmental processes In Xenopus ocular development are shown. A: Eye-field formation and its separation into two optic primordia. B: Optic vesicle formation and ocular specification. C: Cell-fate determination and cell-cycle regulation in retinal histogenesis.
Fig. 1. Retinal development. The three major developmental processes In Xenopus ocular development are shown. A: Eye-field formation and its separation into two optic primordia. B: Optic vesicle formation and ocular specification. C: Cell-fate determination and cell-cycle regulation in retinal histogenesis. 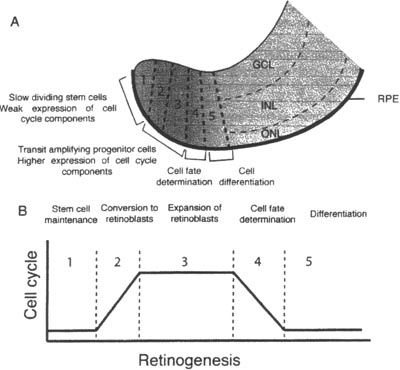 Fig. 2. Structure and cell-cycle progression in CM2. A: Schematic drawing of Xenopus CM2. The CM2 is divided into 5 zones based on cell-cycle activity B: Cell-cycle status in the CM2.
Fig. 2. Structure and cell-cycle progression in CM2. A: Schematic drawing of Xenopus CM2. The CM2 is divided into 5 zones based on cell-cycle activity B: Cell-cycle status in the CM2.
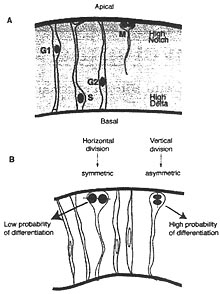 Fig. 3. Dynamics of final cell division influence cell-fate determination. A: Interkinetic nuclear migration. During cell cycle of neural precursor cells, nuclei migrate between apical and basal sides depending on the cell-cycle phase. The position of nuclei during interphase and the duration of interphase can influence their cell fates. B Asymmetric and symmetric divisions. In general, a majority of precursor cells divide by horizontal division, which tends to produce two identical daughter cells that are often still dividing. Thus, it is often called symmetric or proliferative division. During progression of retinogenesis, the ratio of the second type of division, the vertical division increases, producing two distinct cell types. Thus, it is called asymmetric division. Because one daughter cell often differentiates to a neuron, it is also called differentiative division.
Fig. 3. Dynamics of final cell division influence cell-fate determination. A: Interkinetic nuclear migration. During cell cycle of neural precursor cells, nuclei migrate between apical and basal sides depending on the cell-cycle phase. The position of nuclei during interphase and the duration of interphase can influence their cell fates. B Asymmetric and symmetric divisions. In general, a majority of precursor cells divide by horizontal division, which tends to produce two identical daughter cells that are often still dividing. Thus, it is often called symmetric or proliferative division. During progression of retinogenesis, the ratio of the second type of division, the vertical division increases, producing two distinct cell types. Thus, it is called asymmetric division. Because one daughter cell often differentiates to a neuron, it is also called differentiative division.
 Fig. 4. Structure of CDKIs and expression of CDKI and NM23 in retina. A: The Kip/Cip CDKI family members have a conserved cyclin/CDK-binding domain at the N-termini and homologue-specific sequences at the C-termini. B: In Xenopus CMZ, p27Xic1 is expressed in the cells undergoing cell-fate determination. The expression of NM23-X3 and X4 starts slightly more peripheral than p27Xic1 but overlaps with p27Xic1 at the more central side. This is probably important for inhibition of early cell-cycle exit and early gliogenesis in retinal lineage.
Fig. 4. Structure of CDKIs and expression of CDKI and NM23 in retina. A: The Kip/Cip CDKI family members have a conserved cyclin/CDK-binding domain at the N-termini and homologue-specific sequences at the C-termini. B: In Xenopus CMZ, p27Xic1 is expressed in the cells undergoing cell-fate determination. The expression of NM23-X3 and X4 starts slightly more peripheral than p27Xic1 but overlaps with p27Xic1 at the more central side. This is probably important for inhibition of early cell-cycle exit and early gliogenesis in retinal lineage.  Fig. 5. CDKIs co-ordinate cell-cycle arrest, cell-fate determination, and differentiation in neural development. CDKIs are induced by multiple differentiation factors. CDKIs interact with multiple components and regulate three major activities. They bind CDK/cyclin complexes at their N-termini. Also, the N-termini regulate cell-fate determination. On the other hand, the C-termini bind to cytoskeletal regulators. This interaction influences neural differentiation and migration. NM23 also interacts with CDKIs and is likely to influence these three activities of CDKIs.
Fig. 5. CDKIs co-ordinate cell-cycle arrest, cell-fate determination, and differentiation in neural development. CDKIs are induced by multiple differentiation factors. CDKIs interact with multiple components and regulate three major activities. They bind CDK/cyclin complexes at their N-termini. Also, the N-termini regulate cell-fate determination. On the other hand, the C-termini bind to cytoskeletal regulators. This interaction influences neural differentiation and migration. NM23 also interacts with CDKIs and is likely to influence these three activities of CDKIs.