Т.о., прехордальная пластинка и хорда выполняют сходные роли в спецификации медиальной части нервной пластинки и в формировании продольного нейрального паттерна. Однако они также обнаруживают отличающиеся молекулярные свойства, которые могут обеспечивать им специфические индуктивные способности (Placzek et al., 1993), которые вносят вклад в отличающиеся свойства базальной пластинки, покрывающей прехордальную и эпихордальную части. Недавно было продемонстрировано, что epichordal and prechordal basal plates диэнцефалона обладают разными индуктивными свойствами, когда эктопически трансплантируются в талямус или телэнцефалон (Vieira et al. 2006).
Формирование AP паттерна является процессом, который ведет к генерации самостоятельных поперечных доменов в разных позициях оси в ЦНС. Имеются доказательства, что формирование AP паттерна начинается во время ранней гаструляции.
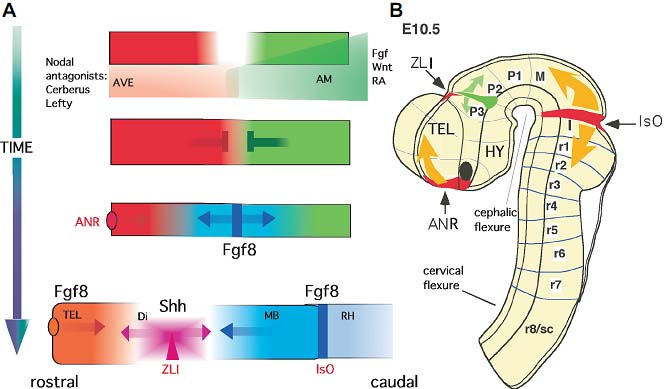
Ранее мы описали, как некоторые эксперименты подтвердили, что вертикальные сигналы от подлежащих тканей (мезодермы и энтодермы) в лежащую поверх дорсальную эктодерму и вообще-то плоскостные (planar) сигналы от организатора (Гензеновского узелка) через плоскость эктодермального эпителия, вносят вклад в спецификацию AP региональных различий (Fig. 1; for review see Doniach 1993; Ruiz i Altaba, 1994). Инициальный AP паттерн индуцируется за счет комбинированного действия двух сигналов, продуцируемых дорсальной мезодермой (rev. Doniach, 1993). Первый сигнал инициирует нейральное развитие и индуцирует нейроэктодерму, которая обладает передней нейральной судьбой (передний и средний мозг). Молекулами кандидатами, которые регулируют этот сигнал, являются Lim1 и Otx2, тогда как кандидатом на роль сигнала является белок Cerberus (see below). Градированный второй сигнал затем постериоризирует нервную пластинку, индуцируя развитие заднего и спинного мозга. Сигналами кандидатами на роль постериоризующего сигнала могут быть ретиноевая кислота (Durston et al., 1989; Papalopulu et al., 1991; Ruiz I Altaba and Jessell, 1991a, b; Blumberg et al., 1997) basic FGF (FGF2; Cox and Hemmati-Brivanlou, 1995; Kelly and Melton, 1995; Lamb and Harland, 1995; Hemmati-Brivanlou and Melton, 1997) и Hox гены. У млекопитающих этот последние гены семейства представлены 39 близко родственными генами для гомеодоменовых транскрипционных факторов, организованных в 4 гомологичных кластера (A, B, C, D) (Pearson et al., 2005). Hox гены имеют четко очерченные границы передней экспрессии, но их задние границы обычно менее ясны и перекрываются с экспрессией более задних Hox генов (Hooiveld et al., 1999).
В дополнение к сигналам, действующим во время гаструляции, некоторые группы, включая Janet Rossant и Siew-Lan Ang, установили, что мезэнтодермальные ткани подлежащие под передней частью нервной пластинки могут регулировать региональные паттерны генной экспрессии (напр., Orthodenticle (Otx2) и Engrailed (En1)) в ростральной части головного мозга (Ang and Rossant, 1993; Ang et al., 1994). Более того, Darnell and Schoenwolf (1997) показали, что регионально ограниченные вертикальные сигналы способны индуцировать нейроэктодерму из нативной ткани и из паттерн-формирующего эпибласта экспрессию некоторых mesencephalic/rhombencephalic маркеров. Недавно мы продемонстрировали необходимость в прехордальной мезодерме для развития нормальной регионализации вентральной части prosencephalon (Garcia-Calero et al., 2008). Один белок, которые может регулировать этот процесс назван Cerberus. Этот секретируемый белок экспрессируется в широком переднем домене, фланкируемом экспрессией Chordin и Lim1 в прехордальной пластинке. Т.о., Cerberus может специфицировать передне-латеральные структуры, такие как передняя аксиальная мезэнтодерма (прехордальная пластинка) и д. таким образом регулировать спецификацию медиальной части в нервной пластинке проэнцефалона. Когда Cerberus эктопически экспрессируется у эмбрионов Xenopus , то он индуцирует почти полностью головные структуры (Bouwmeester et al., 1996). Др. белки, такие как Noggin, Follistatin, Cripto и Chordin также индуцируют передние нейральные ткани, но эти гены могут быть несущественны для формирования AP паттерна (Liguori et al., 2003 and 2009; Lamb et al., 1993; Hemmati-Brivanlou et al., 1994; Lamb and Harland, 1995; for review see Doniach, 1993).
Два гомеодоменовых транскрипционных фактора, Lim1 и Otx2, экспрессируются в тканях, лежащих под передней частью нервной пластинки и, по-видимому, существенные для развития передних структур ЦНС. Мутации потери функции дают эмбрионов мыши с отсутствием переднего и среднего мозга, указывая тем самым, что Lim1 и Otx2 играют роль в формировании раннего AP паттерна (Acampora et al., 1995; Matsuo et al., 1995; Shawlot and Behringer, 1995; Ang et al., 1996). Lim1 экспрессируется в первичной полоске и прехордальной мезодерме. Поскольку экспрессия не выявляется в нервной пластинке, то отсутствие переднего и среднего мозга у Lim1 мутантов является доказательством существенной роли этой мезодермы в развитии передней части ЦНС (Shawlot and Behringer, 1995). Понимание механизмов, лежащих в основе Otx2 фенотипа, более затруднено, из-за динамики паттерна его экспрессии и сложности его молекулярных взаимодействий.
Разнообразные доказательства указывают на то, что AP регионализация может генерировать поперечные блоки нейроэпителия, которые обладают разной компетентностью отвечать на одни и те же индуктивные сигналы (Ericson et al., 1995; Hynes et al., 1995b; Simon et al., 1995; Shimamura and Rubenstein, 1997). Этот феномен четко иллюстрируется с помощью индуктивных реакций на Shh. Shh экспрессируется вдоль всей AP протяженности прехордальной пластинки и хорды. В то время как Shh индуцирует экспрессию некоторых генов (напр., Shh, HNF3β , Nkx2.2) во всех регионах медиальной части нервной пластинки или вентральной части нервной трубки, др. гены индуцируются в определенных интервалах вдоль AP оси. Напр., в то время как Nkx2.1 экспрессируется только в prosencephalic части нервной пластинки, Nkx6.1 экспрессируется в более задних местоположениях (Qiu et al., 1998). Т.о., имеющиеся доказательства указывают на то, что в некоторых случаях программы экспрессии определенных генов в разных позициях AP в медиальной части нервной пластинки обуслволены внутренне присущим различиям в компетентности отвечать на общий сигнал.
Fgf8 является др. примером индуктиного сигнала, который генерирует разные молекулярные реакции на раные аксиальные уровни. Когда Fgf8 воздействует на prosencephalic и mesencephalic домены эксплантов нервной пластинки, то он индуцирует разные гены: впереди он индуцирует FoxG1 (Bf1), тогда как сзади он индуцирует En2
(Shimamura and Rubenstein, 1997).
Regionalization of the rostral brain involves signaling from secondary organizing centers
Регионализация передней части нервной пластинки, по-видимому, является результатом супер-наложения множественных различных паттерн-формирующих механизмов. Формирование AP паттерна создает поперечные зоны, каждая из которых обладает самостоятельной гистогенетической компетентностью, тогда как формирование паттерна вдоль ML оси генерирует продольно расположенные домены. Комбинация формирования ML и AP паттерна затем генерирует решетко-подобную организацию самостоятельных регионов зачатков головного мозга (see Fig. 2). Следовательно, нейральные предшественники в эпителии д. устанавливать свои программы дифференцировки под контролем позиционной информации
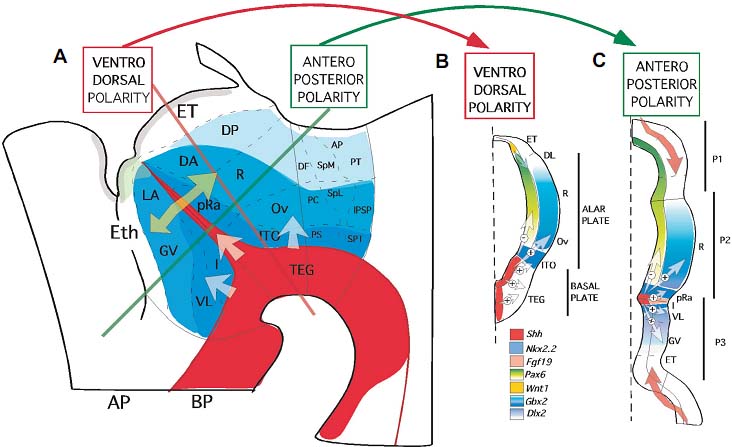 Fig. 4. Shh signal activity and diencephalic regionalization. Schematic representation illustrating the diencephalic regionalization and its relation with thalamic and prethalamic gene markers. Shh morphogenetic activity has a gradient effect in the diencephalic alar plate that could influence ventrodorsal and antero-posterior regionalization. Shh morphogenetic gradient from the basal plate and from the ZLI, represented by graded blue colors, control the expression of diencephalic selector genes (represented by color fields) and is fundamental for the correct specification of the diencephalic regions. The arrows are showing inductive interactions of the morphogenetic signals. Diagrams of transversal (dorso-ventral polarity) and horizontal (antero-posterior polarity) section planes in the diencephalon are represented to the right of the figure. White arrows represent Shh inductive (+) and repressive (-) effects, light blue arrow represent Wnt1 activity from dorsal midline, and light red arrows represent Fgf8 signals from the Isthmus and the anterior neural ridge. Abbreviations: AP, area pretectalis; DA, dorsomedial thalamic complex; DF, dorsofrontal nucleus; DP, dorsolateral thalamic complex; ET, epithalamus; Eth, eminentia thalamica; GV, lateral geniculate nucleus; I, nucleus intercalatus; IPSP, interstitial pretectal-subpretectal nucleus; ITO, interstitial nucleus of the optic tract; LA, anterior lateral nucleus; Ov, nucleus ovoidalis; P1, prosomer 1; P2, prosomer 2; P3, prosomer 3; PC, principal precommissural nucleus; pRA, perirotundic area; PS, superficial precommissural nucleus; PT, principal pretectalis nucleus; R, rotundus nucleus; SpL, lateral spiriformis nucleus; SpM, medial spiriformis nucleus; SPT, subpretectal nucleus; TEG, diencephalic tegmentum; VL, ventrolateralis nucleus.
Fig. 4. Shh signal activity and diencephalic regionalization. Schematic representation illustrating the diencephalic regionalization and its relation with thalamic and prethalamic gene markers. Shh morphogenetic activity has a gradient effect in the diencephalic alar plate that could influence ventrodorsal and antero-posterior regionalization. Shh morphogenetic gradient from the basal plate and from the ZLI, represented by graded blue colors, control the expression of diencephalic selector genes (represented by color fields) and is fundamental for the correct specification of the diencephalic regions. The arrows are showing inductive interactions of the morphogenetic signals. Diagrams of transversal (dorso-ventral polarity) and horizontal (antero-posterior polarity) section planes in the diencephalon are represented to the right of the figure. White arrows represent Shh inductive (+) and repressive (-) effects, light blue arrow represent Wnt1 activity from dorsal midline, and light red arrows represent Fgf8 signals from the Isthmus and the anterior neural ridge. Abbreviations: AP, area pretectalis; DA, dorsomedial thalamic complex; DF, dorsofrontal nucleus; DP, dorsolateral thalamic complex; ET, epithalamus; Eth, eminentia thalamica; GV, lateral geniculate nucleus; I, nucleus intercalatus; IPSP, interstitial pretectal-subpretectal nucleus; ITO, interstitial nucleus of the optic tract; LA, anterior lateral nucleus; Ov, nucleus ovoidalis; P1, prosomer 1; P2, prosomer 2; P3, prosomer 3; PC, principal precommissural nucleus; pRA, perirotundic area; PS, superficial precommissural nucleus; PT, principal pretectalis nucleus; R, rotundus nucleus; SpL, lateral spiriformis nucleus; SpM, medial spiriformis nucleus; SPT, subpretectal nucleus; TEG, diencephalic tegmentum; VL, ventrolateralis nucleus.
(как предопределяется карта Cartesian-типа), передаваемой с помощью молекулярных сигналов.
Характерные нейральные и глиальные качественные особенности приобретаются клетками нейроэпителия посредством прогрессивного ограничения гистогенетического потенциала под влиянием локальных средовых сигналов. Доказательства морфогенетических контролирующих процессов в специфических местах развивающегося зачатка нервной системы привели к концепции вторичных организаторов, которые регулируют качественные особенности и региональную полярность соседних нейроэпителиальных областей (Fig. 3, Ruiz i Altaba, 1998; for review see Martinez, 2001; Echevarria et al., 2003). Т.о., эти организаторы, вторичные по отношению к тем, что оперируют во всем эмбрионе во время гаструляции, обычно развиваются в до этого широко регионализованной нейроэктодерме, учитывая генетические границы (часто там, где клетки, экспрессирующие разные транскрипционные факторы, расположены бок о бок) и их последующие активности предопределяют локальные нейральные характеристики вдоль AP или DV осей, формируя паттерн передней части нервной пластинки и трубки, давая пузыри переднего, среднего и заднего мозга (Meinhardt, 1983; Figdor and Stern, 1993; Wassef and Joyner, 1997; Rubenstein et al., 1998; Joyner et al., 2000).
Три региона в нервной пластинке и трубке идентифицированы как предполагаемые вторичные организаторы (Fig. 3): anterior neural ridge (ANR) на переднем конце нервной пластинки/трубки, zona limitans intrathalamica (ZLI) в середине диэнцефалона и isthmic organizer (IsO) на границе между средним и задним мозгом.
Anterior neural ridge (ANR) Передний вторичный организатор, ANR, впервые был описан Houart et al. (1998) урыбок данио в месте соединения наиболее ростральной части нервной пластинки, зачатком передней commissure и не-нейральной эктодермой. Гены, экспрессируемые этой областью, контролируют др. гены, необходимые для регионализации телэнцефалона (Shimamura and Rubenstein, 1997; Ye et al., 1998). В частности, ген Fgf8 экспрессируется очень рано в клетках ANR т, как было показано, является критическим для спецификации передних областей переднего мозга и телэнцефалона. Экспрессия Fgf8 в ANR необходима для индукции и/или поддержания экспрессии FoxG1 (Bf1), который в свою очередь существенен для пролиферации телэнцефалических предшественников (Xuan et al., 1995; Shimamura and Rubenstein, 1997). Кроме того, имплантация белка Fgf8 в проспективную область телэнцефалона у эмбрионов кур генерирует изменения в паттерне экспрессии генов и соответственно происходит перераспределение телэнцефалических и оптических производных (Crossley et al., 2001). Эктопическая экспрессия Fgf8 в каудальной части телэнцефалона эмбрионов мыши продуцирует удвоение функциональных областей кортекса (Fukuchi-Shimogori and Grove, 2001). Fgf8 регулирует регионализацию прозэнцефалона, по крайней мере частично, путем ингибирования экспрессии Otx2 и Emx2 и кооперации с Bmp4, Wnt и Shh (Fig. 5; Crossley et al., 2001; Garel et al., 1997; Storm et al., 2006). Недавно др. член семейства FGF , такой как Fgf15, оказался экспрессирующимся в ANR. Домен его экспрессии тесно связан с таковым Fgf8 и его экспрессия, по-видимому, индуцируется с помощью белка Fgf8 (Gimeno et al., 2002, 2003).
Др. сигнальный белок, секретируемый вблизи ANR, это Shh. Имеющиеся доказательства указывают на то, что Shh необходим и достаточен для спецификации вентральности во всей нервной системе, включая телэнцефалон (Echelard et al., 1993; Chiang et al., 1996; Hammerschmidt et al., 1997; Wijgerde et al., 2002). Более того, формирование нормального паттерна телэнцефалона зависит от вентральной репрессии функции Gli3 с помощью Shh и наоборот от дорсальной репрессии передачи сигналов Shh с помощью Gli3 (Rallu et al., 2002). Наконец, активность Nkx2.1, гомеодоменового гена, необходимого для развития гипоталямуса и вентральной части переднего мозга (Ericson et al., 1995; Brand et al., 1996) также регулируется с помощью Shh.
Zona limitans intrathalamica (ZLI) Диэнцефалон является регионом головного мозга, который развивается из каудальной части прозэнцефалона. Территория диэнцефалона подразделяется на три сегмента, которые являются поперечными доменами, определенными на базе морфологических и молекулярных критериев. Это, считая от каудального в ростральном направлении, prosomeres 1 -- 3 (Puelles and Rubenstein, 2003; Garcia-Lopez et al. 2004). Alar plate первого диэнцефалического просомера (p1) содержит презумптивную pretectal область. Prosomere 2 alar пластинки развивается в талямус, тогда как p3 alar пластинка разви вается в prethalamus. Граница между p2 и p3 наз. zona limitans intrathalamica (ZLI; reviewed in Martinez and Puelles, 2000). Эта внутриталямическая граница появляется рано в развитии нервной трубки и обладает уникальным паттерном молекулярной экспрессии, который указывает на важную роль этой области как вторичного морфогенетического организатора в гистогенезе диэнцефалона (Kiecker and Lumsden, 2004; for review see: Echevarria et al., 2003).
Клеточные и молекулярные механизмы, которые регулируют позиционирование и спецификацию ZLI могут быть объяснены в терминах взаимодействия между прехордальным и эпихордальным нейроэпителием (Figs. 2 and 3). Это pre-epichordal планарное взаимодействие в алярной пластинке д. создавать условия, которые делают возможной экспрессию Shh в ZLI, и д. активировать морфогенетические свойства этого организатора, специфицирующего в свою очередь компартментализацию и клеточные судьбы различных диэнцефалических просомеров, контролируя специфическую генную экспрессию (Fig. 4; Kobayashi et al., 2002; Vieira et al., 2005). Паттерн экспрессии Shh в ZLI очень динамичен как у эмбрионов мыши, так и кур (Echelard et al., 1993; Shimamura et al., 1995; Fig. 3A in Echevarria et al., 2001). Она начинается, будучи ограниченной diencephalic basal plate и затем распространяется дорсально на базальную часть презумптивного эпителия ZLI, за счет процесса гомогенетической индукции. Важность экспрессии Shh в ZLI подтверждается тем фактом, что мыши, которые несут мутацию Shh, обнаруживают дефекты в раннем развитии с важной редукцией размеров диэнцефалического пузыря (Chiang et al., 1996; Ishibashi and McMahon, 2002).
Клеточные характеристики в диэнцефалоне могут быть под контролем генов. чья экспрессиия регулируется с помощью сигнальных каскадов, активируемых с помощью ZLI-производных морфогенов. В виде гнезда в домене экспрессии Shh ZLI клетки экспрессируют транскрипционный фактор Sim1 (Fan et al., 1999). Как на ростральной, так и каудальной сторонах ZLI, экспрессируются Nkx2.2 и Fgf15 (Fig. 4B and C; Price et al., 1992; Shimamura et al., 1995; Gimeno et al., 2002). Транскрипционный фактор Gbx2 экспрессируется каудальнее ZLI и служит в качестве маркера для талямуса (Martinez-de-la-Torre et al., 2002). Dlx2 и Nkx2.1 экспрессируются в alar и basal plate, соотв., непосредственно ростральнее ZLI (Gonzalez et al., 2002). Также дорсальный конец экспрессии Shh в ZLI фланкируется каудально с помощью Wnt1 (McMahon and Bradley, 1990; Thomas and Capecchi, 1990) и рострально с помощью Fgf8 (Crossley and Martin, 1995; Marti et al., 1995; Crossley et al., 1996).
Недавние экспериментальные данные, полученные нами, показали, что Shh сигнал как от ZLI, так и basal plate играет важную роль в формировании молекулярного паттерна alar пластинки диэнцефалона (Fig. 4A; Vieira et al., 2006). Сигналы от basal plate могут играть инициирующую роль в спецификации продольных территорий в талямической области (формирование вентро-дорсального паттерна; Fig. 4B), тогда как развитие задней части ZLI предоставляет дополнительный источник морфогенетических сигналов, которые накладываются на сигналы передне-задней информации в талямическом эпителии (Fiure 4C). Комбинаторные эффекты этих двух типов информации могут вносить вклад в сложность талямической молекулярной регионализации и как следствие усложнять анатомию.
The Isthmic organizer (IsO) IsO расположен в месте перехода средний-задний мозг и контролирует регионализацию среднего мозга и передней части заднего мозга (Fig. 3 and 5; Martinez and Alvarado-Mallart, 1989; for review see Martinez, 2001; Echevarria et al., 2003; Hidalgo-Sanchez et al., 2005; Aroca and Puelles 2005, Partanen 2007). Многочисленные экспериментальные исследования продемонстрировали морфогенетические свойства этой области и её роль в спецификации и нормальном развитии мозжечка, перешейка и мезэнцефалических территорий. Истмический организатор является критическим для развития соседних регионов (Martinez and Alvarado-Mallart, 1990; Alvarado-Mallart, 1993; Marin and Puelles, 1994), если он трансплантируется эктопически в ростральные регионы нервной трубки (Marin and Puelles, 1994; Martinez et al., 1991; Martinez et al., 1995).
Анализ экспрессии
Fgf8 в области перехода средний-задний мозг позволил отследить развитие IsO, которое происходит на границе
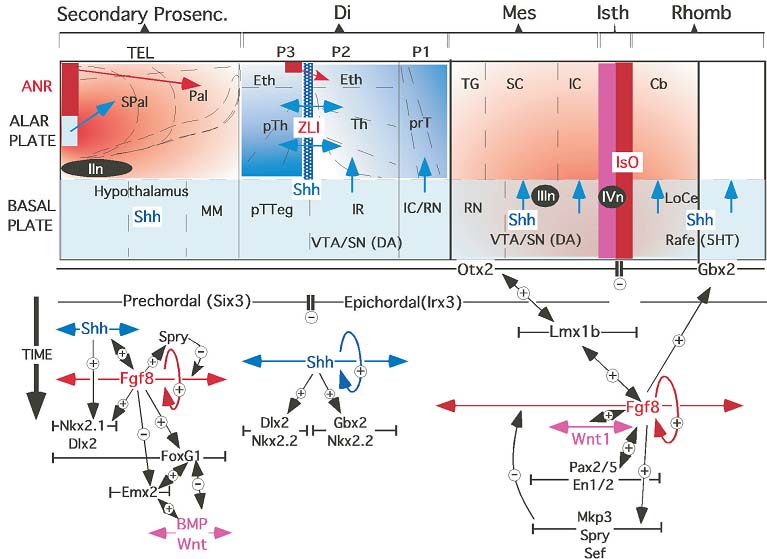 Fig. 5. Molecular pathways controlling brain regionalization. A schematic diagram showing the neural territories influenced by the morphogenetic activity of secondary organizers (ANR, left; ZLI, middle and IsO, right; anterior is to the right). The molecular pathways regulating organizer specification are also shown, together with specific local activity associated with the gradient of the signaling molecules (color gradients). Genetic patterns are represented by their respective symbols inside a lineal sector. This sector ends in a vertical line when the gene is a transcription factor or in an arrowhead when the gene encodes a secreted molecule (signaling molecule). Gene interactions are represented by arrows showing the direction of the interaction and inductive (+) or repressive (-) effects. Abbreviations: ANR, anterior neural ridge; Cb, cerebellum; DI, diencephalon; Eth, eminentia thalami; IC, inferior colliculus; IC/RN, Interstitial of Cajal and parvocellular-red nuclei; IR, interstitial rostral nucleus; Is, isthmus; IsO, isthmic organizer; LCe, locus coeruleus; MES, mesencephalon (midbrain); MM, mammillary region; Pal, pallium; pT, prethalamus; pTTeg, prethalamic tegmentum; rafe, rafe nuclei (5HT, serotoninergic cells); RHOMB, rhombencephalon; RN, magnocellular-red nucleus; SC, superior colliculus; Sec. PROS, secondary prosencephalon; SPal, subpallium; T, thalamus; TEL, telencephalon; TG, tectal grey nucleus; VTA/SN, ventral tegmental area/substantia nigra (DA, dopaminergic cells); ZLI, zona limitans intrathalamica; IIIn, 3rd oculomotor nucleus; IVn, 4th trochlear nucleus.
Fig. 5. Molecular pathways controlling brain regionalization. A schematic diagram showing the neural territories influenced by the morphogenetic activity of secondary organizers (ANR, left; ZLI, middle and IsO, right; anterior is to the right). The molecular pathways regulating organizer specification are also shown, together with specific local activity associated with the gradient of the signaling molecules (color gradients). Genetic patterns are represented by their respective symbols inside a lineal sector. This sector ends in a vertical line when the gene is a transcription factor or in an arrowhead when the gene encodes a secreted molecule (signaling molecule). Gene interactions are represented by arrows showing the direction of the interaction and inductive (+) or repressive (-) effects. Abbreviations: ANR, anterior neural ridge; Cb, cerebellum; DI, diencephalon; Eth, eminentia thalami; IC, inferior colliculus; IC/RN, Interstitial of Cajal and parvocellular-red nuclei; IR, interstitial rostral nucleus; Is, isthmus; IsO, isthmic organizer; LCe, locus coeruleus; MES, mesencephalon (midbrain); MM, mammillary region; Pal, pallium; pT, prethalamus; pTTeg, prethalamic tegmentum; rafe, rafe nuclei (5HT, serotoninergic cells); RHOMB, rhombencephalon; RN, magnocellular-red nucleus; SC, superior colliculus; Sec. PROS, secondary prosencephalon; SPal, subpallium; T, thalamus; TEL, telencephalon; TG, tectal grey nucleus; VTA/SN, ventral tegmental area/substantia nigra (DA, dopaminergic cells); ZLI, zona limitans intrathalamica; IIIn, 3rd oculomotor nucleus; IVn, 4th trochlear nucleus.
доменов экспрессии
Otx2 и Gbx2 (Broccoli et al., 1999; Millet et al., 1999; Katahira et al., 2000; Garda et al., 2001; Li and Joyner, 2001; Martinez-Barbera et al., 2001). На ранних нейральных стадиях,
Otx2 и Gbx2 в течение короткого периода времени ко-экспрессируются в домене на их соотв. интерфейсах экспрессии, обнаруживая или внутриклеточное или межклеточное (Fig. 3; Prochiantz, 1999) молекулярное репрессивное взаимодействие.
Otx2 быстро подавляется, будучи ограниченным задней частью мезэнцефалона,тогда как экспрессия
Gbx2 ограничивается перешейком и ромбэнцефалоном (Millet et al., 1999; Garda et al., 2001). Истмический организатор развивается точно на границе между доменами экспрессии
Otx2 и Gbx2, указывая, что это клеточное взаимодействие на границе экспрессии может быть важным для для спецификации или стабилизации позиции организатора. Потеря функции Gbx2 (Wassarman et al., 1997; Broccoli et al., 1999) или редукция Otx2 (Acampora et al., 1997; Millet et al., 1999) у мышей приводит к фенотипу с преобразованным паттерном в областях среднего-заднего мозга.
Между каудальной и ростральной границами Otx2 и Gbx2, соотв., индуцируется экспрессия Fgf8 (Fig. 3 and 5). Этот нейроэпителиальный регион также динамически экспрессирует Lmxb1, который необходим для экспрессии Fgf8 и, следовательно, для развития истмического организатора (Guo et al., 2007). Более того, приблизительно в конце гаструляции, Pax2, Pax5, En1 и Wnt1 экспрессируются в поперечном домене, который совпадает с областью контакта между Otx2 и Gbx2, и, следовательно, с IsO, но с доменом более широким, чем домен Fgf8 (Fig. 5; Davis and Joyner, 1988; Bally-Cuif et al., 1999; Joyner, 1996; Urbanek et al., 1997; Funashashi et al., 1999; Hidalgo-Sanchez et al., 2000; Rowitch et al., 1999; Hidalgo-Sanchez and Alvarado-Mallart, 2002).
Морфогенетическая активность истмической нейроэпителиальной области впервые была предположена в результате экспериментов с потерей функции, сконцентрированных на гене Wnt1 (McMahon and Bradley, 1990; Thomas and Capecchi, 1990) и было экспериментально продемонстрировано с использованием трансплантаций перепел-курица истмического нейроэпителия в передние мезэнцефалические и диэнцефалические регионы (Martinez et al., 1991). Fgf8, как было установлено позднее, является сигнальной молекулой, ассоциированной истмической активностью (Crossley et al., 1996). Эктопически белок Fgf8 может индуцировать характеристики и структурные альтерации IsO в каудальных просомерах диэнцефалона (p1-p2), среднем и заднем мозге (Fig. 5; Crossley et al., 1996; Martinez et al., 1999; Irving and Mason, 2000).
Экспериментальные манипуляции с этими генами, экспрессирующимися в IsO, продемонстрировали, что как присутствие их белковых продуктов, так и их обычных комбинированных паттернов экспрессии необходимо для нормального морфогенетического процесса. Мутантные мыши, лишенные Wnt1, Pax2, En1, Gbx2 или Fgf8 не дают isthmocerebellar структур (McMahon and Bradley, 1990; Millen et al., 1994; Wurst et al., 1994; Urbaneck et al., 1997; Wassarman et al., 1997; Meyers et al., 1998). Кроме того, эксперименты с участием мутаций En1/2 (Liu and Joyner, 2001), Pax2/5 (Joyner, 1996; Urbanek et al., 1997), Otx1/2 (Matsuo et al., 1995; Suda et al., 1996; Acampora et al., 1997) и гипоморфоного аллеля гена Fgf8 (Meyers et al., 1998; Chi et al., 2003), показали, что наблюдаемые анатомические уродства у этих моделей обусловлены неправильной спецификацией IsO.
Shh signaling pathway С момента их выделения в начале 1990's (Lee et al., 1992;
Echelard et al., 1993; Tashiro et al., 1993) члены семейства Hedgehog межклеточных сигнальных белков были отнесены к ключевым медиаторам большинства фундаментальных процессов в эмбриональном развитии. Их активность является центральной для роста, формирования паттерна и морфогенеза множества различных регионов в плане тела позвоночных и насекомых. Sonic Hedgehog (Shh) хорошо известен как молекула, ответственная за индукцию и поддержание структур вентральной части нервной трубки. Недавние данные показали, что популяции вентральных нейронов реагируют по-разному на количества морфогена, не только в спинном мозге, но и также в более ростральных частях головного мозга, в частности при развитии различных мезэнцефалических базальных ядер в отсутствие Shh (Perez-Balaguer et al. 2009).
Shh протеолитически расщепляется, чтобы дать два секреторных белка, в 19 kDa N-терминальный белок (N-Shh), который обеспечивает все сигнальные активности у позвоночных и беспозвоночных (rev. Hammerschmidt et al., 1996, 1997) и в 25 kDa C-терминальный белок (C-Shh), который обладает протеазной активностью (Porter et al., 1995; Porter et al., 1996). N-Shh далее модифицируется за счет добавления половинки cholesterol к C-терминальной аминокислоте и palmitoyl группы к N-концу преобразованного N-Shh (Chamoun et al., 2001).
На клеточной поверхности Shh соединяется с высоким сродством с patched (Ptc), 12-трансмембранным белком. Соединение Shh с Ptc предупреждает нормальное ингибирование smoothened (Smo), 7-трансмембранного белка (Alcedo et al., 1996; Van den Heuvel and Ingham, 1996; Hammerschmidt and McMahon, 1998; Hynes et al., 2000). Дальнейшие регуляторы пути, которые действуют на поверхности клеток, и отвечают на Shh, были также идентифицированы в ЦНС позвоночных. Hedgehog-interacting protein (Hip) является type I трансмембранным белком. который ослабляет передачу сигналов Shh благодаря связыванию N-Shh со сродством сходным с таковым для Ptc1 (Chuang and McMahon, 1999), тогда как vitronectin, внеклеточный гликопротеин матрикса усиливает активность Shh во время дифференцировки двигательных нейронов также за счет непосредственного связывания Shh (Pons and Marti, 2000).
Внутри ядра чувствительных клеток zinc-finger транскрипционные факторы семейства Ci/Gli действуют на последней из известных ступеней пути передачи сигналов Shh (Hynes et al., 1997; Ruiz i Altaba, 1998). Регион специфический комбинаторный эффект активации Gli2 и репрессии Gli3 с помощью Shh в разных областях нервной трубки детерминирует региональную активность сигнала Shh для формирования паттерна и роста нервов (Blaess et al., 2006; Zervas et al. 2004).
FGF signaling pathway Мы уже упоминали, что на ранних стадиях развития Fgf8 необходим для поддержания экспрессии генов, которые играют роль в формировании паттерна нервной трубки. Более того, он важен для клеточной жизнеспособности, как показывают находки, что инакивация Fgf8 в ранней нервной пластинке вызывает обширную клеточную гибель по всему мезэнйефалону и ростральной части заднего мозга, приводя к полной делеции среднего мозга и моздеяка, Интересно, что если экспрессия Fgf8 слегка редуцирована, чем элиминирована, то наиболее ростральная часть среднего мозга сохраняется, по-видимому, нормальня, тогда как оставшаяся дорсальная часть среднего мозга, перешеек и мозжечок отсутствуют (Chi et al., 2003; Partanen, 2007). Это указывает на то, что существуют регионалные различия в чувствительности к передаче сигналов FGF в мезэнцефалоне и/или ромбэнцефалоне.
Передача сигналов FGF обеспечивается посредством рецепторных tyrosinekinases(RTKs). Эти трансмембранные FGF receptors (FGFRs) активируют сигнальные каскады, включая phosphatidylinositol3 kinase (PI3K) и Ras-ERK pathways (MAPK) (rev. Martin, 1998; Niehrs and Meinhardt, 2002; Tsang and Dawid, 2004). Экспрессия молекул, таких как Mkp3/Sef и тех, что относятся к семейству sprouty (Spry), индуцируется с помощью экспрессии Fgf8 в организаторах (Fig. 5) и может детерминировать пространственное снижение активности Fgf8 градиентным способом благодаря взаимодействию с внутриклеточным механизмом MAP kinase каскада (Furthauer et al., 2002; Tsang and Dawid, 2004; Echevarria et al., 2005a; Vieira et al., 2005; for review see Echevarria et al., 2005b). В частности, негативный модулятор обратной связи передачи сигналов Fgf8, Mkp3, избирательно инактивирует ERK1/2 класс MAP киназ посредством дефосфорилирования, приводя к каталитической инактивации. Он, т.о., предупреждает транслокацию в ядро, приводя к ингибированию ERK1/2-зависимой транскрипции (Camps et al., 1998; Groom et al., 1996; Muda et al., 1996).
Т.о., FGFs активируют сигналы от областей организаторов и обусловливают градиент-подобное распределение во внеклеточном компартменте. Этот градиент, действуя посредством FGF рецепторов, активирует пути внутриклеточной трансдукции, которые необходимы для клеточно автономного контроля экспрессии Fgf8 и для активации экспрессии множественных генов, необходимых для разнообразных онтогенетических процессов, включая решения о клеточной судьбе, детерминацию аксиальной полярности и обеспечеие клеточной жизнеспособности.
Морфогенетическая активность IsO является следствием специфических молекулярных паттернов экспрессии, которые регулируют дифференциальную спецификацию нейроэпителиальных территорий. Снижение концентрационного градиента Fgf8 в alar пластинке является фундаментальным для клеточной жизнеспособности и дифференциального развития мозжечка, перешейка и мезэнцефалических регионов (Basson et al., 2008; Chi et al., 2003; Nakamura et al., 2005). В basal plate, концентрационные градиенты Fgf8 являются ключевыми игроками в клеточной жизнеспособности и вместе с Shh, регулируют каудальные serotoninergic и ростральные dopaminergic судьбы клеточных предшественников (Fig. 5), а также локализацию и развитие др. базальных производных, таких как noradrenergic клетки в locus coeruleus (в ромбэнцефалоне) и красное ядро (в tegmentum мезэнцефалона) (Chi et al., 2003; Puelles and Rubenstein, 2003,2004; Prakash et al., 2006; Prakash and Wurst, 2006). Наконец, мезэнцефалический и диэнцефалический эпителий чувствителен к сигналам Fgf8 (Martinez et al., 1991 and 1999; Crossley et al., 1996), которые могут регулировать генную экспрессию и нейроэпителиальную полярность в alar пластинке этих территорий (Vieira et al., 2006).
Conclusion
The overall organization of the vertebrate CNS is largely due to set down by the concerted action of morphogenetic signals acting during the early gastrula stage of embryonic development. Primary neural induction and fundamental antero-posterior or dorso-ventral regionalization of the early neural tube is due to the activity of the “primary organizer”. Slightly later in development, local signaling centers in the neuroepithelium, known as “secondary organizers”, refine the antero-posterior specification of the three main domains in the brain primordium: forebrain, midbrain and hindbrain. Additionally, the morphogenetic activity of these secondary organizers controls the polarity and the generation of neural sub-regions inside these main regions. Morphogenetic organizers developed in specific domains of the neuroepithelium as a consequence of interactions between two differently pre-specified zones. They confer positional identity by secreting a graded concentration of signal, which triggers concentration-specific genetic cascades. The fact that Gbx2 and Otx2, as well as prechordal and epichordal genes are expressed prior to Fgf8 and Shh in the Isthmic and ZLI organizers, respectively, would support this postulate.
Сайт создан в системе
uCoz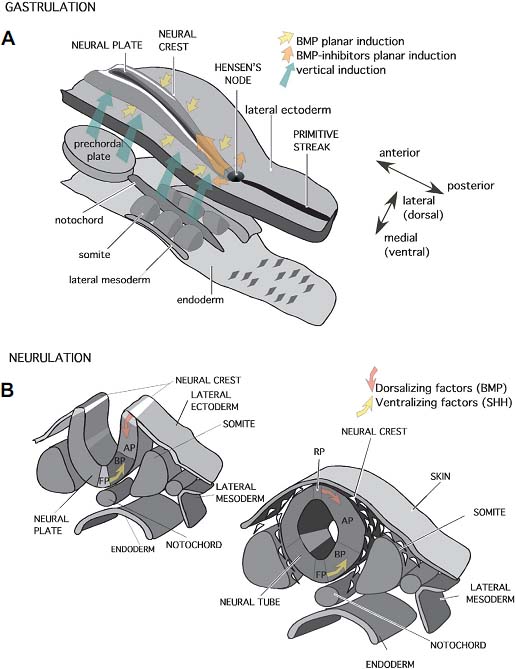 Fig. 1. The neurulation process. (A) At neural plate stage, vertical induction (green arrows) from the underlying axial mesendoderm (notochord and prechordal plate), together with planar induction from Hensen's node (orange arrows) and ectoderm (yellow arrows) regulate dorsoventral polarity and the initial steps of antero-posterior regionalization in the neuroepithelium. (B) During neurulation, neural folds close at the dorsal midline. Neural crests cells delaminate and migrate from the neural folds before closure and the neural grove become the lumen of the neural tube. Planar information from the ventral midline (floor plate; FP; yellow arrow) and dorsal midline (roof plate; RP; red arrow) plays a fundamental role in the establishment of definitive dorsoventral regionalization, using sonic hedgehog (SHH) and bone morphogenetic proteins (BMP) as signaling molecules. As a consequence of these inductive events, the lateral wall of the neural tube is subdivided into two columnar domains: the basal plate (close to the floor plate) and the alar plate (close to the roof plate). AP, alar plate; BP, basal plate.
Fig. 1. The neurulation process. (A) At neural plate stage, vertical induction (green arrows) from the underlying axial mesendoderm (notochord and prechordal plate), together with planar induction from Hensen's node (orange arrows) and ectoderm (yellow arrows) regulate dorsoventral polarity and the initial steps of antero-posterior regionalization in the neuroepithelium. (B) During neurulation, neural folds close at the dorsal midline. Neural crests cells delaminate and migrate from the neural folds before closure and the neural grove become the lumen of the neural tube. Planar information from the ventral midline (floor plate; FP; yellow arrow) and dorsal midline (roof plate; RP; red arrow) plays a fundamental role in the establishment of definitive dorsoventral regionalization, using sonic hedgehog (SHH) and bone morphogenetic proteins (BMP) as signaling molecules. As a consequence of these inductive events, the lateral wall of the neural tube is subdivided into two columnar domains: the basal plate (close to the floor plate) and the alar plate (close to the roof plate). AP, alar plate; BP, basal plate.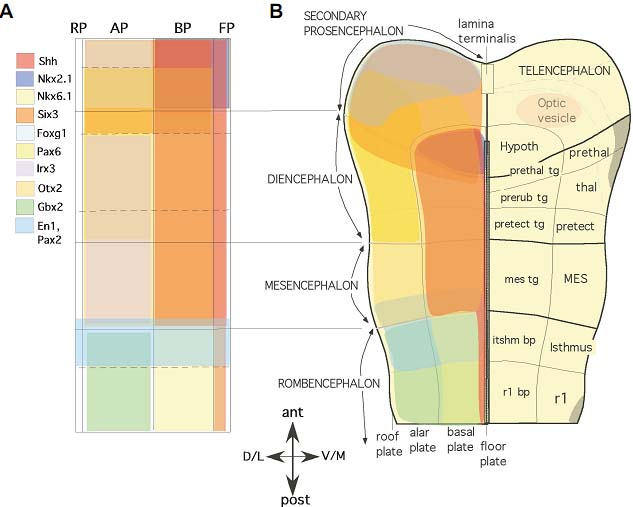 Fig. 2. Molecular regionalization of the neural plate. Schematic (A) and realistic (B) representations of gene expression domains at the neural plate stage. Different colors represent different genes (gene symbol and color codes are identified in the schematic diagram). Medio-lateral (dorso-ventral) and anteroposterior (rostro-caudal) regionalization are identifiable by the limits between expression domains. The presumptive epithelia of different brain regions have been identified, as well as the presumptive localization of the secondary organizers, in relation to precise boundaries between gene expression domains. Secondary organizers: ANR: anterior neural ridge; ZLI: zona limitans intrathalamica; IsO: isthmic organizer. Longitudinal domains: RP, roof plate; AP, alar plate: BP (bp), basal plate; FP, floor plate. Abbreviations: Hypoth, hypothalamus; prethal, prethalamus tg; thal, thalamus; prerub, prerubral; pretect, pretectum; MES, mesencephalon; mes tg, mesencephalic tegmentum; r1, rhombomere 1.
Fig. 2. Molecular regionalization of the neural plate. Schematic (A) and realistic (B) representations of gene expression domains at the neural plate stage. Different colors represent different genes (gene symbol and color codes are identified in the schematic diagram). Medio-lateral (dorso-ventral) and anteroposterior (rostro-caudal) regionalization are identifiable by the limits between expression domains. The presumptive epithelia of different brain regions have been identified, as well as the presumptive localization of the secondary organizers, in relation to precise boundaries between gene expression domains. Secondary organizers: ANR: anterior neural ridge; ZLI: zona limitans intrathalamica; IsO: isthmic organizer. Longitudinal domains: RP, roof plate; AP, alar plate: BP (bp), basal plate; FP, floor plate. Abbreviations: Hypoth, hypothalamus; prethal, prethalamus tg; thal, thalamus; prerub, prerubral; pretect, pretectum; MES, mesencephalon; mes tg, mesencephalic tegmentum; r1, rhombomere 1.