Нейруляция это процесс, ведущий к формированию нервной трубки (NT) у позвоночных, осуществляется с помощью двух пространственно и во времени разделенных процессов у эмбрионов амниот. В передней части тела, которая соответствует цефалическому и шейно-торакальному региону, нейруляция использует изгибание нервной пластинки, утолщенный эпителий которой быстро образует жёлоб, превращающийся в трубку за счет дорсального слияния его боковых краёв. Этот процесс, наз. первичной нейруляцией, он заканчивается приблизительно на ст. 15 сомитов (стадия 12 of Hamburger and Hamilton (1951) (HH12)) на проспективном уровне 27-й пары сомитов, где располагается задний нейропор эмбрионов кур (Schoenwolf, 1979). Напротив, вторичная нейруляция происходит на уровне презумптивной пояснично-копчиковой каудальной области, при этом образование NT происходит за счет кавитации клеток сплошного медуллярного тяжа (Schoenwolf and Delongo, 1980; Catala et al., 1995). Эксперименты по картированию судеб и трансплантациям показали, что несмотря на морфологические отличия, которые отличают эти два способа нейруляции, используется один и тот же механизм с использованием процесса элонгации нервной трубки (Catala et al., 1995; Catala et al., 1996; Wilson and Beddington, 1996; Charrier et al., 2005).
У эмбрионов птиц neural crest (NC), возникающий на цефалическом уровне дает мезэктодермальные производные (такие как скелет лица и свода черепа, дермис головы и шеи, соединителные ткани и сухожилия лица, глазные мышцы и менингеальные оболочки переднего мозга). Он также продуцирует нейральные и глиальные производные, которые дают цефалическую периферическую (сенсорную и парасимпатическую) нервную систему и меланоциты. Напротив на уровне туловища птичьи NCC не дают мезэктодермальных производных, но генерируют Шванновские клетки и нейроны периферической нервной системы (сенсорные, симпатические и парасимпатические), медуллярные клетки надпочечников и меланоциты (see Le Douarin and Kalcheim, 1999 for a review). При первичной нейруляции, зачаток NC соответствует границе между нейральной и не-нейральной эктодермой и затем когда нервные складки сливаются, он оказывается локализованным в дорсальном аспекте нервной трубки (NT). Будучи специфицированными с помощью самостоятельных программ генной экспрессии, эти клетки подвергаются epithelium-to-mesenchyme transition (EMT), отделяются от нейроэпителия и мигрируют на периферию, где они дифференцируются (see Kalcheim and BurstynCohen, 2005 for a review). Как следствие их собственного способа образования дорсальный регион вторичной NT возникает не в результате слияния нервных складок, но он также дает NCC, продуцирующие те же самые типы клеток, что и аналоки из более ростральных частей туловища (Schoenwolf et al., 1985; Catala et al., 1995; Catala et al., 2000).
В последнее время достигнут существенный прогресс в идентификации молекул и механизмов, участвующих на разных ступенях формирования первичного NC. Однако генерация NCC из вторичного NT менее исследована и отсутствуют молекулярные данные, касающиеся некоторых аспектов этих клеток. Это побудило нас на уровне вторичной нейруляции исследовать экспрессию большого набора молекул, действующих на разных этапах генеза NC. Исследование проводилось на эмбрионах кур HH18 - HH20, на 3-й день эмбрионального развития (E3). Морфогенез и рост каудальной части тела возникает в результате развития хвостовой почки, области, расположенной каудальнее заднего нейропора (Schoenwolf, 1979; Catala et al., 1995). Мы сконцентрировались на анализе наиболее недавно организованной области этих эмбрионов, на уровне будущих сомитов 30 - 43, а именно, на несегментированной области, позднее дающей эпителиальные сомиты и early dissociating somites (EDS), в которой можно отследить последовательные стадии созревания NC вдоль ростро-каудальной оси.
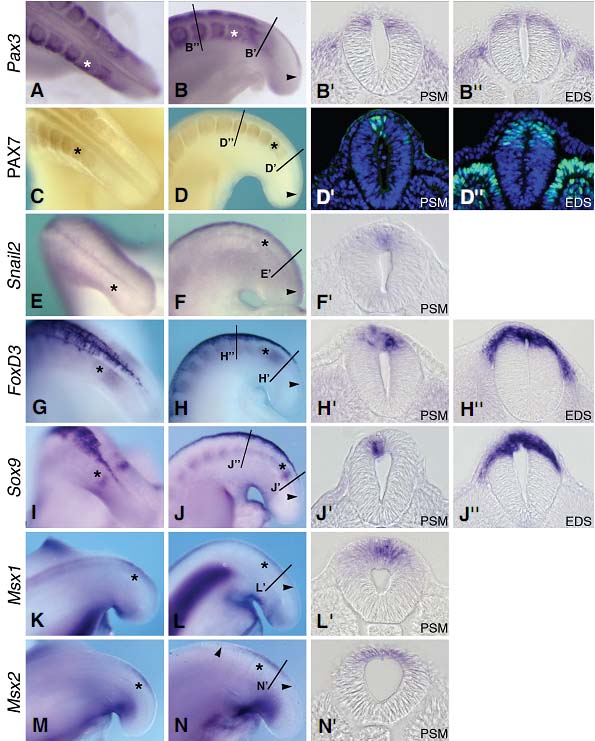 Fig. 1. Specification of secondary neural crest cells in HH18-20 chick embryos. (A,B) Pax3 expression in whole mount, dorsal view (A) and lateral view (B). Asterisk indicates the last formed somites and arrowhead points the posterior limit of expression. Cross-sections at the level of presomitic mesoderm (PSM) (B’) and early dissociating somites (EDS) (B’’). (C,D) PAX7 immuno-detection in whole mount dorsal (C) and lateral (D) and cryo-sections at the levels of PSM (D’) and EDS (D’’). Note that both transcription factors are detected in the dorsal NT soon after its formation facing posterior PSM and persist on migrating NCC close to the dorsal NT. They are also detected in the somite cells (B’’,D’’). (E,F) Whole mount expression of Snail2 in dorsal view (E) and lateral view (F). Snail2 is expressed in the dorsal NT from the level of the 9th -10th last formed somites down to the posterior PSM seen in cross-section (F’). (G,H) Whole mount in situ hybridiza-
tion for FoxD3 in dorsal (G) and lateral (H) views. Cross-sections at the levels of PSM (H’) and EDS (H’’). (I,J) Whole mount expression of Sox9 in dorsal (I) and lateral (J) views and cross-sections at the levels of PSM (J’) and EDS (J’’). FoxD3 and Sox9 are firstly expressed in the dorsal secondary NT facing posterior PSM and their expression persists in more anterior regions. Early migrating NCC located close to the NT are also expressing both of these genes (H’’,J’’). (K,L) Whole mount Msx1 expression in dorsal (K) and lateral (L) views. (L’) Crosssection at the level of anterior PSM. (M,N) Whole mount expression of Msx2 in the dorsal NT from the 4th last formed somite down to the anterior PSM in dorsal (M) and lateral (N) views. (N’) Cross-section at the level of the PSM.
Fig. 1. Specification of secondary neural crest cells in HH18-20 chick embryos. (A,B) Pax3 expression in whole mount, dorsal view (A) and lateral view (B). Asterisk indicates the last formed somites and arrowhead points the posterior limit of expression. Cross-sections at the level of presomitic mesoderm (PSM) (B’) and early dissociating somites (EDS) (B’’). (C,D) PAX7 immuno-detection in whole mount dorsal (C) and lateral (D) and cryo-sections at the levels of PSM (D’) and EDS (D’’). Note that both transcription factors are detected in the dorsal NT soon after its formation facing posterior PSM and persist on migrating NCC close to the dorsal NT. They are also detected in the somite cells (B’’,D’’). (E,F) Whole mount expression of Snail2 in dorsal view (E) and lateral view (F). Snail2 is expressed in the dorsal NT from the level of the 9th -10th last formed somites down to the posterior PSM seen in cross-section (F’). (G,H) Whole mount in situ hybridiza-
tion for FoxD3 in dorsal (G) and lateral (H) views. Cross-sections at the levels of PSM (H’) and EDS (H’’). (I,J) Whole mount expression of Sox9 in dorsal (I) and lateral (J) views and cross-sections at the levels of PSM (J’) and EDS (J’’). FoxD3 and Sox9 are firstly expressed in the dorsal secondary NT facing posterior PSM and their expression persists in more anterior regions. Early migrating NCC located close to the NT are also expressing both of these genes (H’’,J’’). (K,L) Whole mount Msx1 expression in dorsal (K) and lateral (L) views. (L’) Crosssection at the level of anterior PSM. (M,N) Whole mount expression of Msx2 in the dorsal NT from the 4th last formed somite down to the anterior PSM in dorsal (M) and lateral (N) views. (N’) Cross-section at the level of the PSM.
Мы проанализировали паттерны экспрессии большого числа транскрипционных фактоов, участвующих в спецификации NC (see Sauka-Spengler and Bronner-Fraser, 2006 for a review). Все они обнаруживаются в дорсальной части вторичной NT вскоре после её полного образования и они обнаруживают дифференциальную экспрессию в соответствии с состоянием созревания NT вдоль каудо-ростальной оси. Гены, подобные Pax3 и Pax7 (Fig. 1A-D) обнаруживаются дорсально в только что сформированной NT, сразу после завершения кавитации, на уровне, соотв. posterior presomitic mesoderm (PSM) (Fig. 1B',D'). Более рострально их экспрессия продолжается в дорсальную область NT и они также временно экспрессируются NCC, которые недавно эмигрировали из нейроэпителия (Fig. 1B",D"). Snail2 (ранее известный как Slug) экспрессируется временно во вторичной NT, вскоре после её полной кавитации, от уровня задней PSM (Fig. 1E-F') до 9-10 последних сформированных сомитов (not shown). Мы установили, что FoxD3 и Sox9 (Fig. 1G-J), могут рассматриваться как "NC-специфицирующие" гены вместе с Snail2 (Cheung et al., 2005), они также экспрессируются дорсально в недавно сформированной вторичной NT. Однако их первое обнаружение на уровне задней части PSM слегка более ростральное (Fig. 1H',J'), чем таковое для Pax3, Pax7 и Snail2. В противоположность последним, распределение которых заканчивается приблизительно в 10
из последних сформированных сомитов, их экспрессия персистирует более рострально (not shown). Более того, они временно присутствуют в рано мигрирующих NCC, расположенных вблизи NT (Fig. 1H",J"). Напротив, Msx1 и Msx2 впервые обнаруживаются в дорсальной части NT, расположенной на уровене передней части PSM (Fig. 1K-N'). Msx1 персистирует в более ростальной части NT (Fig. 1L), тогда как Msx2 обнаруживается лишь временно и исчезает на уровне 4-го из последних сформированных сомитов (Fig. 1N). Как только они специфицируются, то эмигрирующие NCC приобретают специфические маркеры. Первый из них, Ap2, обнаруживается в дорсальной части NT на уровне передней части PSM подобно маркерам спецификации NC (Fig. 2A-B) и он персистирует в NCC, которые недавно эмигрировали из нейроэпителия ена уровне 2-го из последних сформированных сомитов (Fig. 2 A,B). Др. маркеры, такие как Sox10 и HNK1, метят миграторные вторичные NCC несколько позднее. В то время как Sox10 появляется на уровне 3-го из последних сформированных сомитов (Fig. 2C,D), HNK1 обнаруживается на месте перехода между 3
и 4 из последних сформированных сомитов (Fig. 2E,F). Итак, хотя Ap2 и др. маркеры ранней миграции (такие как Pax3, Pax7, FoxD3 и Sox9) обнаруживают вторичные NCC, эмигрирующие во фронте 2-го из последних сформированных сомитов, др. маркеры, подобные HNK1 дают результаты, сходные с таковыми, описанными для регионов первичной нейруляции: на 15 - 25-сомитной стадии (HH11 - HH15) эмбрионов кур начало миграции NCC происходит на уровне 3-го -4-го из последних сформированных сомитов (Tosney, 1978; Thiery et al., 1982; Teillet et al., 1987).
Затем мы исследовали процесс вычленения вторичных NCC, процесс, используемый в шейно-торакальной области, серию клеточных событий, которые сходны с теми, что происходят при любом EMT (see Duband, 2006 for a review). Мы наблюдали, что RhoB, малая GTPase, предположительно контролирующая адгезию и подвижность клеток (Liu and Jessel, 1998), обнаруживается вдоль всей длины вторичной NT (Fig. 3B), в виде дорсо-вентрального градиента(Fig. 3A), который становится видимым вскоре после образования NT на уровне. обращенном лицом к задней части PSM (not shown). Кроме того, мы показали, что
экспрессия RhoB поляризована в дорсальных клетках NT, обращенных к EDS, где транскрипты накапливались на апикальной стороне (Fig. 3A). Эмигрирующие вторичные NCC не экспрессируют RhoB (not shown). Этот паттерн экспрессии RhoB совершенно отличty от таковых, опиcанных в более передних регионах на тех же стадиях. Напр., было показано, что на ст. 10 сомитов (HH10) эмбрионов кур эти молекулы первоначально экспрессируются на дорсальных кончиках нервных складок, дорсальных частых NT и временно в мигрирующих NCC, расположенных вблизи NT (Liu and Jessel, 1998). мы анализировали экспрессию RhoB во время первичной нейруляции у эмбрионов на ст. 17- 18-сомитов (HH12-13) и были получены результаты, сходные с таковыми у Liu and Jessel (1998) (not shown). Т.о., RhoB дифференциально экспрессируется во время первичной и вторичной нейруляции. Поэтому было предположено, что эта молекула участвует в EMT клеток NCC путем динамической регуляции активного цитоскелета (Liu and Jessel, 1998), и поэтому было проанализировано распределение F-actin в контексте вторичной нейруляции. Было установлено, что F-actin накапливается как на базальной, так и апикальной стороне дорсальных клеток вторичной NT перед началом миграции NCC на уровне PSM (Fig. 3D). Как только стартует миграция на уровне EDS, базальные накопления F-actin теряются, тогда как апикальные остаются (Fig. 3C). Т.о., реорганизация актинового цитоскелета, вносит вклад в изменения клеточной формы, которые предшествуют эмиграции NCC (Newgreen and Minichiello, 1996), одинаково при вторичной и первичной нейруляции, хотя разные паттерны экспрессии RhoB, как полагают, контролируют актиновый цитоскелет (Liu and Jessell, 1998), в этих двух регионах.
Мы также наблюдали достоверные признаки изменений в клеточной адгезии дорсальных клеток вторичной NT. Задолго до миграции NCC дорсальные клетки вторичной NT экспрессируют Cad6B (Fig. 4A,B'). Более того, N-cadherin, присутствует в дорсальных клетках вторичной NT, расположенной на уровне задней части PSM (Fig. 4E,E'), прогрессивно исчезает из этих клеток перед и во время эмиграции NCC, как это наблюдается соотв. на уровнях передней части PSM (Fig. 4D,D') и EDS (Fig. 4C,C'). Начав мигрировать вторичные NCC, сначала видны на уровне 3-го из последних сформированных сомитов, экспрессирующих Cad7 (Fig. 4F-G'). Мы также установили статус некоторых компонетов extracellular matrix (ECM) во время генерации вторичных NCC. Как было показано, с помощью иммунно-детекции laminin, базальная мембрана вторичной NT частично отсутствует (точечные разрывы) в дорсальной части вторичной NT , тогда как она образуется на уровне задней части PSM (Fig. 5B). Это отсутствие полной базальной мембраны сохраняется во время эмиграции NCC (Fig. 5A). Напротив, одновременно с дорсальными разрывами базальной ламины мы наблюдали, что два основных компонента фибриллярного ECM, fibronectin и tenascinC, обнаруживаются вокруг вторичной NT и вдоль путей миграции NCC перед (Fig. 5D,F) и во время (Fig.5C,E) эмиграции этих клеток. Одновременно с изменениями как формы клеток (see Figure 3) так и адгезии (see figure 4), мы наблюдали, что распределение TASC, активированной формы beta1-integrin, также модифицируется, когда происходит эмиграция вторичных NCC. На уровне PSM, мы нашли, что TASC обладает поляризованным распределением на базальной стороне дорсальных клеток вторичной NT (Fig. 5H). Потеря этих базальных накоплений наблюдается, когда начинается эмиграция NCC на уровне EDS (Fig. 5G). Итак, вычленение вторичных NCC использует те же самые клеточные события, которые происходят во время эмиграции NCC на уровне первичной нейруляции.
Помимо EMT, начало миграции туловищных NCC обычно нуждается в BMP-зависимой активности WNT (SelaDonenfeld and Kalcheim, 1999; Sela-Donenfeld and Kalcheim, 2000; Burstyn-Cohen et al., 2004; Shoval et al., 2007). Bmp4 экспрессируется и в дорсальной части вторичной NT в виде ростро-каудального градиента, который исчезает на уровне задней части PSM (Fig. 6AB''). Более того, один из его ингибиторов, Noggin, имеет комплементарный паттерн экспрессии (Fig. 6C-D"), обнаруживаясь в недавно сформированной дорсальной части NT, от уровня задней части PSM (Fig. 6D") до 1-2-го из последних сформированных сомитов (Fig. 6C-D). Noggin перестает обнаруживаться, когда сомиты отмежёвываются(Fig. 6D') и это совпадает с детекцией мигрирующих NCC (see figure 2). Более того, мы наблюдали, что экспрессия Wnt1 в дорсальной части вторичной NT стартует на уровне 1-2-го из последних сформированных сомитов (Fig. 6F') , где Noggin перестает обнаруживаться (Fig. 6D'). Экспрессия Wnt1 персистирует в более передних регионах (Fig. 6E,F). Как и при первичной нейруляции (Burstyn-Cohen et al., 2004), подавление Noggin совпадает с инициацией экспрессии Wnt1 что слегка предшествует миграции вторичных NCC.
IМы описали разные ступени генерации вторичных NCC в пояснично-кресцовом регионе на уровне сомитов 30 - 43, у эмбрионов кур. Несколько транскрипционных факторов, которые участвуют в спецификации туловищных NCC экспрессируются и в дорсальном регионе вторичной NT сразу же после её образования (полной кавитации). Гены, подобные
Pax3, Pax7 и Snail2 обнаруживаются рано на уровне задней части PSM, тогда как др. (такие как Msx1 и Msx2) обнаруживаются позднее на уровне передней части PSM. Более того, как только происходит спецификация вторичных NCC, начинается эмиграция этих клеток из нейроэпителия, обращенного лицом к EDS. Вычленение вторичных NCC использует серию клеточных событий, такипх как реорганизация F-actin цитоскелета, которая вносит вклад в изменения формы премиграторных клеток. Более того, динамическая регуляция адгезии вторичных NCC также имеет место, как показывает дифференциальна экспрессия этими клетками Cad6B, N-cadherin и Cad7. Все эти изменения сопровождаются модификациями взаимодействия с компонентами ECM, наэ то указывает распределение TASC в дорсальных клетках вторичной NT. Кроме того, мы показали , что приобретение подвижности вторичными NCC совпадает с повышением активности Bmp4, благодаря как увеличению собственных транскриптов, так и подавлению их ингибитора Noggin, и экспрессии
de novo Wnt1. Эти события связаны с созреванием соседних сомитов, т.к. мигрирующие NCC сначала обнаруживаются на уровне рано отчленившихся сомитов. Тщательное сравнение начала экспрессии некоторых проанализированных генов позволяет нам предложить молекулярную иерархию, оперирующую во время онтогенеза вторичного NC (Fig. 7). Анализ большого набора молекул указывает на то, что молекулярный код и механизмы, действующие на разных стадиях генерации NC сходны вдоль оси туловища у эмбрионов кур, независимо от типа нейруляции, это вдет к образованию NT. Однако наши результаты выявляют некоторые отличия относительно генерации NC в голове. Сюда входят вариации начала экспрессии генов, таких как
Pax3, Snail2 и RhoB. В цефалическом регионе, экспрессия
Snail2 предшествует таковой
Pax3 (del Barrio and Nieto, 2002) , а RhoB присутствует в небольшой популяции
Snail2-экспрессирующих клеток (del Barrio and Nieto, 2004). мы установили, что во время вторичной нейруляции начало экспрессии
Pax3 и Snail2 в дорсальном аспекте вторичной NT сопровождается таковой
RhoB, которая обнаруживается раньше, чем у этих двух факторов. Более того, Cad6B быстро подавляется в голове с помощью Snail2 (del Barrio and Nieto, 2002; Coles et al., 2007), тогда как его экспрессия сохраняется во вторичной NT после начала эмиграции NCC (this study). Более того, механизмы запуска вычленения NCC также отличны в регионах головы и туловища. Как в первичной, так и вторичной туловищной NT, эмиграция NCC из нейроэпителия использует Bmp4 активность, регулируемую градиентом экспрессии Noggin в дорсальной части NT (SelaDonenfeld and Kalcheim, 1999; this study). Напротив, типичное вычленение NCC в головном регионе использует активность Snail2 и Ets1 (Theveneau et al., 2007) а не активность Bmp4. Т.о., наши результаты о формировании вторичных NCC подчеркивают некоторые отличия в развитии NC в цефалической в противоположность туловищной части.
 Fig. 7. Comparative molecular expression during secondary neural crest genesis. The neural tube (NT), presomitic mesoderm (PSM) and the 6 last formed somites (So I to VI) are schematized in the middle of the figure. Vertical bars indicate the anterior and posterior limits of gene expression in accordance with the state of maturation of the paraxial mesoderm. The expression patterns of the genes present in the dorsal secondary NT are on the left side, while those occurring in the extracellular matrix (ECM) and migratory secondary neural crest cells (NCC) are on the right side. Striped bars represent a polarized basal expression in the dorsal cells of the NT. Dotted bar represents the incomplete accumulation of laminin around the dorsal aspect of the secondary NT.
Fig. 7. Comparative molecular expression during secondary neural crest genesis. The neural tube (NT), presomitic mesoderm (PSM) and the 6 last formed somites (So I to VI) are schematized in the middle of the figure. Vertical bars indicate the anterior and posterior limits of gene expression in accordance with the state of maturation of the paraxial mesoderm. The expression patterns of the genes present in the dorsal secondary NT are on the left side, while those occurring in the extracellular matrix (ECM) and migratory secondary neural crest cells (NCC) are on the right side. Striped bars represent a polarized basal expression in the dorsal cells of the NT. Dotted bar represents the incomplete accumulation of laminin around the dorsal aspect of the secondary NT.
Сайт создан в системе
uCoz  Fig. 1. Specification of secondary neural crest cells in HH18-20 chick embryos. (A,B) Pax3 expression in whole mount, dorsal view (A) and lateral view (B). Asterisk indicates the last formed somites and arrowhead points the posterior limit of expression. Cross-sections at the level of presomitic mesoderm (PSM) (B’) and early dissociating somites (EDS) (B’’). (C,D) PAX7 immuno-detection in whole mount dorsal (C) and lateral (D) and cryo-sections at the levels of PSM (D’) and EDS (D’’). Note that both transcription factors are detected in the dorsal NT soon after its formation facing posterior PSM and persist on migrating NCC close to the dorsal NT. They are also detected in the somite cells (B’’,D’’). (E,F) Whole mount expression of Snail2 in dorsal view (E) and lateral view (F). Snail2 is expressed in the dorsal NT from the level of the 9th -10th last formed somites down to the posterior PSM seen in cross-section (F’). (G,H) Whole mount in situ hybridiza-
tion for FoxD3 in dorsal (G) and lateral (H) views. Cross-sections at the levels of PSM (H’) and EDS (H’’). (I,J) Whole mount expression of Sox9 in dorsal (I) and lateral (J) views and cross-sections at the levels of PSM (J’) and EDS (J’’). FoxD3 and Sox9 are firstly expressed in the dorsal secondary NT facing posterior PSM and their expression persists in more anterior regions. Early migrating NCC located close to the NT are also expressing both of these genes (H’’,J’’). (K,L) Whole mount Msx1 expression in dorsal (K) and lateral (L) views. (L’) Crosssection at the level of anterior PSM. (M,N) Whole mount expression of Msx2 in the dorsal NT from the 4th last formed somite down to the anterior PSM in dorsal (M) and lateral (N) views. (N’) Cross-section at the level of the PSM.
Fig. 1. Specification of secondary neural crest cells in HH18-20 chick embryos. (A,B) Pax3 expression in whole mount, dorsal view (A) and lateral view (B). Asterisk indicates the last formed somites and arrowhead points the posterior limit of expression. Cross-sections at the level of presomitic mesoderm (PSM) (B’) and early dissociating somites (EDS) (B’’). (C,D) PAX7 immuno-detection in whole mount dorsal (C) and lateral (D) and cryo-sections at the levels of PSM (D’) and EDS (D’’). Note that both transcription factors are detected in the dorsal NT soon after its formation facing posterior PSM and persist on migrating NCC close to the dorsal NT. They are also detected in the somite cells (B’’,D’’). (E,F) Whole mount expression of Snail2 in dorsal view (E) and lateral view (F). Snail2 is expressed in the dorsal NT from the level of the 9th -10th last formed somites down to the posterior PSM seen in cross-section (F’). (G,H) Whole mount in situ hybridiza-
tion for FoxD3 in dorsal (G) and lateral (H) views. Cross-sections at the levels of PSM (H’) and EDS (H’’). (I,J) Whole mount expression of Sox9 in dorsal (I) and lateral (J) views and cross-sections at the levels of PSM (J’) and EDS (J’’). FoxD3 and Sox9 are firstly expressed in the dorsal secondary NT facing posterior PSM and their expression persists in more anterior regions. Early migrating NCC located close to the NT are also expressing both of these genes (H’’,J’’). (K,L) Whole mount Msx1 expression in dorsal (K) and lateral (L) views. (L’) Crosssection at the level of anterior PSM. (M,N) Whole mount expression of Msx2 in the dorsal NT from the 4th last formed somite down to the anterior PSM in dorsal (M) and lateral (N) views. (N’) Cross-section at the level of the PSM.  Fig. 7. Comparative molecular expression during secondary neural crest genesis. The neural tube (NT), presomitic mesoderm (PSM) and the 6 last formed somites (So I to VI) are schematized in the middle of the figure. Vertical bars indicate the anterior and posterior limits of gene expression in accordance with the state of maturation of the paraxial mesoderm. The expression patterns of the genes present in the dorsal secondary NT are on the left side, while those occurring in the extracellular matrix (ECM) and migratory secondary neural crest cells (NCC) are on the right side. Striped bars represent a polarized basal expression in the dorsal cells of the NT. Dotted bar represents the incomplete accumulation of laminin around the dorsal aspect of the secondary NT.
Fig. 7. Comparative molecular expression during secondary neural crest genesis. The neural tube (NT), presomitic mesoderm (PSM) and the 6 last formed somites (So I to VI) are schematized in the middle of the figure. Vertical bars indicate the anterior and posterior limits of gene expression in accordance with the state of maturation of the paraxial mesoderm. The expression patterns of the genes present in the dorsal secondary NT are on the left side, while those occurring in the extracellular matrix (ECM) and migratory secondary neural crest cells (NCC) are on the right side. Striped bars represent a polarized basal expression in the dorsal cells of the NT. Dotted bar represents the incomplete accumulation of laminin around the dorsal aspect of the secondary NT.