Ощущение соленого у грызунов обычно подразделено на два компонента, базируясь на основных вкусовых предпочтениях соль-содержащих растворов и чувствительности солевых реакций на блокатор каналов amiloride (Breslin et al., 1993; Spector et al., 1996). При низких концентрациях (10-150 mM NaCI), мыши с удовольствием потребляют соль, но поведение (и нервные реакции) в основном блокируется amiloride (Bachmanov et al., 2002). При высоких концентрациях соли однако мыши обнаруживают внутренне присущее отвращение и на эти реакции не влияет amiloride. Поскольку эпителиальные натриевые каналы ENaC строго ингибируются amiloride, то было предположено их участие в восприятии соленого (Heck et al., 1984; Brand et al., 1985). Однако качественные особенности солевых рецепторов и механизмы, обусловливающие влечение и отвращение к соленому, остаются неизвестными. Мыши, неспособные воспринимать вкус сладкого, umami, горького или кислого всё ещё сохраняют нервную и поведенческую реакцию на соли (Huang et al., 2006), подтверждая тем самым расхождение всех вкусовых ощущений на периферии и демонстрируя существование одной или нескольких популяций TRC, предназначенных для восприятия соленого.
Экспрессия рецепторов горького, сладкого, umami и кислого в разделенных TRCs указывает на то, что эти вкусы обеспечиваются самостоятельными, предназначенными для этого клетками, каждая из которых тонко настроена на определенное вкусовое ощущение (Figure 3). В самом деле, серия исследований генетически искусственно созданных мышей подтвердила эту логику кодирования вкуса и предоставила окончательные доказательства организации из меченных клонов периферии вкусовой системы (Chandrashekar et al., 2006). Напр., специфические популяции вкусовых рецепторных клеток могут быть генетически устранены с помощью экспрессии субъединицы α diphtheria toxin и возникающие в результате животные обнаруживали дефицит только одного вкусового ощущения, тогда как остальные оставались интактными (Huang et al., 2006; Chandrashekar et al., 2009). Кроме того, прирожденная природа вкусовых предпочтений строго указывает на то, что TRCs обладают жестко запрограммированными поведенческими программами привлечения и отторжения. Если это так, то активация избирательных популяций TRC д. быть достаточной для управления вкусовым поведением. Напр., экспрессия рецептора синего цвета в клетках, воспринимающих сладкое д., в принципе, производить голубого цвета "вкус" сладкого. Хотя такой эксперимент ещё не был проведен, но экспрессия невкусового рецептора в TRCs сладкого или горького д. позволять вкусовым клеткам активироваться и осуществлять строго специфическое поведение, вызванное с помощью ординарного невкусового лиганда (Zhao et al., 2003; Mueller et al., 2005). Как показывает Figure 4, если такой рецептор (RASSL, Coward et al., 1998) экспрессируется в клетках, воспринимающих сладкое под контролем T1R2 промтора, то такие мыши д. сильно привлекаться к растворам, содержащим обычно не вкусовые лиганды (Zhao et al., 2003). Если, с др. стороны, тот же самый RASSL рецептор экспрессируется в клетках, воспринимающих горькое, то эти мыши д. обнаруживать строгое отвращение (Mueller et al., 2005). Сходным образом, экспрессия рецептора горького в клетках, воспринимающих сладкое, дает животных, которые обнаруживают сильное влечение к соотв. горькому лиганду, т.е. вкус горького
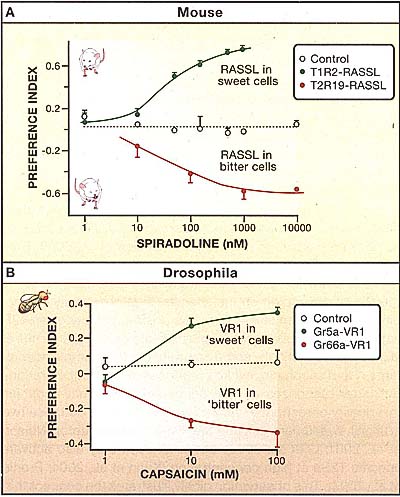 Figure 4. Behavioral Attraction and Aversion Are Hardwired
Mice and flies have converged on a similar organization of taste coding at the periphery. In both cases, dedicated cells tuned to selective taste qualities are hardwired to trigger specific behavioral responses. The synthetic opiate spiradoline is normally tasteless to mice (A, open circles). However, after targeted expression of the spiradoline receptor (RASSL) to sweet cells, mice exhibit dose-dependent attraction to spiradoline (Zhao et al., 2003). In marked contrast, directing expression of the very same RASSL receptor to bitter cells results in strong aversion to the ligand (Mueller et al., 2005). Similarly, activation of selective populations of gustatory receptor neurons in flies (B) mediates robust innate behavioral responses (Marella et al., 2006). Expression of the mammalian ion channel TrpV1 in sugar-sensing GRNs (Gr5a-TrpV1) results in strong behavioral preference for capsaicin. In contrast, expression of TrpV1 in the "bitter-responsive" Gr66a cells makes capsaicin an aversive tastant. Normal flies do not respond to capsaicin (open circles); preference index = (tastant - control)/ total.
Figure 4. Behavioral Attraction and Aversion Are Hardwired
Mice and flies have converged on a similar organization of taste coding at the periphery. In both cases, dedicated cells tuned to selective taste qualities are hardwired to trigger specific behavioral responses. The synthetic opiate spiradoline is normally tasteless to mice (A, open circles). However, after targeted expression of the spiradoline receptor (RASSL) to sweet cells, mice exhibit dose-dependent attraction to spiradoline (Zhao et al., 2003). In marked contrast, directing expression of the very same RASSL receptor to bitter cells results in strong aversion to the ligand (Mueller et al., 2005). Similarly, activation of selective populations of gustatory receptor neurons in flies (B) mediates robust innate behavioral responses (Marella et al., 2006). Expression of the mammalian ion channel TrpV1 in sugar-sensing GRNs (Gr5a-TrpV1) results in strong behavioral preference for capsaicin. In contrast, expression of TrpV1 in the "bitter-responsive" Gr66a cells makes capsaicin an aversive tastant. Normal flies do not respond to capsaicin (open circles); preference index = (tastant - control)/ total.
воспринимается сладким (Mueller et al., 2005). Такое поведение не исправляется обучением, поскольку экспрессия рецептора отсутствует во время развития и индуцируется только непосредственно перед поведенческими тестами. Итак, эти эксперименты демонстриуют, что, что поведенческие реакции на вкусовые стимулы детерминируются за счет качественных особенностей стимулируемых типов клеток и не за счет свойств молекул вкусовых рецепторов или даже источников вкуса; они также иллюстрируют, как функциональная сегрегация вкусовых ощущений обеспечивает вкусовую систему утонченным устройством для управления врожденным поведением. Было бы интересным понять генетическую программу и механизмы, с помощью которых каждый тип вкусовых клеток жестко закреплен на соотв. нервной дуге (circuitry) и будет действовать, если она сможет также изменять вкусовое поведение за счет манипуляций в схеме соединений.
Давно установлено, что каждая вкусовая луковица состоит из гетерогенной коллекции типов клеток. Ранние ЭМ исследования структуры вкусовых почек классифицировали TRCs
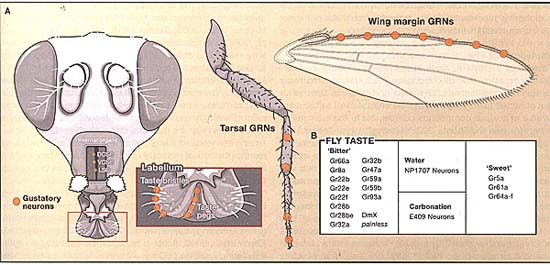 Figure 5. Fly Taste Reception
(A) Flies detect tastants via gustatory receptor neurons (GRNs) housed in sensilla distributed across the mouth parts (labella), legs, and wings. Stimulation of GRNs by appetitive tastants elicits extension of the proboscis to initiate feeding. Upon intake, food contacts GRNs in the taste pegs of the inner labellum and in the internal taste organs lining the pharynx (lateral sensory organ, ventral cibarial organ, and dorsal cibarial sensory organ).
(B) Like mammals, fly gustatory receptors are expressed into dedicated classes of GRN detecting distinct classes of attractive or aversive tastants. Most, but not all, sugar and bitter receptors are members of the "Gustatory Receptor" (Gr) gene family (Montell, 2009; Al-Anzi et al., 2006; Mitri et al., 2009). To date, several Grs have been linked to detection of specific attractive or aversive tastants. For example, mutants for Gr66a and Gr93a both show defective behavioral and physiological responses to caffeine (Lee et al., 2009); logically, as fruit flies are not normally exposed to caffeine, this receptor must be activated by ligands sharing structural features with caffeine. As for sugar detection, Gr64f is a candidate receptor required for responses to a wide range of sugars, including sucrose, maltose, glucose, and trehalose (Dahanukar et al., 2007; Jiao et al., 2008; Slone et al., 2007). In contrast, Gr5a is a narrowly tuned receptor for trehalose alone (Chyb et al., 2003). Thus, many receptors may recognize the same sugars, and a given sugar may act on several receptors (or receptor complexes). Carbonation and water are sensed by different subpopulations of GRNs (Fischler et al., 2007; Inoshita and Tanimura, 2006).
Figure 5. Fly Taste Reception
(A) Flies detect tastants via gustatory receptor neurons (GRNs) housed in sensilla distributed across the mouth parts (labella), legs, and wings. Stimulation of GRNs by appetitive tastants elicits extension of the proboscis to initiate feeding. Upon intake, food contacts GRNs in the taste pegs of the inner labellum and in the internal taste organs lining the pharynx (lateral sensory organ, ventral cibarial organ, and dorsal cibarial sensory organ).
(B) Like mammals, fly gustatory receptors are expressed into dedicated classes of GRN detecting distinct classes of attractive or aversive tastants. Most, but not all, sugar and bitter receptors are members of the "Gustatory Receptor" (Gr) gene family (Montell, 2009; Al-Anzi et al., 2006; Mitri et al., 2009). To date, several Grs have been linked to detection of specific attractive or aversive tastants. For example, mutants for Gr66a and Gr93a both show defective behavioral and physiological responses to caffeine (Lee et al., 2009); logically, as fruit flies are not normally exposed to caffeine, this receptor must be activated by ligands sharing structural features with caffeine. As for sugar detection, Gr64f is a candidate receptor required for responses to a wide range of sugars, including sucrose, maltose, glucose, and trehalose (Dahanukar et al., 2007; Jiao et al., 2008; Slone et al., 2007). In contrast, Gr5a is a narrowly tuned receptor for trehalose alone (Chyb et al., 2003). Thus, many receptors may recognize the same sugars, and a given sugar may act on several receptors (or receptor complexes). Carbonation and water are sensed by different subpopulations of GRNs (Fischler et al., 2007; Inoshita and Tanimura, 2006).
в 4 морфологических типа. Типы I, II и III (также наз. темными, светлыми и промежуточными клетками) образуют контакты с вкусовой порой, тогда как клетки типа IV располагаются в основании почки (Murray et al., 1969; Delay et al., 1986; Royer and Kinnamon, 1988; Kinnamon et al., 1993). Клонирование и характеристика вкусовых рецепторов показали, что клетки типа II включают клетки, воспринимающие сладкое, горькое и umami (Clapp et al., 2004), клетки типа III являются клетками, ощущающими кислое (Kataoka et al., 2008), а клетки типа IV, по-видимому, являются клетками предшественниками, которые делятся, чтобы регенерировать зрелые TRCs. Эти молекулярные исследования закрыли брешь давней анатомической мистерии и показали. что вообще-то клетки типа I соответствуют TRCs, воспринимающим соленое. Но для чего клетки вкусовых рецепторов организованы во вкусовые почки? Тесная близость клеток, чувствительных к разным вкусовым качествам, делает возможными латеральные взаимодействия, которые происходят, хотя всё ещё сохраняются отдельные конечные результаты. При таком сценарии вкусовая почка является функциональной единицей, интегрированным "органом вкуса." В самом деле, множественные потенциальные нейротрансмиттеры и их рецепторы экспрессируются в избирательных популяциях вкусовых рецепторных клеток, намекая, что происходят взаимодействия внутри вкусовых почек (Herness et al., 2005; Roper, 2006, 2009; Herness and Zhao, 2009). Напр., PKD2L1 клетки, ощущающие кислое, продуцируют serotonin и GABA (Huang et al., 2005; Cao et al., 2009) и как сообщалось высвобождают serotonin способом, зависимым от активности (Huang et al., 2005). Такое высвобождение может потенциально модулировать активность рецепторных клеток сладкого, umami или горького и изменять процесс молчания и тем самым поведенческую реакцию, вызванную ощущением смеси, содержащей как привлекательные, так и отталкивающие вкусовые вещества.
Как же TRCs передают информацию первичным афферентным нейронам? Удивительно, лишь немногие клетки в каждой вкусовой луковице, а именно PKD2L1-экспрессрующие клетки кислого вкуса, обладают настоящими синапсами, как показали ультраструктурные исследования (Yang et al., 2000). Так, устранение этих клеток избирательно элиминирует реакции на источники кислого, не нарушая др. виды ощущений (Huang et al., 2006). Это привело к нескольким моделям атипичной передачи синаптических сигналов, включая предположение, что вкусовые реакции на сладкое, горькое, umami и соленое передаются преимущественно афферентным влокнам посредством нестандартных соединений, таких как высвобождение из подповерхностных цистерн (Royer and Kinnamon, 1988) или высвобождение АТФ посредством pannexin/connexin полуканалов (Huang et al., 2007; Romanov et al., 2007). Незавиимо от механизмов передачи было бы чрезвычайно полезно проследить соединение определенных TRCs с нейронами второго и более высокого порядка. Три группы сообщили о передаче предположительно транснейронального трассера агглютинина из проростков пшеницы из генетически меченных TRCs в более высокие инстанции (Sugita and Shiba, 2005; Ohmoto et al., 2008; Damak et al., 2008). Хотя эти подходы дали ограниченные и в некоторой степени противоречивые результаты о вкусовых путях, эти данные в комбинации с функциональными исследованиями могут помочь определить, как вкусовые сигналы трансформируются и как организация сигналов на периферии предоставляется более высоким нервным инстанциям (ганглиям, стволу мозга и первичной коре).
Taste in Fruit Flies
принимая во внимание, что вкусовая система плодовых мушек развивалась довольно независимо от таковой млекопитающих, выявляется довольно сходный круг возбудителей вкуса (tastants). Подобно мыши и человеку дрозофилу привлекают сахара и низкие концентрации соли и отталкивают ядовитые субстанции, сравнимые с горечями для млекопитающих (Amrein and Thome, 2005). Хотя мы используем "сладкий" и "горький" вкус для описания привлекающих и отталкивающих вкусовых ощущений у мух и мышей, важно отметить, что эти описания базируются скорее на аналогии, чем гомологии. В самом деле, философы и нейроэтиологи давно спорят о смысле перцепции (т.е. является ли ваше ощущение сладкого тем же самым, что у меня, и чем является ощущение сладкого для мух?); мы хотели бы избежать этих споров, используя определение detection скорее, чем perception.
В отличие от млекопитающих плодовые мушки индифферентны к L-аминокислотам или низким pH в своей диете. Это, скорее всего, является адаптацией к их специализированной диете (часто поврежденных) в виде фруктов, которые обычно довольно кислы и сильно обогащены простыми углеводами скорее, чем аминокислотами. В отличие от мышей мухи значительно меньше, своего источника пищи и обычно разгуливают по её поверхности, прежде чем отведать её. поэтому помимо имеющихся вкусовых рецепторов на частях своего ротового аппарата они также имеют gustatory receptor neurons (GRNs) , расположенные на их ногах и крыльях (Figure 5).
Мухи поглощают пищу с помощью своего хоботка, который состоит из мышечной трубки, глотки, снабженной двумя лабиальными щупиками (labellum). GRNs располагаются в 200-300 вкусовых сенсиллах, расположенных на хоботке, конечностях и крыльях. У Drosophila, каждый labellum содержит 31 вкусовую щетинку, на каждой наружной поверхности и около 30 внутренних вкусовых pegs, расположенных между бороздками псевдотрахей (используемые, когда мухи начинают активно питаться). Дополнительные GRNs расположены в серии внутренних вкусовых органов, выстилающих глотку. Вкусовые щетинки на хоботке и ногах включают длинные, короткие и промежуточного субтипа, каждая содержит один механосенсорный и два (промежуточных) или четыре (коротких и длинных) вкусовые нейроны. Каждый вкусовой нейрон выпускает дендриты в терминальную пору на кончике ости щетинки и аксональный отросток, который заканчивается преимущественно в subesophageal ganglion (SOG).
Хоботок обычно убран в основание головы, но стимулирование ножных или лабиальных вкусовых нейронов привлекательными вкусовыми веществами, такими как сахар, вызывает выдвижение хоботка, открытие labella, и инициирует программу приема пищи. Как и следовало ожидать добавление невкусных субстанций к источнику пищи супрессирует proboscis extension reflex (PER) и вызывает втягивание хоботка; вытягивание/втягивание хоботка является прирожденным проявлением и используется как поведенческий подход для выявления дефектов функционирования вкусовой системы.
Вкусовые щетинки
Drosophila отвечают за внеклеточную регистрацию и достаточно просты, чтобы реакции вкусовых нейронов могли действительно отличать один вкус от др. посредством spike sorting. ранние исследования с использованием этого подхода идентифицировали несколько функциональных классов GRNs. Короткие и длинные вкусовые щетинки содержат один нейрон, которые отвечает на сахар (S), один на воду (W), и один на соль (L1), и четвертый, который отвечает на горькие соединения и высокие концентрации солей (L2; Meunier et al., 2003; Siddiqi and Rodrigues, 1980; Thorne et al., 2005). Промежуточные щетинки содержат только две хемосенсорные клетки (Hiroi et al., 2004), одна настроена на низкие уровни соли и сахаров (т.e., привлекательные источники вкуса) и одна на высокие уровни соли и горечи (т.e., отвращающие источники вкуса ). Как и ожидалось, разные вкусовые источники, которые ощущаются одной и той же клеткой (такие как высокое содержание соли, кофеин и quinine) стимулируют одинаковую поведенческую реакцию. Такая раскладка строго напоминает ситуацию у млекопитающих, у которых избирательность к разным вкусовым качествам распределена среди ограниченного количества типов клеток. Как и у мышей, установление причинных взаимоотношений между активностью вкусового нейрона и поведением нуждается в молекулярной изоляции вкусовых рецепторов, чтобы выявить организацию вкусовой системы.
"Sweet" and "Bitter" Pathways in Flies
Вкусовые рецепторы мух являются по большей части членами семейства "Gustatory Receptor" (Gr), группы из 68 удаленно родственных генов, кодирующих предположительно heptahelical трансмембранные белки (Clyne et al., 2000; Scott et al., 2001; Dunipace et al., 2001). Интересно, что хотя Grs первоначально рассматривали функционирующими как GPCRs, но в настоящее время неясно, передаются ли сигналы Grs посредством каскада зависимых от G белка вторичных мессенджеров или оперируют как лигандом контролируемые ионные каналы. Ближайшими родственниками Grs является обонятельные рецепторы насекомых, которые действуют как ионные каналы (Sato et al., 2008; Wicher et al., 2008).
Как м у млекопитающих экспрессия вкусовых рецепторов у мух определяется в строго разграниченных популяциях GRNs. Вкусовой рецептор сладкой trehalose, Gr5a (Chyb et al., 2003), экспрессируется в популяции вкусовых нейронов, которые полностью не перекрываются с нейронами, экспрессирующими Gr66a (Thorne et al., 2004; Wang et al., 2004), рецептором. необходимым для детекции горечей (Moon et al., 2006). Каждый из этих рецепторов присутствует в одиночном самостоятельном GRN почти во всех вкусовых щетинках. Кроме того, проекции этих нейронов в SOG заканчиваются в пространственно разграниченных доменах. Функция Gr5a в качестве рецептора сахара непосредственно подтверждает, что этот класс меченных клеток (и проекций) представляет собой меченную линию для восприятия сладкого вкуса, тогда как Gr66a-экспрессирующие нейроны могут соответствовать меченной линии для горьких стимулов. В самом деле, комбинация исследований функциональных картин, устранения клеток и активации показывает, что все соединения, которые активируют Gr5a нейроны, привлекательны для мух, а все соединения, которые стимулируют Gr66a нейроны отвратительны для них (Thorne et al., 2004; Wang et al., 2004; Marella et al., 2006). Т.о., эти два функциональных пути метят линии для "сладкого" (Gr5a) и "горького" (Gr66a) вкуса.
У мышей избирательная активация TRCs строго управляет поведением, независимо от источника активации (see Figure 4). Распространяется ли это и на мух? Scott et al. экспрессировали рецептор capsaicin млекопитающих, TrpV1, во вкусовых нейронах мух и установили, что экспрессия в Gr5a нейронах вызывает дозово-зависимое предпочтение к capsaicin, тогда как экспрессия в Gr66a нейронах вызывает отвращение к нему (Marella et al., 2006). Аналогичные эксперименты, которых обонятельные рецепторы экспрессировали в Gr5a и Gr66a нейронах вызывали привлечение или отталкивание, соотв., на соотв. одорант (Hiroi et al., 2008). Наконец, недавнее исследование показало, что экспрессия и активация активируемого светом канала rhodopsin-2 репортера в Gr5a нейронах достаточна, чтобы индуцировать мощную инициацию программы приема пищи после стимуляции голубым светом (Gordon and Scott, 2009). Т.о., как и у млекопитающих разные популяции вкусовых рецепторных клеток жестко смонтированы, чтобы вызывать соотв. поведенческие реакции.
Как же вкусовые импульсы контролируют поведение? Головной мозг мух на несколько порядков величин меньше, чем головной мозг млекопитающих; это позволяет выделять рефлекторные дуги (circuits), контролирующие поведение (напр., изо рта к сенсорным и интеграционным центрам головного мозга к моторным реакциям) менее проблематичным, чем у мышей. Напр., недавнее исследование на мухах идентифицировало двигательный нейрон в SOG (E49; Gordon and Scott, 2009), который, по-видимому, действует как интегратор горьких и сладких сигналов, чтобы контролировать выпускание хоботка. Отметим, что этот нейрон стимулируется за счет активности в Gr5a нейронах и ингибируется за счет активности Gr66a; т.о., "bitter" и "sweet" меченные линии в конечном итоге совместно ведут к хореографии антагонистических реакций в нейронах, обеспечивающих поведение на пищу.
The Tastes of Salt, Water, and Carbonation
Подобно млекопитающим мух привлекают соли в низких концентрациях и отталкивают в высоких концентрациях. И Gr66a- и Gr5a-экспрессирующие нейроны обнаруживают функциональные реакции на NaCI (Marella et al., 2006). В то время как Gr5a GRNs реагируют на концентрации ниже 10 mM NaCI, чувствительные к горькому нейроны Gr66a нуждаются в более высоких концентрациях стимулов, соответствующих порогам отталкивающего поведения. Устранение Gr5a нейронов существенно снижает PER к низким концентрациям солей (Wang et al., 2004). Неожиданно устранение Gr66a нейронов несущественно влияет на уклонение от соли (Wang et al., 2004), указывая на существование дополнительных путей, участвующих в отвращении к высокому содержанию соли (таких как L1 чувствительные к соли нейроны). Кандидатами на роль солевых рецепторов у мух являются члены Degenerin/ENaC (pickpocket) семейства ионных каналов (Liu et al., 2003). О связь пока не доказана.
Мухи обладают мощной PER воды, особенно если они лишены воды (Inoshita and Tanimura, 2006). Эта реакция соответствует чувствительности вкусового нейрона W, который стимулируется чистой водой и ингибируется увеличивающимися концентрациями солей или др. растворов. Заметим, что недавно охарактеризованный Drosophila enhancer trap line, NP1017, управляет экспрессией репортера в одиночном нейроне в каждой чувствительной к воде длинной или короткой labial сенсилле. Замалчивание этих нейронов устраняет PER воды, не нарушая реакцию на сахара (Inoshita and Tanimura, 2006). Эти клетки позволяют изолировать и охарактеризовать предполагаемые водные рецепторы.
Помимо вкусовых щетинок ухи обладают примерно 30 вкусовыми отростками (pegs) на внутренней поверхности каждого лабиального щупика. Приблизительно 6 вкусовых peg нейронов экспрессируют
Gr5a (Thorne et al., 2004), но остальные не экспрессируют какие-либо известные Gr. Какова же функция этих предполагаемых вкусовых нейронов? Анатомический скрининг на enhancer trap lines для экспрессии во вкусовой ткани идентифицировал одну линию, E409, которая метит все не экспрессирующие Gr5a вкусовые peg нейроны (Fischler et al., 2007). Используя эту driver линию, Scott с сотрудниками элегантно продемонстрировали, что E409 клетки функционируют как сенсоры C0
2, активируемые растущими дрожжами, пивом, углекислой минеральной водой, сухим льдом и даже газобразным C0
2 (Fischler et al., 2007). Метод изучения пищевых предпочтений у мух выявил склонность к пище в виде растворов. содержащих C0
2. Однако это предпочтение существенно снижено в генетически замалчиваемых E409 нейронах (Fischler et al., 2007). Кроме того, экспрессия канала TrpV1 в E409 клетках дает животных, которые обнаруживают мощное вкусовое влечение к capsaicin (Fischler et al., 2007). Всё это указывает на то, что мухи обладают соотв. путем вкусовой детекции C0
2 и что C0
2 является важным стимулом в выборе пищи (напр., ферментированных фруктов).
Aftertastes and Afterthoughts
Мухи и мыши дивергируют от общего родоначальника в кембрийский период 550 миллионов лет назад. Теперь каждый вид обладает вкусовой системой, обладающей общими одними и теми же фундаментальными принципами организации. Обе системы категоризируют разные наборы пригодных для пищи соединений, используя относительно небольшие количества метящих сигналов: сладкое, кислое, соленое, горькое и umami у мыши и "сладкое," "горькое," вода, C02 и (возможно) соленое у мух. Эти сигналы соответствуют раздельным популяциям рецепторных клеток на периферии, каждая ответственна за детекции одного вкусового качества. "Вкус" пищи, т.о., является отражением ансамбля активированных типов TRC.
Остаются важные вопросы: первичная вкусовая информация подвергается процессингу или трансформируется внутри"вкусовых органов" (луковицы у мышей и сенсорные щетинки и pegs у мух)?. Как сигналы передаются между TRCs и афферентными нервами? Существуют ли вкусовые рецепторы для жира или др. orosensory стимулов? Как закрепленная специфичность поддерживается несмотря на постоянный оборот TRC? Все ли Gr66a нейроны у мух функционально эквивалентны или мухи используют разные субклассы "горьких" нейронов, чтобы отличать поведенчески токсины? Как мухи используют информацию от разных вкусовых органов, распределенных по телу для избирательного поведения?
Is tastant location encoded along with quality?
What about the central representation of taste? The role of our senses is to create an internal representation of the physical and chemical features of the outside world. In the case of taste, this question can be reduced to how does the brain know what the tongue knows? Given our new understanding of the organization of the taste system at the periphery, it is reasonable to speculate on strategies to encode tastant identity (and intensity) in the primary taste cortex. Current models of taste coding propose that neuronal lines for each taste converge into common targets, even at the earliest of neuronal stations (see Roper, 2007). However, if the spatial segregation seen in the periphery is largely preserved through the central stations, we may instead discover a chemotopic map of taste qualities, reminiscent of the logic seen in the somatosensory, visual, and auditory systems. Recent advances in multi-electrode recording and imaging techniques now provide a venue to answer this question.
Finally, although taste is the only sense strictly devoted to feeding behavior, all senses play a role in influencing dietary choices. To humans, a dish that is sweet, savory, and perfectly salted may be rendered unappetizing due to foul odor, unexpected color, or bad association with a particular experience. As we follow taste information upwards from the primary taste cortex, two exciting challenges will be to identify the sites where information from different sensory modalities converges onto decision centers to control feeding behavior and to determine how taste and odor represetations are bound to create perceptions of "flavor".
Сайт создан в системе
uCoz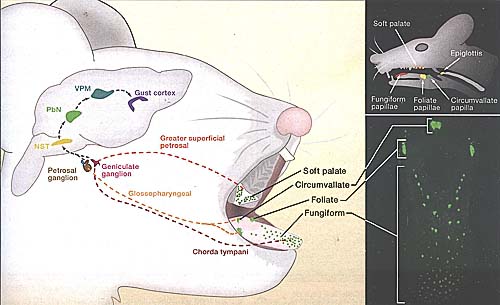 Figure 1. The Anatomy of Taste
Taste buds are broadly distributed on the tongue and soft palate. On the tongue, taste buds are localized to three classes of papillae: In mice, the single circumvallate papilla is found at the very back of the tongue; foliate papillae are at the posterior lateral edge, and fungiform papillae are distributed over the anterior two thirds of the tongue; these three classes of paplilae can be highlighted in mice engineered to express green fluorescent protein in taste bud areas (lower right panel). The taste buds on the tongue and palate are innervated by three afferent nerves: the chorda tympani, greater superficial petrosal, and glossopharyngeal. These nerves carry taste information from the taste receptor cells to the nucleus of the solitary tract (NST) in the brain stem. From the NST, taste responses are transmitted (and processed) through the parabrachial nucleus (PbN) and the thalamus (VPM) to the primary gustatory cortex in the insula. Behavioral responses to food (and perceptions of flavor) are ultimately choreographed by the integration of gustatory information with other sensory modalities (such as olfaction, texture, etc.)
Figure 1. The Anatomy of Taste
Taste buds are broadly distributed on the tongue and soft palate. On the tongue, taste buds are localized to three classes of papillae: In mice, the single circumvallate papilla is found at the very back of the tongue; foliate papillae are at the posterior lateral edge, and fungiform papillae are distributed over the anterior two thirds of the tongue; these three classes of paplilae can be highlighted in mice engineered to express green fluorescent protein in taste bud areas (lower right panel). The taste buds on the tongue and palate are innervated by three afferent nerves: the chorda tympani, greater superficial petrosal, and glossopharyngeal. These nerves carry taste information from the taste receptor cells to the nucleus of the solitary tract (NST) in the brain stem. From the NST, taste responses are transmitted (and processed) through the parabrachial nucleus (PbN) and the thalamus (VPM) to the primary gustatory cortex in the insula. Behavioral responses to food (and perceptions of flavor) are ultimately choreographed by the integration of gustatory information with other sensory modalities (such as olfaction, texture, etc.) 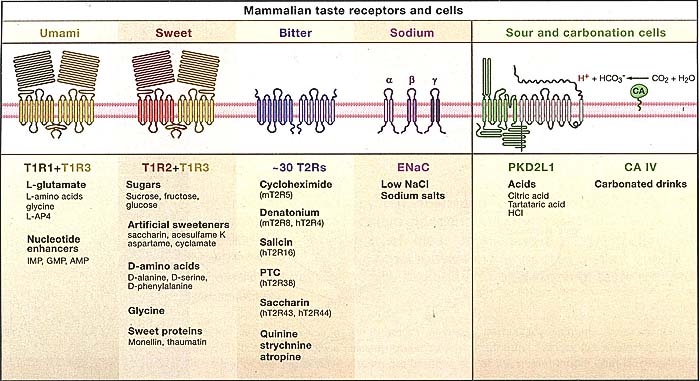 Figure 2. Mammalian Taste Receptors, Cells, and Ligands
Detection of the gustatory world is mediated by several distinct classes of taste receptors and taste receptor cells. Sweet and umami compounds are sensed by T1R heterodimers (Nelson etal., 2001, 2002; Li et al., 2002), while bitter compounds activate T2R receptors (Chandrashekar et al., 2000; Mueller et al., 2005; Meyerhof et al., 2005). Salt is detected via several mechanisms, one of which is thought to rely on the sodium channel ENaC (Heck et al., 1984). Sour-sensing cells are defined by the expression of PKD2L1 (Huang et al., 2006), whereas gustatory responses to carbonation are mediated by the membrane-tethered carbonic anhydrase CA IV (Chandrashekar et al., 2009).
Figure 2. Mammalian Taste Receptors, Cells, and Ligands
Detection of the gustatory world is mediated by several distinct classes of taste receptors and taste receptor cells. Sweet and umami compounds are sensed by T1R heterodimers (Nelson etal., 2001, 2002; Li et al., 2002), while bitter compounds activate T2R receptors (Chandrashekar et al., 2000; Mueller et al., 2005; Meyerhof et al., 2005). Salt is detected via several mechanisms, one of which is thought to rely on the sodium channel ENaC (Heck et al., 1984). Sour-sensing cells are defined by the expression of PKD2L1 (Huang et al., 2006), whereas gustatory responses to carbonation are mediated by the membrane-tethered carbonic anhydrase CA IV (Chandrashekar et al., 2009). 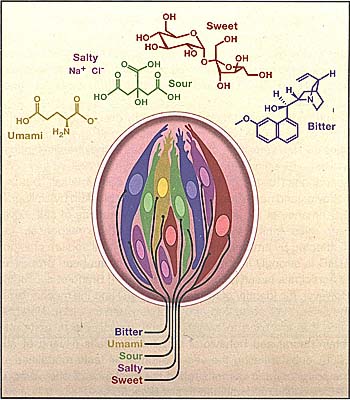 Figure 3. Labeled Lines Mediate Taste Sensation
It is now known that tastes to sweet (red), bitter (blue), sour (green), umami (yellow), and sodium (purple) are mediated by separate populations of selectively tuned taste receptor cells. Notably, taste buds from all regions of the oral cavity contain cells that respond to the five basic modalities. Thus, contrary to popular belief, there is no topographic map (i.e., a tongue map) of taste qualities on the tongue.
Figure 3. Labeled Lines Mediate Taste Sensation
It is now known that tastes to sweet (red), bitter (blue), sour (green), umami (yellow), and sodium (purple) are mediated by separate populations of selectively tuned taste receptor cells. Notably, taste buds from all regions of the oral cavity contain cells that respond to the five basic modalities. Thus, contrary to popular belief, there is no topographic map (i.e., a tongue map) of taste qualities on the tongue.  Figure 4. Behavioral Attraction and Aversion Are Hardwired
Mice and flies have converged on a similar organization of taste coding at the periphery. In both cases, dedicated cells tuned to selective taste qualities are hardwired to trigger specific behavioral responses. The synthetic opiate spiradoline is normally tasteless to mice (A, open circles). However, after targeted expression of the spiradoline receptor (RASSL) to sweet cells, mice exhibit dose-dependent attraction to spiradoline (Zhao et al., 2003). In marked contrast, directing expression of the very same RASSL receptor to bitter cells results in strong aversion to the ligand (Mueller et al., 2005). Similarly, activation of selective populations of gustatory receptor neurons in flies (B) mediates robust innate behavioral responses (Marella et al., 2006). Expression of the mammalian ion channel TrpV1 in sugar-sensing GRNs (Gr5a-TrpV1) results in strong behavioral preference for capsaicin. In contrast, expression of TrpV1 in the "bitter-responsive" Gr66a cells makes capsaicin an aversive tastant. Normal flies do not respond to capsaicin (open circles); preference index = (tastant - control)/ total.
Figure 4. Behavioral Attraction and Aversion Are Hardwired
Mice and flies have converged on a similar organization of taste coding at the periphery. In both cases, dedicated cells tuned to selective taste qualities are hardwired to trigger specific behavioral responses. The synthetic opiate spiradoline is normally tasteless to mice (A, open circles). However, after targeted expression of the spiradoline receptor (RASSL) to sweet cells, mice exhibit dose-dependent attraction to spiradoline (Zhao et al., 2003). In marked contrast, directing expression of the very same RASSL receptor to bitter cells results in strong aversion to the ligand (Mueller et al., 2005). Similarly, activation of selective populations of gustatory receptor neurons in flies (B) mediates robust innate behavioral responses (Marella et al., 2006). Expression of the mammalian ion channel TrpV1 in sugar-sensing GRNs (Gr5a-TrpV1) results in strong behavioral preference for capsaicin. In contrast, expression of TrpV1 in the "bitter-responsive" Gr66a cells makes capsaicin an aversive tastant. Normal flies do not respond to capsaicin (open circles); preference index = (tastant - control)/ total.  Figure 5. Fly Taste Reception
(A) Flies detect tastants via gustatory receptor neurons (GRNs) housed in sensilla distributed across the mouth parts (labella), legs, and wings. Stimulation of GRNs by appetitive tastants elicits extension of the proboscis to initiate feeding. Upon intake, food contacts GRNs in the taste pegs of the inner labellum and in the internal taste organs lining the pharynx (lateral sensory organ, ventral cibarial organ, and dorsal cibarial sensory organ).
(B) Like mammals, fly gustatory receptors are expressed into dedicated classes of GRN detecting distinct classes of attractive or aversive tastants. Most, but not all, sugar and bitter receptors are members of the "Gustatory Receptor" (Gr) gene family (Montell, 2009; Al-Anzi et al., 2006; Mitri et al., 2009). To date, several Grs have been linked to detection of specific attractive or aversive tastants. For example, mutants for Gr66a and Gr93a both show defective behavioral and physiological responses to caffeine (Lee et al., 2009); logically, as fruit flies are not normally exposed to caffeine, this receptor must be activated by ligands sharing structural features with caffeine. As for sugar detection, Gr64f is a candidate receptor required for responses to a wide range of sugars, including sucrose, maltose, glucose, and trehalose (Dahanukar et al., 2007; Jiao et al., 2008; Slone et al., 2007). In contrast, Gr5a is a narrowly tuned receptor for trehalose alone (Chyb et al., 2003). Thus, many receptors may recognize the same sugars, and a given sugar may act on several receptors (or receptor complexes). Carbonation and water are sensed by different subpopulations of GRNs (Fischler et al., 2007; Inoshita and Tanimura, 2006).
Figure 5. Fly Taste Reception
(A) Flies detect tastants via gustatory receptor neurons (GRNs) housed in sensilla distributed across the mouth parts (labella), legs, and wings. Stimulation of GRNs by appetitive tastants elicits extension of the proboscis to initiate feeding. Upon intake, food contacts GRNs in the taste pegs of the inner labellum and in the internal taste organs lining the pharynx (lateral sensory organ, ventral cibarial organ, and dorsal cibarial sensory organ).
(B) Like mammals, fly gustatory receptors are expressed into dedicated classes of GRN detecting distinct classes of attractive or aversive tastants. Most, but not all, sugar and bitter receptors are members of the "Gustatory Receptor" (Gr) gene family (Montell, 2009; Al-Anzi et al., 2006; Mitri et al., 2009). To date, several Grs have been linked to detection of specific attractive or aversive tastants. For example, mutants for Gr66a and Gr93a both show defective behavioral and physiological responses to caffeine (Lee et al., 2009); logically, as fruit flies are not normally exposed to caffeine, this receptor must be activated by ligands sharing structural features with caffeine. As for sugar detection, Gr64f is a candidate receptor required for responses to a wide range of sugars, including sucrose, maltose, glucose, and trehalose (Dahanukar et al., 2007; Jiao et al., 2008; Slone et al., 2007). In contrast, Gr5a is a narrowly tuned receptor for trehalose alone (Chyb et al., 2003). Thus, many receptors may recognize the same sugars, and a given sugar may act on several receptors (or receptor complexes). Carbonation and water are sensed by different subpopulations of GRNs (Fischler et al., 2007; Inoshita and Tanimura, 2006).