Яйцеклетки высвобождаются в перитонеальную или bursal полость и затем подхватываются ресничками воронки. Яйцеклетки млекопитающих почти всегда покрыты многочисленными кумулюсными клетками и обширным внеклеточным матриксом. который распознается с помощью специфических рецепторов на кончиках ресничек. Захват этого комплекса яйцеводами записан с помощью видео, доступного online с использованием хомячков (Talbot et al., 1999) (Fig. 1). После захвата из воронки яйца перемещаются в ампулу яйцевода и ожидают оплодотворения спермием. Непонятно почему и как они остаются в этой области, но они делают это, покрытые кумулюсными массами вплоть до оплодотворения. Способность к оплодотворению яиц зависит от природы cumulus клеток и zona pellucida (Yanagimachi, 1994), но неожиданно, способность слияния со спермием формируется даже тогда, когда незрелые яйцеклетки развиваются без кумулюсных клеток внутри семенников мышей (Isotani et al., 2005).
Спермии и яйцеклетки перемещаются в разных направлениях. Спермиям необходимо достичь женского репродуктивного тракта, чтобы найти яйцеклетки, располагающиеся в яйцеводах, тогда как яйцеклетки спускаются по овидуктам и вступают в матку после оплодотворения. Обычно одна яйцеклетка у человека и около десятка у мышей ожидают спермиев в яйцеводах. По сравнению с количеством яйцеклеток несметное количество спермиев эйякулируется в репродуктивный тракт самки. Однако лишь небольшое количество спермиев достигает места оплодотворения. Матка и яйцеводы соединения uterotubal junction (UTJ). Наружная часть яйцевода провисает в матку и формирует colliculus у мышей, свиней и коров. Тракт очень узок в UTJ и спермий не способен свободно мигрировать в яйцевод через UTJ, это снижает количество спермиев, участвующих в оплодотворении. Неизвестно, только ли один избранный спермий может проникать через UTJ, но известны различные факторы, существенные для прохождения спермиев через UTJ (Cho et al., 1998, Hagaman et al., 1998, Ikawa et al., 2001, Nishimura et al., 2004). Если мы получим химерных мышей, которые эйякулируют смесь спермиев дикого типа и подвижные, но не фертильные спермии от calmegin-аномальных мышей, то только первые спермии из одного и того же эйякулята могут проникать в яйцеводы. Этот результат указывает на возможность отбора на уровне UTJ (Nakanishi et al., 2004).
Хемотаксис спермиев в направлении яйцеклеток до оплодотворения четко продемонстрирован у асцидий (Yoshida et al., 2002). У человека, olfactory receptors (ORs) на спермиях могут участвовать в нахождении яйцеклеток. Было продемонстрировано, что hOR17-4 участвует в хемотаксисе спермиев человека (Spehr et al., 2003). Спермии мышей также находят яйцеклетки путем восприятия хемоаттрактанта (Fukuda et al., 2004). Разрушение ионного канала, экспрессируемого в VNO нейронах является причиной того, что самки ведут себя подобно самцам (Kimchi et al., 2007). Вклад ORs в оплодотворение д. быть подкреплен экспериментами по разрушению генов.
Спермии, продуцируемые в семенниках, переносятся в epididymis и хранятся в cauda epididymis. Будучи эйякулированными, они д. быть активированы стимулами среды самки и начинают энергично плавать. Только стимулированные (capacitated) и acrosome-reacted спермии компетентны оплодотворить яйцеклетку, подобно спичкам, которые необходимо чиркнуть и активировать, прежде чем они получат способность зажечь огонь (Fig. 2).
Природа процесса capacitation недостаточно ясна, но имеется множество работ, показывающих важность фосфорилирования белка и притока ионов кальция после высвобождения "decapacitation factor(s)" из спермиев (De Jonge, 2005). Необходимо отметить, что акросомная реакция является изменением, которое происходит только в capacitated сперматозоидах и постепенно увеличивается на 30- 40% в течение 1-2 ч инкубации in vitro в популяции спермиев мыши.
Это означает. то спермии не гомогенны, а индивидуально отличны один от др. Однако большинство сообщений трактует спермии как смешанную массу, чтобы оценить статус спермиев, поскольку нет подходящего метода для разделения спермиев разных стадий capacitation и/или акросомной реакции. Мы должны знасть, что существует проблема гомогенности в экспериментах которые анализируют спермии как комбинированную массу.
Предложены различные методы для наблюдения за акросомной реакцией (Cross and Meizel, 1989, Larson and Miller, 1999, Saling and Storey, 1979). Наша стратегия наблюдать акросомный статус под микроскопом связана с испоьзованием линий трансгенных мышей с green
fluorescent protein (GFP) в их акросомах. Мы получали трансгенных мышей, чьи спермии имели GFP в их акросоме; зеленая флюоресценция четко видна без предварительной обработки спермиев. После акросомной реакции, GFP исчезает в течение 3-х сек. (Nakanishi et al., 1999). Спермии таких мышей легко могут быть проанализированы с использованием flow cytometer, и real-time анализа акросомной реакции (Nakanishi et al., 1999). Хотя GFP быстро исчезает из акросом, др. компоненты акросом, такие как MN7 антиген и MC41 антиген остаются в спермии, по крайней мере, 15 мин. Т.о., было показано, что акросомная реакция не просто феномен типа всё или ничего, но с промежуточными стадиями. Взаимодействия между спермием и яйцеклеткой необходимо исследовать, принимая во внимание факторы, такие как промежуточная стадия acrosome-reacted спермиев (Kim and Gerton, 2003). Мыши acrosin-GFP доступны все желающим в RIKEN BRC или CARD, Kumamoto University under the registered name, B6;C3 Tg(acro3-EGFP)01Osb or C57BL/6-Tg(CAG/Acr-EGFP)C3-N01-FJ002Osb (http://www.brc.riken.jp/lab/animal/en).
Sperm-egg interactions: an original view
PH-20, как было показано, обладает ролью в связывании спермиев с прозрачной зоной, исходя из находок, что два из трех моноклональных антител, полученных против PH-20, ингибируют связывание спермиев с прозрачной зоной (Primakoff et al., 1988). В 1993, группа, изучающая змеиный яд, нашла достоверную гомологию hyaluronidase с PH-20 (Gmachl and Kreil, 1993). Эти структурные данные, казавшиеся подтверждающие давнишнее мнение, что гиалуронидаза играет роль в оплодотворении, но фактически у обезьян макак зона пенетрантности была полностью блокирована с помощью анти-PH-20 IgG, если воздействовали во время взаимодействия спермий-ооцит (Yudin et al., 1999). Однако, когда мыши с разрушенным геном PH-20 были получены и проверены, то мыши обнаруживали пониженную способность рассеивать кумулюсные клетки, но оставались плодовитыми (Baba et al., 2002). Baba's группа нашла остаточную hyaluronidase активность в спермиях с разрушенным PH-20 мышей и они открыли дополнительную специфичную для спермиев hyaluronidase ген
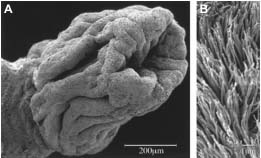 Fig. 1. Hamster infundibulum and magnified view of cilia on its
surface (Talbot et al., 1999). An online video showing the movement of
ovulated eggs into the oviduct is available at: http://www.molbiolcell.org/content/vol10/issue1/images/video/mk0190776002b.mov
Fig. 1. Hamster infundibulum and magnified view of cilia on its
surface (Talbot et al., 1999). An online video showing the movement of
ovulated eggs into the oviduct is available at: http://www.molbiolcell.org/content/vol10/issue1/images/video/mk0190776002b.mov
Hyal5 очень близко к PH-20 в геноме (Kim et al., 2005). Роль hyaluronidase во взаимодействии спермий яйцо была подтверждена, когда мы увидели способность к связыванию у аномальных спермиев после Hyal5 нокаута или двойных нокаутных мышей PH-20 и Hyal5. Имеются множественные факторы, указывающие на участие во взаимодействиях между спермием и прозрачной зоной. Beta 1,4-galactosyltransferase (GalTase), как сообщалось, действует не как фермент, а как фактор связывания спермия с яйцом. Множественные сообщения подтверждают это мнение. Однако, когда была получена линия мышей с нарушенной GalTase группой Shur's, то неожиданно было обнаружено, что спермии, лишенные GalTase, могут оплодотворять яйцеклетки и самцы не стерильны, хотя имеются некоторые минорные дефекты взаимодействий спермий-яйцо (Asano et al., 1997, Lu and Shur, 1997). Это м.б. интерпретировано как доказательство, что роль GalTase компенсируется др. факторами и др. кандидат SED1 был описан как второй фактор соединения с зоной (Ensslin and Shur, 2003). Когда ген
SED1 разрушался, то было установлено, что мыши не стерильны. Такой неожиданный исход по разрушению генов для взаимодействий спермий-яйцо возвращает к 1994. Первое разрушение гена с целью изучения взаимодействий спермий-яйцо было проделано для гена
acrosin. Несмотря на сотни работ, подтвердивших важность acrosin спермиев для оплодотворения, acrosin-нулевые спермии всё ещё могут оплодотворять яйца, хотя и с легкой задержкой по сравнению с диким типом (Adham et al., 1997, Baba et al., 1994). Baba's группа установила, что персистирует protease активность в спермиях мышей с разрушенным геном
acrosin. Хотя они обнаружили 5 более тестис-специфических протеаз с TESP1 по TESP5 (Honda et al., 2002), но роль этих энзимов в оплодотворении нуждается в дальнейшем исследовании.
Существуют дополнительные примеры того, что разрушение "важных" факторов ведет к неожиданно легким фенотипам или дает непредсказуемый фенотип оплодотворения. Fertilin был первоначально выявлен как антиген, распознающий моноклональные антитела против РН-30 спермиев морских свинок. Т.к. PH-30 антитела ингибируют слияние спермий с яйцеклетками, то был клонирован и проанализирован ген PH-30. Было установлено, что антиген является гетеродимером и один из мономерных генов содержит вызывающий слияния домен, сходный с вирусным fusogen. Более того, др. половина гетеродимера, ка было установлено, содержит disintegrin домен, который соединяется с integrin. Т.о., антиген, который реагирует на PH-30, было предположено, является белком слияния и был назван "fertilin," который представлен из fertilin alpha и beta (ADAM1/2) гетеродимером (Blobel et al., 1992). После этого сообщения различного типа дополнительные улики были описаны в подтверждение роли fertilin. Однако, когда Adam2, который формирует гетеромер fertilin, был разрушен, то Adam2-нулевые спермии обнаруживали способность к слиянию с яйцеклетками, но неожиданно спермии оказались неспособны соединяться с прозрачной зоной (Cho et al., 1998). Позднее было установлено, что Adam1 образуется двумя независимыми генами: Adam1a and Adam1b (Nishimura et al., 2002). Оба белка семейства ADAM1 могут образовывать гетеродимер с ADAM2, но "fertilin" на поверхности спермиев обнаруживается исключительно при ADAM1b/ADAM2 типе. Группа Baba's разрушали генADAM1b, но мыши были фертильны без fertilin на спермиях (Kim et al., 2006). Сходная история продолжилась при разрушении CD46 (Inoue et al., 2003), ZPBP1 (Lin et al., 2007) и PKD-REJ (our unpublished data) и некоторых др. факторов (private communications).
Если механизм оплодотворения контролируется избыточно подготовленными факторами, то невозможно проанализировать роль факторов в экспериментах по разрушению единичного гена. Если это так, то упомянутые выше факторы могут представлять собой скорее всего избыточные перекрывающиеся факторы. Если имеется фактор, который не является избыточным и не способен быть компенсирован, то разрушение заинтересованного фактора может продуцировать стерильных мышей. Такие случаи описаны ниже
Sperm-egg interactions: an emerging view
Первый случай нормально плавающих спермиев нормальной формы и количеств, неспособных оплодотворять яйцеклетки был описан нами у мышей с разрушенным геном calmegin (Ikawa et al., 1997). Calmegin
-/- самцы почти полностью стерильны с отсутствием способности у спермиев связываться с прозрачной зоной. Если спермии от таких самцов добавляли к лишенных кумулюсных клеток яйцам под микроскопом, то отмечалось, что спермии теряют свою способность соединяться с зоной и отскакивают от zona pellucida. Однако calmegin непрямо участвует во взаимодействиях спермий-яйцо
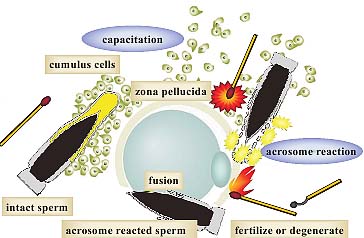 Fig. 2. Mechanism of sperm-egg interaction. Sperm stored in the epididymis are kept metabolically inert to facilitate prolonged storage (left). Each sperm has a membranous sac over the nucleus called the acrosome which is filled with many kinds of hydrolytic enzymes. After sperm are exposed to the female reproductive environment, they become metabolically active.
They undergo capacitation, which permits the acrosome reaction, and start to swim extremely vigorously (hyperactivation). Near the eggs, probably stimulated by the cumulus cells and zona pellucida, they undergo
the acrosome reaction to release the acrosomal contents by exocytosis. Only acrosomereacted sperm are known to fuse with eggs but their competency for fusion does not last long. The integrity of the acrosome in
the mouse sperm can be monitored easily by using transgenic mice in which the GFP protein is targeted to the acrosomal contents (Nakanishi et al., 1999).
Fig. 2. Mechanism of sperm-egg interaction. Sperm stored in the epididymis are kept metabolically inert to facilitate prolonged storage (left). Each sperm has a membranous sac over the nucleus called the acrosome which is filled with many kinds of hydrolytic enzymes. After sperm are exposed to the female reproductive environment, they become metabolically active.
They undergo capacitation, which permits the acrosome reaction, and start to swim extremely vigorously (hyperactivation). Near the eggs, probably stimulated by the cumulus cells and zona pellucida, they undergo
the acrosome reaction to release the acrosomal contents by exocytosis. Only acrosomereacted sperm are known to fuse with eggs but their competency for fusion does not last long. The integrity of the acrosome in
the mouse sperm can be monitored easily by using transgenic mice in which the GFP protein is targeted to the acrosomal contents (Nakanishi et al., 1999).
Calmegin является тестис-специфическим гомологом повсеместно экспрессируемого endoplasmic (ER) молекулярного шаперона calnexin. Во время сперматогенеза спермии прячут аппарат синтеза белка, включая ER. Т.о., даже у мышей дикого типа не остается calmegin на спермиях. Следовательно, можно предположить, что calmegin дей2ствует. чтобы упаковывать молекулы, которые предназначены функционировать в связывании спермий-яйцо. Затем мы опубликовали результаты разрушения calmegin, и связанные с разрушением двух др. генов, Adam2 и angiotensin converting enzyme (ACE), которые и приводили к стерильности самцов. Особенность в том. что нокаутные линии мышей и нокаутные calmegin мыши имели общий фенотип нарушения способности связывания прозрачной зоны и в то же самое время нарушение способности преодолевать UTJ. Мы полагаем, что взаимодействие calmegin с ADAM2 вполне возможно, так мы иммунопреципитировали calmegin из тестикулярных лизатов и проверяли взаимодействия calmegin с ADAM2. Иммунопреципитация, сопровождаемая western blot анализом показала, что ADAM1a, ADAM1b и ADAM2 специфически формируют комплексы с calmegin в ER. Разрушение calmegin, как было установлено, вызывает нарушение гетеродимеризации ADAM1a/2 и
ADAM1b/2 , ведущее к полной потере ADAM2 из взрослых спермиев. Т.о., причина, почему мыши с разрушенным calmegin и Adam2 обладают одни и тем же фенотипом, становится ясной (Ikawa et al., 2001).
К нашему удивлению, мыши с разрушенным геном Adam3также оказались стерильны с нарушением способности соединяться с прозрачной зоной (Shamsadin et al., 1999). Почему столь многие нарушения генов приводят к одному фенотипу? Это объясняется простой причиной. Количество белка семейства ADAM в спермиях легко затрагивается исчезновением любого др. члена семейства ADAM. Группа Baba's нашли, что тестис-специфический ADAM1a существенен для оплодотворения, но они также установили, что если ADAM1a элиминируется, то, ADAM3 также исчезает из спермиев (Nishimura et al., 2004). Синхронное исчезновение белков семейства ADAM описано многими исследователями (Cho et al., 1998, Ikawa et al., 2001, Nishimura et al., 2004, Stein et al., 2005). Ошеломляющий результат был описан группой Baba's. Когда они получали мышей с разрушенным Adam1b (fertilin beta) геном, то они установили, что Adam2 также исчезает из спермиев, но спермии остаются фертильными. Это ясно указывает на то, что интенсивно изучаемый белок "fertilin" исчезает при оплодотворении. Сведя эти данные вместе, стало ясно, что ADAM3 выступает как предполагаемая ключесвая молекула при оплодотворении. Механизм бесплодия, вызываемый разрушением ACE остается неясным. Однако было продемонстрировано взаимоотношение между ACE и ADAM3. Мы анализировали ADAM3 у мышей с разрушенным Ace, и подтвердили специфическое исчезновение мембранного микро домена ADAM3. Мы выявили достоверное снижение ADAM3 у Ace-/- спермиев в Triton X-114 detergent-обогащенной фазе после фазы разделения, тогда как ADAM2 оставался неизменным на спермиях (Yamaguchi et al., 2006) (Fig. 3).
Комбинирование вместе этих фактов показало, что наиболее важный фактор, который может участвовать в связывании спермиев с прозрачной зоной, ориентировочно является ADAM3
(Yamaguchi et al., 2006). Однако множественные изоформы транскриптов Adam3, обнаруживаемые у человека оказались нефункциональными из-за присутствия делеций и in-frame кодонов окончания (Frayne et al., 1999). Следовательно, ADAM3 не может быть безусловно универсальным зона-связывающим фактором среди млекопитающих.
В терминах др. факторов кандидатов для связывания зоны, sp56 был идентифицирован как имеющий характеристики, ожидаемые для белка спермиев, ответственного за распознавание zona pellucida яйца. Комплементарная ДНК кодирующей sp56 была выделена и её первичные последовательности показали, что sp56 является членом сверхсемейства белковых рецепторов(Bookbinder et al., 1995). Zonadhesin является много-доменовым трансмембранным белком, по-видимому, действующим как белок связывания спермий-zona pellucida (Hardy and Garbers, 1995, Jansen et al., 2001, Lea et al., 2001, Wassarman, 1992). Необходимо проверить способность к оплодотворению спермиев. которые лишены этих факторов, чтобы придти к окончательному решению.
Более того необходимо отметить, что все спермии мышей с calmegin-, ADAM1a- , ADAM2- и ACE-разрушенным геном обладают фенотипом неспособности не только соединяться с прозрачной зоной, но и также мигрировать в яйцеводы (Cho et al., 1998, Hagaman et al., 1998, Ikawa et al., 2001, Nishimura et al., 2004) Загадка, почему же разные неспособности соединения спермий-зона и миграция в яйцеводы идут параллельно в этих экспериментах по разрушению генов.
Membrane fusion
Липидная мембрана обладает текучестью как горизонтально, так и поперечно и существуют различные механизмы для поддержания липидной конституции как наружной, так и внутренней сторон мембраны. Если клетке необходимо разделиться, то мембрана д. быть разделена на две секции. Топологически, чтобы достичь этого д. произойти разрыв мембраны в липидном бислое в определенный момент цитокинеза. Если мембрана яйцеклетки разрывается искусственно, как это делается, когда мы внедряемся в яйцевую мембрану для intracytoplasmic sperm injection (ICSI), то отверстие запечатывается немедленно. Однако способность к восстановлению непрочна. Она отличается в зависимости от стадии яиц. Она отличается также в зависимости от вида. Напр., мышиные яйцеклетки более ломки, чем яйцеклетки человека. Мы не знаем о причинах, но образование и формирование характерной природы мембраны д. происходить путем комбинирования различных механизмов, таких как формирование подслоя и состав липидов мембраны. Мембраны спермиев также, как известно, обладают сложной структурой, которая содержит холестероловые плотные "платформы", которые модифицируются активно во время capacitation спермиев (De Jonge, 2005), а однородно выглядящие мембраны под ЭМ в действительности подразделены на некоторые области, если проверять с помощью антител, направленных против спермиев.
Существуют различные важные события слияния мембран в некоторых тканях. Напр., скелетномышечные клетки формируются после слияния миобластных клеток. Клетки трофобласта сливаются др. с др., чтобы сформировать синцитиотрофобласт, который необходим для имплантации. Остеокласты резорбируют кость во многих местах, изредка содержат более 100 ядер и формируются за счет слияний клеток (Yagi et al., 2005). Митохондриальные мембраны сливаются с соседними митохондриальными мембранами, используя mitofusin1 и mitofusion2 (Chen and Chan, 2005). Одним из наиболее точно исследованных процессов слияния является экзоцитоз. SNAREs (soluble N-ethylmaleimide-sensitive fusion protein attachment protein receptors), а некоторые типы вирусов, по-видимому, воспроизводят механизм слияния, используя SNAREs для инвазии (Chan et al., 1997, Lu et al., 1995, Weissenhorn et al., 1997). Структуры вирусных белков слияния указывают на то, что аппарат слияния использует фундаментально сходный механизм для соединения липидных слоёв. Оплодотворение является феноменом, который использует слияние мембран между плазматической мембраной неоплодотворенного яйца и только что перестроенной мембраной спермия вскоре после акросомной реакции. Обе гаметы собственно подготовлены для совершения слияния мембран, но факторы, участвующие в слиянии неизвестны.
Sperm-egg fusion in gene disrupted mice
Эксперименты по разрушению генов не только опрокидывают предсказанную важность различных факторов, но и также вносят новые факторы в механизм оплодотворения. Поскольку все, кто получают линии мышей с нокаутными генами, нуждаются в их разведении для поддержания линии, то если имеется какой-либо дефект в процессе оплодотворения, то это привлекает внимание исследователей. Напр., CD9 был разрушен с целью определить эффекты на иммунную функцию. Однако CD9-дефицитные мыши выглядели здоровыми и жили нормально, но неожиданно, самки, лишенные CD9 были стерильными, тогда как самцы мышей оставались нормальными (Kaji et al., 2000, Le Naour et al., 2000, Miyado et al., 2000). Мы анализировали причину стерильности, используя in vitro fertilization (IVF) и установили, что яйцеклетки лишены способности сливаться со спермиями (Miyado et al., 2000). Т.к. слияния не происходит, то кортикальные гранулы не высвобождаются, чтобы блокировать полиспермию (Barros and Yanagimachi, 1971, Yanagimachi, 1994), это делает возможным проникновение множественных спермиев в перивителлиновое пространство ( Fig. 4A). Т.о., был открыт случайно первый фактор слияния спермий-яйцо. CD9 является членом семейства "tetraspanin", белков обладающих 4 трансмембранными доменами и способностью соединяться с интегринами. Т.к. integrins α6 и β1 ,быи нацдены на яйцевой мембране, изучался эффект добавления синтетических интегриновых пептидов в системе IVF и было отмечено подавления слияния спермий-яйцо (Chen et al., 1999). И снова эксперименты по разрушению гена для integrin α6 и β1 показали, что оба интегрина
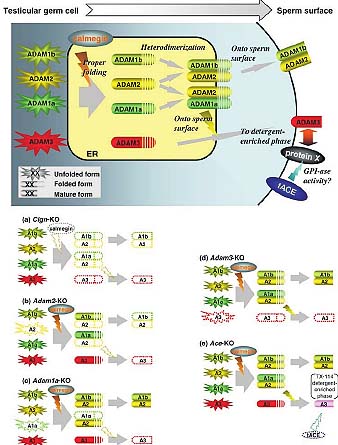 Fig. 3. Schematic model for ADAMs and their roles in sperm function. The disruption of the genes that encode Adam1a, Adam2, and Adam3 results in impaired sperm-ZP binding. CLGN is required for the folding of ADAM1a, ADAM1b, and ADAM2 and the subsequent dimerization of these proteins. In Clgn-/- (a) and Adam2-/- (b) sperm, the disappearance of the ADAM1a/ADAM2 and ADAM1b/ADAM2 heterodimers results in the loss of ADAM1b, ADAM2, and ADAM3
from the sperm. ADAM1a is a testis-specific protein that is not found in sperm (Kim et al., 2003). When ADAM1a is eliminated (c), the ADAM1a/ADAM2 heterodimer disappears from the testis, whereas the expression of ADAM1b/ADAM2 is not affected. However, these sperm
lack ADAM3 (Nishimura et al., 2004). The disruption of ADAM3 (d) is reported to have no significant effect on ADAM1a, ADAM1b or ADAM2 (Nishimura et al., 2001). These findings suggest that ADAM3 is located downstream of these
other ADAM proteins. The disruption of tACE leads to the aberrant localization of ADAM3 (e), most likely due to a different pathway from the
one hypothesized for CLGN/ADAMs. These results indicate the importance of ADAM3 in sperm-ZP interaction and explain why disruption of the
individual Ace, Clgn, Adam1a, Adam2, and Adam3 genes produces similar phenotypes.
Fig. 3. Schematic model for ADAMs and their roles in sperm function. The disruption of the genes that encode Adam1a, Adam2, and Adam3 results in impaired sperm-ZP binding. CLGN is required for the folding of ADAM1a, ADAM1b, and ADAM2 and the subsequent dimerization of these proteins. In Clgn-/- (a) and Adam2-/- (b) sperm, the disappearance of the ADAM1a/ADAM2 and ADAM1b/ADAM2 heterodimers results in the loss of ADAM1b, ADAM2, and ADAM3
from the sperm. ADAM1a is a testis-specific protein that is not found in sperm (Kim et al., 2003). When ADAM1a is eliminated (c), the ADAM1a/ADAM2 heterodimer disappears from the testis, whereas the expression of ADAM1b/ADAM2 is not affected. However, these sperm
lack ADAM3 (Nishimura et al., 2004). The disruption of ADAM3 (d) is reported to have no significant effect on ADAM1a, ADAM1b or ADAM2 (Nishimura et al., 2001). These findings suggest that ADAM3 is located downstream of these
other ADAM proteins. The disruption of tACE leads to the aberrant localization of ADAM3 (e), most likely due to a different pathway from the
one hypothesized for CLGN/ADAMs. These results indicate the importance of ADAM3 in sperm-ZP interaction and explain why disruption of the
individual Ace, Clgn, Adam1a, Adam2, and Adam3 genes produces similar phenotypes.
несущественны для слияния со спермием (Miller et al., 2000). Спермий д. завершить акросомную реакцию до оплодотворения. Это может повлиять так, что fusogenic факторы, латентные в свежих спермиях, экспозируются только после акросомной реакции. Мы получили моноклональные антитела против спермиев человека и провели скрининг, какие из них не реагируют со свежими спермиями, но реагируют на спермии после акросомной реакции. Если антитела могут ингибировать слияние спермий-яйцо, то соотв. антиген д. быть хорошим кандидатом на роль фактора слияния. Базируясь на этой гипотезе, мы получили моноклональные антитела против спермиев человека MH61, удовлетворяющие этому критерию (Okabe et al., 1990). Был идентифицирован реагирующий антиген как CD46, чья функция заключалась быть complement receptor у человека. Однако, когда мы клонировали ген
CD46 у мышей, то CD46 оказался присутствующим только в спермиях (Tsujimura et al., 1998). Мы полагаем, что это указывает на оригинальную роль CD46, связанную со взаимодействием спермий-яйцо. Следовательно, мы получали мышей с разрушенным CD46 с ожидаемой индуцированной стерильностью, но такие мыши не обнаруживали видимых изменений в способности к оплодотворению у самцов и самок (Inoue et al., 2003).
Затем мы анализировали OBF13 моноклональные антитела, которые были получены против спермиев мышей, и которые соединялись только со спермиями после акросомной реакции и ингибировали слияние спермий-яйцо у мышей (Okabe et al., 1987). Недавно м идентифицировали антиген путем отделения из неочищенных экстрактов спермиев мышей с помощью двумерного гель электрофореза и последующего immunoblotting с моноклональными антителами. Идентифицированные пятна были проанализированы с помощью жидкостной хроматографии и mass spectrometry (LC-MS/MS). Ген антигена кодирует мембранный белок immunoglobulin superfamily (IgSF), type I с внеклеточным иммуноглобулиновым доменом, который содержит один из предполагаемых сайтов гликозилирования. Мы назвали антиген "Izumo" по-японски Shinto shrine, означающем замужество. Затем мы получили линию мышей с разрушенным Izumo. Izumo-нулевые самцы обнаруживали полную стерильность, несмотря на нормальное поведение спаривания с обычным образованием вагинальных пробок. Этими мышами не было произведено потомство. Когда проверили способность спермиев к оплодотворению в системе оплодотворения
in vitro , то многие спермии обнаруживались внутри перевителлинового пространства, указывая тем самым, что оплодотворения прекращалось на стадии слияния спремий-яйцо (Fig. 4B). Однако, когда мы осуществили intracytoplasmic sperm injection (ICSI) , используя Izumo
-/- спермии, то они могли активировать яйцеклетки и яйца имплантировались нормально давали нормальных эмбрионов. Следовательно, дефицит белка Izumo влияет только на стадию слияния спермий-яйцо (Inoue et al., 2005).
Relationship between the gene disruptions and their
apparent phenotype
Необходима осторожность относительно "off target" эффектов разрушения генов. Целенаправленное разрушение миогенного basic-helix-loop-helix гена
Mrf4 является прекрасным примером. Фенотипы трех разных линий мышей, с разрушенным Mrf4 из трех разных лабораторий со слегка отличными векторами доставки, оказались очень разными, в пределах от полной жизнеспособности гомозигот до гомозигот с полной летальностью. Эти три сходные, но слегка отличные вектора оказывали очень разные эффекты на экспрессию соседнего гена
Myf5, это объясняет такие фенотипические вариации (Olson et al., 1996). Др. примером потенциальной западни разрушения гена является случай разрушения гена Prion (PrP). Описано 5 независимых PrP нокаутных линий мышей с отсутствием фенотипических отклонений (Bueler et al., 1992, Manson et al., 1994) и с мозжечковыми симптомами (Moore et al., 1999, Sakaguchi et al., 1996, Silverman et al., 2000). Расхождения оказались ассоциированными с межгенным сплайсингом с соседним
Doppel геном в некоторых и векторов доставки (Flechsig et al., 2003, Rossi et al., 2001). Чтобы проверить, что отсутствие Izumo непосредственно вызывается неспособностью к слиянию, мы получили трансгенную линию, где Izumo управляется с помощью тестис-специфического промотора calmegin. Фенотип стерильности устранялся после трансгенной экспрессии Izumo на спермиях мышей. Т.о., мы убедились, что Izumo является фактором спермиев, важным для слияния спермий-яйцо.
Generality of sperm-egg fusion factors
В событии связывания спермия с прозрачной зоной ADAM3 занимает центральную позицию у мышей, но эквивалентный ген у человека, по-видимому, не продуцирует функциональный белок (Frayne et al., 1999). Было бы любопытно посмотреть, не является ли Izumo видо-специфичным. Поэтому, Izumo
-/- спермии смешивали с яйцеклетками хомячков, которые были способны сливаться во спермиями разных видов. В результате было установлено, что Izumo важен для спермиев мыши, чтобы сливаться с яйцеклетками хомячка. Сходным образом, слияние спермиев человека с яйцеклетками хомячка ингибируется при добавлении антител против Izumo человека. Это может указывать на то, что Izumo участвует в слиянии спермий-яйцо у человека также. Однако добавление антител в условиях IVF часто предоставляет нам другое мнение, полученное на основании различных манипуляций с генами животных. Поэтому пока слишком рано делать вывод, что Izumo функционирует и у человека. Это станет ясно, когда люди с мутациями в своем гене
Izumo будут охарактеризованы как бесплодные с симптомом неспособности к слиянию. Во всяком случае, первые
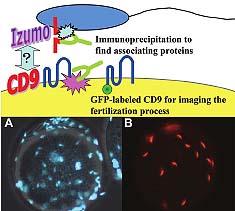 Fig. 4. Accumulation of sperm in the perivitelline space caused by
failure of sperm–egg fusion. Only one factor each on sperm and eggs
is available at the moment. As in the case of live imaging acrosome
reaction (ftp://ftp.gen-info.osaka-u.ac.jp/ARmovie/), the imaging of the
fusion factors at the time of fertilization may be possible by producing
fluorescent chimeric proteins. Immunoprecipitation will also clarify the
new factors involved in the fusion event. (A) Sperm accumulated in the
perivitelline space of CD9–/– mouse eggs. The sperm could penetrate the
zona pellucida but failed to fuse with the egg surface. Many sperm were
able to enter because of the lack of egg activation, which normally leads
to cortical granule release and the zona block to polyspermy. Sperm
nuclei were stained with Hoechst 33342(Miyado et al., 2000). (B) Similarly, when eggs were inseminated with Izumo–/– sperm, the sperm could penetrate the zona pellucida but failed to fuse with the eggs. This also resulted in the accumulation of many sperm inside the perivitellinespace (Inoue et al., 2005). These penetrated sperm had clearly undergone the acrosome reaction, as they were all exposing the acrosome reacted sperm-specific antigen MN9 (Toshimori et al., 1998).
Fig. 4. Accumulation of sperm in the perivitelline space caused by
failure of sperm–egg fusion. Only one factor each on sperm and eggs
is available at the moment. As in the case of live imaging acrosome
reaction (ftp://ftp.gen-info.osaka-u.ac.jp/ARmovie/), the imaging of the
fusion factors at the time of fertilization may be possible by producing
fluorescent chimeric proteins. Immunoprecipitation will also clarify the
new factors involved in the fusion event. (A) Sperm accumulated in the
perivitelline space of CD9–/– mouse eggs. The sperm could penetrate the
zona pellucida but failed to fuse with the egg surface. Many sperm were
able to enter because of the lack of egg activation, which normally leads
to cortical granule release and the zona block to polyspermy. Sperm
nuclei were stained with Hoechst 33342(Miyado et al., 2000). (B) Similarly, when eggs were inseminated with Izumo–/– sperm, the sperm could penetrate the zona pellucida but failed to fuse with the eggs. This also resulted in the accumulation of many sperm inside the perivitellinespace (Inoue et al., 2005). These penetrated sperm had clearly undergone the acrosome reaction, as they were all exposing the acrosome reacted sperm-specific antigen MN9 (Toshimori et al., 1998).
недвусмысленно связанные со слиянием факторы на спермиях (Izumo) и яйцеклетках (CD9) выяснены. Мыши доступны всем желающим через Japanese animal distribution systems
(indicated earlier).
Conclusions
Experiments using gene-manipulated animals are very powerful tools for judging the essentiality of concerned factors in fertilization. Of course, if a certain factor is judged as “not essential,” it does not necessarily mean the factor is not functioning in vivo. However, the number of genes that are indispensable in fertilization is accumulating and their relationships with fertilization biology are emerging in the field of sperm-zona interaction. Gene disruption experiments are pursued in many research fields and the number of genes disrupted is increasing day by day. Thus, any genes that might affect reproduction will continue to be found even by researchers in different field. The day that we can draw a clear image of the sperm-egg fusion mechanism in molecular biology is definitely nearing.
Сайт создан в системе
uCoz Fig. 1. Hamster infundibulum and magnified view of cilia on its
surface (Talbot et al., 1999). An online video showing the movement of
ovulated eggs into the oviduct is available at: http://www.molbiolcell.org/content/vol10/issue1/images/video/mk0190776002b.mov
Fig. 1. Hamster infundibulum and magnified view of cilia on its
surface (Talbot et al., 1999). An online video showing the movement of
ovulated eggs into the oviduct is available at: http://www.molbiolcell.org/content/vol10/issue1/images/video/mk0190776002b.mov  Fig. 2. Mechanism of sperm-egg interaction. Sperm stored in the epididymis are kept metabolically inert to facilitate prolonged storage (left). Each sperm has a membranous sac over the nucleus called the acrosome which is filled with many kinds of hydrolytic enzymes. After sperm are exposed to the female reproductive environment, they become metabolically active.
They undergo capacitation, which permits the acrosome reaction, and start to swim extremely vigorously (hyperactivation). Near the eggs, probably stimulated by the cumulus cells and zona pellucida, they undergo
the acrosome reaction to release the acrosomal contents by exocytosis. Only acrosomereacted sperm are known to fuse with eggs but their competency for fusion does not last long. The integrity of the acrosome in
the mouse sperm can be monitored easily by using transgenic mice in which the GFP protein is targeted to the acrosomal contents (Nakanishi et al., 1999).
Fig. 2. Mechanism of sperm-egg interaction. Sperm stored in the epididymis are kept metabolically inert to facilitate prolonged storage (left). Each sperm has a membranous sac over the nucleus called the acrosome which is filled with many kinds of hydrolytic enzymes. After sperm are exposed to the female reproductive environment, they become metabolically active.
They undergo capacitation, which permits the acrosome reaction, and start to swim extremely vigorously (hyperactivation). Near the eggs, probably stimulated by the cumulus cells and zona pellucida, they undergo
the acrosome reaction to release the acrosomal contents by exocytosis. Only acrosomereacted sperm are known to fuse with eggs but their competency for fusion does not last long. The integrity of the acrosome in
the mouse sperm can be monitored easily by using transgenic mice in which the GFP protein is targeted to the acrosomal contents (Nakanishi et al., 1999).  Fig. 3. Schematic model for ADAMs and their roles in sperm function. The disruption of the genes that encode Adam1a, Adam2, and Adam3 results in impaired sperm-ZP binding. CLGN is required for the folding of ADAM1a, ADAM1b, and ADAM2 and the subsequent dimerization of these proteins. In Clgn-/- (a) and Adam2-/- (b) sperm, the disappearance of the ADAM1a/ADAM2 and ADAM1b/ADAM2 heterodimers results in the loss of ADAM1b, ADAM2, and ADAM3
from the sperm. ADAM1a is a testis-specific protein that is not found in sperm (Kim et al., 2003). When ADAM1a is eliminated (c), the ADAM1a/ADAM2 heterodimer disappears from the testis, whereas the expression of ADAM1b/ADAM2 is not affected. However, these sperm
lack ADAM3 (Nishimura et al., 2004). The disruption of ADAM3 (d) is reported to have no significant effect on ADAM1a, ADAM1b or ADAM2 (Nishimura et al., 2001). These findings suggest that ADAM3 is located downstream of these
other ADAM proteins. The disruption of tACE leads to the aberrant localization of ADAM3 (e), most likely due to a different pathway from the
one hypothesized for CLGN/ADAMs. These results indicate the importance of ADAM3 in sperm-ZP interaction and explain why disruption of the
individual Ace, Clgn, Adam1a, Adam2, and Adam3 genes produces similar phenotypes.
Fig. 3. Schematic model for ADAMs and their roles in sperm function. The disruption of the genes that encode Adam1a, Adam2, and Adam3 results in impaired sperm-ZP binding. CLGN is required for the folding of ADAM1a, ADAM1b, and ADAM2 and the subsequent dimerization of these proteins. In Clgn-/- (a) and Adam2-/- (b) sperm, the disappearance of the ADAM1a/ADAM2 and ADAM1b/ADAM2 heterodimers results in the loss of ADAM1b, ADAM2, and ADAM3
from the sperm. ADAM1a is a testis-specific protein that is not found in sperm (Kim et al., 2003). When ADAM1a is eliminated (c), the ADAM1a/ADAM2 heterodimer disappears from the testis, whereas the expression of ADAM1b/ADAM2 is not affected. However, these sperm
lack ADAM3 (Nishimura et al., 2004). The disruption of ADAM3 (d) is reported to have no significant effect on ADAM1a, ADAM1b or ADAM2 (Nishimura et al., 2001). These findings suggest that ADAM3 is located downstream of these
other ADAM proteins. The disruption of tACE leads to the aberrant localization of ADAM3 (e), most likely due to a different pathway from the
one hypothesized for CLGN/ADAMs. These results indicate the importance of ADAM3 in sperm-ZP interaction and explain why disruption of the
individual Ace, Clgn, Adam1a, Adam2, and Adam3 genes produces similar phenotypes.  Fig. 4. Accumulation of sperm in the perivitelline space caused by
failure of sperm–egg fusion. Only one factor each on sperm and eggs
is available at the moment. As in the case of live imaging acrosome
reaction (ftp://ftp.gen-info.osaka-u.ac.jp/ARmovie/), the imaging of the
fusion factors at the time of fertilization may be possible by producing
fluorescent chimeric proteins. Immunoprecipitation will also clarify the
new factors involved in the fusion event. (A) Sperm accumulated in the
perivitelline space of CD9–/– mouse eggs. The sperm could penetrate the
zona pellucida but failed to fuse with the egg surface. Many sperm were
able to enter because of the lack of egg activation, which normally leads
to cortical granule release and the zona block to polyspermy. Sperm
nuclei were stained with Hoechst 33342(Miyado et al., 2000). (B) Similarly, when eggs were inseminated with Izumo–/– sperm, the sperm could penetrate the zona pellucida but failed to fuse with the eggs. This also resulted in the accumulation of many sperm inside the perivitellinespace (Inoue et al., 2005). These penetrated sperm had clearly undergone the acrosome reaction, as they were all exposing the acrosome reacted sperm-specific antigen MN9 (Toshimori et al., 1998).
Fig. 4. Accumulation of sperm in the perivitelline space caused by
failure of sperm–egg fusion. Only one factor each on sperm and eggs
is available at the moment. As in the case of live imaging acrosome
reaction (ftp://ftp.gen-info.osaka-u.ac.jp/ARmovie/), the imaging of the
fusion factors at the time of fertilization may be possible by producing
fluorescent chimeric proteins. Immunoprecipitation will also clarify the
new factors involved in the fusion event. (A) Sperm accumulated in the
perivitelline space of CD9–/– mouse eggs. The sperm could penetrate the
zona pellucida but failed to fuse with the egg surface. Many sperm were
able to enter because of the lack of egg activation, which normally leads
to cortical granule release and the zona block to polyspermy. Sperm
nuclei were stained with Hoechst 33342(Miyado et al., 2000). (B) Similarly, when eggs were inseminated with Izumo–/– sperm, the sperm could penetrate the zona pellucida but failed to fuse with the eggs. This also resulted in the accumulation of many sperm inside the perivitellinespace (Inoue et al., 2005). These penetrated sperm had clearly undergone the acrosome reaction, as they were all exposing the acrosome reacted sperm-specific antigen MN9 (Toshimori et al., 1998).