Транскрипционная негативная обратная связь, генерируемая с помощью ERK-обусловленной экспрессии DuSP, может вызывать осцилляции ERK и DuSP, которые образуются на более длинной временной шкале, чем осцилляции, возникающие в результате непосредственной негативной обратной связи в цитозоле8,27. У гаплоидных Saccharomyces cerevisiae, секретируемые феромоны активируют передачу сигналов MAPK в клетках противоположного типа спаривания, приводя к образованию проекций для спаривания. Недавнее исследование выявило, что в этих клетках осцилляции активности Fus3 MAPK зависят от транскрипционной индукции MAPK phosphatase msg5 и передачи сигналов негативного регулятора рецепторов феромонов, Sst2 (REF. 28). Осцилляции Fus3 наблюдаются на той же временной шкале (2-3 ч) как и при периодическом образовании дополнительных проекций для спаривания28. Т.о., осцилляции сигнальной активности MAPK играют физиологическую роль в контроле генной экспрессии на длинной временной шкале.
Ультра чувствительные и бистабильные реакции (FIG. 1f) могут быть выявлены с помощью длинных позитивных34 или коротких позитивных петель обратной связи. Напр., длинные позитивные петли обратной связи это инактивация RKIP с помощью ERK16. Короткие позитивные петли обратной связи возникают, когда Ras-GTP (продуцируемые, когда SOS катализирует замену GDP на GTP в нуклеотид-связывающем кармане Ras) соединяются с SOS аллостерическим карманом.
Это вызывает существенное увеличение активности этих Ras-активирующих GEF, тем самым стимулируется дальнейшая активация Ras
35. Преобразование в цифровую форму сигнала наблюдается также в ядре. В Swiss 3T3 фибробластах EGF вызывает мимолётную активность ERK и ничтожную индукцию FOS IEG, тогда как platelet-derived growth factor (PDGF) вызывает длительную активность ERK и длительную FOS ответную реакцию
36. Это результат кооперативной экспрессии и фосфорилирования. EGF-индуцированная активность ERK стимулирует транскрипцию FOS, но FOS быстро деградирует. PDGF вызывает длительную активность ERK и её субстрата, ribosomal S6 kinase (RSK), которая стабилизирует зарождающиеся FOS путем фосфорилирования их по множественным сайтам. Инициальное фосфорилирование FOS по С-концу ERK docking сайта ведет к дальнейшему фосфорилированию по Thr325 и Thr331 (REF. 36). Мы полагаем, что фосфорилирование множественных сайтов и гнездовая feed-forward стабилизация петель от ERK и RSK к FOS, приводят к наблюдаемой switch-like экспрессии
4,18,37. Т.о., FOS служит в качестве бинарного клеточного сенсора продолжительности и интенсивности порога передачи сигналов ERK
36.Реакция всё-или-ничего ERK-индуцируемых IEG продуктов генерирует самостоятельные транскрипционные программы, это ведет к разным клеточным фенотипам.
Spatiotemporal control of information
Помимо спецификации временной кинетики функционирования сети, пространственный контроль играет большую и комплементарную часть. Хотя пространственный компонент менее изучен, чем временной, его важность подчеркивается новыми находками.
Spatiotemporal organization controls network function. Недавние работы показали, как различия в динамическом ERK interactome побуждают клетки PC12 выбирать клеточные судьбы
3. Количественная протеомика показала, что ~20% партнеров ERK по взаимодействию соединяются с ERK регулируемым ростовыми факторами способом, а ~30% из этих взаимодействий дифференциально регулируются с помощью EGF и NGF
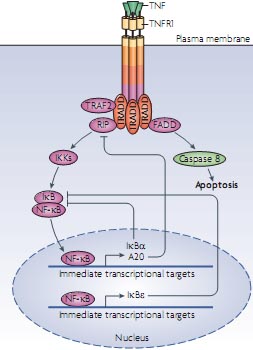 Figure 2 | Intrinsic transcriptional feedback inhibition of NF-κB. In resting cells nuclear factor-κB (NF-κB) is inactive because inhibitor of NF-κB (IκB) retains it in the cytosol. On activation, for example by tumour necrosis factor (TNF), TNF receptor 1 (TNFR1) forms a complex with the adaptor protein TNFR-associated DEATH domain (TRADD), which recruits different proteins to initiate dual signalling pathways. TRADD recruits FAS-associated death domain (FADD) to promote apoptosis by stimulating caspase 8 activation. By contrast, TRADD recruits the adaptor receptor interacting protein (RIP) to counteract apoptosis by activating NF-κB. NF-κB activation is enabled as a result of the stimulus-induced degradation of IκBs following their phosphorylation by IκB kinases (IKKs), which releases NF-κB from its cytosolic anchor proteins so that it can translocate to the nucleus. However, nuclear NF-κB also induces the transcription of its own inhibitors. IκBs can bind to nuclear NF-κB and export it back to the cytosol, and A20 can interrupt receptor-mediated NF-κB activation by inducing the degradation of RIP.
Figure 2 | Intrinsic transcriptional feedback inhibition of NF-κB. In resting cells nuclear factor-κB (NF-κB) is inactive because inhibitor of NF-κB (IκB) retains it in the cytosol. On activation, for example by tumour necrosis factor (TNF), TNF receptor 1 (TNFR1) forms a complex with the adaptor protein TNFR-associated DEATH domain (TRADD), which recruits different proteins to initiate dual signalling pathways. TRADD recruits FAS-associated death domain (FADD) to promote apoptosis by stimulating caspase 8 activation. By contrast, TRADD recruits the adaptor receptor interacting protein (RIP) to counteract apoptosis by activating NF-κB. NF-κB activation is enabled as a result of the stimulus-induced degradation of IκBs following their phosphorylation by IκB kinases (IKKs), which releases NF-κB from its cytosolic anchor proteins so that it can translocate to the nucleus. However, nuclear NF-κB also induces the transcription of its own inhibitors. IκBs can bind to nuclear NF-κB and export it back to the cytosol, and A20 can interrupt receptor-mediated NF-κB activation by inducing the degradation of RIP.
и влияют на дифференцировку. Известно, что большинство этих взаимодействий регулирует пространственные и временные аспекты передач сигналов ERK. Цитозольные взаимодействия используют преформированные комплексы, из которых ERK высвобождается в ответ на стимуляцию с помощью NGF и EGF. Ядерные взаимодействия ERK индуцируются в ответ на NGF, который стимулирует транслокацию в ядро ERK (это необходимо для дифференцировки). В ядре ERK фосфорилирует транскрипционные факторы и способствует экспорту транскрипционных ингибиторов; вмешательство в эти процессы блокирует дифференцировку. Т.о., часть NGF-специфической транскрипционной программы инициируется за счёт физического устранения ингибиторов из ядра. В цитозоле регулируемые ERK взаимодействия включают процессы тонкой пространственной компартментализации. Напр., NGF индуцирует длительную диссоциацию Ras GTPase-activating protein (RasGAP) NF1 от Ras-ERK комплекса, пролонгируя активацию Ras и ERK. NGF индуцирует также длительное высвобождение ERK от закрепляющего белка PEA15, который секвестрирует ERK в цитозоле. При каждом тестировании партнеры ERK по взаимодействию также обнаруживаются как ERK субстраты, указывая тем самым, что ERK закрепляется в цитозоле с помощью своих субстратов. Это гарантирует быстрое ERK-обеспечиваемое фосфорилирование и локализует передачи сигналов ERK в разных микрокомпартментах, которые детерминируются с помощью экспрессии и распределения субстратов.
Было бы интересно исследовать, могут ли вышестоящие активаторы ERK также участвовать в этих преформированных комплексах и могут ли они достигать их с помощью свободной диффузии или активного рекрутирования (BOX 2). Существование бинарных или троичных каркасов, которые связывают различные компоненты Ras- RAF-MEK-ERK каскада, показывает, что появляются как частично, так и полностью снабженные каркасами комплексы. Напр., MAPK organizer 1 (MORG1) взаимодействует с RAF, mEK и ERK, а также с MP1 (также известным как MAPKSP1), который создает каркас для MEK и ERK. Т.о., MORG1 может действовать как каркас из каркасов, который делает возможной модулярную сборку из комбинаторного разнообразия сигнальных комплексов с разными input-output функциями. Можно предположить, что MORG1s способность регулировать активацию ERK лишь в ответ на избранные стимулы связана с его super-scaffolding функцией. Участие индивидуальных белков в разных сигнальных комплексах д. создавать конкурентное разбиение между комплексами и может усиливать спецификацию выхода конечного продукта. Это может служить в качестве механизма, чтобы скоординировать сигнальную специфичность, хотя этот вопрос ещё не был исследован.
Выход nuclear factor-κB (NF-κB) также регулируется с помощью пространственно-временной координации (FIG. 2). NF-κB неактивен в цитозоле, если прикреплен к ингибитору NF-κB (IκB). IκB фосфорилируется с помощью IκB kinase (IKK) и затем деградирует, приводя к высвобождению и транслокации NF-κB в ядро, где он активирует транскрипцию, сопровождаемую транспортом NF-κB обратно в цитоплазму
40. Циклические осцилляции снования между ядром и цитоплазмой тонко настраиваются с помощью нескольких путей ингибиторов, включая A20 и IκB изоформы, экспрессия которых стимулируется с помощью NF-κB. Изоформы IκB могут связывать NF-κB в ядре и форсировать их экспорт в цитозоль, где NF-κB затем удерживается. A20 блокирует активацию NF-κB путем индукции деградации адаптора receptor interacting protein (RIP), который обусловливает активацию IKK
41. Анализ одиночных клеток и моделирование с использованием флюоресцентно меченных слитых белков, экспрессирующихся почти на физиологических уровнях, показал, что разные частоты осцилляций перемещений между ядром и цитоплазмой NF-κB детерминируются дифференциально распределенными во времени пульсовыми стимулирующими воздействиями и последовательной индукцией ингибиторов
42. Существует общее предостережение, что экзогенная экспрессия может нарушать поведение сигнальных сетей. Однако недавние результаты показали. что уровни эндогенных белков в индивидуальных клетках сильно варьируют
29, делая артефакты от слабой избыточной экспрессии маловероятными. Модель тройных обратных связей, касающаяся стохастической транскрипции
IKBA (гена, кодирующего IκBα) и
A20 и задержанной транскрипции гена, кодирующего IκBε предсказывает, что IκBα и A20 вызывают осцилляции перемещенийNF-κB , тогда как IκBε усиливает ответную реакцию
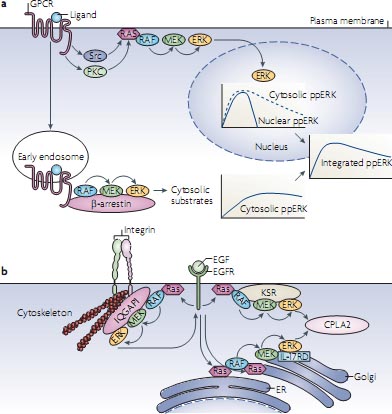 Figure 3 | Scaffolds and spatial organization. a | G-protein coupled receptors (GPCRs)
activate extracellular signal-regulated kinase (ERK) through two spatially and temporally separated pathways. Mechanistic details are omitted for the sake of clarity and were reviewed previously113. Rapid ERK activation emanating from the plasma membrane through protein kinase C (PKC), Src, and receptor Tyr kinase stimulation is transient and ОІ-arrestin independent, and allows ERK translocation to the nucleus. Sustained ERK activation is triggered from an endosomal ОІ-arrestin-dependent RAF-MEK-ERK (RAF-MAPK/ERK kinase-extracellular signal-regulated kinase) module and restrains ERK signalling to the cytosol. The integrated dually phosphorylated ERK (ppERK) results from combining the nuclear and cytosolic ppERK levels. b | Ras activated at different subcellular compartments uses different scaffolding proteins to target ERK substrates. IQGAP1 (on the cytoskeleton) mediates negative ERK feedback phosphorylation of epidermal growth factor receptor (EGFR), and kinase suppressor of Ras (KSR) (at the plasma membrane) and interleukin-17 receptor D (IL-17RD; also known as SEF1) (in the Golgi) facilitate phosphorylation of cytoplasmic phospholipase A2 (CPLA2) by ERK activated at the plasma membrane or intracellular membranes, respectively. Ras activated at the endoplasmic reticulum (ER) might stimulate IL-17RD-bound ERK at the Golgi53. However, Ras can also be activated directly114 at the Golgi. In either case, ERK phosphorylation activates CPLA2 to generate arachidonic acid, which is a precursor to signalling molecules such as leukotrienes and prostaglandins.
Figure 3 | Scaffolds and spatial organization. a | G-protein coupled receptors (GPCRs)
activate extracellular signal-regulated kinase (ERK) through two spatially and temporally separated pathways. Mechanistic details are omitted for the sake of clarity and were reviewed previously113. Rapid ERK activation emanating from the plasma membrane through protein kinase C (PKC), Src, and receptor Tyr kinase stimulation is transient and ОІ-arrestin independent, and allows ERK translocation to the nucleus. Sustained ERK activation is triggered from an endosomal ОІ-arrestin-dependent RAF-MEK-ERK (RAF-MAPK/ERK kinase-extracellular signal-regulated kinase) module and restrains ERK signalling to the cytosol. The integrated dually phosphorylated ERK (ppERK) results from combining the nuclear and cytosolic ppERK levels. b | Ras activated at different subcellular compartments uses different scaffolding proteins to target ERK substrates. IQGAP1 (on the cytoskeleton) mediates negative ERK feedback phosphorylation of epidermal growth factor receptor (EGFR), and kinase suppressor of Ras (KSR) (at the plasma membrane) and interleukin-17 receptor D (IL-17RD; also known as SEF1) (in the Golgi) facilitate phosphorylation of cytoplasmic phospholipase A2 (CPLA2) by ERK activated at the plasma membrane or intracellular membranes, respectively. Ras activated at the endoplasmic reticulum (ER) might stimulate IL-17RD-bound ERK at the Golgi53. However, Ras can also be activated directly114 at the Golgi. In either case, ERK phosphorylation activates CPLA2 to generate arachidonic acid, which is a precursor to signalling molecules such as leukotrienes and prostaglandins.
гетерогенности между клетками
42. Это обусловлено задержкой транскрипционной индукции IKBE, что добавляет стохастические шумы
42. Биологическая польза от добавления шумов не совсем понятна, но это может быть связано с десинхронизацией осцилляций в разных клетках. Клеточная гетерогенность, генерируемая шумами, может давать преимущества, в которых нуждается популяция клеток, чтобы реагировать высоко адаптивным и селективным образом, так как при иммунном ответе. Сходные заключения были сделаны при экстенсивных стохастических стимуляциях пути NF-κB pathway
43. Важно, что частоты осцилляций модулируют специфичность генной экспрессии
42. Эти исследования показали, что пространственное расположение сигнальных белков является предметом динамической регуляции и
vice versa, что пространственная организация может специфицировать профили кинетической активности (FIG. 2).
Scaffolds: managers of spatiotemporal organization. Подгонка пространственной и временной оркестровки воплощена в каркасных белках. Каркасы являются отличительным признаком их способности одновременно связывать два и более сигнальных белков, которые обычно обнаруживают отношения энзим-субстрат. Физическая колокализация генерирует интересные свойства, такие как изоляция сигнальных модулей с помощью физического связывания их вместе, редуцируя реакционные кинетики до нулевого порядка, делая возможной непосредственную обратную связь и прикрепление белковых комплексов к разным субклеточным сайтам. Важно, что каркасы позволяют повторно использовать энзимы для разных функций высоко контекст-зависимым способом, предоставляя простое решение дилеммы меньшего количества генов, чем процессов. Эти свойства делают каркасы идеально приспособленными для действия в качестве организующих принципов как синтетических, так и метаболических сигнальных сетей. Первыми описанными примерами каркасов были A-kinase anchoring proteins (AKAPs), которые обладают многими разнообразными функциями44. AKAPs (которые многократно рассматривались в обзорах) часто связывают киназы, их фосфатазы, вышестоящие активаторы и нижестоящие эффекторы. Они собирают сигнальные платформы, которые управляют input-output взаимоотношениями посредством физически сцепленных циклов активации-деактивации в очень локальных сайтах в клетках. Функция каркасов в др. системах, таких как путь MAPK высоко оценены и также недавно рассматривались в обзорах45-47. Здесь мы сфокусируемся на открытых вопросах и попытаемся очертить принципы построения, как каркасы вносят вклад в пространственно-временную организацию сигнальных сетей. Чтобы проиллюстрировать это, мы используем два примера (FIG. 3).
Первым является β-arrestin, каркас, который координирует активацию множественных сигнальных путей ниже G-protein coupled receptors (GPCRs)
48. GPCRs активируют ERK посредством двух пространственно и во времени разделенных путей. Быстрая активация ERK, исходящая из плазматической мембраны, является мимолетной, β-arrestin независим и делает возможной транслокацию ERK в ядро. Длительная активация ERK запускается с помощью эндосомного RAF-MEK-ERK модуля, который собирается с помощью образования каркаса β-arrestin и ограничивает передачу сигналов ERK цитоплазмой (FIG. 3a). Первоначально описанный как белок, который десенсибилизирует передачу сигналов от GPCRs, β-arrestin как оказалось является мультивалентным каркасным белком, который связывает большие наборы сигнальных молекул. Некоторые из этих молекул являются нижестоящими эффекторами, которые распространяют сигналы в клетке, такие ERK, jNK3, p38 и AKT, тогда как др. являются энзимами, которые деактивируют вторичные мессенджеры и ингибируют GPCR-индуцированную передачу сигналов, таких как phosphodiesterases (которые деградируют cAMP) и diacylglycerol kinases (которые деградируют diacylglycerol)
48-50. Обычно, β-arrestin образует каркас для целых сигнальных модулей, таких как RAF-MEK-ERK или каркас формируется с помощью киназ, чстоящих выше jNK3, apoptosis signal-regulating kinase 1 (ASK1; также известной как MEKK5) and MAPK kinase 4 (MKK4; также известной как MAPKK4) и jNK3. Возникает вопрос, как регулируется связывание с каркасом и как корректно генерируются специфические ансамбли
|
Box 3 | Microscopic technologies to analyse spatiotemporal organization of signalling networks
 Assembling signalling networks in time and space requires cellular imaging. Different methods provide high-resolution spatial and temporal information by spatially mapping molecules with respect to a defined cellular structure or another molecule. Each method has limitations, and complete visualization of a network requires multiple approaches.
2D imaging
Wide-field fluorescence imaging cannot provide three-dimensional (3D) resolution. This problem is partially mitigated by total internal reflection fluorescence microscopy, which limits imaging to a thin (~200 nm) slice of the cell that is adherent to the coverslip. Events occurring on or near the basal plasma membrane can be observed.
3D imaging
Three-dimensional imaging is achieved by confocal and two-photon microscopy; two-photon microscopy can access deep into samples. Both methods are diffraction limited. Higher resolution imaging is feasible with 4-Pi and stimulated emission depletion (STED) microscopy, which use non-linear de-excitation of fluorophores to bypass the resolution limit of diffraction. STED microscopy can visualize lipid rafts in live cells 65.
FRET
Methods using FГrster resonant energy transfer (FRET) detect the proximity of molecules on length scales of 1-10 nm. Live cell FRET imaging can quantify and localize specific molecular interactions to cellular structures. Fluorescence lifetime imaging microscopy is predominantly used as a robust method to measure FRET. FRET between donor and acceptor fluorophores reduces the fluorescence lifetime of the donor, which can be used to generate a FRET image.
For example, the lifetime of monomeric green fluorescent protein (mGFP) tagged to KRASGly12Val in BHK cells decreases when it is co-expressed with monomeric red fluorescent protein (mRFP) tagged to RAF1 owing to FRET between mGFP and mRFP after RAF1 is recruited to Ras nanoclusters (see the figure). Pixel-by-pixel fitting of two lifetimes and calibration using an mGFP-mRFP fusion protein allows the fraction of mGFP molecules undergoing FRET to be calculated (~30%). Fluorescence anisotropy microscopy, used to identify homo-FRET between identical florophores mapped the spatiotemporal dynamics of the nanoclustering of glycosylphosphatidylinositol-anchored protein 66.
Single molecule and spectroscopic techniques
Single particle tracking and single fluorophore video tracking track the diffusion of single molecules with high spatial and temporal resolution. Fluorescence correlation spectroscopy and fluorescence cross-correlation spectroscopy (FCCS) measure fluorescent fluctuations in small confocal volumes. The data can be used to derive diffusion constants and, in
the case of FCCS, infer and quantify molecular interactions without relying on FRET. |
Последнее может быть объяснено частично взаимодействием сайтов, которые существуют в индивидуальных компонентах специфических сигнальных каскадов и ведут к предварительно сформированным модулям
51. Каркас, в данном случае β-arrestin, д. стабилизировать преформированные ансамбли, но также регулировать специфичность, эффективность и амплитуду распространения сигналов
52. Однако , β-arrestin всё ещё необходим для подбора соотв. модулей и это может регулироваться с помощью пространственного распределения и динамики. Напр., как описывается ниже, активация RAF-MEK-ERK каскада происходит на плазматической мембране в разных Ras нанокластерах (see below) с использованием kinase suppressor of Ras (KSR), каркаса для RAF-MEK-ERK (FIG. 3b). GPCR-обусловленная активация ERK может быть подразделена на две фазы: раннюю фазу, которая независима от β-arrestin и может соответствовать активации нанокластеров мембраны, и поздняя фаза, которая распространяет активность ERK и завсисит от β-arrestin. Интересно, что ранняя фаза делает возможной транслокацию в ядро ERK, тогда как поздняя фаза запускается с помощью эндоцитозированных GPCRs и ограничивает передачу сигналов ERK цитозолем
48 (FIG. 3a). Этот механизм разнообразит функцию ERK в передаче сигналов GPCR, используя пространственное и временное разделение активации, концептуально напоминая сигнальные разделители (splitters) в электронной цепи. Т.о., образование каркаса может контролировать передачу сигналов, определяя последовательность событий во времени и пространстве.
Вторая парадигма иллюстрирует, что специфичность ERK фосфорилирования субстрата может быть предопределена локализацией вышестоящих сигналов53,54. Опять же каркасы могут играть важную роль в управлении ERK фосфорилирования разных субстратов в цитозоле или ядре, в зависимости от субклеточной структуры, на которой активируется Ras. Ras активация не ограничивается плазматической мембраной и может также происходить во внутриклеточных мембранах54. Чтобы фосфорилировать cytosolic phospholipase A2 (CPlA2), ERK активируется в плазматической мембране с использованием каркаса KSR, тогда как ERK активирует в endoplasmic reticulum (ER) эмбрионов interleukin-17 receptor D (Il-17RD; также известный как SEF1). Для обратной связи фосфорилирования EGFR, ERK использует каркас IQGAP153 (FIG. 3b). Итак, в зависимости от входящего импульса дифференциальное образование каркасов и субклеточный targeting могут позволять киназным модулям передавать сигналы к разным эффекторам параллельно. Мы всё ещё мало знаем о молекулярных механизмах, но новые оптические подходы позволят преодолеть эти изъяны (BOX 3), а недавние успехи начинают прояснять некоторые мембранные структуры, которые организуют передачу сигналов.
Возникает новый интересный аспект после открытия, что каркасы могут действовать как аллостерические регуляторы своих клиентов киназ. KSR может активировать своего клиента BRAF за счёт димеризации бок-о-бок, преимущественно за счет аллостерического механизма55. Были разработаны тонкие механистические детали для дрожжевого каркаса Ste5, который функционирует в феромоновом пути спаривания. Ste5 имеет два сайта швартовки (docking) для своего клиента киназы Fus3. Сильный docking сайт стимулирует Fus3 к фосфорилированию и подавлению передачи сигналов посредством пути Ste556. Слабый сайт связывания обеспечивает активацию Fus3 за счёт аллостерического улучшения её доступности для фосфорилирования с помощью вышестоящей киназы Ste7, тем самым усиливается передача сигналов феромона57. Кроме того, локализация Ste5 является критической для качества выходного сигнала. Ste5 генерирует градированный выпуск в клеточной мембране (его природном местоположении), тогда как ограничение Ste5 цитозолем усиливает врожденную ультрачувствительную активацию Fus3 (REF. 58).
Organelle apposition facilitates signal transfer. Как только каркасы сводят сигнальные молекулы вместе, чтобы облегчить их взаимодействия, наложение двух органелл может создавать между ними пространственные шоссе для обмена сигнальными молекулами. Напр., тот факт, что митохондрии близки к ER Ca2+-высвобождающим каналам позволяет преодолевать низкое сродство митохондриальных Ca2+ транспортеров для кальция, делая возможным быстрое накопление Ca2+ в митохондриальном матриксе вследствие открытия ER хранилищ Ca2+59. Недавно компоненты макромолекулярных связей между ER и митохондриями были идентифицированы в качестве интегрального ER мембранного белка maintenance of mitochondrial morphology protein 1 (mmm1) и белков наружной митохондриальной мембраны mitochondrial distribution and morphology protein 10 (mdm10), mdm12 и mdm34 (REF. 60). Этот крупный комплекс связи, названный ER-mitochondrion encounter structure (ERMES), содержит множественные копии этих белков. Кроме того, ERMES, как было установлено, облегчает непосредственный обмен фосфолипидов между ER и митохондриями60.
Истощение ER хранилищ Ca
2+ запускает открытие оперирующих с хранилищами Ca
2+ каналов плазматической мембраны, двая возможность внеклеточному Ca
2+ проникать в клетку. Соединения между ER и плазматической мембраной, по-видимому, являются ключевыми регуляторами притока Ca
2+, тогда как ER белок stromal interaction molecule 1 (STIM1) служит в качестве сенсора Ca
2+61. STIM1 стягивает агрегаты ER мембраны в олигомерные комплексы на истощенные хранилища Ca
2+ и транслоцируется в плазматическую мембрану, чтобы активировать Ca
2+ release-activated Ca
2+ (CRAC) каналы в невозбуждающихся клетках. Подобно контактам ER-митохондрии, сборка белковых комплексов, которые содержат как ER, так и плазматической мембраны белки, необходима для канализации сигналов через соединения между ER и плазматической мембраной. STIM олигомеры непосредственно связывают белок CRAC канала ORAI1 (также известен как CRACM1), который открывает CRAC каналы
62. Соотв., гладкого ER Ca
2+ ATPase насос снова наполняет ER хранилища Ca
2+.
Nano- and microscale signalling domains
Плазматическая мембрана является основной платформой lzk передачи сигналов. Архитектура плазматической мембраны в свою очередь диктует сетевые свойства путем секвестрирования сигнальных белков в пространстве и времени. Плазматическая мембрана является асимметричными билипидным слоем, состоящим из более 7000 видов липидов. Она организована в ультратонкие компартменты за счет соединения трансмембранных белков с субмембранной кортикальной актиновой сетью. Классическая диффузия происходит внутри индивидуальных компартментов, но дальнодействующей диффузии, пересекающей множественные компартменты, мешают компартментные границы63. Негомогенность в липидном бислое также существует как результат неполного перемешивания липидов. Эти липидные ансамбли, включающие комплексы из glycosphingolipid и cholesterol, известны как липидные плотики64, которые временно существуют на временной шкале ~20 ms на шкале длин менее 20 nm65. Липидные плотики могут быть стабилизированы за счет привлечения закрепленных на липидах белков или за счет поперечных связей66-68. Как результат плазматическая мембрана представлена сложным, неслучайным динамическим набором липидов и белок-липидных комплексов на многих отличающихся шкалах длины и времени. Степень, с которой специфические белок-липидные и липид-липидные комплексы используются клетками, обсуждается64,67. Однако существуют чёткие доказательства для белок-липидных и базирующихся на липидах платформ сортировки, участвующих в эндоцитотическом и экзоцитотическом трафике, формировании изгибов мембран, клеточной миграции и полярности68.
Assembling protein-lipid nanodomains. Пространственно-временная динамика плазматической мембраны может регулировать сигнальные комплексы, которые постоянно прикреплены или временно рекрутируются на плазматическую мембрану. Одним из примеров является формирование временных белковых кластеров на нано-шкале (nano-clusters), которые оперируют как временные сигнальные платформы или реакционные камеры. Эти кластеры содержат смеси киназ, фосфатаз и др. сигнальных белков, которые закреплены непосредственно на мембране или на закрепленных на липидах регуляторных белках или субъединицах. Локализация белков на таких доменах нано-шкалы может увеличивать скорости реакций сигнальных событий, которые необходимы для специфических межбелковых или белок-липидных взаимодействий69.
Fine control of input-output by signalling nanocircuits. Среди хорошо охарактеризованных мембранных протеин-липидных комплексов находятся и те, что формируются с помощью Ras GTPases. Три Ras изоформы HRAS, KRAS и NRAS имеют консервативный guanine nucleotide-binding domain (G domain), но используют разные С-терминальные якоря для соединения с мембраной: HRAS и NRAS подвергаются farnesylation и acylation, тогда как KRAS только farnesylated и нуждается в соседнем многоосновном домене для стабильного закрепления
70. Ras белки располагаются на плазматической мембране в виде комбинации нано-кластеров и свободно диффундирующих мономеров
71 (FIG. 4). Нано-кластеры представлены ~7 Ras белками, имеют радиус ~9 nm и продолжительность жизни 0.5-1 s
72,73 (FIG. 4a). Образование высоко динамичных нано-кластеров нуждается в сложном взаимодействии между Ras липидным якорем, элементами плазматической мембраны, аминокислотами в С-терминальной Ras гипервариабельной области и в её G домене и в вспомогательных каркасных белках, таких как galectins. Как результат HRAS, KRAS и NRAS собираются в пространственно разобщенные, не смешивающиеся кластеры с дальнейшей сегрегацией между GTP-загруженными и GDP-загруженными белками. Напр., HRAS-GDP кластеры являются cholesterol и actin зависимым, HRAS-GTP кластеры являются actin и cholesterol независимыми
72 . KRAS-GTP и HRAS-GTP кластеры нуждаются в специфических каркасных белках, чтобы способствовать сборке: сюда входит galectin 1 или
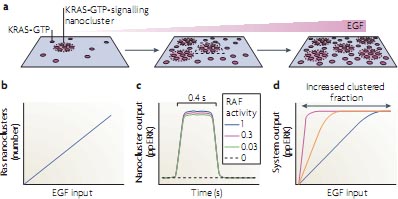 Figure 4 | ras nanoclusters digitize transmembrane signal transmission.
a | Activation of epidermal growth factor receptors (EGFRs) generates KRAS-GTP on the plasma membrane. A fixed proportion of these KRAS-GTP molecules (the clustered fraction) assemble into signalling nanoclusters. Each cluster has a radius of ~9 nm and contains ~7 KRAS-GTP molecules72. At higher EGF concentrations more nanoclusters form. b | Because KRAS-GTP levels are directly proportional to non-saturating EGF doses, and the KRAS-GTP clustered fraction remains constant as KRAS-GTP levels increase, the number of KRAS-GTP nanoclusters depends linearly on stimulating EGF concentration. c | After the recruitment of RAF and KSR-MEK-ERK (kinase suppressor of Ras-MAPK/ERK kinase-extracellular signal-regulated kinase) complexes from the cytosol, each nanocluster outputs a digital pulse of dually phosphorylated ERK (ppERK). The ppERK output is insensitive to RAF kinase input and is limited by disassembly of the nanocluster; a two-log range of relative RAF inputs is shown. d | As a result of b and c, the total system response to EGF, which is the aggregated digital outputs from all of the transiently active nanoclusters, is analogue (blue line). The gain of the response is increased if the KRAS
clustered fraction increases from 40% to higher values (orange and purple lines).
Figure 4 | ras nanoclusters digitize transmembrane signal transmission.
a | Activation of epidermal growth factor receptors (EGFRs) generates KRAS-GTP on the plasma membrane. A fixed proportion of these KRAS-GTP molecules (the clustered fraction) assemble into signalling nanoclusters. Each cluster has a radius of ~9 nm and contains ~7 KRAS-GTP molecules72. At higher EGF concentrations more nanoclusters form. b | Because KRAS-GTP levels are directly proportional to non-saturating EGF doses, and the KRAS-GTP clustered fraction remains constant as KRAS-GTP levels increase, the number of KRAS-GTP nanoclusters depends linearly on stimulating EGF concentration. c | After the recruitment of RAF and KSR-MEK-ERK (kinase suppressor of Ras-MAPK/ERK kinase-extracellular signal-regulated kinase) complexes from the cytosol, each nanocluster outputs a digital pulse of dually phosphorylated ERK (ppERK). The ppERK output is insensitive to RAF kinase input and is limited by disassembly of the nanocluster; a two-log range of relative RAF inputs is shown. d | As a result of b and c, the total system response to EGF, which is the aggregated digital outputs from all of the transiently active nanoclusters, is analogue (blue line). The gain of the response is increased if the KRAS
clustered fraction increases from 40% to higher values (orange and purple lines).
galectin 3, которые избирательно рекрутируются из цитозоля с помощью HRAS-GTP и KRAS-GTP, соотв.
74-76. Каркас стабилизирует G домен Ras-GTP мономера в компетентной для передачи сигналов ориентации по отношению к плазматической мембране
76,77.
Субнабор Ras-GTP белков, обнаруженных в нано-кластерах наз. clustered фракцией (~40% в фибробластах). Доступные сегодня данные подтверждают, что Ras-GTP нано-кластеры могут быть единственными сайтами рекрутирования RAF и активации ERK на плазматической мембране; если нанокластеры Ras устранены, то активация ERK на плазматической мембране не происходит. Напротив, увеличение фракции KRAS-GTP кластеров усиливает передачу сигналов ERK75,76. Ras-GTP нано-кластеры рекрутируют RAF и KSR-MEK-ERK комплексы из цитозоля для активации. Благодаря образованию каркаса модуль пути ERK в нано-кластерах генерирует тот же самый активированный дуально фосфорилированный ERK продукт в ответ на широкий круг входящих импульсов RAF и поэтому оперирует как переключатель низкого порога78-80 (FIG. 4c). Генерация ERK завершается с помощью спонтанной разборки нано-кластеров без необходимой биохимической деактивации киназного каскада. Это является новым использованием пространственно-временной динамики, которая элиминирует потенциальную проблему hysteresis, возникающую в результате двойного processive фосфорилирования ERK внутри digital нано-домена81.
Пространственно-временная динамика также ответственна за клеточные активирование ERK реакции, которые аналогичны в отношении EGF стимуляции. Как результат неравновесная кинетика Ras-GTP образования фракции кластеров приблизительно постоянна в широком круге уровней RasGTP. Следовательно, имеется линейное взаимоотношение между уровнями Ras-GTP и количеством нано-кластеров, генерируемых на плазматической мембране (FIG. 4b). Т.о., хотя каждый нано-кластер поставляет краткие, квантовые активированные ERK исходы (FIG. 4c), общий конечный результат активированной ERK с плазматической мембраны аналогичен (FIG. 4d). Ras нано-кластерные circuitry, следовательно, позволяют плазматической мембране оперировать как analogue-digital-analogue конвертор, преобразующий в цифровую форму EGF analogue input сигналы для передачи через плазматическую мембрану путём генерации соотв. количеств Ras нано-кластеров и затем путём повторной генерации analogue EGF сигнала как подогнанного активированного ERK конечного продукта в цитозоль. Система оперирует с высокой точностью, как и ожидается для цифровых (digital) сигнальных систем78.
Сходный analogue-digital-analogue преобразователь оперирует посредством glycosylphosphatidylinositol (GPI) закрепленного белкового CD59 nanocircuitry, который регулирует активацию иммунных клеток. Передача сигналов запускается за счет образования CD59 кластеров. Src семейства киназа LYN и гетеромерная G protein субъединица Gαi рекрутируются на кластеры и активируются, в свою очередь активируя phospholipase Cγ (PLCγ). Выходной сигнал от каждого такого кластера является цифровым импульсом (digital pulse) inositol-1,4,5-trisphosphate (InsP3); он продуцируется с помощью PLCγ-катализируемого гидролиза phosphatidylinositol bisphosphate, который вычвобождается в цитозоль. Как и в случае Ras нано-кластеров, продолжительность пульсового действия InsP ограничено во времени и происходит на той же самой временной шкале что и конечный продукт активированной ERK из Ras нано-кластеров81-83. Общий системный ответ является аналогичным, поскольку InsP3 конечные продукты из индивидуальных кластеров суммируются в цитозоле и превращаются в аналоги Ca2+ сигнала вследствие активации InsP3 рецепторов на внутриклеточных хранилищах кальция. Короткое время жизни Ras и CD59 кластеров является критическим для высокой точности передачи сигналов, поскольку это позволяет высокую долю выборки в общей совокупности аналогового выходного сигнала. В самом деле, подсчеты показывают, что как только увеличивается продолжительность жизни кластеров точность теряется и системная реакция становится прогрессивно digital, будучи определена по биохимической кинетике и пространственно-временной динамике вне плазматической мембраны.
Учитывая сходство между системами Ras и GPI-закрепленных нано-кластеров, можно предположить, что этого типа analogue-digital-analogue circuitry может представлять общий механизм высокой точности передач сигналов с помощью закрепленных на липидах сигнальных белков. Сходство с Ras, GPI-закрепленными белками также обнаруживают фиксированные мономеры для кластерного распределения, которые нарушают кинетику действия простых масс. Недавняя работа показала, что это распределение активно поддерживается и критически зависит от динамики кортикального актина84. Если шире, роль уникальной архитектуры плазматической мембраны в поддержании ансамблей из analogue-digital-analogue конвертеров дает ясную картину пространственно-временной динамики мембраны как нового регулятора сигнальной трасмиссии. Ответный сигнал предопределяется превалирующими фракциями нанокластеров из ключевых сигнальных молекул. Поскольку собранные в кластеры фракции зависят, помимо прочего, от состояния кортикального актинового цитоскелета и липидного содержимого плазматической мембраны, то эти и др. входящие сигналы, такие как клеточный рост и метаболическое состояние, миграторная информация и данные клеточных контактов, могут быть интегрированы в наборы обеспечивающих контроль analogue-digital-analogue конвертеров (FIG. 4d).
Активация ERK каскада на Golgi с помощью HRAS или NRAS, или в цитозоле, зависит от входящего сигнала RAF. Следовательно, активированные ERK выходные продукты из Ras нано-кластеров, если они оперируют на мембранах Golgi являются аналоговыми, а не digital79,80. Т.о., субклеточная локализация критически детерминирует как ERK module output смонтирован. Эти разные выходные эффекты системы из разных компартментов биологически важны. Напр., развивающаяся иммунная система мыши, антигены, которые управляют высокой силой активации Ras-ERK пути с плазматической мембраны, ведут к клональной делеции Т клеток, тогда как антигены, которые управляют низкой силой активации с Golgi ведут к клональной экспансии85. Итак, пространственная организация может непосредственно детерминировать качество и биологический эффект сигнального выхода.
Chemical reactions and diffusion form spatial domains. Недавно клетки рассматривались, как мешок энзимов, в котором биохимические реакции протекают внутри хорошо перемешанной, пространственно униформной среды. Однако , Alan Turing теоретическая работа показала, что биохимические реакции могут накладывать пространственный порядок и нарушают симметрию первоначально гомогенной среды86. Фундаментальным новшеством идеи Тьюринга является то, что диффузия, которая интуитивно кажется процессом, который элиминирует пространственную гетерогенность, может генерировать периодические пространственные паттерны в первоначально униформной среде, если коэффициенты диффузии взаимодействующих типов различны. Это заложило основу физико-химической теории морфогенеза87.
Если два морфогена, обычно активатор и ингибитор, имеют разную диффузию и активатор аутокаталитически воспроизводит сам себя и стимулирует свой ингибитор, то пространственно униформное распределение может стать нестабильным и управлять образованием гетерогенных пространственных паттернов. Чтобы предупредить аутокаталитический взрыв, процесс ингибирования д. быть быстрее и его коэффициент диффузии д.быть больше, чем у активатора. Пространственные ранги активации и ингибирования детерминируются коэффициентом диффузии и периодом полу-жизни разновидностей. Коротко-действующая локальная активация и дально-действующее ингибирование управляют периодическими повышениями концентрации активатора и пространством между повторяющимися пиками. Сходные пространственные паттерны возникают, когда дально-действующее ингибирование замещается истощением субстрата, который необходим для продукции активатора и расходуется за счёт активации87
Др. механизм используется для генерации позиционной информации и формирования пространственного паттерна в случает предсуществующей гетерогенности в клетках88. Сигнальная трансдукция осуществляется посредством циклов обратимых ковалентных модификаций белков мишеней, катализируемых активатором и деактиватором, такими как киназа и фосфатаза для фосфорилированных белков или GEF и GAP для малых GTPase. Благодаря присутствию клеточных структур, таких как мембраны, цитоплазма, органеллы и хромосомы, оппозитные активирующий и деактивирующий энзимы часто пространственно разобщены. Др. словами внутриклеточная среда для реакций и диффузия первоначально негомогенны и не напоминают униформную среду традиционно рассматриваемую для моделей Тьюрингова типа. Для белка, который фосфорилируется с помощью связанной с мембраной киназой и дефосфорилируется с помощью цитозольной фосфатазы, может быть предсказан крутой градиент фосфорилирования с высокими концентрациями фосфорилированного белка вблизи мембраны и низкими концентрациями в глубине клетки88. При условии, что фосфатаза далека от насыщения, стационарный профиль фосфорилирования распадается почти экспоненциально в зависимости от расстояния от мембраны. Характерная длина распада (Lgrad) детерминируется с помощью коэффициента диффузии (D) и очевидной первого порядка скоростной константой (k) phosphatase (деактиватора) и не зависит от кинетики киназы (активатора) , Lgrad= крень D/k . Этот простой пространственный паттерн является стабильным и возникает из-за предсуществующего разделения оппозитных энзимов. Градиенты активности этого типа были открыты экспериментально для малой GTPase RAN89, дрожжевой MAPK Fus3 (REF. 90), protein Tyr phosphatase 1B91, aurora B kinase92 и дрожжевой протеин киназы Pom193.
Если активный белок ассоциирует с др. белками в мультибелковый комплекс или быстро и обратимо соединяется с элементами цитоскелета, то очевидный коэффициент диффузии (D*) этой формы становится меньше, чем коэффициент диффузии (D) свободной неактивной формы. Затем стабильные внутриклеточные градиенты из всего обилия белков возникают в результате пространственного разделения активирующего и деактивирующего энзимов. Эти тотальные белковые градиенты (Gradtotal) менее отвесны, чем градиенты активной формы95 (Gradtotal/Grada = (1-D*/D) < 1. Т.о., при стабильных стационарных паттернах разные сигнальные активности и количества белков в разных субклеточных доменах могут возникать благодаря пространственному разделению оппозитных энзимов и диффузии.
Intricate concentration landscapes in single cells. Замысловатые ландшафты установившихся состояний белковых активностей возникают из различных пространственных расположений киназ и фосфатаз и GEFs с GAPs на клеточных мембранах, хроматиновых структурах или в цитоплазме. Для многих киназных каскадов, таких как MAPK каскады, киназа первого уровня активируется на плазматической мембране в ответ на внешнюю стимуляцию. Если это происходит в среде с полными каркасами, такими как нано-кластеры, то весь процесс активации кинетически ограничивается пространственно ко-локализацией. Однако, если компоненты каскада становятся способны к диффузии или в результате быстро разборки нано-кластеров или альтернативных типов активации в разных компартментах, то уровень фосфорилирования и активности первой киназы резко снижается во время распространения диффузии в цитоплазму96. Поскольку только фракция фосфорилированных киназ может стимулировать нижестоящую киназу, то происходит прогрессивное снижение эффективности стимуляции вниз по каскаду. Возникает вопрос, как в таких условиях сигналы. исходящие от мембраны сильно распространяются в глубину клетки. Предположение, что как киназы так и фосфатазы далеки от насыщения и что безусловно константы скоростей первого порядка не изменяются от слоя к слою, позволяя сформулировать простой критерий распространения сигналов97 . Если соотношение констант скоростей phosphatase (deactivator) и kinase (activator) значительно меньше единицы, то активационные сигналы с лёгкостью распространяются от плазматической мембраны вглубь клетки. Профили стационарной активации последовательных киназ вниз по каскаду достигают длинного, плоского плато, которое резко распадается в пространственных расположениях, следуя др. за др. почти с постоянными пространственными интервалами. Эти интервалы могут быть значительно больше, чем характеризующие длину распада профиля пространственной активации для инициальной киназы, распространяя сигналы фосфорилирования вглубь клетки. Если соотношение констант скоростей активатора и деактиватора больше единицы, то распространение сигнала останавливается как только пространственные профили последовательно активируемых белков быстро распадаются, ограничивая сигнал мембраной97. Более сложные стабильные пространственные паттерны могут возникать в результате фосфорилирования многих сайтов киназ в сигнальных каскадах. Напр., если киназа на каждом уровне обладает двумя сайтами фосфорилирования и выполняются условия распространения сигнала, рассмотренные выше, то профили активации дважды фосфорилированных форм на последовательных уровнях каскада будут обладать одинаково длинными, плоскими плато, тогда как единожды фосфорилированные киназы обладают не монотонными, мимолётными профилями концентраций. Их пик локализуется вблизи места, где стационарные фронты дважы фосфорилированных киназ быстро распадаются.
В GTPase каскадах активная GTPase может позитивно или негативно контролировать GEFs или GAPs на многих уровнях. Напр.,'ballet' малых GTPases контролирует динамику цитоскелета, во время которого Cdc42 активирует Rac и позитивно Rho, тогда как Rac и Rho ингибируют др. др.98. Теоретические рассуждения показывают, что пространственное разделение GEFs и GAPs может приводить к сложным паттернам активностей GTPase в клетке, в которой активности могут снижаться, повышаться или достигать пика с увеличением расстояния от клеточной структуры (такой как мембрана или хромосома), где располагается инициальный GEF95. Такие сложные, немонотонные, стабильны концентрационные профили были недавно описаны для хромосом-зависимого RAN-importin-β каскада, связанного с сетью вторичного фосфорилирования99. Все эти паттерны вызваны пространственным разделением оппозитных энзимов в циклах активации-деактивации белковых модификаций скорее, чем пространственных нарушений и нестабильностей симметрии пространственно униформного распределения, которое происходит по механизму Тьюринга.
Позитивные и негативные петли обратной связи в белковых каскадах могут вызывать динамические нестабильности во времени и пространстве
27. Напр., перемещение волн может происходить в бистабильных MAPK каскадах, в которых коэффициенты диффузии компонентов, как предполагается одни и те же
100 (BOX 2). Включение существующей пространственной гетерогенности, вызванной клеточными структурами в модели типа Тьюринга, по-видимому, многообещающее для объяснения многих запутанных динамических процессов внутри клетки. Напр., недавно было показано, что нелинейные взаимодействия между прототипическим активатором и ингибитором на плазматической мембране может приводить к возникновению Turing's пространственных паттернов даже при одинаковых константах диффузии, показывая, что скорости обмена между мембраной и цитоплазмой или скорости распада в цитоплазме оказываются разные для активатора и ингибитора
101. Скорее всего Turing-типа модель, как показано, объясняет спонтанную инициацию клеточной поляризации с помощью малой GTPase Cdc42, и её GEF Cdc24 и эффекторного белка bud emergence 1, который снуёт между мембраной и цитоплазмой
102. Предложены альтернативные модели клеточной поляризации, которые базируются на бистабильной кинетике Cdc42-Rac-Rho сети
103. Эти расхождения могут отражать неполноту нашего понимания или просто тот факт, что природа использует более одного решения.
Conclusions
We have changed our perception of signalling pathways from linear pipelines to networks. We also have begun to rationalize how these network structures can deter- mine the kinetics of distinct biochemical processes with high fidelity to translate them into specific biological responses. Along this way we have realized that spe- cificity is generated by combinatorial assemblies and spatiotemporal dynamics rather than by a large number of genes with specific functions. We now face the chal- lenge of explaining why evolution chose combinatorial assemblies over single pathway deterministic solutions. An obvious advantage of the former is that successful designs can be recycled and adapted for new purposes. Spatial and temporal separation can be a convenient means to specify signalling functions. This suggests that cell shape has an important role as it defines the spatial coordinates. Intriguing first glimpses were provided by work showing that cell shape controls the dynamics of localized biochemical activities104,105. This also highlights the need for new approaches, both conceptually and technologically, to move hand in hand for developing the insights and tools that allow us to survey the complex landscape of cell signalling.
Сайт создан в системе
uCoz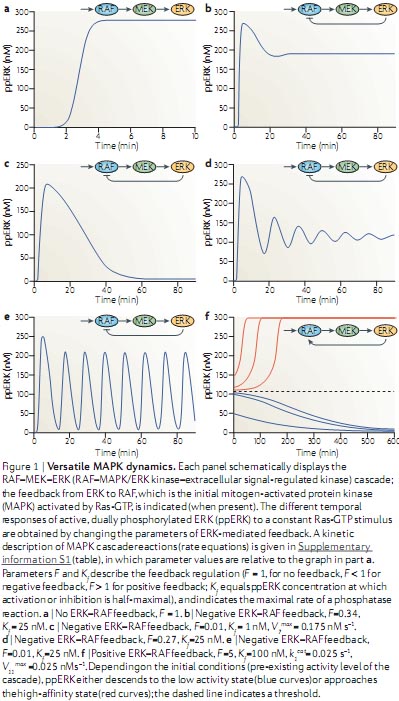
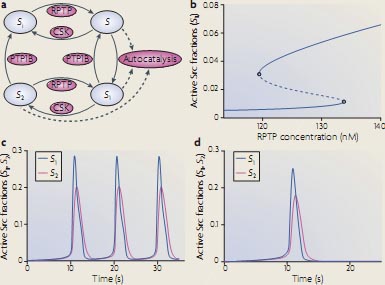 Understanding the temporal dynamics of signalling networks is facilitated by using
kinetic schemes and ordinary differential equations (ODEs). Each signalling species is produced and consumed in particular reactions. The left-hand side of the ODE is the time derivative of a species concentration, and the right-hand side of the ODE is the algebraic sum of the reaction rates, which produce and consume that species. Because ODEs do not consider spatial dimension, this kinetic description implies a well-mixed, homogeneous reaction medium. This simplification facilitates the analysis of the effects of multiple inputs, feedback loops and pathway crosstalk on the dynamics of complex signalling networks106,107. Remarkably, already simple signalling motifs display intricate temporal dynamics18,27,30. For example, the basic activation-deactivation cycle of the Src Tyr kinase can show complex signalling dynamics that includes oscillations, toggle switches and excitable behaviour32. Src kinases can exist in four states (see the figure, part a). In the basal autoinhibited conformation (S ), Src is phosphorylated on the carboxy-terminal inhibitory Tyr and dephosphorylated on the activating Tyr in the catalytic domain. Both Tyr residues are dephosphorylated in the partially active form (S). In the first fully active conformation (S1 ) the inhibitory Tyr is dephosphorylated and the activating Tyr is phosphorylated, and in the second fully active form (S2 ) both Tyr are phosphorylated. A crucial non-linearity is brought about by intermolecular autophos-phorylation of the activating Tyr (shown by dashed lines). Importantly, the complex Src dynamics do not require imposed external feedback loops and can occur at constant activities of Src inhibitors (such as C-terminal Src kinase (CSK)) and Src activators (such as protein Tyr phosphatase 1B (PTP1B)) and receptor-type protein Tyr phosphatases (RPTPs)). In different ranges of activities of these Src regulators, Src kinase activity can exhibit hysteresis (bistability) (see the figure, part b), oscillations (see the figure, part c), and excitable responses of active Src kinase fractions (see the figure, part d). Figure modified, with permission, from REF. 32 В© National Academy of Sciences (2000).
Understanding the temporal dynamics of signalling networks is facilitated by using
kinetic schemes and ordinary differential equations (ODEs). Each signalling species is produced and consumed in particular reactions. The left-hand side of the ODE is the time derivative of a species concentration, and the right-hand side of the ODE is the algebraic sum of the reaction rates, which produce and consume that species. Because ODEs do not consider spatial dimension, this kinetic description implies a well-mixed, homogeneous reaction medium. This simplification facilitates the analysis of the effects of multiple inputs, feedback loops and pathway crosstalk on the dynamics of complex signalling networks106,107. Remarkably, already simple signalling motifs display intricate temporal dynamics18,27,30. For example, the basic activation-deactivation cycle of the Src Tyr kinase can show complex signalling dynamics that includes oscillations, toggle switches and excitable behaviour32. Src kinases can exist in four states (see the figure, part a). In the basal autoinhibited conformation (S ), Src is phosphorylated on the carboxy-terminal inhibitory Tyr and dephosphorylated on the activating Tyr in the catalytic domain. Both Tyr residues are dephosphorylated in the partially active form (S). In the first fully active conformation (S1 ) the inhibitory Tyr is dephosphorylated and the activating Tyr is phosphorylated, and in the second fully active form (S2 ) both Tyr are phosphorylated. A crucial non-linearity is brought about by intermolecular autophos-phorylation of the activating Tyr (shown by dashed lines). Importantly, the complex Src dynamics do not require imposed external feedback loops and can occur at constant activities of Src inhibitors (such as C-terminal Src kinase (CSK)) and Src activators (such as protein Tyr phosphatase 1B (PTP1B)) and receptor-type protein Tyr phosphatases (RPTPs)). In different ranges of activities of these Src regulators, Src kinase activity can exhibit hysteresis (bistability) (see the figure, part b), oscillations (see the figure, part c), and excitable responses of active Src kinase fractions (see the figure, part d). Figure modified, with permission, from REF. 32 В© National Academy of Sciences (2000). 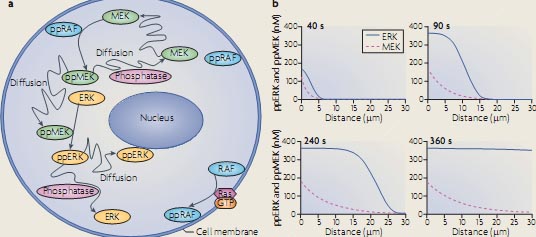 Ordinary differential equation-based models can account for spatial dynamics only by using coarse-grained compartmentalization; for example, by considering the cytoplasm and nucleus as two different, well-mixed compartments. More accurately, spatially distributed signalling processes are modelled using partial differential equations (PDEs), which contain derivatives with respect to time and space and are referred to as reaction–diffusion equations. Reaction–diffusion PDEs describe the concentration changes that are due to the production and consumption of a species in chemical reactions and its redistribution in space caused by diffusion and transport87,100. Solutions to reaction–diffusion equations are generally obtained by numerical integration, although for linear or saturated kinetics, stationary concentration profiles are obtained analytically. In spatially distributed signalling networks, such as the β-adrenergic receptor pathway105 or mitogen-activated protein kinase (MAPK) cascades100, the initiating signals, cyclic AMP or RAF activity, respectively, are generated at the plasma membrane and subsequently spread into the cell through the sequential activation of downstream proteins (see the figure, part a, which illustrates the activation of successive kinases in the RAF–MEK–ERK (Raf–MAPK/ERK kinase–extracellular signal-regulated kinase) cascade). Importantly, the transmission of spatial information is controlled by feedback and feed-forward network motifs and cell shape104,109,110. For instance, bistability in a two-site ERK phosphorylation and dephosphorylation cycle18 was shown to generate a phosphoprotein wave that propagates from the surface into the cell interior100. The simulated time course of the propagation of MEK and ERK activation into the cytoplasm of a large cell, such as Xenopus laevis egg (cell radius 50 µm; nuclear radius 20 µm), is shown in the figure, part b. This wave propagation is facilitated by feedback inhibition of phosphatases owing to the generation of reactive oxygen species100. Positive feedback from dually phosphorylated ERK (ppERK) to cytoplasmic MEK further enhances the propagation span of the wave, making it possible to convey phosphorylation signals over exceedingly long distances. Such waves of protein phosphorylation and modification that travel with constant amplitude and velocity can transmit survival signalling along axons in developing neurons111,112 . Figure in part b is modified, with permission, from Molecular Systems Biology REF.100 © 2006 Macmillan Publishers Ltd. All rights reserved.
Ordinary differential equation-based models can account for spatial dynamics only by using coarse-grained compartmentalization; for example, by considering the cytoplasm and nucleus as two different, well-mixed compartments. More accurately, spatially distributed signalling processes are modelled using partial differential equations (PDEs), which contain derivatives with respect to time and space and are referred to as reaction–diffusion equations. Reaction–diffusion PDEs describe the concentration changes that are due to the production and consumption of a species in chemical reactions and its redistribution in space caused by diffusion and transport87,100. Solutions to reaction–diffusion equations are generally obtained by numerical integration, although for linear or saturated kinetics, stationary concentration profiles are obtained analytically. In spatially distributed signalling networks, such as the β-adrenergic receptor pathway105 or mitogen-activated protein kinase (MAPK) cascades100, the initiating signals, cyclic AMP or RAF activity, respectively, are generated at the plasma membrane and subsequently spread into the cell through the sequential activation of downstream proteins (see the figure, part a, which illustrates the activation of successive kinases in the RAF–MEK–ERK (Raf–MAPK/ERK kinase–extracellular signal-regulated kinase) cascade). Importantly, the transmission of spatial information is controlled by feedback and feed-forward network motifs and cell shape104,109,110. For instance, bistability in a two-site ERK phosphorylation and dephosphorylation cycle18 was shown to generate a phosphoprotein wave that propagates from the surface into the cell interior100. The simulated time course of the propagation of MEK and ERK activation into the cytoplasm of a large cell, such as Xenopus laevis egg (cell radius 50 µm; nuclear radius 20 µm), is shown in the figure, part b. This wave propagation is facilitated by feedback inhibition of phosphatases owing to the generation of reactive oxygen species100. Positive feedback from dually phosphorylated ERK (ppERK) to cytoplasmic MEK further enhances the propagation span of the wave, making it possible to convey phosphorylation signals over exceedingly long distances. Such waves of protein phosphorylation and modification that travel with constant amplitude and velocity can transmit survival signalling along axons in developing neurons111,112 . Figure in part b is modified, with permission, from Molecular Systems Biology REF.100 © 2006 Macmillan Publishers Ltd. All rights reserved.  Figure 2 | Intrinsic transcriptional feedback inhibition of NF-κB. In resting cells nuclear factor-κB (NF-κB) is inactive because inhibitor of NF-κB (IκB) retains it in the cytosol. On activation, for example by tumour necrosis factor (TNF), TNF receptor 1 (TNFR1) forms a complex with the adaptor protein TNFR-associated DEATH domain (TRADD), which recruits different proteins to initiate dual signalling pathways. TRADD recruits FAS-associated death domain (FADD) to promote apoptosis by stimulating caspase 8 activation. By contrast, TRADD recruits the adaptor receptor interacting protein (RIP) to counteract apoptosis by activating NF-κB. NF-κB activation is enabled as a result of the stimulus-induced degradation of IκBs following their phosphorylation by IκB kinases (IKKs), which releases NF-κB from its cytosolic anchor proteins so that it can translocate to the nucleus. However, nuclear NF-κB also induces the transcription of its own inhibitors. IκBs can bind to nuclear NF-κB and export it back to the cytosol, and A20 can interrupt receptor-mediated NF-κB activation by inducing the degradation of RIP.
и влияют на дифференцировку. Известно, что большинство этих взаимодействий регулирует пространственные и временные аспекты передач сигналов ERK. Цитозольные взаимодействия используют преформированные комплексы, из которых ERK высвобождается в ответ на стимуляцию с помощью NGF и EGF. Ядерные взаимодействия ERK индуцируются в ответ на NGF, который стимулирует транслокацию в ядро ERK (это необходимо для дифференцировки). В ядре ERK фосфорилирует транскрипционные факторы и способствует экспорту транскрипционных ингибиторов; вмешательство в эти процессы блокирует дифференцировку. Т.о., часть NGF-специфической транскрипционной программы инициируется за счёт физического устранения ингибиторов из ядра. В цитозоле регулируемые ERK взаимодействия включают процессы тонкой пространственной компартментализации. Напр., NGF индуцирует длительную диссоциацию Ras GTPase-activating protein (RasGAP) NF1 от Ras-ERK комплекса, пролонгируя активацию Ras и ERK. NGF индуцирует также длительное высвобождение ERK от закрепляющего белка PEA15, который секвестрирует ERK в цитозоле. При каждом тестировании партнеры ERK по взаимодействию также обнаруживаются как ERK субстраты, указывая тем самым, что ERK закрепляется в цитозоле с помощью своих субстратов. Это гарантирует быстрое ERK-обеспечиваемое фосфорилирование и локализует передачи сигналов ERK в разных микрокомпартментах, которые детерминируются с помощью экспрессии и распределения субстратов.
Figure 2 | Intrinsic transcriptional feedback inhibition of NF-κB. In resting cells nuclear factor-κB (NF-κB) is inactive because inhibitor of NF-κB (IκB) retains it in the cytosol. On activation, for example by tumour necrosis factor (TNF), TNF receptor 1 (TNFR1) forms a complex with the adaptor protein TNFR-associated DEATH domain (TRADD), which recruits different proteins to initiate dual signalling pathways. TRADD recruits FAS-associated death domain (FADD) to promote apoptosis by stimulating caspase 8 activation. By contrast, TRADD recruits the adaptor receptor interacting protein (RIP) to counteract apoptosis by activating NF-κB. NF-κB activation is enabled as a result of the stimulus-induced degradation of IκBs following their phosphorylation by IκB kinases (IKKs), which releases NF-κB from its cytosolic anchor proteins so that it can translocate to the nucleus. However, nuclear NF-κB also induces the transcription of its own inhibitors. IκBs can bind to nuclear NF-κB and export it back to the cytosol, and A20 can interrupt receptor-mediated NF-κB activation by inducing the degradation of RIP.
и влияют на дифференцировку. Известно, что большинство этих взаимодействий регулирует пространственные и временные аспекты передач сигналов ERK. Цитозольные взаимодействия используют преформированные комплексы, из которых ERK высвобождается в ответ на стимуляцию с помощью NGF и EGF. Ядерные взаимодействия ERK индуцируются в ответ на NGF, который стимулирует транслокацию в ядро ERK (это необходимо для дифференцировки). В ядре ERK фосфорилирует транскрипционные факторы и способствует экспорту транскрипционных ингибиторов; вмешательство в эти процессы блокирует дифференцировку. Т.о., часть NGF-специфической транскрипционной программы инициируется за счёт физического устранения ингибиторов из ядра. В цитозоле регулируемые ERK взаимодействия включают процессы тонкой пространственной компартментализации. Напр., NGF индуцирует длительную диссоциацию Ras GTPase-activating protein (RasGAP) NF1 от Ras-ERK комплекса, пролонгируя активацию Ras и ERK. NGF индуцирует также длительное высвобождение ERK от закрепляющего белка PEA15, который секвестрирует ERK в цитозоле. При каждом тестировании партнеры ERK по взаимодействию также обнаруживаются как ERK субстраты, указывая тем самым, что ERK закрепляется в цитозоле с помощью своих субстратов. Это гарантирует быстрое ERK-обеспечиваемое фосфорилирование и локализует передачи сигналов ERK в разных микрокомпартментах, которые детерминируются с помощью экспрессии и распределения субстратов.  Figure 3 | Scaffolds and spatial organization. a | G-protein coupled receptors (GPCRs)
activate extracellular signal-regulated kinase (ERK) through two spatially and temporally separated pathways. Mechanistic details are omitted for the sake of clarity and were reviewed previously113. Rapid ERK activation emanating from the plasma membrane through protein kinase C (PKC), Src, and receptor Tyr kinase stimulation is transient and ОІ-arrestin independent, and allows ERK translocation to the nucleus. Sustained ERK activation is triggered from an endosomal ОІ-arrestin-dependent RAF-MEK-ERK (RAF-MAPK/ERK kinase-extracellular signal-regulated kinase) module and restrains ERK signalling to the cytosol. The integrated dually phosphorylated ERK (ppERK) results from combining the nuclear and cytosolic ppERK levels. b | Ras activated at different subcellular compartments uses different scaffolding proteins to target ERK substrates. IQGAP1 (on the cytoskeleton) mediates negative ERK feedback phosphorylation of epidermal growth factor receptor (EGFR), and kinase suppressor of Ras (KSR) (at the plasma membrane) and interleukin-17 receptor D (IL-17RD; also known as SEF1) (in the Golgi) facilitate phosphorylation of cytoplasmic phospholipase A2 (CPLA2) by ERK activated at the plasma membrane or intracellular membranes, respectively. Ras activated at the endoplasmic reticulum (ER) might stimulate IL-17RD-bound ERK at the Golgi53. However, Ras can also be activated directly114 at the Golgi. In either case, ERK phosphorylation activates CPLA2 to generate arachidonic acid, which is a precursor to signalling molecules such as leukotrienes and prostaglandins.
Figure 3 | Scaffolds and spatial organization. a | G-protein coupled receptors (GPCRs)
activate extracellular signal-regulated kinase (ERK) through two spatially and temporally separated pathways. Mechanistic details are omitted for the sake of clarity and were reviewed previously113. Rapid ERK activation emanating from the plasma membrane through protein kinase C (PKC), Src, and receptor Tyr kinase stimulation is transient and ОІ-arrestin independent, and allows ERK translocation to the nucleus. Sustained ERK activation is triggered from an endosomal ОІ-arrestin-dependent RAF-MEK-ERK (RAF-MAPK/ERK kinase-extracellular signal-regulated kinase) module and restrains ERK signalling to the cytosol. The integrated dually phosphorylated ERK (ppERK) results from combining the nuclear and cytosolic ppERK levels. b | Ras activated at different subcellular compartments uses different scaffolding proteins to target ERK substrates. IQGAP1 (on the cytoskeleton) mediates negative ERK feedback phosphorylation of epidermal growth factor receptor (EGFR), and kinase suppressor of Ras (KSR) (at the plasma membrane) and interleukin-17 receptor D (IL-17RD; also known as SEF1) (in the Golgi) facilitate phosphorylation of cytoplasmic phospholipase A2 (CPLA2) by ERK activated at the plasma membrane or intracellular membranes, respectively. Ras activated at the endoplasmic reticulum (ER) might stimulate IL-17RD-bound ERK at the Golgi53. However, Ras can also be activated directly114 at the Golgi. In either case, ERK phosphorylation activates CPLA2 to generate arachidonic acid, which is a precursor to signalling molecules such as leukotrienes and prostaglandins.  Assembling signalling networks in time and space requires cellular imaging. Different methods provide high-resolution spatial and temporal information by spatially mapping molecules with respect to a defined cellular structure or another molecule. Each method has limitations, and complete visualization of a network requires multiple approaches.
Assembling signalling networks in time and space requires cellular imaging. Different methods provide high-resolution spatial and temporal information by spatially mapping molecules with respect to a defined cellular structure or another molecule. Each method has limitations, and complete visualization of a network requires multiple approaches.  Figure 4 | ras nanoclusters digitize transmembrane signal transmission.
a | Activation of epidermal growth factor receptors (EGFRs) generates KRAS-GTP on the plasma membrane. A fixed proportion of these KRAS-GTP molecules (the clustered fraction) assemble into signalling nanoclusters. Each cluster has a radius of ~9 nm and contains ~7 KRAS-GTP molecules72. At higher EGF concentrations more nanoclusters form. b | Because KRAS-GTP levels are directly proportional to non-saturating EGF doses, and the KRAS-GTP clustered fraction remains constant as KRAS-GTP levels increase, the number of KRAS-GTP nanoclusters depends linearly on stimulating EGF concentration. c | After the recruitment of RAF and KSR-MEK-ERK (kinase suppressor of Ras-MAPK/ERK kinase-extracellular signal-regulated kinase) complexes from the cytosol, each nanocluster outputs a digital pulse of dually phosphorylated ERK (ppERK). The ppERK output is insensitive to RAF kinase input and is limited by disassembly of the nanocluster; a two-log range of relative RAF inputs is shown. d | As a result of b and c, the total system response to EGF, which is the aggregated digital outputs from all of the transiently active nanoclusters, is analogue (blue line). The gain of the response is increased if the KRAS
clustered fraction increases from 40% to higher values (orange and purple lines).
Figure 4 | ras nanoclusters digitize transmembrane signal transmission.
a | Activation of epidermal growth factor receptors (EGFRs) generates KRAS-GTP on the plasma membrane. A fixed proportion of these KRAS-GTP molecules (the clustered fraction) assemble into signalling nanoclusters. Each cluster has a radius of ~9 nm and contains ~7 KRAS-GTP molecules72. At higher EGF concentrations more nanoclusters form. b | Because KRAS-GTP levels are directly proportional to non-saturating EGF doses, and the KRAS-GTP clustered fraction remains constant as KRAS-GTP levels increase, the number of KRAS-GTP nanoclusters depends linearly on stimulating EGF concentration. c | After the recruitment of RAF and KSR-MEK-ERK (kinase suppressor of Ras-MAPK/ERK kinase-extracellular signal-regulated kinase) complexes from the cytosol, each nanocluster outputs a digital pulse of dually phosphorylated ERK (ppERK). The ppERK output is insensitive to RAF kinase input and is limited by disassembly of the nanocluster; a two-log range of relative RAF inputs is shown. d | As a result of b and c, the total system response to EGF, which is the aggregated digital outputs from all of the transiently active nanoclusters, is analogue (blue line). The gain of the response is increased if the KRAS
clustered fraction increases from 40% to higher values (orange and purple lines).