И TRF1 и TRF2 участвуют в ремоделировании ДНК. TRF1 может давать петлю, изгибаться и способствовать синапсису с теломерной ДНК
, эти активности в основном приписываются его домену гомодимеризации (Bianchi et al., 1997; Biancht et al., 1999; Griffith et al., 1998). TRF2 может индуцировать топологические изменения в ДНК, которые стимулируют инвазию нити (Amiard et al., 2007; Griffith et al., 1999; Stansel et al., 2001; Verdun and Karlseder, 2006). Синергические свойства по ремоделированию ДНК этих двух компонентов shelterin, как полагают, дают архитектуру высокого порядка концов хромосом (T-loop) (Fig. 1). Доказательства также указывают на то, что TRF2 может модулировать сборку теломерного G-quadruplex (Pedroso et al., 2009). Вполне возможно, что формирование G-quadruplex на G-довеске может снижать эффективность процесса инвазии нити (Pedroso et al., 2009); альтернативно, формирование quadruplex на D-loop может помогать стабилизировать место инвазии (see Fig. 1B). Следовательно, TRF2 может участвовать или в предупреждении или способствовании образования G-quadruplex в зависимости от контекста. Более того, TRP2, как было показано, обладает строгим сродством к четырехнитчатым соединениям
, и этому предпочтению способствует TRF2 в будущей стабилизации места инвазии в довеске (Fouche et al., 2006).
TIN2 первоначально был идентифицирован с помощью дрожжевого двугибридного метода (Kim et al., 1999). Он, как было установлено, негативно регулирует зависимую от теломеразы элонгацию теломер, это напоминает функцию TRF1 в регуляции длины теломер. Биохимический анализ выявил, что TIN2 стимулирует гомодимеризацию TRF1, тем самым делая возможным синапсис теломерной ДНК. Это указывает на то, что TIN2 обеспечивает свою регуляцию длины теломер, вызывая конформационные изменения в TRF1, которые, в свою очередь, создают структуру теломерной ДНК (Kim et al., 2003). TIN2 также непосредственно взаимодействует с TRF2 и это взаимодействие ещё более стабилизируется за счёт соединения TRF1-TIN2. Экспресия мутантов TIN2, которые дефектны по связыванию или TRF1 или, в особенности, TRF2, вызывает реакцию повреждения ДНК, демонстрируемая по присутствию TIFs и указывающая на de-protection теломер (Kim et al., 2004). Недавно было предположено, что существуют два самостоятельных субкомплекса, которые кооперируются и поддерживают др. др., чтобы сформировать высокого порядка защитные концевые структуры на теломере: TIN2-TRF1 ассоциирована с TPP1-POT1; а TIN2-TRF2-hRAP1 ассоциирована с TPP1-POT1. Первый субкомплекс, как полагают, усиливает стабильность и функцию последнего (Kim et al., 2008b). Был идентифицирован сплайс-вариант TIN2, TIN2L, , он может дифференцироваться из своего первоначально описанного аналога, TIN2S за счёт присутствия 97 дополнительных аминокислот на С-конце. TIN2L поддерживает тесную ассоциацию с ядерным матриксом и как полагают скрепляет shelterin-ассоциированные теломеры с матриксом (Kaminker et al., 2009). Значение этой находки ещё предстоит определить.
POT1 and TPP1
POT1 и TPP1 являются наиболее эволюционно законсервированными компонентами комплекса shelterin , так что они представляют собой человеческие гомологи α- и β-субъединиц telomere end-binding proteins (TEBPs) реснитчатых, соотв. (Baumann and Cech, 2001; Lei et al., 2004; Wang et al., 2007; Xin et al., 2007). POT1 гомологи из дрожжей yeast (Baumann and Cech, 2001), растений (Shakirov et al., 2005) и недавно из реснитчатых Tetrahymena thennophila (Jacob et al., 2007) и потенциально нематоды C. elegans (Raices et al., 2008) были идентифицированы на базе их последовательностей и структурных характеристик с oligonucleotide/oligosaccharide-binding (OB) складкой в ДНК-связывающем домене TEBPs.
Как обсуждалось выше, теломерный довесок является известным субстратом для связывания POT1. ДНК-связывающий мотив hPOT1 располагается на на его двух N-терминальных OB складках (OB1 и OB2) (Lei et al., 2004), тогда как С-конец обеспечивает его взаимодействие с TPP1 (Houghtaling et aL, 2004; Liu et al., 2004b; Ye et al., 2004b). Кристаллическая структура ДНК-связывающего мотива hPOT1 в ассоциации с теломерной ssDNA иллюстрирует, что минимум 10 нуклеотидов точного регистра (5'-TTAGGGTTAG-3') необходимы для оптимального взаимодействия (Lei et al., 2004). Более того, доказано, что концевые 3' нуклеотиды запрятаны внутри молекулярной поверхности домена OB2. Это указывает на то, что один POT1 может быть достаточен, чтобы обеспечить защиту G-довеска (Lei et al., 2004). Это предсказание было проверено с помощью in vitro биохимического подхода, который продемонстрировал, что hPOT1 может взаимодействовать с его декамером последовательности распознавания двумя отличающимися способами: при одном из которых взаимодействие осуществляется дистально от 3' конца, заставляя свободный конец ДНК приспосабливаться , чтобы обеспечить доступ и элонгацию с помощью рекомбинантной теломеразы; а при втором доступ закрыт за счет соединения более проксимально с 3' концом (Lei et al., 2005). Такое бимодальное связывание G-довеска с помощью hPOT1 д. объяснить наблюдение, что искусственно нарушенные уровни hPOT1 оказывают как негативные, так и позитивные эффекты на зависимое от теломеразы поддержание длины теломер in vivo (Colgin et al.. 2003: Loayza and De Lange, 2003).
Фенотипические последствия потери POT1 in vivo до некоторой степни не согласуются у разных видов. Устранение гена pot1 у делящихся дрожжей ведут к полной потере теломерной ДНК и замыканию хромосом в кольца, это позволяет выживать в отсутствие защиты концов хромосом (Baumann and Cech, 2001). Напротив, в клетках человека, где только частичная делеция POT1 выполнима, дает фенотип значительно более лёгкий: слияния обнаруживаются не всегда, длина G-довеска до некоторой степени изменена, в результате возникают временные реакции на повреждения ДНК и в некоторых случаях присутствуют хромосомные аномалии, сопровождаемые арестом клеточного цикла или апоптозом (Hockemeyer et al., 2005; Veldman et al., 2004). У грызунов ситуация снова отличается. У большинства позвоночных POT1 кодируется одиночным геном, но у грызунов обнаружена недавняя дупликация, дающая два POT1 ортолога, POT1a и POT1b, каждый выполняет самостоятельную роль в защите теломер (Hockemeyer et al., 2006; Wu et al., 2006). Условная делеция одного лишь Pot1a или вместе с Pot1b вызывает тяжелую ATR-управляемую реакцию на повреждения ДНК (Denchi and de Lange, 2007; Hockemeyer et al., 2006; Wu et al., 2006), в то время как делеция одного Pot1b вызывает прогрессирующее укорочение теломер и избыточную резекцию 5' нити, давая в результате длинные G-довески (Hockemeyer et al., 2006; Hockemeyer et al., 2008). И POT1a и POT1b, как было установлено, играют роль в контроле теломерной рекомбинации, судя по событиям telomere sister chromatid exchange (t-SCE) (Hockemeyer et al., 2005) или по внехромосомным теломерным кругам (Wu et al., 2006). Эксперименты по обмену местами доменов показали, что hPOT1 содержит признаки двух мышиных аналогов (Palm et al., 2009), он обнаруживает и сильный эффект на ATR-управляемую реакцию на повреждения ДНК и гарантирует защиту довеска от нежелательных processing активностей или теломеразы. Следовательно, очевидно, что POT1 у мыши и человека обеспечивают защиту специфически от ATR и реакции на повреждения ДНК (Denchi and de Lange, 2007). Это также верно для куриного POT1 (Churikov and Price, 2008), выстраиваются некоторые параллели для ролей POT1 позвоночных в защите концов.
У C. elegans, как упоминалось ранее, имеется два специфичных для теломер ssDNA-связывающих белка, CeOB1 и CeOB2; они обнаруживают общую структурную гомологию с OB2 и OB1 складками hPOT1, соотв. Интересно, что делеция CeOB1 ведет к удлинению довеска и теломер, тогда как потеря CeOB2 вызывает гетерогенность длин теломер (Raices et al., 2008). Это указывает на то, что, с одной стороны, CeOB1 может регулировать доступ теломеразы к довеску; с др. стороны, CeOB2 может предупреждать неконтролируемую потерю или избыток теломерной ДНК благодаря дерегуляции рекомбинации.
Вовлечение POT1 в регуляцию динамики длин теломер в основном обусловлено её связью с TPP1. Было предположено, что TPP1 играет инструментальную роль в координации сборки всего shelterin комплекса (O'Connor et al., 2006), и это, как полагают, стабилизирует взаимодействие TIN2-TRF2 стыкуемость TRF1 и TRF2 субкомплексов. Помехи TIN2-зависимой локализации TPP1 на теломерах нарушают сборку собственно shelterin, приводя к избыточной элонгации теломер в клетках, которые экспрессируют telomerase (Houghtaling et al., 2004; O'Connor et al., 2006). Нарушение POT1-TPP1 связи приводит к сходному результату, что сопровождается реакцией на повреждения ДНК (Xin et al., 2007). Длительное время было непонятно, как shelterin комплекс поддерживает связь с теломеразой и контролирует её доступ к G-довеску. Затем было установлено, что OB домен в TPP1 может физически взаимодействовать с каталитической субъединицей теломеразы человека, hTERT, и способствовать её рекрутированию на хромосомный конец (Xin et al., 2007). Более того, POT1-TPP1 гетеродимер, как было установлено, усиливает активность и способность к преобразованиям рекомбинантной теломеразы человека in vitro (Wang et al., 2007). Эти находки проливают свет на то, как POT1-TPP1 дуэт может модулировать изменения длины теломер. Недавно Miyoshi и др. идентифицировали tpz1 как гомолог TPP1 у делящихся дрожжей (Miyoshi et al., 2008). Комплекс pot1-tpz1 также участвует в регуляции длин теломер и защите концов у делящихся дрожжей, хотя с участием двух новых партнёров по взаимодействию, poz1 и ccq1, это предписывает им функцию в регуляции длины негативным и позитивным способом, соотв. (Miyoshi et al., 2008).
Итак, POT1, по-видимому, выполняет две ключевые роли в теломерном довеске: TPP1-ассистируемый (у большинства видов) контроль флюктуаций длин теломер, обеспечиваемый за счёт теломеразы или событий рекомбинации, и защита довеска от инсультов с помощью аппарата, реагирующего на ДНК-повреждения.
RAP1
RAP1 является довольно хорошо изученным членом комплекса shelterin у человека. Он впервые был идентифицирован как взаимодействующий с TRF2 белок, который обладает существенным сходством последовательностей с белком Rap1p у
Saccharomyces cerevisiae (Li et al., 2000), как известно, играющего ключевую роль в регуляции длины теломер (Marcand et al., 1997). Экзогенная экспрессия полной длины или мутантного аллеля человеческого RAP1 ведет к элонгации теломер, это согласуется с идеей, что экзогенный белок или замещает своего эндогенного аналога в теломерах или оттитровывает др. факторы, участвующие в негативной регуляции длины теломер; или с помощью обоих сценариев, флюктуации длин теломер обнаруживали зависимость от экспрессии теломеразы (Li et al., 2000: O'Connor et al., 2004). Делеционный анализ выявил, что центральный линкерный домен human RAP1 (hRAP1) ответственен за его негативную регуляторную роль (O'Connor et al., 2004), в то время как N-терминальный BRCT домен участвует, влияя на гетерогенность длин теломер (Li et al., 2000). Помимо его участия в гомеостазе длин теломер, hRAP1, как было установлено, ассистирует TRF2 в ингибировании событий слияний конец-в-конец на теломерных субстратах
in vitro, указывая тем самым, что TRF2 сам по себе недостаточен для прекращения NHEJ-обусловленных слияний концов хромосом и что hRAP1 является существенным для защиты концов (Bae and Baumann, 2007).
Accessory proteins
TRF1 и TRF2, координационный центр межбелковых взаимодействий на теломерах, обладает общим TRF homology (TRFH) доменом. который, по-видимому, необходим для гомодимеризации каждого индивидуального белка; гетеродимеризации двух белков не наблюдалось. Удивительно, экспрессии два белка эксплуатируют TRFH мотив для рекрутирования разных взаимодействующих партнеров. TRF1 использует молекулярную поврехность TRFH, чтобы распознавать TIN2 и акцессорный белок, PinX1 (Zhou and Lu, 2001), тогда как TRF2 использует эту поверхность, чтобы соединиться с Apollo (Freibaum and Counter, 2006; Lenain et al., 2006; van Overbeek and de Lange, 2006), др. акцессорным членом. TRF2-TIN2 взаимодействие происходит вне TRFH домена. Эти находки привели к предположению, что TRFH является местом швартовки, которое распознает белки, базируясь на консенсусной последовательности [F/Y]xLx(
P) (Chen et al., 2008). Базируясь на последовательности этого мотива, были идентифицированы два новых взаимодействующих с TRF2 партнёра, phosphatase nuclear-targeting subunit (PNLTS) и microcephalin 1 (MCPH1) (Kim et al., 2009). Исчерпывающий список белков, связанных с комплексом shelterin человека, см. Table 1.
Telomere maintenance pathways
ДНК теряется каждый раз во время деления клетки в отсутствие теломеразы (Harley et al.. 1990: Lundblad and Szostak. 1989). Эта потеря в основном приписывается 'end replication problem' (see below) (Olovnikov, 1973; Watson, 1972) и событиям процессинга, которые сопровождают полу-консервативную репликацию ДНК. Хотя большинство клеток в теле человека обречено подвергаться изнашиванию теломер, что в конечном итоге приводит их к старению, клетки зародышевой линии и большинство (>85%) из тех, что подвергаются злокачественному перерождению, экспрессируют теломеразу (Shay and Bacchetti, 1997: Wright et al., 1996), энзим, который корректирует теломерные потери (Box 1, Fig. ЗА).
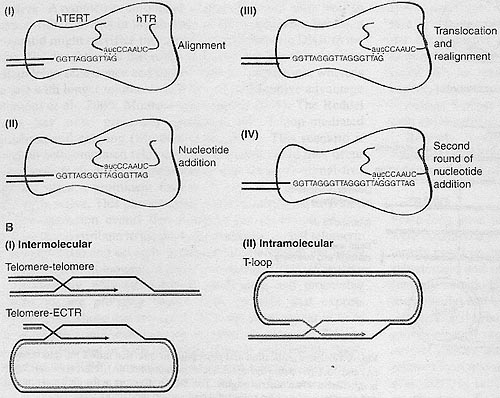 ) and homologous-recombination-driven (B) synthesis of telomeric DNA. (Al) DNA synthesis is initiated with the alignment of the 3' telomeric G-overhang (in blue) with the RNA template (in red). (AH) Telomerase catalyzes nucleotide addition to the overhang until the 5' end of the template is reached. (АШ) The enzyme translocates and realigns with the newly sunthesised 3' end of the overhang ( primer). (ATV) A second round of nucleotide addition ensues. (B) Both inter- and intratelomeric recombination events have been hypothesised to foster telomere maintenance in ALT. In both types of recombination, the 3' overhang of the telomere initiates invasion and uses its host DNA as a template for DNA copying. (BI) Intermolecular recombination might involve telomeres from two adjacent chromosomes or chromatids. Alternatively, telomere alignment and invasion into circular or linear (not shown) ECTR could also promote DNA synthesis. (ВII) The telomere could also use itself as a template and synthesize DNA via rolling circle replication.
) and homologous-recombination-driven (B) synthesis of telomeric DNA. (Al) DNA synthesis is initiated with the alignment of the 3' telomeric G-overhang (in blue) with the RNA template (in red). (AH) Telomerase catalyzes nucleotide addition to the overhang until the 5' end of the template is reached. (АШ) The enzyme translocates and realigns with the newly sunthesised 3' end of the overhang ( primer). (ATV) A second round of nucleotide addition ensues. (B) Both inter- and intratelomeric recombination events have been hypothesised to foster telomere maintenance in ALT. In both types of recombination, the 3' overhang of the telomere initiates invasion and uses its host DNA as a template for DNA copying. (BI) Intermolecular recombination might involve telomeres from two adjacent chromosomes or chromatids. Alternatively, telomere alignment and invasion into circular or linear (not shown) ECTR could also promote DNA synthesis. (ВII) The telomere could also use itself as a template and synthesize DNA via rolling circle replication.
Поддержание теломер в отсутствие теломеразы базируется на механизмах, которые используют меж- и внутрителомерную рекомбинацию, обозначаемую общим термином ALT (Box 1, Fig. 3B).
Telomere replication and processing
Репликация теломер и последующие их ступени процессинга изучены плохо, особенно в контексте активированных путей поддержания теломер. Репликация теломер, по-видимому, однонаправлена, поскольку, как было установлено, она начинается в субтеломере, при этом репликационная вилка движется в направлении конца хромосомы. Учитывая законсервированную ориентацию теломерных повторов, G- и С-rich нити неминуемо синтезируются с помощью leading- и lagging-strand полимераз, соотв. (Gilson and Geli, 2007) (Fig, 4A). Обычный аппарат репликации ДНК работает только в направлении 5'-3' и базируется на присутствии РНК праймера, чтобы синтезировать короткие кусочки ДНК (Okazaki фрагменты), которые в конечном итоге соединяются и образуют непрерывную нить ДНК. Последовательности матрицы между крайним концом нити ДНК и наиболее дистальным фрагментом Okazaki не могут быть реплицированы после удаления РНК праймера, это приводит к потере ДНК на 5' конце вновь синтезированной С-нити; это известно как 'end replication problem'. Хотя синтез отстающей нити дает короткий 3' довесок, продукт синтеза с лидирующей нити заканчивается тупо. Это составляет проблему для теломеразы, поскольку она нуждается в G-rich довеске в качестве своего субстрата. Генерация 3' теломерного довеска, по-видимому, влечет за собой резекцию C-rich нити; однако, nuclease(s), ответственные за это событие процессинга ДНК, ещё не идентифицированы. Теломеразная элонгация G-rich довеска сопровождается полу-консерватисной репликацией C-rich нити, это завершается с помощью конвенционных полимераз (Verdun and Karlseder, 2007) (Fig. 4A). Дальнейшее преобразование 3' концов ДНК, по-видимому, сопровождается кооперативным синтезом G- и C-rich нитей, чтобы облегчить образование T-петли. Очевидно, что распознавание реплицируемых теломер как повреждений ДНК является обязательной ступенью, которая запускает молекулярный аппарат, использующий упомянутую выше HR и теломерные белки, чтобы способствовать образованию довеска и сборке этой защитной структуры (Verdun et al., 2005; Verdun and Karlseder, 2006).
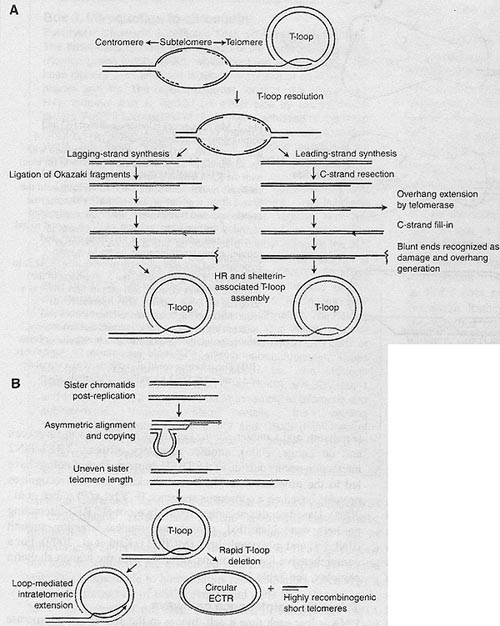 Fig. 4, Telomere replication and processing in cells that utilize the telomerase (A) and ALT (B) pathways of telomere maintenance. (A) Telomeric replication is initiated at subtelomeric origins. The T-loop structure at the chromosome end must be resolved for successful replication; the factors responsible for T-loop disassembly, if required, are unknown. The product of lagging-strand synthesis bears a short G-rich overhang, whereas that of leading-strand synthesis is blunt-ended and thus needs to be processed to yield the correct substrate for telomerase. It is unclear whether further processing also needs to occur at the lagging-strand synthesis product. Telomerase elongates the newly formed overhangs and conventional DNA polymerases till in the opposite strand. At this point, fully replicated telomeres are envisaged to provoke DNA damage, which is thought to be the trigger for end processing and T-loop assembly to reinstate a protected telomere end. (B) Post-replication telomeres at sister chromatids are of equivalent length. In cells that use the ALT pathway, asymmetric alignment could promote unbalanced telomere elongation of one telomere at the expense of the other, resulting in very long and short telomeres. Such alignments could also initiate uneven t-SC'E events (not shown) in the absence of DNA synthesis. All replicated telomeres of sufficient length can then take up the T-loop structure, whereby further self-templated telomere synthesis could ensue via rolling circle replication. Alternatively. T-loops could be inappropriately resolved, resulting in release of free telomere circles and severely shortened telomeres with high recombinogenic potential.
Fig. 4, Telomere replication and processing in cells that utilize the telomerase (A) and ALT (B) pathways of telomere maintenance. (A) Telomeric replication is initiated at subtelomeric origins. The T-loop structure at the chromosome end must be resolved for successful replication; the factors responsible for T-loop disassembly, if required, are unknown. The product of lagging-strand synthesis bears a short G-rich overhang, whereas that of leading-strand synthesis is blunt-ended and thus needs to be processed to yield the correct substrate for telomerase. It is unclear whether further processing also needs to occur at the lagging-strand synthesis product. Telomerase elongates the newly formed overhangs and conventional DNA polymerases till in the opposite strand. At this point, fully replicated telomeres are envisaged to provoke DNA damage, which is thought to be the trigger for end processing and T-loop assembly to reinstate a protected telomere end. (B) Post-replication telomeres at sister chromatids are of equivalent length. In cells that use the ALT pathway, asymmetric alignment could promote unbalanced telomere elongation of one telomere at the expense of the other, resulting in very long and short telomeres. Such alignments could also initiate uneven t-SC'E events (not shown) in the absence of DNA synthesis. All replicated telomeres of sufficient length can then take up the T-loop structure, whereby further self-templated telomere synthesis could ensue via rolling circle replication. Alternatively. T-loops could be inappropriately resolved, resulting in release of free telomere circles and severely shortened telomeres with high recombinogenic potential.
В клетках, которые связаны с ALT путём поддержания теломер, потеря теломерной ДНК, обусловленная репликацией и процессингом, в основном нейтрализуется пост-репликативно посредством событий меж- и внутримолекулярной рекомбинации (Fig. 3B and Fig. 4B). Предполагается, что выравнивание сестринских хроматид (или хроматид соседних хромосом; Fig. 3B) делает возможной инвазию 3' довеска одной из хроматид в дуплексный регион её сестры, которая может затем служить в качестве матрицы для копирования теломеры. Если выравнивание асимметрично, то д. происходить неодинаковое удлинение теломеры одной хроматиды, это д. происходит за счёт другой, давая чрезвычайно длинную и короткую теломеры, которые являются типичными для клеток, в которых активен ALT. Асимметричное расположение хроматид д. также приводить к событиям неравного t-SCE в отсутствие синтеза ДНК; при этом хроматида может жертвовать полностью свою теломерную ДНК сестринской хроматиде. Дочерняя клетка, которая получает хромосому без теломеры д. подвергаться старению и теряться из популяции, тогда как та, с более длинной теломерой получает пролиферативные преимущества (Muntoni ei al., 2009; Muntoni and Reddel, 2005). Группа Reddel представила доказательства T-loop-обеспечиваемого внутрихроматидного копирования (Muntoni et al., 2009). Этот сценарий базируется на синтезе с теломеры, служащей сама себе матрицей, и д. происходить поэтому до или после репликации. Хромосомы с концами, свободными от теломерного сигнала, часто примечательное свойство клеток, в которых активен путь ALT. Этот феномен может быть приписан событиям T-loop junction-resolution, которые приводят к образованию свободных T-кружков, которые вносят вклад в пул extrachromosomal telomeric repeats (ECTRs), и сильно укорачивают теломеры, которые, скорее всего, являются высоко рекомбиногенными (Cesare and Reddel, 2008) (Fig. 4R).
Итак, хотя репликация и аппарат процессинга теломер возможно одинаковы ежду клетками, которые экспрессируют теломеразу и теми, что задействуют ALT, последние, по-видимому, находятся в более ненадёжном состоянии в терминах защиты теломер. T-loops наблюдались в обоих типах клеток (Cesare and Griffith. 2004; Griffith et at, 1999); однако очевидно, что теломерный хроматин внутри этой структуры в клетках, которые используют ALT, организован более рыхло. Более того, большая пропорция теломер может не обладать T-петлёй из-за недостаточной длины. Вполне возможно, что функция shelterin, в особенности функция TRF2, каким-то образом поставлена под угрозу, хотя специфические дефекты не были описаны для каждого из членов shelterin в клетках с активированным ALT.
Telomere length homeostasis
Telomerase access and levels Даже в злокачественных клетках, которые экспрессируют теломеразу на высоких уровнях, длина теломер сдерживается. Накапливающиеся доказательства показывают, что доступ теломеразы к своему субстрату тонко регулируется, это позволяет дать одно из возможных объяснений баланса длины; др. возможным объяснением является то, что уровни теломеразы ограничены. В самом деле, повышенная экспрессия hTERT и уровней telomerase RNA (hTR) в клетках, которые уже экспрессируют теломеразу, приводила к массивной элонгации теломер, одновременно с усилением загрузки теломерных белков (Cristofari and Lingner, 2006). Это подтверждает, что несмотря на повышенную загрузку TRF1 и TRF2, длинные теломеры не постоянно находятся в закрытом недоступном состоянии и, что, более важно, гомеостаз теломер требует, чтобы уровни теломеразы были ограничены (Cristofari and Lingner, 2006). В одном исследовании сообщалось, в контексте избытка теломеразы, обусловленного избыточной экспрессией hTR в telomerase-позитивных клетках, теломеры удлинялись в несколько раз за пределы своей физиологической нормы. Однако эта длина возрастала не экспоненциально; скорее она достигала плато после экстенсивного культивирования. Эта стабилизация длины теломер сопровождалась гетерогенностью длин теломер, появлением циркулярных и однонитчатых внехромосомных теломерных ДНК и формированием ALT-ассоциированных PML body (APB)-подобных ядерных фокусов; это все признаки, характеризующие клетки, которые используют ALT путь (Pickett et al., 2009). На базе этих наблюдений авт. предположили, что клетки обладают прирожденным механизмом, который позволяет урезать теломеры, как только они достигнут определенного порога, хотя детерминанты этого порога неизвестны. Важно, что через чур удлиненные теломеры не запускают реакции на повреждения ДНК, указывая тем самым, что они были достаточно защищены (Pickett et al., 2009).
Кроме того, исходя из канонической роли в противодействии потере теломерной ДНК, теломераза также, как полагают, играет более непосредственную роль в защите теломер; это предполагается вызыванием 'capping' концов хромосом посредством устойчивого взаимодействия с G-довеска (Chan and Blackburn, 2002). Хотя такая роль может быть приложима только к трансформированным или злокачественным клеткам, которые экспрессируют теломеразу на высоком уровне, имеются некоторые доказательства, что существует скромная специфичная для S-фазы экспрессия этого энзима в первичных клетках (Masutomi et al., 2003).
Недавно получена информация, что гомеостаз длин теломер может также достигаться с помощью самостоятельного, прежде неизвестного механизма - продукции теломерных транскриптов.
TERRA
Длительное время теломеры и соседняя субтеломерная область рассматривались как транскрипционно молчащие. Это мнение в основном базировалось на наблюдениях метилирования циркулярной ДНК в субтеломерной области и на избыточной репрезентации гетерохроматичеcqких меток (а именно, триметилировании гистонов H3 и H4 по лизинам 9 и 20, соотв.) и связыванию гетерохроматинового белка 1 как в теломерной, так и субтеломерной областях (Blasco, 2007). Однако недавно было сообщено, что теломеры являются интактными, транскрибируются у некотоых видов и дают L'UAGGG-содержащие РНК повторы, обозначенные как telomeric repeat-containing RNA (TERRA) (Azzalin etal., 2007) или TelRNA(Schoeftner and Blasco, 2008). Транскрипция является нить-специфичной и обеспечивается с помощью RNA polymerase II (Luke et al., 2008: Schoeftner and Blasco, 2008). Транскрипты оказываются предметом негативной регуляции с помощью 5'-3' exonuelease активности Rat1p у
S. cerevisiae (Luke et al., 2008) и с помощью эффекторов nonsense-mediated распада мРНК, известных как SMG белки у дрожжей (Azzalin et al., 2007). TERRA локализуется в теломерах (Azzalin et al., 2007; Schoeftner and Blasco, 2008) и, как предполагается, негативно влияет на активность теломеразы одни из трёх предполагаемых способов: с помощью гибридизации TERRA с комплементарным районом матрицы в РНК части теломеразы (Schoeftner and Blasco, 2008): путём образования РНК-ДНК дуплексов (Luke et al., 2008); путём образования G-quadruplexes на теломерах (Xu et ai., 2008). В соответствии с этими предположениями уровни TERRA строго снижаются в иммортализованных telomerase-позитивных клеточных линиях по сравнению с первичными клетками или клетками, вовлеченными в ALT (Ng et al., 2009). Кроме того, уровни TERRA сильно повышаются у пациентов с синдромом immunodeficiency, centromeric region instability, facial anomalies (ICF), клетки которых обладают аномально коротки теломерами (Yehezkel et al., 2008), это подтверждает потенциальное использование TERRA в гомеостазе длин теломер.
Telomerase-independent homeostasis
Гомеостаз длин теломер в теломераза-дефицитных клетках может быть обусловлен рекомбинацией, инициируемой самыми короткими теломерами. Эта идея подтверждена недавними находками из Лаб. Greider, показавшими, что некоторые элементы механизма ALT, такие как t-SCE и случаи субтеломерной рекомбинации могут быть использоаны нетрансформированными клетками, чтобы поддерживать стабильные теломеры без чистого выигрыша в длине (Morrish and Greider, 2009).
Telomeric chromatin
Теломеры млекопитающих содержат нуклеосомы (Lejnine et al., 1995; Tommerup et al., 1994) , а теломеры мышей обладают метками конституитивного гетерохроматина (Blasco, 2007) (Box 3). Недавние находки на грызунах выявили связь между эпигенетическим состоянием теломерного хроматина и поддержанием длин теломер. Напр., эухроматин эукариот представлен ДНК, упакованной гистонами. Базовым строительным блоком хроматина является нуклеосомная частица (Kornberg and Lorch, 1999), которая содержи примерно 147 пар оснований ДНК, обёрнутых по поверхности октамера из 4 гистоновых белков. Гистоновый октамер состоит из центрального (H3-H4)2 тетрамера, которые фланкированы с любой из сторон двумя H2A-H2B 1 димерами. Дальнейшая компакция хроматина достигается с помощью линкерного гистона H1. Теломерный хроматин млекопитающих сходен в этом с дрожжевым, и как было показано, обеспечивает эффект молчания в оношении экспрессии соседних генов (Baur et at., 2001), феномен наз. telomere-position effect (TPE).
Хроматин существует в двух состояниях: эухроматин и гетерохроматин. Теломеры и соседние субтеломерные последовательности рассматриваются как лишенные генов и представляют собой гетерохроматин. Признаками модификаций ДНК в гетерохроматин является добавление метильной группы к пятой позиции цитозина в CG динуклеотидах. Эта реакция катализируется тремя ДНК meihyltransferases - DNMT1, DNMT3a и DMMT3b. Теломерная ДНК млекопитающих лишена CG динуклеотидов, но они многочисленны в субтеломере, которая является поэтому предметом сильного метилирования. Флексибельные N-терминальные хвосты гистонов ответственны за разнообразные посттрансляционные модификации, такие как триметилирование по H3K9 или H4K20, которые в дальнейшем предопределяют теломерный гетерохроматин. Эти гистоновые модификации обеспечиваются с помощью гистоновых methyltransferases SUV39H1 и H2 (для H3K9), иSUV420H1 and Н2 (для H4K20). Сборка гетерохроматина в теломерной и субтеломерной областях влечет за собой связывание chromobox белков CBX1,CBX3 and CBX5 (гомологи Drosophila metanogaster hetefochromatin protein 1, HP1) в эти области (Biasco, 2007).
Напр., укороченные теломеры у telomerase-нулевых мышей обнаруживают потерю триметилированных H3K.9 и H4K20 гетерохроматиновых меток, уменьшение связывания HP1 теломерным хроматином и потерю метилирования субтеломерной ДНК. Все эти находки указывают на то, что более короткие теломеры ассоциированы с более 'открытым' состоянием хроматина, которое ответственно за гомологичную рекомбинацию, заметную по увеличению частоты событий t-SCE и APB фокусов (Benetri et at., 2007). В согласии с этой идеей метилирование повторов субтеломерной ДНК негативно коррелирует с длиной и рекомбинацией теломер в большом наборе раковых клеточных линий человека (Vera et al., 2008). Кроме того, клетки. генетически дефицитные по гистону или ДНК methyltransferases, или нулевые по членам семейства Retinoblastoma (Rb), как было установлено, обладают драматически удлененными теломерами и более склонны к рекомбинации (Garcia-Cao et al., 2002; Garcia-Cao et al., 2004; Gonzalo and Biasco, 2005; Gonzalo et al.. 2006). Следовательно, теломерный гетерохроматин в своей компактной конфигурации является негативным регулятором длин теломер.
Потеря гетерохроматиновых меток на мышиных теломерах не влияет на положение на теломерах TRF1 и TRP2 белков (Benetti et al., 2007); тем не менее оба эти белка участвуют в эпигенетической регуляции теломер. Избыточная экспрессия TRF1 в культивируемых клетках человека, как было установлено, временно ослабляет теломерную репрессию искусственно введенного репортерного гена с субтеломерную область, это указывает на освобождение от telomere-position effect (TPE); это событие дерепрессии коррелирует с вытеснением изоформ HP1из теломер (Koering et al., 2002). Избыточная экспрессия TRF2 в первичных кератиноцитах мыши ведет к специфичной дл теломер потере признаков гетерохроматина, усменьшению числа стержневых гистонов и увеличению нуклеосомных пространств, всё это признаки более расслабленного состояния хроматина теломер. Это указывает на потенциальное вовлечение TRF2 в сборку хроматина (Benetti et al., 2008), и указывает на связь между организацией хроматина теломер и защитой концов. Отметим, что устранение защиты теломер, которые чувствительны или к NHEJ или HDR пути репарации, не сказывается на ощущении потери положения на нуклеосоме, как это характерно для др. частей генома, подверженных репарации ДНК (Wu and de Lange, 2008). Это указывает на то, что нуклеосомная организация телмер может быть уникально доступной для репаративной активности (Wu and de Lange, 2008). Недавно группа de Lange сообщила, что теломеры, лишенные защиты, свободные от TRF2 были более мобильны и оказывались собранными на более крупных территориях в ядре, и что подобное увеличение динамики теломерного хроматина облегчает 53BP1 -обеспечиваемый NHEJ (Dimitrova et al., 2008).
Было предположено, что нуклеосомы предоставляют дополнительный слой защиты теломерам, поскольку связывание теломерных белков, таких как TRF1, не приводит к высвобождению нуклеосом от теломерного хроматина. Скорее подобное связывание вносит изменения в структуру нуклеосом, что может вести к образованию защитной теломерной шапочки (Galati et al., 2006).
В контексте рака, линии раковых telomerase-позитивных клеток обладают плотно метилированными субтеломерами, тогда как опухоли, происходящие из клеток, использующих ALT, ассоциированы с гетерогенными паттернами метилирования; первое скоррелировано с сильно пониженными уровнями теломерных транскриптов. Это наблюдение позволяет предполагать, что эпигенетические различия между telomerase- и ALT-позитивными опухолями могут поддерживать механизм поддержания длин теломер при туморогенезе у человека
(Ng et al., 2009).
Perspectives
Although we have made significant progress in uncovering the intricate layers of chromosome-end protection, many aspects of this process remain poorly understood. We have yet to identify the enzvme(s) involved in overhang generation, which is a prerequisite for T-loop formation. The prevalence of the T-loop in vivo is unknown, meaning that other modes ofproteetion are possible. Furthermore, the ambiguous interplay between shclierin and the DNA-damage sensor and repair machinery has yet to be dissected. Recent findings regarding telomeric chromatin and its involvement in homeostasis of telomere length have introduced a new facet of telomere biology, the understanding of which is still in its infancy. Finally, the importance of potential differences between mouse and human telomere biology has vet to be explored in detail. Therefore, despite much progress, many challenges in improving our understanding of telomere protection still lie ahead.
Сайт создан в системе
uCoz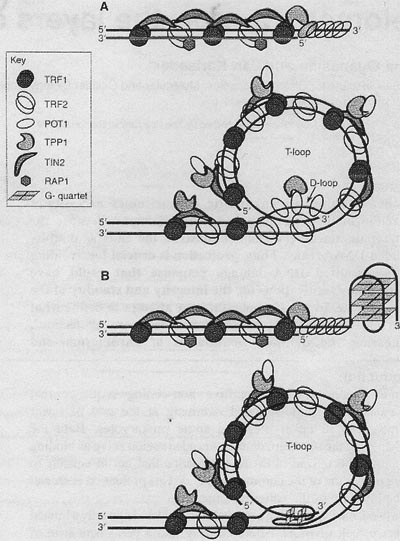 Fig. I. Schematic representation of the chromosome end decorated with members of the shelterin complex. (A) Linear (top) and folded T-loop (bottom) structural states of the telomere arc depicted. Note that in the 'open" linear conformation, POT I alone might be sufficient to confer 3' overhang protection. Ш) An anti-parallel intramolecular G-quadruplex either alone ( top i or in the context of a T-loop (bottom) might perform a capping role to protect the chromosome terminus from degradation bv nucleases or extension bv telomerase or .ALT.
G-довеска в вышестоящую двунитчатую область теломеры, посредством чего довесок спаривается с оппозитной нитью, давая более короткую displacement loop (D-loop) из G-rich нити . Такая ДНК-белок структурная организация, как полагают, секвестрирует иным способом экспозированный теломерный довесок, тем самым обеспечивая распознавание хромосомного конца как двунитчатый разрыв и ограничивая несанкционированный доступ теломеры к её субстрату. POTl , как полагают, стабилизирует основание T-loop посредством её взаимодействия с D-loop. У С elegans, илиr CeOB 1 или CeOB2, по-видимому, располагаются на основании T-петель (Raices et al., 2008). Более того, получены доказательства с помощью метода инвазии in vitro, что искусственно сконструированные 3' G-rich и 5' C-rich довески теломерных полседовательностей позвоночных могут вторгаться в двунитчатую ДНК столь же эффективно, показывая тем самым отсутствие преференций в отношении полярности ДНК (Verdun and Karlseder, 2006). Это делает возможным, что 5 ' C-rich довески могут также участвовать в формировании T-петли, а , следовательно, играют роль в защите теломер.
Fig. I. Schematic representation of the chromosome end decorated with members of the shelterin complex. (A) Linear (top) and folded T-loop (bottom) structural states of the telomere arc depicted. Note that in the 'open" linear conformation, POT I alone might be sufficient to confer 3' overhang protection. Ш) An anti-parallel intramolecular G-quadruplex either alone ( top i or in the context of a T-loop (bottom) might perform a capping role to protect the chromosome terminus from degradation bv nucleases or extension bv telomerase or .ALT.
G-довеска в вышестоящую двунитчатую область теломеры, посредством чего довесок спаривается с оппозитной нитью, давая более короткую displacement loop (D-loop) из G-rich нити . Такая ДНК-белок структурная организация, как полагают, секвестрирует иным способом экспозированный теломерный довесок, тем самым обеспечивая распознавание хромосомного конца как двунитчатый разрыв и ограничивая несанкционированный доступ теломеры к её субстрату. POTl , как полагают, стабилизирует основание T-loop посредством её взаимодействия с D-loop. У С elegans, илиr CeOB 1 или CeOB2, по-видимому, располагаются на основании T-петель (Raices et al., 2008). Более того, получены доказательства с помощью метода инвазии in vitro, что искусственно сконструированные 3' G-rich и 5' C-rich довески теломерных полседовательностей позвоночных могут вторгаться в двунитчатую ДНК столь же эффективно, показывая тем самым отсутствие преференций в отношении полярности ДНК (Verdun and Karlseder, 2006). Это делает возможным, что 5 ' C-rich довески могут также участвовать в формировании T-петли, а , следовательно, играют роль в защите теломер. 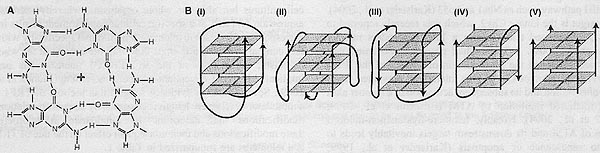 Fi". 2. G-quadruplex heterogeneity. (A) Chemical structure of the G-quartet, the base unit of a G-quadruplex, with a monovalent cation at its core (indicated by the red +). (B) Multiple G-quartets stack on top of"each other to form a G-quadruplex. A single DNA strand can fold upon itself to form an intramolecular G-quadruplex (I-III). whereas two or four DNA strands can assemble into dimeric (IV) or tetramcric (V) intermolecular G-quadruplexes. respectively. The arrows indicate the parallel (II, V) or anti-parallel i i, III. IV) orientation of DNA strands, introducing a further source of heterogeneity. Parallel and anti-parallel hybrid conformations have also been reported (III).
Эта структура с готовностью образуется in vitro при использовании олигонуклеотидов теломерных последовательностей и стабилизируется с помощью моновалентных катионов, таких как натрий и калий, оба из которых обильны внутри клетки. Давно предполагалось, что G-quadrupIexes имеют физиологическое значение в теломерах; , однако, предоставление доказательств их существования in vivo затруднено в большинстве организмов (Oganesian and Bryan, 2007). Тем не менее, имеются убедительные доказательства существования in vivo внутримолекулярных G-quadruplex в соматических микроядрах ресничатых протозоа Stylonichia lemnae (Paeschke et al., 2005; Schaffitzel et al., 2001). Синтетически сконструированные G-quadruplex-специфические антитела были использованы для детекции этой структуры в экспериментах с иммунофлюоресценцией. Позитивное окрашивание не обнаруживается, когда S. lemnae telomere-binding proteins (αTBP и βTBP) были истощены, с использованием RNA interference, указывая тем самым, что эти белки необходимы для образования G-quadruplex in vivo. Более того, зависимое от клеточный цикл cyclin-dependent kinase 2 (Cdk2)-обусловленного фосфорилировани C-терминальной порции βTBP необходимо для распаковывания G-quadruplex из-за ингибирования этого фосфорилирования in vivo, приводящего к позитивному окрашиванию на G-quadruplex ДНК на репликационном диске макроядер S. lemnae, регионе, который ранее был лишён сигналов G-quadruplex signals. Это указывает на то, что ДНК G-quadruplex д. быть разрешена во время репликации теломеры и что это событие демонтажа обеспечивается с помощью βTBP фосфорилирования (Paeschke et al, 2005).
Fi". 2. G-quadruplex heterogeneity. (A) Chemical structure of the G-quartet, the base unit of a G-quadruplex, with a monovalent cation at its core (indicated by the red +). (B) Multiple G-quartets stack on top of"each other to form a G-quadruplex. A single DNA strand can fold upon itself to form an intramolecular G-quadruplex (I-III). whereas two or four DNA strands can assemble into dimeric (IV) or tetramcric (V) intermolecular G-quadruplexes. respectively. The arrows indicate the parallel (II, V) or anti-parallel i i, III. IV) orientation of DNA strands, introducing a further source of heterogeneity. Parallel and anti-parallel hybrid conformations have also been reported (III).
Эта структура с готовностью образуется in vitro при использовании олигонуклеотидов теломерных последовательностей и стабилизируется с помощью моновалентных катионов, таких как натрий и калий, оба из которых обильны внутри клетки. Давно предполагалось, что G-quadrupIexes имеют физиологическое значение в теломерах; , однако, предоставление доказательств их существования in vivo затруднено в большинстве организмов (Oganesian and Bryan, 2007). Тем не менее, имеются убедительные доказательства существования in vivo внутримолекулярных G-quadruplex в соматических микроядрах ресничатых протозоа Stylonichia lemnae (Paeschke et al., 2005; Schaffitzel et al., 2001). Синтетически сконструированные G-quadruplex-специфические антитела были использованы для детекции этой структуры в экспериментах с иммунофлюоресценцией. Позитивное окрашивание не обнаруживается, когда S. lemnae telomere-binding proteins (αTBP и βTBP) были истощены, с использованием RNA interference, указывая тем самым, что эти белки необходимы для образования G-quadruplex in vivo. Более того, зависимое от клеточный цикл cyclin-dependent kinase 2 (Cdk2)-обусловленного фосфорилировани C-терминальной порции βTBP необходимо для распаковывания G-quadruplex из-за ингибирования этого фосфорилирования in vivo, приводящего к позитивному окрашиванию на G-quadruplex ДНК на репликационном диске макроядер S. lemnae, регионе, который ранее был лишён сигналов G-quadruplex signals. Это указывает на то, что ДНК G-quadruplex д. быть разрешена во время репликации теломеры и что это событие демонтажа обеспечивается с помощью βTBP фосфорилирования (Paeschke et al, 2005).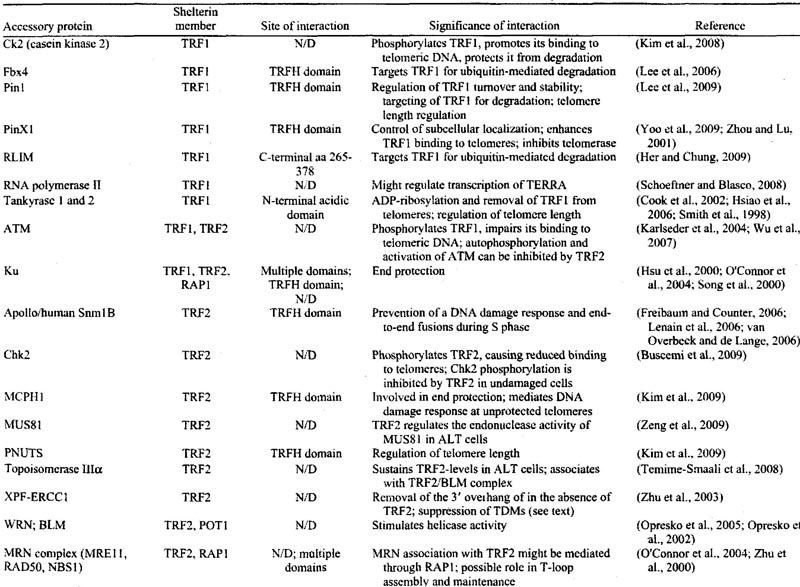
 ) and homologous-recombination-driven (B) synthesis of telomeric DNA. (Al) DNA synthesis is initiated with the alignment of the 3' telomeric G-overhang (in blue) with the RNA template (in red). (AH) Telomerase catalyzes nucleotide addition to the overhang until the 5' end of the template is reached. (АШ) The enzyme translocates and realigns with the newly sunthesised 3' end of the overhang ( primer). (ATV) A second round of nucleotide addition ensues. (B) Both inter- and intratelomeric recombination events have been hypothesised to foster telomere maintenance in ALT. In both types of recombination, the 3' overhang of the telomere initiates invasion and uses its host DNA as a template for DNA copying. (BI) Intermolecular recombination might involve telomeres from two adjacent chromosomes or chromatids. Alternatively, telomere alignment and invasion into circular or linear (not shown) ECTR could also promote DNA synthesis. (ВII) The telomere could also use itself as a template and synthesize DNA via rolling circle replication.
Поддержание теломер в отсутствие теломеразы базируется на механизмах, которые используют меж- и внутрителомерную рекомбинацию, обозначаемую общим термином ALT (Box 1, Fig. 3B).
) and homologous-recombination-driven (B) synthesis of telomeric DNA. (Al) DNA synthesis is initiated with the alignment of the 3' telomeric G-overhang (in blue) with the RNA template (in red). (AH) Telomerase catalyzes nucleotide addition to the overhang until the 5' end of the template is reached. (АШ) The enzyme translocates and realigns with the newly sunthesised 3' end of the overhang ( primer). (ATV) A second round of nucleotide addition ensues. (B) Both inter- and intratelomeric recombination events have been hypothesised to foster telomere maintenance in ALT. In both types of recombination, the 3' overhang of the telomere initiates invasion and uses its host DNA as a template for DNA copying. (BI) Intermolecular recombination might involve telomeres from two adjacent chromosomes or chromatids. Alternatively, telomere alignment and invasion into circular or linear (not shown) ECTR could also promote DNA synthesis. (ВII) The telomere could also use itself as a template and synthesize DNA via rolling circle replication.
Поддержание теломер в отсутствие теломеразы базируется на механизмах, которые используют меж- и внутрителомерную рекомбинацию, обозначаемую общим термином ALT (Box 1, Fig. 3B).  Fig. 4, Telomere replication and processing in cells that utilize the telomerase (A) and ALT (B) pathways of telomere maintenance. (A) Telomeric replication is initiated at subtelomeric origins. The T-loop structure at the chromosome end must be resolved for successful replication; the factors responsible for T-loop disassembly, if required, are unknown. The product of lagging-strand synthesis bears a short G-rich overhang, whereas that of leading-strand synthesis is blunt-ended and thus needs to be processed to yield the correct substrate for telomerase. It is unclear whether further processing also needs to occur at the lagging-strand synthesis product. Telomerase elongates the newly formed overhangs and conventional DNA polymerases till in the opposite strand. At this point, fully replicated telomeres are envisaged to provoke DNA damage, which is thought to be the trigger for end processing and T-loop assembly to reinstate a protected telomere end. (B) Post-replication telomeres at sister chromatids are of equivalent length. In cells that use the ALT pathway, asymmetric alignment could promote unbalanced telomere elongation of one telomere at the expense of the other, resulting in very long and short telomeres. Such alignments could also initiate uneven t-SC'E events (not shown) in the absence of DNA synthesis. All replicated telomeres of sufficient length can then take up the T-loop structure, whereby further self-templated telomere synthesis could ensue via rolling circle replication. Alternatively. T-loops could be inappropriately resolved, resulting in release of free telomere circles and severely shortened telomeres with high recombinogenic potential.
Fig. 4, Telomere replication and processing in cells that utilize the telomerase (A) and ALT (B) pathways of telomere maintenance. (A) Telomeric replication is initiated at subtelomeric origins. The T-loop structure at the chromosome end must be resolved for successful replication; the factors responsible for T-loop disassembly, if required, are unknown. The product of lagging-strand synthesis bears a short G-rich overhang, whereas that of leading-strand synthesis is blunt-ended and thus needs to be processed to yield the correct substrate for telomerase. It is unclear whether further processing also needs to occur at the lagging-strand synthesis product. Telomerase elongates the newly formed overhangs and conventional DNA polymerases till in the opposite strand. At this point, fully replicated telomeres are envisaged to provoke DNA damage, which is thought to be the trigger for end processing and T-loop assembly to reinstate a protected telomere end. (B) Post-replication telomeres at sister chromatids are of equivalent length. In cells that use the ALT pathway, asymmetric alignment could promote unbalanced telomere elongation of one telomere at the expense of the other, resulting in very long and short telomeres. Such alignments could also initiate uneven t-SC'E events (not shown) in the absence of DNA synthesis. All replicated telomeres of sufficient length can then take up the T-loop structure, whereby further self-templated telomere synthesis could ensue via rolling circle replication. Alternatively. T-loops could be inappropriately resolved, resulting in release of free telomere circles and severely shortened telomeres with high recombinogenic potential.