До и после оплодотворения цитогенетический анализ гигантских ооцитов выявляет два возможных пути оплодотворения. После созревания ооцита два гаплоидных набора хромосом могут объединяться во время образования мейотического веретена, давая в результате одиночный диплоидный набор хромосом и диплоидное первое полярное тельце; оплодотворение одиночным спермием д. приводить к образованию гаплоидного мужского и диплоидного женского пронуклеусов. Морфологически эти собственно 2PN эмбрионы по хромосомному содержанию являются триплоидными. Второй сценарий возникает, если двуядерное состояние сохраняется в результате выталкивания двух гаплоидных первых полярных телец и двух материнских гаплоидных наборов в ооцит. Моноспермное оплодотворение в этом случае д. приводить к образованию трех гаплоидных пронуклеусов (Veeck, 1999). Такие генетически аномальные эмбрионы может быть идентифицированы при контроле оплодотворения и не используются для переноса в матку.
Женский репродуктивный тракт является первой защитой против оплодотворения двумя спермиями. Хотя 200-300 миллионов спермиев выбрасываются во влагалище во время спаривания, лишь несколько сотен в конечном итоге достигает яйцеводов. В случае обычного IVF, ооциты подвергаются действию значительно более высоких концентраций спермиев, что ведет к более высокой доле триплоидии по сравнению с состоянием in vivo (Ducibella, 1996). Однако врожденные oocyte механизмы помогают минимизировать оплодотворение двумя спермиями.
Наиболее важной линией защиты против триплоидии является zona pellucida (ZP). Прозрачная зона состоит из трех гликопротеинов (ZP1, ZP2 и ZP3), которые взаимодействуют посредством нековалентрных связей, чтобы создать решетчатую конструкцию внеклеточной мембраны (Wasserman, 1988). ZP2 и ZP3, как полагают являются структурной основой мембраны, тогда как ZP1 взаимосвязывает два белка. Нулевые мыши, дефицитные по ZP2 или ZP3, стерильны из-за полного отсутствия у них zona pellucida, тогда как дефицитные по ZP1 имеют рыхло организованную мембрану ZP и обнаруживают пониженную плодовитость (Wasserman, 2004). Непосредственно после соединения спермия с ZP3 белковым рецептором, увеличивается внутриклеточный кальций посредством 1P3/DAQ пути, который ведет к высвобождению кортикальных гранул (Kline et al., 1994). Точный механизм активации ооцита до конца неясен. Имеются некоторые доказательства на модельных мышах, которые подтверждают увеличение цитоплазматического кальция как следствие высвобождения "sperm factor" после слияния спермия с яйцом (Dale et al., 1985: Stice et al., 1990; Swann et al., 1990). Др. полагают, что этот феномен происходит благодаря sperm-receptor coupled G-protein receptor пути (Kline et al., 1988; Miyazaki et al., 2006; Williams et al., 1992), В конечном итоге высвобождение кортикальных гранул ведет к реакции прозрачной зоны или к уплотнению внеклеточного слоя. Эта реакция зоны предупреждает от проникновения дополнительных спермиев в прозрачную зону и тем самым от полиспермии.
The human centrosome and the fate of digynic and dispermic embryos
Объяснение, почему некоторые триплоидные эмбрионы не способны развиваться после стадии пронуклеуса, тогда как др. выживают до рождения, лежит в механизмах нормальных клеточных делений и расхождения хромосом. Когда клетки готовятся к делениям, то несколько ступеней приводят к равному разделению геномного материала между двумя дочерними клетками. Во время профазы реплицированные хромосомы конденсируются; в метафазе они выстраиваются в экваториальную пластинку, а в анафазе, по одному полному набору хромосом мигрирует к полюсам веретена. Митотическое веретено является ключевым фактором в этом процессе, веретено состоит из микротрубочек, которые испускаются центросомами.
Центросомы первоначально были описаны независимо Boveri и van Beneden в 1887. Каждая центросома состоит из двух центриолей, каждая продуцирует 9 палочек из микротрубочек и окружена околоцентриолярным материалом (Palermo et al., I997"). Центросомы служат центром кристаллизации микротрубочек и делая это они также помогают организовывать элементы цитоскелета. Правильное митотическое деление клетки нуждается в двух центриолях, чтобы раздвоиться и кристаллизовать вторую центриолю под прямым углом к исходной матричной центриоле (Boveri 1887"). Каждая вновь сформированная пара мигрирует к противоположным полюсам и клеточное деление затем проходит метафазу, анафазу и телофазу. Если центриоля неспособна удваиваться, то не формируется биполярное митотическое веретено и заканчивается данная клеточная линия.
Во время слияния гамет женская центриоля неактивна (Santhananthan et al., 1996), поэтому мужская центриоля ответственна за инициальное эмбриональное клеточное деление (Santhananthan et al., 1998). Мужская центриоля реплицируется, чтобы сформировать биполярное микротубулярное веретено, необходимое для точного геномного разделения в раннем развитии эуплоидных клеток. Необходимость в отцовском наследовании является ключом, почему партеногенетической активации ооцита обычно не происходит при нормальных клеточных делениях, из-за отсутствия функциональных центросом. Eсли очищенные отцовские хромосомы инъецируются в активированное яйцо, то яйцо может делиться (Glover &t al.. 1093: Ralermo et al., 1997).
Функциональное значение отцовских хромосом объясняет, почему судьба digynic эмбрионов отличается от dispermic эмбрионов. Потому что материнская центросома неактивна, поэтому digynic триплоидные эмбрионы имеют нормальное количество происходящих из спермия биполярных центриолей от одиночного спермия. Поэтому показатель хромосомного мозаицизма в развитии ранних эмбрионов, происходящих из digynic триплоидов низок (Palermo et al., 1997). C lh/ стороны, dispermic триплоиды содержат две пары активных центриолей на одно яйцо. В 50% случаев конечным продуктом является триполярное веретено, вызывающее дезорганизованное распределение хромосом внутри каждого бластомера, приводящее к большой анеуплоидии (Golubovsky, 2003) (Fig. 3). Это различие может объяснить, почему in vivo digynic триплоиды живут дольше, чем dispermic эмбрионы (Masegawa et al., 1999) , а также почему dispermic эмбрионы непропорционально ведут к образованию неэмбриональных пузырных заносов (Daniel et al., 2001).
Изучение хромосомной конституции триплоидных эмбрионов, образуемых при обычных IVF и IVF/ICSI, помогает пролить свет как на происхождение добавочного пронуклеуса, так и на его митотическую компетенцию. Т.к. ICSI участвует во внесении одиночного спермия в ооцит, то это препятствует оплодотворению двумя спермиями, поэтому возникающие триплоидные эмбрионы д. быть в подавляющем большинстве digynic как результат неспособности выталкивания вторичного полярного тельца. Обычные IVF д. продуцировать высокую пропорцию dispermic триплоидных эмбрионов с распределением, которое и воспроизводит in vivo долю триплоидных концептусов - хотя естественное возникновение digynic всё ещё возможно (McFadden et al. , 2000).
FISH анализ триплоидных эмбрионов в отношении половых хромосом и хромосомы 18 подтверждает эту теорию. Каждый из бластомеров от эмбрионов, развивающихся из tripronuclear ооцитов, получаемых в результате ICSI, был проанализирован и 100% были или XXX181818 или XXY181818 при этом отсутствовали XYY181818 (указывающие на диспермию). Из них только 16% были триплоидными мозаиками - мозаицизм обнаруживался, по крайней мере, в одном полностью триплоидном бластомере - подтверждая доказательства, что одной активной отцовской центромеры достаточно для регулярного первого митотического клеточного деления. У триплоидных эмбрионов, возникающих в результате обычного IVF, наблюдалось высокое преобладание dispermic триплоидов (XYY181818) (Staessen et al., 1997). Более чем 60% этих эмбрионов были мозаичными или сложными мозаиками, обнаруживающими хаотическое распределение хромосом, инициируемое в первом клеточном делении из-за присутствия двух активных отцовских центросом. Удвоение каждой из центросом дает образование 4-х активных центросом скорее, чем обычных двух, тем самым не позволяется 69 хромосомам сформировать метафазную пластинку для равного распределения по дочерним клеткам. Однако необходимо отметить, что некоторые триплоидные эмбрионы от ICSI или IVF могут спорадически демонстрировать триплоидные клетки, указывающие на регулярное расхождение хромосом. Хотя это происходит более часто у эмбрионов, оплодотворенных с помощью ICSI по сравнению с обычным оплодотворением.
Enucleation procedures
Показатель триплоидии при обычном IVF составляет в среднем 4% на цикл и, по крайней мере, одна триплоидная prezygote обнаруживается в 60% от всех IVF циклов (Escriba etal,, 2006). Поэтому потенциальное использование терапевтической энуклеации триплоидных оплодотворенных ооцитов для получения диплоидных зигот, вполне допустимо. Это может сказаться в 5-20% увеличении числа эмбрионов, пригодных для переноса или криоконсервации. Однако надежность коррекции триплоидных эмбрионов в гетерородительских диплоидов зависит от нескольких факторов, от аккуратной идентификации добавочного пронуклеуса до технических аспектов самой процедуры энуклеации.
Первая описанная попытка микрохирургической энуклеации из трехядерных зигот человека осуществлена Rawlins et al. в 1988. они описали предварительную обработку трех dispermic зигот с помощью cytochalasin B - агента расслабляющего цитоскелет - и удаление одного из мужских пронуклеусов, идентифицируемых по более крупным размерам и ассоциированным кусочками хвоста спермиев. В этом сообщении один эмбрион осуществлял сингамию, но дробления не произошло (Rawlins ef at., 1988). С тех пор появились ещё три сообщения о процедурах микрохирургической энуклеации, дающих эмбрионы стадии дробления у человека (Gordon et at., 1989; Malter et al, 1989; Palermo et al, 1994), и одно сообщение о 46XY живорожденном после этой процедуры (Kattera et al., 2003).
Инициальное исследование Rawlins' сравнивало исходы процедуры энуклеации с и без реляксации цитоскелета с помощью cytochalasin. На сегодня 100% эмбрионов выживают с расслабляющим агентоа и не выживают без cytochalasin (Gordon et ai, 1989). Позднее в том же году др. группа сообщила о 36% выживания после процедуры энуклеации с использованием просверливания зоны ооцита бел использования расслабляющих агентов (Malter etal., 1989). Несмотря на увеличение доли выживших cytochalasin потенциально может вызывать увеличение фрагментации, задержку дробления и нестабильность митотического веретена из-за нарушений организации цитоскелета ооцита (Hoppe et ai, 1977; Pickering et ai, 1988). Необходимо попытаться использовать для энуклеации трехядерных эмбрионов, используя технику биопсии, сходную с используемой для preimplantation genetic diagnosis (PGD) вместо использования cytochalasin (Fig. 4).
Хотя потенциал для терапевтической энуклеации обнадеживает, следует учитывать практические недостатки. Во-первых, выбр добавочного пронуклеуса базируется на трех неточных критериях: детекция ассоциированного с пронуклеусом хвоста спермия, обычно более крупный размер мужского пронуклеуса и более значительное расстояние пронуклеуса от второго полярного тельца по сравнению с женским пронуклеусом. Эти критерии субъективны и содержат присущую долю ошибки. Подтверждением того, что удален правильный пронуклеус д. быть PGD с fluorescent in situ hybridization (FISH). Для этого необходима ещё одна биопсия аномально оплодотворенного эмбриона. Каждая дополнительная биопсия бластомеров снижает потенциал имплантации эмбриона. Напротив, проведение PGD и проведение непосредственного переноса эмбриона граничит с риском переноса diandric эмбриона, приводящего к пузырному заносу и потенциальному озлокачествлению. Некорректное удаление мужского пронуклеуса из digynic зиготы после ICSI не будет давать жизнеспособных эмбрионов из-за отсутствия функциональных центросом и униформности материнского генетического материала.
Clinical observations of triploidy
Лежащая в основе триплоидии этиология вследствие обычного IVF или ICSI была неуловимой в лучшем случае. Опубликованные сообщения указывали на роль супрафизиологических уровней эстрогена вследствие стимуляции яичников, продолжительности периода стимуляции, качества ооцитов, источника спермиев и продвинутого материнского возраста (Spandorfer et ai, 1998, Mercan et al, 1998; Oehninger et al., 1995). Т.к. предыдущие исследования были противоречивы, мы осуществили обзор нашего собственного опыта за трехлетний период, чтобы пролить свет на показатель и возможные этиологические факторы, отвечающие за возникновение триплоидных эмбрионов.
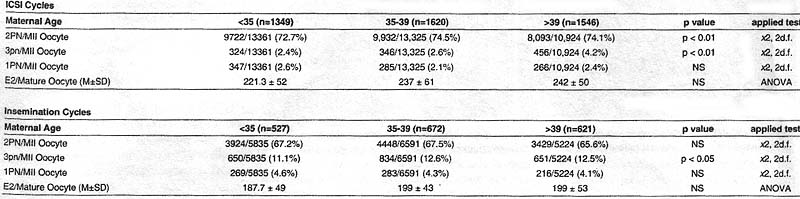
Все циклы IVF с января 2004 по январь 2007 суммированы и проанализированы. В течение этого периода было всего 6,335 IVF циклов в нашем центре, из которых 4,515 нуждались в ICSI , а остальные 1,820 получали обычный циклы оплодотворения. Наши данные подтверждают, что ICSI ассоциирует с достоверным общим снижением доли триплоидии во всех возрастных группах по сравнению с циклами оплодотворения (2.9% vs. 12.0% соотв., pменее 0.01). Это подтверждает мнение, что наиболее распространенным механизмом естественно возникающей триплоидии является оплодотворение двумя спермиями гаплоидного ооцита, процесс который преодолевается в основном с помощью ICSI.
Результаты были проанализированы в материнских возрастных группах: <35, 35-39 и >39 лет. Показатель образования 3PN был достоверно выше в возрастной группе матерей более 39 независимо от метода оплодотворения, хотя 4.17% от всех зрелых ооцитов после ICSI и 12.46% от всех зрелых ооцитов после обычного IVF были триплоидными (Table 1). Это ведет к предположению, что функция ооцитов снижается с возрастом матери и является критической для нормального оплодотворения.
Пластичность мембраны ооцита во время инъекции одиночного сперматозоида оказывает влияние на жизнеспособность ооцита и паттерны оплодотворения. Внезапный разрыв oolema в отсутствие обычно наблюдаемого узкого прохода в оолеме после проникновения инъекционной иглы ассоциирует с высоким показателем digynic эмбрионов в одной и той же кагорте. Этот феномен часто предвещает снижение доли выживших у нормально оплодотворенных эмбрионов одного и того же цикла (Palermo etal., 1996).
Это не только подразумевает. что качество ооцита исключительно зависит от материнского возраста. Метод стимуляции также может влиять ка качество ооцита и влиять на успех оплодотворения. Более высокие уровни estradiol (E2) во время IVF цикла, возникающие в результате агрессивных доз экзогенных гонадотропинов, или из-за продолжительной стимуляции оварий могут ухудшать мембрану oolemma (Gelety et al.; Sachs et al., 2000). Дальнейшие доказательства эффекта более высоких уровней E2 на качества ооцитов получены в IVF циклах, когда применялся "coasting'. Coasting это техника, использующая снижение риска синдрома гиперстимуляции оварий. Она используется для спасения IVF циклов, когда обнаруживается неожиданная сильная реакция на стимуляцию оварий; отказ от экзогенных gonadotropins из-за продолжающегося действия агониста GnRH. Ооциты из гиперстимулированных циклов обнаруживают повышенную долю образования 3PN и 1PN и морфологически оказываются не соответствующими стандарту по сравнению с контролем того же возраста матерей (Kang et al, 2006). Доля беременностей от этих циклов в основном не изменялась, однако из-за преобладания более молодых, лучше прогнозируемых пациентов, которые имели риск избыточной реакции (Kang ef al., 2006). Более молодые пациентки более склонны иметь, по крайней мере, немногие оставшиеся 2PN оплодотворенные эмбрионы, которые нормальны по хромосомам. Если циклы нуждались в "coasting" , то они анализировались отдельно, наши результаты согласуются с мнением, что высокая доля возникновения триплоидии наблюдается во всех возрастных группах (Data not shown).
Источник спермиев ещё один фактор, который может влиять на аномальный паттерн оплодотворения. Как отмечалось ранее мужчины с аномальными параметрами спермиев более склонны давать диплоидные спермии, проникающие в гаплоидный ооцит. Мужской фактор бесплодия нуждается в использовании тестикулярных или эпидидимальных спермиев, этом может быть причинным фактором некоторого снижения выхода 2PN в возрастной группе более 35 (72.7% vs. 74.5%, менее 0.01), хотя при этом не было отмечено повышения доли 3PN эмбрионов.
Methods to improve normal fertilization
Понимание того, как создается предпочтительная гормональная среда для оплодотворения, д. предотвращать потребность в процедуре энуклеации после IVF циклов. Согласно нашим coasting данным, ооциты, подвергшиеся высоким уровням эстрогена, обнаруживают повышенную тенденцию давать триплоидных эмбрионов после оплодотворения. Хотя мы не можем изменить влияние возраста на качество ооцитов наш опыт указывает на то, что целостность мембраны ооцита является наилучшей при уменьшении как величины, так и продолжительности стимуляции гонадотропинами. Одним из эффективных методов уменьшения уровня эстрогена при IVF цикле является ступенчатый подход, при котором дозы экзогенного гонадотропина постепенно снижаются, когда достигается рекрутирование фолликулов (Davis et at., 1996). В целом тщательное рассмотрение и отслеживание протокола стимуляции во время IVF может позитивно влиять на качество ооцитов.
Conclusion
Assisted reproductive technology has improved our understanding of human fertilization patterns. There is an exquisitely delicate balance that needs to be maintained between heteroparental chromosomes in order for an embryo to gain mitotic competence. With respect to incidence, In vitro rates of triploid embryo formation may not mimic in vivo rates as the
TABLE 1
NORMAL, 3PN, AND 1PN FORMATION IN ICSI AND INSEMINATION CYCLES BY MATERNAL AGE GROUP
conditions for fertilization in each are quite different. For example, in the instance of conventional IVF there are thousands of additional sperm exposed to each oocyte compared to the natural environment within the fallopian tube. With ICSI, there is only one spermatozoon directly introduced into the oocyte. In reality, hi vivo rates of triploidy most likely fall somewhere between these two scenarios - more than 2.4% but less frequent than 12.6% of all fertilized oocytes. It should additionally be stressed that in both cases the treated population is comprised of infertile couples who may harbor biologic or genetic polymorphisms which may predispose to abnormal fertilization patterns.
Overwhelmingly, most triploid embryos will not achieve viability as they cannot overcome developmental checkpoints. One cannot discount the possibility of a teleologic mechanism behind triploid fertilization as a way to prevent chromosomally incompetent oocytes from progressing to the point of implantation. As triploid fertilization is only one of the many events that can go awry in an early conceptus, the creation and development of a chromosomally competent embryo and its faithful mitotic replication into a human fetus is indeed an impressive feat of nature.
Сайт создан в системе
uCoz