Критическая роль плацентарного кровоснабжения у человека подтверждается наблюдениями, что ограничение внутриматочного роста на третьем триместре беременности характеризуется или нарушениями в маточного (материнской части плаценты) или пупочного (плодной части плаценты) кровотока, ведущих к снижению потребления плодом питательных веществ, к фетальной гипоксии, гипогликемии и асимметричному росту органов (Pardi et al., 1993; Marconi et al., 1996; Ferrazi et al., 2000; Konje et al., 2003). Кроме того, повышенная резистентность сосудов матки и пониженный кровоток в матке во время ранней беременности могут быть использованы как показатели беременности высокого риска невынашивания, т.к. ассоциированы с задержкой роста плода (Trudinger et al., 1985; North et al., 1994).
Жвачные животные в качестве модели довольно уникальны тем, что макроскопически их плацента представлена 60-100 дискретными структурами или единицами, известными как placentomes (Ramsey, 1982; Mossman, 1987). Каждая из таких плацентом состоит из материнской caruncular и плодной cotyledonary частей, которые взаимно проникают (переплетаются) и тем самым создают тесное соседство, облегчая тем самым трансплацентарный обмен питательными веществами, респираторными газами и отходами (Fig. 2; Ramsey, 1982). У млекопитающих с эпителиохориальной placentation (кроты, ламантины, киты, лошади, свиньи, крупный рогатый скот, овцы и немногие предобезьяны), chorioallantois ('дефинитивная' плацента eutherian млекопитающих) минимально инвазивен и поэтому эпителий матки остается интактным во время беременности (Ramsey, 1982; Mossman, 1987; Wooding and Flint, 1994). Из-за этого плацента жвачных является идеальной моделью для изучения плацентарного развития поскольку материнская и плодная части плаценты остаются тесно ассоциированы, но интактны и поэтому можно оценить каждую ткань отдельно (Ramsey, 1982; Reynolds & Redmer, 1995; Reynolds et al., 2005 a,b). Хотя эпителиохориальная плацента жвачных и копытных совершенно отлична анатомически от hemochorial плаценты большинства млекопитающих, функционально они, по-видимому, оперируют совершенно одинаково.
Further evidence for the importance of placental angiogenesis and blood flow
Как мы показали в нашем обзоре 1995, базируясь на принципе Fick, транспортная способность плаценты, также наз. плацентарное потребление может быть подсчитано как:
Потребление = кровотоку x [A - V], где [A - V] представляет артерио-венозные различия в концентрации (represented as [v - a] for the umbilical vein minus umbilical arterial, or fetal, uptake; Reynolds and Redmer, 1995). Т.о., трансплацентраный обмен д. увеличиваться при увеличении скорости экстракции (различия в A-V концентрации) или при увеличении скорости кровотока или обоих.
Исходя из многочисленных исследований, очевидно, что увеличенный кровоток является критическим для увеличения трансплацентарного обмена в ходе беременности (Meschia, 1983; Reynolds et al., 1986, 2006; Metcalfe et al., 1988; Reynolds and Redmer, 1995). Напр., у крупного рогатого скота от середины до поздней ст. беременности извлечение кислорода беременной маткой возрастает лишь 0.4-раза, тогда как маточный кровток возрастает приблизительно в 4.5-раз (Reynolds et al., 1986). Т.о., увеличенный маточный кровток объясняет почти 5- 6-кратное увеличение
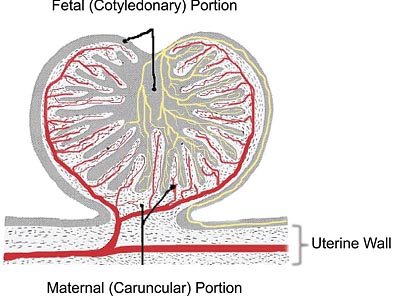 Fig. 2. Schematic representation of the sheep placentome. Taken from Reynolds et al., 2005b.
Fig. 2. Schematic representation of the sheep placentome. Taken from Reynolds et al., 2005b.
общего потребления кислорода беременной маткой. 16-кратное увеличение потребление кислорода плодом коровы может быть объяснено, прежде всего, увеличением скорости кровотока через пупочный канатик (Reynolds et al., 1986). Сходным образом у овец, извлечение кислрода маткой увеличивается приблизительно в 0.4-раза от средней до поздней ст. беременности, тогда как маточный кровоток увеличивается приблизительно в 3-раза (Meschia, 1983). Более того, основное увеличение потребление беременной маткой и плодом глюкозы, лактата и аминокислотного азота с середины до поздней ст. беременности у крупного рогатого скота, по-видимому, зависит прежде всего от значительного увеличения кровотока в матке и пупочном канатике, поскольку различия в A-V концентрациях для питательных веществ остаются относительно постоянными (Reynolds et al., 1986; Reynolds and Redmer, 1995).
Т.о., адекватный кровоток в плаценте является критическим для нормального роста плода. Это, однако, не уменьшает важности сопутствующего увеличения обилия специфических транспортеров и увеличения градиента концентрации от матери к плоду, также, по-видимому, важных компонентов для увеличения трансплацентарного обмена, по крайней мере, для тех субстанций, диффузия которых ограничена (или зависит от транспортеров), такие как глюкоза и аминокислоты (Bell et al., 1999). Тем не менее, потребление беременной маткой и пупочным канатиком глюкозы, которое обеспечивает до 60% метаболических нужд плода (Reynolds et al., 1986; Bell et al., 1999), снижено примерно пропорционально снижению массы и кровотока плаценты при беременности, поставленной под угрозу пищевым или средовым тепловым шоком (Reynolds et al., 1985, 2006).
Базируясь на концепции, что хроническое увеличение кровотока в любой растущей ткани зависит от роста сосудов или ангиогенеза, Meschia (1983) утверждал "the large increase of blood flow to the uterus during pregnancy … results primarily from the formation and growth of the placental vascular bed." Многочисленные исследования затем подтвердили, что ангиогенез в самом деле является основным компонентом увеличения кровотока плаценты в ходе беременности, а становление функционального плодного и плацентарного сосудистого ложа является одним из самых ранних событий во время эмбрионального/плацентарного развития (Reynolds and Redmer, 1992, 1995; Magness, 1998; Charnock-Jones et al., 2004; Kaufmann et al., 2004; Mayhew et al., 2004; Reynolds et al., 2005a,b; Borowicz et al. , 2007). Фактически, происходит непрерывное увеличение кровотока в беременной метке и канатике в зависимости от развития плацентарного сосудистого ложа, но и рост самой плаценты зависит от плацентарного ангиогенеза, поскольку рост ткани любого размера не возможен без сосудистого роста (Bassingthwaighte and Goresky, 1984; Hudlicka, 1984). Эта зависимость от сосудистого развития возникает в результате высоких метаболических потребностей, связанных с тканевым ростом и ограниченной способности респираторных газов, питательных веществ и отходов диффундировать через внеклеточный компартмент (Bassingthwaighte and Goresky, 1984; Adair et al., 1990). Т.о., рост и развитие сосудистого ложа являются критическими компонентами тканевого роста и функции, включая то, что в у uteroplacenta, как упоминалось, важность сосудистого развития для функции плаценты уже давно замечена. Однако проведено лишь немного количественных исследований плацентарного ангиогенеза (Kaufmann et al., 2004; Mayhew et al., 2004; Reynolds et al., 2005b).
Оценка плацентарного ангиогенеза использует две методологии: (1) классические гистологические методы, сопровождаемые стереологическим анализом (в последнее время используется конфокальная микроскопия и компьютеризированный анализ картин) микроциркуляции и иногда с фиксацией перфузии (Borowicz et al., 2007; Vonnahme et al. , 2007); и (2) процедуры сосудистого слепка (casting) с использованием перфузии с casting средой, такой как Batson's No. 17, сопровождаемые перевариванием ткани и оценкой с помощью сканирующей электронной микроскопии оставшегося микрососудистого слепка (Hafez et al., 2007).
Чтобы оценить uteroplacental ангиогенез во время ранней беременности мы использовали простые классические гистологические методы с иммерсионной фиксацией, сопровождаемой пропитыванием парафином и срезами фиксированных тканей. Эти методологии были описаны в деталях Reynolds and Redmer (1992). Хотя мы использовали некоторые более специфические методы для идентификации микрососудов в др. тканях, такие как иммуногистохимия по Factor VIII, alpha-actin гладкомышечных клеток, или гистохимию с использованием специфических лектинов (JablonkaShariff et al., 1993; Redmer et al., 2001), не работают столь же хорошо в плодной плаценте. Поэтому мы использовали прежде всего периодический acid-Schiff'sреагент, который является наиболее распространенным методом окраски базальных мембран, чтобы идентифицировать плацентарную микроциркуляцию (Hudlicka, 1984; Reynolds and Redmer, 1988; Reynolds and Redmer, 1992; Borowicz et al., 2007).
В противоположность этому во время ранней беременности микрососудистые ложа uteroplacenta во время поздней беременности очень сильно взаимопроникают и микрососуды, особенно те что в cotyledons плода или ворсинках становится очень трудно идентифицировать, поскольку микрокапилляры обоих кажутся настолько незрелыми, что они они не готовы окрашиваться с использованием классических маркеров микрососудов (Factor VIII, lectins, и т.д.) , а также поскольку они легко спадаются, возможно, из-за высокого содержания воды в плацентарной ткани. Т.о., чтобы решить эти проблемы, мы разработали технику перфузионной фиксации, подобную описанной ранее (Jablonka-Shariff et al., 1996). Эти методы
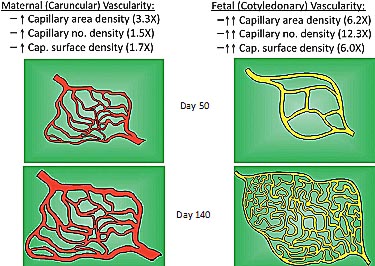 Fig. 5. Model of angiogenesis in the sheep placenta throughout the last two-thirds of gestation (taken from Borowicz et al., 2007).
Fig. 5. Model of angiogenesis in the sheep placenta throughout the last two-thirds of gestation (taken from Borowicz et al., 2007).
описаны в деталях Borowicz et al. (2007) и Vonnahme et al. (2007). Используя эти методы, мы показали, что общий объем капилляров материнской плаценты у овец увеличивается драматически после 18-го дня беременности одновременно с драматическим ростом капилляров (Fig. 3). Этот рост микрососудистого ложа плаценты, включая как материнские, так и плодные ткани, продолжается в течение всей беременности (Fig. 4). Эти количественные гистологические методы также позволили разработать модель развития микрососудов плаценты (Fig. 5). В это caruncular (maternal placental) капиллярные ложа растут прежде всего за счет увеличения размеров капилляров (область на капилляр), с лишь незначительным увеличением количества капилляров или поверхностной плотности, приводящих к среднему 3-кратному увеличению плотности области капилляров. Напротив cotyledonary (fetal villous) капиллярные ложа растут прежде всего за счет ветвления, приводя к значительному 12-кратному увеличению плотности количества капилляров, что сопровождается снижением размеров капилляров. Относительно большое, 6-кратное увеличение области капилляров и поверхностной плотности плодных ворсинок (Fig. 5) может быть объяснено за счет роста в виде паттерна ветвления.
Наша эмпирическая модель ангиогенеза в caruncles и cotyledons подтвержена исследованиями физиологических и анатомических ограничений морфологии сосудистого ложа (Reynolds et al., 2005c). Напр., согласно "Murray's Правилу," даметр (D) родительских сосудов равен сумме кубических корней из диаметров их веточек; т.e., (D
parent)
1/3= (D
branch1 )
1/3 + …(D
branch2 )
1/3+ (D
branchn )
1/3 (Murray, 1926; Hutchins et al., 1976; West et al., 1997). Предполагая 2-кратное ветвление (т.e., две веточки на родительский сосуд или систему бифуркаций) и используя Murray's правило, мы
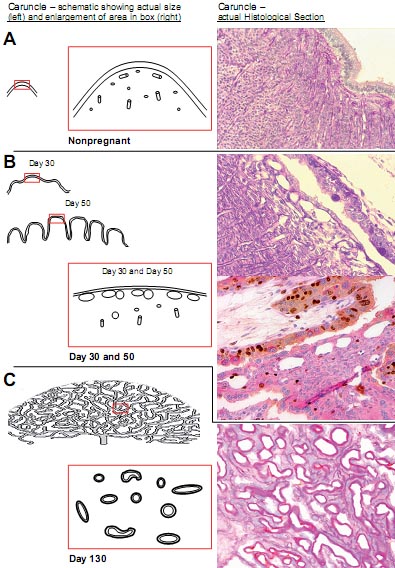 Fig. 6. Developmental changes in the microvascular architecture of the maternal placenta (caruncle) throughout gestation in sheep. (A) Nonpregnant, (B) Day 30 and 50 of gestation, and (C) Day 130 of gestation (length of pregnancy approximately 145 days; taken from Reynolds et al., 2005c).
Fig. 6. Developmental changes in the microvascular architecture of the maternal placenta (caruncle) throughout gestation in sheep. (A) Nonpregnant, (B) Day 30 and 50 of gestation, and (C) Day 130 of gestation (length of pregnancy approximately 145 days; taken from Reynolds et al., 2005c).
определили, что число раундов ветвлений капилляров, необходимых, чтобы перейти от самых маленьких caruncular и cotyledonary артериол (mean D = 80 µm) к среднему диаметру caruncular и cotyledonary капилляров на 140 день беременности составляло 10 для материнских caruncles и 15 для плодных cotyledons, что д. составлять в результате 2
5 или в 32-раза больше сосудов в cotyledons по сравнению с caruncles (Reynolds et al., 2005c; Borowicz et al. , 2007; Vonnahme et al., 2007). Т.о., наша эмпирическая модель подтверждает заключение, что капилляры плодной части плаценты значительно более разветвлены, чем капилляры материнской части плаценты.
Эти различия в паттерне роста между капиллярным ложем плодной и материнской части плаценты ассоциируют с дополнительными и драматическими различиями в их микроскопической анатомии и, скорее всего, в их физиологической функции. Как показано на Fig. 6, с очень ранних сроков беременности капилляры материнской части плаценты начинаю формировать 'капиллярное сплетение,' первоначально на поверхности просвета матки, где caruncle контактирует с хорионалантоисом плода (сравнение caruncle в отсутствие беременности с caruncle на 30 и 50 день беременности; Fig. 6). С началом последней трети беременности (приблизительно 90 - 100 день беременности у овец), материнская caruncular ткань состоит прежде всего из этих крупных 'капилляров,' большинство имеет диаметр 20 µm или более (Reynolds et al., 2005c; Borowicz et al., 2007). Напротив диаметр плодных капилляров уменьшается по ходу беременности, приводя в результате к среднему диаметру капилляров в 4.5µm в конце беременности (Reynolds et al., 2005c; Borowicz et al., 2007). Кроме того, наши недавние ЭМ оценки сосудистых слепков подтвердили такие драматические различия в микрососудистой архитектуре между плодной и материнской тканью плаценты (Fig. 7).
Архитектру микрососудов материнского компартмента плаценты характеризуется преобладание очень крупных капилляров, которые диктуют низкую скорость, 'irrigation-flow' или систему типа медленного процеживания, которая используется, прежде всего, как система доставки (и, напротив, удаления отходов) (Reynolds et al. , 2005a,c; Borowicz et al., 2007). Напротив архитектура микрососудов плодной части плаценты, которая сильно разветвлена и состоит преимущественно из большого количества маленьких капилляров, предназначена для высокоскоростного, быстрого транспорта (Reynolds et al., 2005c; Borowicz et al., 2007).
Предполагаемые различия в токе и транспорте между материнским и плодным кровообращение сравнимы с различными функциональными наблюдениями. Напр., ток крови в канатике увеличивается в 2-3-раза по сравнению со скоростью (proportional or percentage increase per day) тока крови в матке во время последних двух третей беременности (Reynolds and Redmer 1995; Reynolds et al., 2005a,b, 2006). Более того, поскольку происходит увеличение ветвления и тем самым увеличение количества капилляров на единицу тканей (Fig. 5), то область поверхности, доступная для обмена больше в cotyledonary ворсинках по сравнению с материнскими caruncles во время последней трети беременности (Reynolds et al., 2005a,b). Кроме того, толщина барьеров между плодными и материнскими капиллярами также уменьшается в ходе беременности (Faber and Thornburg, 1983; Longo 1987). Все эти наблюдения позволяют объяснить, почему при нормальной беременности пропорция потребления питательных веществ и кислорода, что транспортируются беременной маткой в плод возрастает в 2-4-раза с середины до поздних сроков беременности (и наоборот, пропорция, которая используется плацентой, снижается в 2-4-раза), что существенно для поддержания скорости роста плода (Reynolds and Redmer, 1995; Reynolds et al., 2005c).
Т.о., хотя архитектура микрососудов плаценты идеально приспособлена как для доставки питательных веществ с материнской стороны и потребления питательных веществ и их транспорта со стороны плода, такое строение, по-видимому, не уникально для овец. Напр., имеется несколько сходств в функции плаценты между овцами и коровами, которые являются др. плацентомными или cotyledonary млекопитающими (Reynolds and Redmer, 1995; Vonnahme et al., 2007). Капиллярные сплетения, которые формируются материнской частью плаценты также наблюдается на ранней беременности у свиней (Assheton 1906; King et al., 1982), хотя они не были исследованы на поздних сроках беременности. У приматов, включая и человека, хориоалантоис является столь инвазивным, что часть материнского эндометрия эрозируется и плодные ворсинки купаются в материнской крови (Ramsey, 1982); такое устройство обеспечивает предельную низкую скорость, irrigation-flow системы. Интересно отметить, что такой 'hemochorial' тип плаценты (означающий, что хорион или наружный слой хориоалантоиса, купается в материнской крови) широко распространен среди млекопитающих, присутствуя не только у огромного большинства приматов. но также у грызунов, насекомоядных и летучих мышей, которые вместе составляют 95% из более чем 4,000 видов млекопитающих (Ramsey, 1982; Nowak, 1991).
Как суммировано в Table 1, у овец, исследованных в поздней беременности, маточный или канатиковый кровоток или оба снижены в каждой модели беременности, находящейся под угрозой. Эти модели беременности под угрозой включают перекормленные девушки, недокормленные девушки и взрослые, а также тепловой стресс, гипоксический стресс и многоплодие. Эти наблюдения сравнимы с таковыми у женщин со сниженной пропускной способностью (perfusion) плаценты во время беременности с ограниченным ростом плода (Poston, 1997; Moore et al., 2004; Redmer et al., 2004; Huppertz and Peeters, 2005). В этих разных моделях беременности под угрозой невынашивания хотя развитие сосудов плаценты также снижено в некоторых случаях, но повышено в др. (Table 1). Интересно, что в двух моделях, в которых сосудистая сеть плаценты усилена (высокий диетический Se, или гипоксический стресс), это не сказывалось на размерах плода, указывая на адаптивную реакцию плаценты, которая пытается компенсировать доставку питательных веществ плоду. В др. модели с повышенной сосудистой сетью в плаценте (Romanov vs. Columbia genotype), животные были подвергнуты долговременной генетической селекции, что приводило к увеличению размеров выводка. Этот последний случай напоминает тот, что у Meishan и Yorkshire свиней, пи этом Meishans обнаруживают увеличение размера и веса выводка, что связано с увеличением сосудистой сети плаценты и экспрессии VEGF (Biensen et al., 1998; Wilson et al., 1998; Vonnahme and Ford, 2004).
Regulation of placental angiogenesis
Как уже упоминалось, ангиогенез означает образование нового сосудистого ложа и этот процесс является критическими для нормального роста и развития ткани, включая и плаценту (Reynolds and Redmer, 1995, 2001; Reynolds et al., 1992, 2005a,b, 2006). Хотя многочисленные молекулы участвуют в регуляции роста сосудов, недавние наблюдения привели к идентификации основных факторов, регулирующих васкуляризацию плаценты и др. мест (Yancopoulos et al., 2000; Koh et al., 2002; Charnock-Jones et al., 2004; Reynolds et al., 2005a; Borowicz et al., 2007). Эти ангиогенные факторы включают семейства белков vascular endothelial growth factor (VEGF), fibroblast growth factor (FGF) и angiopoietin (ANGPT), а также соотв. их рецепторов
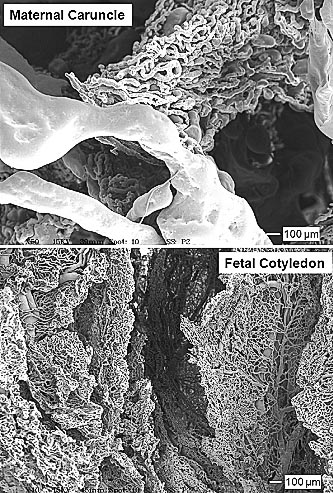 Fig. 7. Scanning electron photomicrographs of placental microvascular casts. Day 130 [0.9] of pregnancy; Hafez, Borowicz, Reynolds and Redmer, unpublished.
Fig. 7. Scanning electron photomicrographs of placental microvascular casts. Day 130 [0.9] of pregnancy; Hafez, Borowicz, Reynolds and Redmer, unpublished.
В терминах регуляции экспрессии uteroplacental ангиогенных факторов, estrogen, по-видимому, является ключевым игроком; у оварийэктомированных крыс или овец эндометриальные мРНК VEGF, FGF, ANGPT1 и ANGPT2 mRNA строго позитивно регулируются в течение нескольких часов после воздействия estrogen с одновременным драматическим усилением васкуляризации матки и кровотока (Culllinan-Bove et al., 1993; Magness, 1998; Reynolds et al., 1998; Johnson et al., 2006), как в случае экспрессии мРНК эндотелиальной nitric oxide synthase (eNOS или NOS3), которая продуцирует оксид азота (NO) и т.о.. является важным регулятором как ангиогенеза , так и расширения кровеносных сосудов (Rosenfeld et al., 1996; Magness, 1998; Vagnoni et al., 1998; Reynolds and Redmer, 2001; Redmer et al., 2005; Borowicz et al. , 2007).
Чтобы оценить взаимоотношения между ангиогенезом в плаценте и экспрессией ангиогенных факторов в плаценте овец, мы определяли экспрессию мРНК набора плацентарных ангиогенных и вазоактивных факторов и измеряли также плацентарный ангиогенез у тех же самых осец на 10-20-дн. интервалами в течение последних двух третей беременности (Borowicz et al., 2007). Чтобы оценить относительный вклад этих разных факторов в развитие сосудов плаценты (т.е., плотности капиллярной области, плотности количества капилляров, плотности капиллярной поверхности и области на капилляр), мы использовали процедуру множественной регрессии, сходную с методом Wright's (1934) 'path coefficient analysis.' Эта процедура позволяет подсчитать коэффициенты стандартной частичной регрессии, это позволяет измерить относительный вклад различных независимых переменных в каждую зависимую переменную. Как показано в Table 2,
TABLE 2
STANDARD PARTIAL REGRESSION COEFFICIENTS
1
ILLUSTRATING THE RELATIONSHIPS OF VARIOUS ANGIOGENIC FACTOR mRNA (INDEPENDENT VARIABLES) WITH MEASURES OF CARUNCULAR (MATERNAL PLACENTAL) VASCULARITY (DEPENDENT VARIABLES) OF SHEEP THROUGHOUT PREGNANCY
2
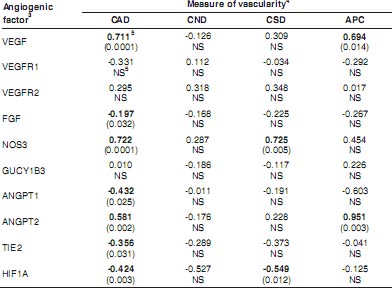
1
This procedure calculates standard partial regression coefficients, also termed β , which provide a measure of the relative contribution of the various independent variables to each dependent variable (Wright, 1934). The data for the regressions were taken from Borowicz et al. (2007); and the overall R2= 0.92, 0.52, 0.80, and 0.76 for CAD, CND, CSD, and APC, respectively.
2Days of pregnancy were days 50, 70, 90, 110, 130, and 140 (n = 5 ewes per day, except for day 90, for which n = 2; Borowicz et al., 2007). Relative expression of angiogenic factor mRNA was by quantitative, real-time PCR, as described by Borowicz et al. (2007).
3VEGF = vascular endothelial growth factor; VEGFR1 = VEGF receptor-1 (FLT1); VEGFR2 = VEGF receptor-2 (KDR); FGF = fibroblast growth factor-2 (basic FGF); NOS3 = endothelial nitric oxide synthase; GUCY1B3 = soluble guanylate cyclase (NO receptor); ANGPT1 = angiopoietin1; ANGPT2 = angiopoietin-2; TIE2 = angiopoietin receptor; and HIF1A = hypoxia-inducible factor1alpha.
4 CAD = capillary area density, CND = capillary number density, CSD = capillary surface density, and APC = area per capillary (Borowicz et al., 2007).
5 Standard partial regression coeffiencent (β ) with P-value in parentheses (significant β are shown in bold).
6 NS = not significant (P > 0.05).
использование этой методологии дает некоторые интригующие результаты. Напр., хотя уровни VEGF, NOS3 и ANGPT2 мРНК обнаруживали строгие позитивные взаимоотношения, мРНК некоторых факторов (напр., FGF, ANGPT1 и TIE2) обнаруживали строгие негативные взаимоотношения в отношении плотности области капилляров материнской (caruncular) части плаценты. Сходным образом для плотности капиллярной поверхности NOS3 мРНК обнаруживала строгое позитивное взаимоотношение (Table 2). Для области на капилляр (размер капилляра), VEGF и ANGPT2 мРНК обнаруживали строгие позитивные взаимоотношения (Table 2). Неожиданно, ни один из оцененных ангиогенных или вазоактивных факторов не обнаруживал позитивного взаимоотношения в отношении любого измерения сосудистой сети в плодной плацентарной (cotyledonary) ткани (Table 3). Необходимы дальнейшие исследования и на большем числе стадий беременности, чтобы полнее понять взаимоотношения между экспрессией ангиогенных факторов и архитектурой плацентарных микрососудов.
'Rescue' of placental angiogenesis and blood flow in compromised pregnancies
Ограничение роста плода и возникающий в результате малый вес при рождении наблюдаются в 7- 8% беременностей у женщин США и это ассоциирует с повышенной перинатальной смертностью и заболеваемостью (NLM, 2002a,b; NVSR, 2004). Из-за важности плацентарного кровообращения и находки, что размер плаценты, uteroplacental кровоток и ангиогенез и экспрессия ангиогенных и вазоактивных факторов снижен или нарушен при угрожающей беременности, было предположено, что терапевтические агенты, которые нацелены на плацентарный кровоток и развитие сосудов д. использоваться для снятия ограничений роста плода (Godfrey, 2002; Ahmad and Ahmed, 2005; Wu et al., 2004; Wareing et al., 2005; Reynolds et al., 2006).
Измененный рост и развитие сосудов плаценты ассоциируют с измененной экспрессией генов основных ангиогенных факторов и их рецепторов (Redmer et al., 2005; Reynolds et al., 2005a,b, 2006; Luther et al., 2007; Vonnahme et al. , 2007, 2008). Кроме того, плацентарные экспланты от preeclamptic беременностей человека вызывают повышенную продукцию и высвобождение растворимого VEGF receptor-1, который соединяется с и тем самым ингибирует активность VEGF лигандов (Ahmad and Ahmed, 2005).Т.о., плацентарные ангиогенные и вазоактивные факторы могут служить в качестве терапевтических мишеней при угрожающих беременностях у человека (Godfrey, 2002; Ahmad and Ahmed, 2005; Reynolds et al., 2005a,b, 2006).
TABLE 3
STANDARD PARTIAL REGRESSION COEFFICIENTS
1 ILLUSTRATING THE RELATIONSHIPS OF VARIOUS ANGIOGENIC FACTOR mRNA (INDEPENDENT VARIABLES) WITH MEASURES OF COTYLEDONARY (FETAL PLACENTAL) VASCULARITY (DEPENDENT VARIABLES) OF SHEEP THROUGHOUT PREGNANCY
2
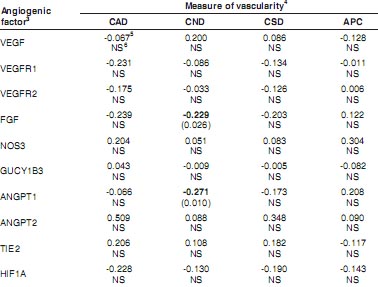
1
This procedure calculates standard partial regression coefficients, also termed β , which provide a measure of the relative contribution of the various independent variables to each dependent variable (Wright, 1934). The data for the regressions were taken from Borowicz et al. (2007); and the overall R2= 0.92, 0.52, 0.80, and 0.76 for CAD, CND, CSD, and APC, respectively.
2Days of pregnancy were days 50, 70, 90, 110, 130, and 140 (n = 5 ewes per day, except for day 90, for which n = 2; Borowicz et al., 2007). Relative expression of angiogenic factor mRNA was by quantitative, real-time PCR, as described by Borowicz et al. (2007).
3VEGF = vascular endothelial growth factor; VEGFR1 = VEGF receptor-1 (FLT1); VEGFR2 = VEGF receptor-2 (KDR); FGF = fibroblast growth factor-2 (basic FGF); NOS3 = endothelial nitric oxide synthase; GUCY1B3 = soluble guanylate cyclase (NO receptor); ANGPT1 = angiopoietin1; ANGPT2 = angiopoietin-2; TIE2 = angiopoietin receptor; and HIF1A = hypoxia-inducible factor1alpha.
4 CAD = capillary area density, CND = capillary number density, CSD = capillary surface density, and APC = area per capillary (Borowicz et al., 2007).
5 Standard partial regression coeffiencent (β ) with P-value in parentheses (significant β are shown in bold).
6 NS = not significant (P > 0.05).
Оксид азота является важным регулятором кровотока в матке в отсутствие беременности и также при беременности (Magness, 1998). Экспрессия eNOS и GUCY1B3 (также известного как растворимая guanylate cyclase), которые служат в качестве рецепторов для NO и тем самым обеспечивают его эффекты на сосудистые гладкие мышцы, повышена в артериях матки во время беременности (Itoh et al., 1998; Vagnoni et al., 1998; Zheng et al., 2000; Magness et al., 2001; Joyce et al., 2002). Кроме того, базовая продукция NO вносит вклад в низкую плодно-плацентарную сосудистую резистентность во время беременности (Sladek et al., 1997). NO и его метаболиты в кровообращении повышены во время беременности множественными по сравнению с единственным плодом (Vonnahme et al., 2005). Экспрессия в плаценте eNOS снижена в некоторых моделях угрожающей беременности, включая различные состояния с ограничением внутриматочного роста у женщин (Bird et al., 2003; Maul et al., 2003; Wu et al., 2004; Redmer et al., 2005). Более того, NO, продуцируемый эндотелиальными клетками и VEGF, продуцируемый прежде всего сосудистыми гладкими мышцами и капиллярными перицитами, могут взаимодействовать и стимулировать экспрессию др. др. (Ahmed and Perkins, 2000; Reynolds and Redmer, 2001). Т.о., нарушение плацентарного синтеза NO может предоставить единое объяснение задержки роста плода в моделях недокормленных и перекормленных овец с задержкой роста плодов (Wu et al., 2004).
Т.о., одними из лучших кандидатов на роль терапевтических агентов восстановления плацентарного кровотока и ангиогенеза являются phosphodiesterase 5 (PDE5A)-специфические ингибиторы, которые включают sildenafil, tadalafil и vardenafil (меченные торговыми марками как Viagra, Cialis и Levitra, соотв.). Эти фармакологические агенты усиливают сосудорасширяющее действие NO путем ингибирования разрушения cGMP, вторичного мессенджера для NO, вызывая тем самым устойчивую реляксацию сосудистых гладких мышц (Michel, 2006). Sildenafil усиливает как базовое, так и индуцированное estrogen увеличение кровотока в матке оварийэктомированых овец (Zoma et al. , 2004). Sildenafil также стимулирует расслабление сосудов артерий миометрия у женщин, у которых отмечается задержка роста плода (Wareing et al., 2005). Т.о.,, PDE5 ингибиторы в самом деле, по-видимому, являются терапевтическими агентами для увеличения uteroplacental кровоснабжения и также плацентарного ангиогенеза при угрожающей беременности и это предположение подтверждается предварительными исследованиями (Reynolds et al., 2006).
Помимо отклонений в активности PDE5A, nutriceutical подходы также могут быть использованы для манипуляций с системой NO. Citrulline является предшественником arginine, который является субстратом для синтеза NO посредством любой из различных NOS (Flynn et al., 2002). Задержка роста плода, вызванная недостаточным питанием матери с 28 по 78 день беременности у овец, ассоциирует со снижением аргинина и цитруллина в плазме матери, плода и аллантоисной жидкости на 23-30% на 78 день беременности (Kwon et al., 2004). Далее концентрации biopterin (показателя синтеза de novo tetrahydrobiopterin [BH4], который является важным кофактором для NOS) в плазме плодов, амниотической и аллантоисной жидкости, где снижается 32-36% у недокормленных овец (G. Wu, unpublished results, as referenced in Reynolds et al., 2006), указывая, что снижение доступности BH4 для продукции NO у плода. Эти изменения д. нарушать синтез в плаценте и у плодов NO, приводя тем самым к снижению кровотока в плаценте у недокормленных овец (Bell and Ehhardt 2002; Kwon et al., 2004).
В свете критической роли arginine-зависимых метаболических путей, внутривенное и оральное применение arginine может составлять терапевтическую стратегию для усиления маточного и плацентарного кровоток при угрозе беременности, и тем самым роста плода. В самом деле, Xiao and Li (2005) сообщили, что ежедневное внутривенное вливание аргинина в течение 7 дней во время поздней беременности (33 недели), женщинам с неизвестной причиной задержки внутриматочного роста плода, вызывало 6.4% увеличение веса при рождении. Сходным образом потребление с пищей arginine во время беременности вызывало 24% увеличение живого веса выводка у свиней (Mateo et al., 2007), а добавление аргинина лактирующим свиноматкам увеличивало прирост веса поросят на 11% спустя 21 день после родов (Mateo et al., 2008).
Как упоминалось выше, эстроген, по-видимому, является первичным регулятором маточно-плацентарного ангиогенеза благодаря своей строгой позитивной регуляции ангиогенных и вазоактивных факторов (Rosenfeld et al., 1996; Magness, 1998; Vagnoni et al., 1998; Culllinan-Bove et al., 1993; Magness, 1998; Reynolds et al., 1998; Johnson et al., 2006). Недавно, на одной из наших моделей угрожающей беременности; а именно, у перекормленных молодых свиней, мы наблюдали драматическое снижение уровней материнского системного эстрадиола во время последней половины беременности (Wallace et al., 2008; Vonnahme et al., unpublished, Fig. 8). Обусловлены ли уровни estradiol повышенным метаболизмом или снижением продукции в плаценте эстрогенов, остается неизвестным. Тем не менее снижение эстрадиола в кровообращении, скорее всего виновного в снижении плацентарного кровообращения и ангиогенеза, наблюдаемых у этих моделей (Table 1), оставляет открытой возможность заместительной эстрогеновой терапии для восстановления плацентарной функции и роста и развития плода у этого типа угроз беременности (Wallace et al., 2008).
Summary and challenges
Nearly 15 years ago, we reviewed the current state of knowledge concerning uteroplacental vascular development, its contribution to placental function, and, ultimately, its importance to fetal and neonatal growth and development. In the intervening period, we have learned much more about the critical role of placental vascular development in placental function in both normal pregnancy as well as numerous models of compromised pregnancy, including those in which fetal or placental growth, or both, are reduced due to abnormal maternal dietary intake, increased numbers of fetuses, maternal or fetal genotype, maternal age, or maternal environmental stress. We also have learned much about the factors that regulate placental vascular growth, or angiogenesis. Based on these observations, we suggest several potential therapeutic approaches to ‘rescuing’ placental vascular development, and thus fetal and placental growth and development.
Although we have learned much in a relatively short time, we obviously have much more to do. For example, we need a much better understanding of when and where and how changes in angiogenic factor expression and the process of angiogenesis itself occur in various compromised pregnancies, and the effects of various therapeutic agents not only on fetal and placental growth and development but also on postnatal outcomes. It seems equally obvious that animal models of compromised pregnancy will be critical to solving these problems, which have large socioeconomic consequences.
Сайт создан в системе
uCoz Fig. 2. Schematic representation of the sheep placentome. Taken from Reynolds et al., 2005b.
Fig. 2. Schematic representation of the sheep placentome. Taken from Reynolds et al., 2005b.  Fig. 5. Model of angiogenesis in the sheep placenta throughout the last two-thirds of gestation (taken from Borowicz et al., 2007).
описаны в деталях Borowicz et al. (2007) и Vonnahme et al. (2007). Используя эти методы, мы показали, что общий объем капилляров материнской плаценты у овец увеличивается драматически после 18-го дня беременности одновременно с драматическим ростом капилляров (Fig. 3). Этот рост микрососудистого ложа плаценты, включая как материнские, так и плодные ткани, продолжается в течение всей беременности (Fig. 4). Эти количественные гистологические методы также позволили разработать модель развития микрососудов плаценты (Fig. 5). В это caruncular (maternal placental) капиллярные ложа растут прежде всего за счет увеличения размеров капилляров (область на капилляр), с лишь незначительным увеличением количества капилляров или поверхностной плотности, приводящих к среднему 3-кратному увеличению плотности области капилляров. Напротив cotyledonary (fetal villous) капиллярные ложа растут прежде всего за счет ветвления, приводя к значительному 12-кратному увеличению плотности количества капилляров, что сопровождается снижением размеров капилляров. Относительно большое, 6-кратное увеличение области капилляров и поверхностной плотности плодных ворсинок (Fig. 5) может быть объяснено за счет роста в виде паттерна ветвления.
Fig. 5. Model of angiogenesis in the sheep placenta throughout the last two-thirds of gestation (taken from Borowicz et al., 2007).
описаны в деталях Borowicz et al. (2007) и Vonnahme et al. (2007). Используя эти методы, мы показали, что общий объем капилляров материнской плаценты у овец увеличивается драматически после 18-го дня беременности одновременно с драматическим ростом капилляров (Fig. 3). Этот рост микрососудистого ложа плаценты, включая как материнские, так и плодные ткани, продолжается в течение всей беременности (Fig. 4). Эти количественные гистологические методы также позволили разработать модель развития микрососудов плаценты (Fig. 5). В это caruncular (maternal placental) капиллярные ложа растут прежде всего за счет увеличения размеров капилляров (область на капилляр), с лишь незначительным увеличением количества капилляров или поверхностной плотности, приводящих к среднему 3-кратному увеличению плотности области капилляров. Напротив cotyledonary (fetal villous) капиллярные ложа растут прежде всего за счет ветвления, приводя к значительному 12-кратному увеличению плотности количества капилляров, что сопровождается снижением размеров капилляров. Относительно большое, 6-кратное увеличение области капилляров и поверхностной плотности плодных ворсинок (Fig. 5) может быть объяснено за счет роста в виде паттерна ветвления.  Fig. 6. Developmental changes in the microvascular architecture of the maternal placenta (caruncle) throughout gestation in sheep. (A) Nonpregnant, (B) Day 30 and 50 of gestation, and (C) Day 130 of gestation (length of pregnancy approximately 145 days; taken from Reynolds et al., 2005c).
определили, что число раундов ветвлений капилляров, необходимых, чтобы перейти от самых маленьких caruncular и cotyledonary артериол (mean D = 80 µm) к среднему диаметру caruncular и cotyledonary капилляров на 140 день беременности составляло 10 для материнских caruncles и 15 для плодных cotyledons, что д. составлять в результате 25 или в 32-раза больше сосудов в cotyledons по сравнению с caruncles (Reynolds et al., 2005c; Borowicz et al. , 2007; Vonnahme et al., 2007). Т.о., наша эмпирическая модель подтверждает заключение, что капилляры плодной части плаценты значительно более разветвлены, чем капилляры материнской части плаценты.
Fig. 6. Developmental changes in the microvascular architecture of the maternal placenta (caruncle) throughout gestation in sheep. (A) Nonpregnant, (B) Day 30 and 50 of gestation, and (C) Day 130 of gestation (length of pregnancy approximately 145 days; taken from Reynolds et al., 2005c).
определили, что число раундов ветвлений капилляров, необходимых, чтобы перейти от самых маленьких caruncular и cotyledonary артериол (mean D = 80 µm) к среднему диаметру caruncular и cotyledonary капилляров на 140 день беременности составляло 10 для материнских caruncles и 15 для плодных cotyledons, что д. составлять в результате 25 или в 32-раза больше сосудов в cotyledons по сравнению с caruncles (Reynolds et al., 2005c; Borowicz et al. , 2007; Vonnahme et al., 2007). Т.о., наша эмпирическая модель подтверждает заключение, что капилляры плодной части плаценты значительно более разветвлены, чем капилляры материнской части плаценты. Fig. 7. Scanning electron photomicrographs of placental microvascular casts. Day 130 [0.9] of pregnancy; Hafez, Borowicz, Reynolds and Redmer, unpublished.
Fig. 7. Scanning electron photomicrographs of placental microvascular casts. Day 130 [0.9] of pregnancy; Hafez, Borowicz, Reynolds and Redmer, unpublished. 
