Дифференцировка сомитов контролируется на двух разных уровнях. Один уровень включает механизмы, ответственные за формирование и дифференцировку компартментов сомита, которые в основном консервативны вдоль всей длины осевого скелета (Marcelle et at, 2002). Второй уровень контроля предоставляет позиционную информацию вдоль anterior-posterior (A-P) оси, и тем самым объясняет генез морфологически отличных структур из сомитов, расположенных на разных уровнях оси. Эти последние механизмы и является предметом обзора.
Генетические эксперименты идентифицировали различные молекулы, которые играют существенную роль в контроле спецификации сегментов в осевом скелете. В целом, и довольно искусственно, они могут быть подразделены на транскрипционные факторы и сигнальные молекулы. Схематическое представление избранных фенотипов, возникающих в результате мутаций в некоторых из этих факторов, представлено на Рис. 1.
Transcription factors
Большинство классических регуляторов сегментных характеристик у большинства организмов и тканей являются членами семейства Нох генов. Первоначальная идея о такой роли возникла при анализе генетических основ гомеотических фенотипов, которые были описаны сначала у мутантов Drosophila более 100 тому назад (Bateson. 1894; Lewis, 1978). Млекопитающие содержат 39 Hox генов, распределенных по 4 геномным кластерам, при этом каждый кластер обладает общим структурным сходством в Drosophila HOM-C комплексом (Krumlauf, 1994). Разные члены кластеров позвоночных расклассифицированы на 13 групп (обозначаются как паралоги) в соответствии с гомологией последовательностей и их позицией внутри кластера.
Участие Hox генов как в контроле качественных особенностей вдоль оси, так и в эволюции оси позвоночника подтверждается сравнением профилей экспрессии Hox генов у видов позвоночных с разными осевыми формулами (Gaunt, 1994; Burke et al., 1995). В этих исследованиях было показано, что границы передней экспрессии эквивалентных Hox генов у разных видов не соответствуют одному и тому же абсолютному количеству сомитов, но преобразовываются в соответствии со специфическими анатомическими признаками. Кроме того, относительный сдвиг экспрессии генов Hox , наблюдаемый в разных областях вдоль оси отражает относительную экспансию и контракцию морфологических регионов (Gaunt. 1994; Burke et al., 1995: Cohn and Tickle, 1999). Следовательно, вполне возможно, что Hox гены выполняют фундаментальную роль в эволюции осевого скелета позвоночных.
Поскольку эти сравнительные исследования указывают на участие Hox генов в спецификации качественных особенностей позвонков, то демонстрация этой идеи подтверждена обширными генетическими исследованиями на мышах (Chisaka and Capecchi, 1991; Le Mouellic H et al, 1992; Condie and Capecchi, 1993; Dolle etat 1993; Jeannotte et al., 1993; Ramirez-Solis et al., 1993; Condi and Capecchi, 1994; Horan et al.. 1994; Kostic and Capecch 1994; Horan el al., 1995; Rancourt et al., 1995; Fromenta Ramain et al.. 1996; Chen and Capecchi, 1997; Manley an Capecchi, 1997; Chen et al, 1998; Godwin and Capecchi, 1998: van den Akker et al, 2001; Economides et al., 2003; Wellik an Capecchi, 2003). Как эктопическая экспрессия, так и инактивация большинства Hox генов ведет к скелетным фенотипам, подчеркивающими качественные особенности трансформаций, которые варьируют в зависимости от специфичности Hox гена или генов, участвующих в эксперименте or genes involved in the experiment (Krumlauf, 1994). Эти эксперименты показали, что в целом Hox гены, расположенные на 3' конце кластеров (также наз. "передними" Hox генами на основании их доменов экспрессии) участвуют в спецификации передних структур и те, что расположены на 5' конце кластера (также известные как "задние" Hox гены) ответственны за контроль качественных особенностей задних позвонков. Однако, несмотря на многие годы интенсивных исследований мы всё ещё не понимаем механизм, с помощью которого Hox гены контролируют качественны особенности позвонков, и мы не имеем удовлетворительного объяснения взаимодействий среди разных Hox генов.
Одна из первых гипотез для объяснения, как Hox гены генерируют региональные качественные особенности в параксиальной мезодерме, базируется на результатах анализа последствий эктопической экспрессии определенных Hox генов в развивающемся осевом скелете мыши и на базе корреляций альтераций в экспрессии Hox генов с гомеозисными трансформациями у эмбрионов мышей, подвергнутых действию ретиноевой кислоты (RA) на разных стадиях беременности (Kessel and Gruss, 1991: Kessi 1992). Согласно этой гипотезе комбинация продуктов различных Hox генов, ко-экпрессирующихся в данном сомите, или "Hox codes" д. специфицировать финальную морфологию возникающих в результате позвонков. Однако, эта модель простой комбинации неспособна объяснить скелетные фенотипы всё увеличивающегося списка Hox мутантных мышей. Среди характеристик, которые кажутся очевидными, исходя из первоначальных экспериментов по инактивации генов, были такие, что домен активности Hox генов уменьшается к их наиболее передней части домена экспрессии. Эти результаты вместе с функциональной иерархией, существующей среди продуктов HOM-C генов у Drosophila , подтверждает модель "posterior prevalence" для паттерн-формирующей активности Нох генов (Bachiller et al., 1994; Duboule and Morata, 1994). Согласно этой модели функция "задних" (5') Hox генов превалирует над таковой их более "передних" (3') родственников. Соответственно, более "задние" Hox гены, экспрессирующиеся на данном А-Р уровне, д. диктовать морфогенетическую программу. Однако эта модель также неспособна объяснить многие Hox мутантные фенотипы. Сегодня активность Hox генов, контролирующих качественные особенности позвонков, обычно объясняется как комбинационный код, который учитывает как функциональный вес, так и результат активности Hox генов в зависимости от их специфических Hox партнеров на каждом определенном аксиальном уровне. Т.к. эта модель достаточно гибкая, чтобы объяснить почти любой возможный фенотип, в то же время она также слишком неопределенна, чтобы делать успешные предсказания или объяснения.
Несмотря на определенные трудности в создании унифицированного мнения о функции Нох генов, некоторые уроки могут быть усвоены из анализа огромной палитры Нох мутантных фенотипов. Функциональное перекрывание и синергичная активность среди членов групп паралогов является широко распространенным свойством Нох генов. Примером функциональной избыточности являются группы Hox паралогов 10 и 11. Обе группы содержат 3 члена и поэтому диплоидны в целом по 6 аллелям. Было показано, что эти гены обнаруживают строгие паттерн-формирующие эффекты в поясничной и крестцовой областях, соотв., которые выявляются только когда все 6 аллелей группы паралогов инактивируются (Wellik and Capecchi, 2003). Качественные особенности специфических членов паралогов, по-видимому, не являются столь важными как общее количество функциональных аллелей, экспрессирующихся в эмбрионе, т.к. одиночный аллель любого из генов паралогов, по-видимому, достаточен, чтобы устранить большую часть фенотипических отклонений (Wellik and Capecchi, 2003). Для др. групп паралогов пороговые уровни активности, необходимые для нормального развития, более высокие. Как следствие наблюдаемые фенотипы у компаундных мутантов обнаруживают дозово-зависимое усиление трансформаций (Condie and Capecchi, 1994; Horan el al., 1995; Fromental-Ramain eta!.. 1996: Chen and Capecchi. 1997; Manley and Capecchi. 1997; Chen et al., 1998). Напр., мутанты группы паралогов 4 обнаруживают передние трансформации шейных позвонков от совсем слабых у одиночных мутантов до очень обширных у тройных мутантов для генов паралогов 4 из a, b и d кластеров, при этом шейные позвонки трансформируются, приобретая C1 характеристики (Horan el al., 1995). Кроме того, ив противовес тому, что, по-видимому, происходит с Hox группами 10 и 11, функциональный вес каждого члена паралога, по-видимому, слегка отличен, на что указывают специфичность одиночных и компаундных мутантов. На данный момент уровень избыточности большинства др. групп паралогов неясен из-за летальности некоторых Hox мутаций, осложняющей генез глобальных мутантов паралогов. Необходимо отметить, однако, что для некоторых Hox паралогов, в частности группы 8, мутации в специфических членах группы, по-видимому, устраняют фенотипические отклонения, возникшие в результате инактивирующих мутаций в др. членах группы, как показывает анализ компаундных мутантных мышей (van den Akker eta!.. 2001). Эта находка указывает на то, что перекрывание также не является универсальным принципом активности Hox генов.
Также важной является находка, что гены одной и той же группы паралогов часто не обнаруживают не только перекрывающиеся функции, но и также уникальные активности. Напр., Hox паралогов группа 9. Поскольку как Hoxa9, так и Hoxd9, по-видимому, необходимые для поясничного уровня, но очевидно только Hoxa9 оказывает влияние на уровень ниже торакального/торако-люмбарного перехода (Fromental-Ramain et al., 1996).
Др. очень интересной характеристикой активности Hox генов является то, что группы паралогов Hox обычно обладают специфическими функциональными характеристиками, которые отличают их от др. групп паралогов Hox. Типичными примерами являются соседние группы паралогов 3 и 4, обе участвуют в формировании паттерна шейной области. В то время как отсутствие членов группы 3 ведет к потере сегментов позвонков (Condie and Capecchi, 1994; Manley and Capecchi. 1997), мутации в группе 4 приводят к идентичным изменениям в шейной области (Horan et al., 1995). Др. прекрасным примером являются упоминавшиеся уже группы 10 и 11, обе принадлежат к AbdB классу Hox генов. В то время как Hox группа 10 генов специфицирует поясничные позвонки, активность генов группы 11 необходима для генеза крестцовых позвонков (Wellik and Capecchi. 2003). Однако это правило один паралог -- одна функция также не универсально в мире Hox, т.к. синергичные взаимодействия среди членов разных групп паралогов также описаны. Среди др. примеров следует упомянуть дефекты, затрагивающие шейно-торакальный переход у транс-гетерозигот между Hoxb9 и Hoxb8 или Hoxb7 (Chen and Capecchi, 1997) или появление не-аллельной комплементации Hoxb5-Hoxb6 генов в формировании аксиального паттерна (Rancourt et at., 1995).
Повторяющееся содержание в Hox-зависимых фенотипах позвонков также указывают на то, что области осевого скелета, наиболее типично затрагиваемые у Hox мутантов являются местами переходов между доменами позвонков. Т.о., альтерации в первом шейном позвонке, в шейно-торакальном и торокально-поясничном переходах, или в количестве позвоночно-грудинных ребер (тех, которые прикрепляются к грудине), часто описываются как ассоциированные с мышами, мутантными по разным Нох генам. Напротив, альтерации в позвонках в средних позвоночных доменах (подобно T4 или L3) описываются редко. Возможно, что некоторые из этих несоответствий объясняются более легкой идентификацией модификаций в первой группе по сравнении со второй. Однако, это может также указывать на то, что эти области переходов позвонков представляют собой фундаментальные изменения в дифференцировке сомитов, которые более чувствительны к нарушениям, чем механизмы, участвующие в совершенствовании глобальных программ по продукции индивидуальных структур. Интересно, что экспериментальная проверка существования некоего типа Hox-зависимого глобального механизма, ответственного за развитие специфических доменов позвонков недавно была приведена Wellik and Capecchi (2003). Это исследование инактивации всех 6 Hox аллелей группы 10 давало животных с ребрами в проспективных поясничных позвонках, указывая тем самым на глобальную потребность в активности Hox группы 10, чтобы формировать паттерн поясничной области, в основном блокируя развитие ребер из соотв. сегментов. Сходным образом полная инактивация Hox группы 11 приводит к трансформации проспективных крестцовых и каудальных позвонков в позожие на поясничные, указывая тем самым на потребность в активности позитивной Hox группы 11, чтобы давать характеристики крестцовых и хвостовых позвонков (Wellik and Capecchi, 2003). Может ли этот принцип глобальной детерминации доменов позвонков быть расширен на др. области осевого скелета, ждет экспериментальной оценки.
Наконец, необходимо отметить, что т.к. генеральный принцип, который в основном исходит от Drosophila, рассматривает, что Нох гены участвуют в обеспечении качественных особенностей сегментов, а не в самом процессе сегментации, так что определенные Hox мутантные фенотипы, не д. ассоциировать с потерей или избытком позвоночных сегментов. Hoxb13 мутантные мыши, однако, имеют добавочные хвостовые позвонки, указывая тем самым, что эти мыши могут давать дополнительные сегменты в параксиальной мезодерме (Economides eta!., 2003). Напротив, у компаундных Hoxa3:Hoxd3 и Hoxb3:Hoxd3 мутантов первый шейный позвонок, атлант, не формируется (Condie and Capecchi, 1994; Manley and Capec 1997). Неясно, или потеря атланта является следствием отсутствия соотв. сомитного домена, или его неспособности дифференцироваться и последующей потери, или за счет "пропуска" целого сегмента в программе дифференцировки. Интересно, что НохdЗ ген обнаруживает экспрессию с циклическим поведением в PSM, это может указывать на связь между этим геном и процессом сегментации (Zakany et al., 2001)(see below).
Др. гомеобоксный ген, который, как было показано, участвует в процессе спецификации в параксиальной мезодерме является Gbx2 (Cагар et al.. 2005). Мыши. мутантные по этому гену обнаруживают мутантный фенотип, очень напоминающий тот, что продуцируется мутациями в Нохс8 гене (van den Akker et al., 2001). Неясно, как этот ген контролирует качественные особенности позвонков, поскольку он не экспрессируется в сомитах, его инактивация не влияет на экспрессию Hox генов (Carapuc al., 2005). Действительно, фенотипы этих мутантов предоставлют хороший аргумент в пользу потребности в гомеодомен-содержащей активности в PSM, чтобы контролировать сегментные характеристики в параксиальной мезодерме (see below).
Cdx гены являются др. семейством транскрипционных факторов, также необходимых для собственно контроля спецификации позвонков. У млекопитающих это семейство состоит из трех генов Cdx1, Cdx2 и Cdx4, с гомологией с Drosophilа геном caudal (Pollard and Holland. 2000). Мыши, мутантные по Cdx генам обнаруживают гомеозисные трансформации в своем осевом скелете, хотя обычно не столь выраженные, как у мутантов Hox. Cdx1 нулевые мутанты обнаруживают передние трансформации, которые затрагивают шейную и верхнюю торакальную область (Subramanian et al., 1995). Отсутствие Cdx2 ведет к преимплантационной эмбриональной летальности, тем самым препятствует анализу их скелета (Chawengsaksophak et al., 1997). Однако , Cdx2-/- эмбрионы обнаруживают передний гомеотический сдвиг в осевом скелете, хотя судя по виду слабый и ограниченный шейно-торокальным переходом, указывая тем самым, что Cdx2 ген также играет роль в контроле спецификации позвонков (van den Akker et al., 2002; Chawengsaksophak eta!., 1997; 2004). Инактивация Cdx4 не затрагивает развития осевого скелета (van Nes et al., 2006). Однако инактивация этого гена усиливает трансформации, вызываемые мутациями в Cdx1 и Cdx2 генах, указывая тем самым, что Cdx4 также играет роль в спецификации качественных особенностей позвонков и что гены Cdx обнаруживают перекрывающиеся функции (van Nes et al.. 2006). Перекрывание наблюдалось также между Cdx1 и Cdx2, т.к. комбинация мутантных аллелей обоих генов давала более тяжелые скелетные дефекты, чем одиночные мутанты (van den Akker et al., 2002).
За исключением Cdx1, который также экспрессируется в передней части параксиальной мезодермы, экспрессия генов семейства Cdx в основном локализуется в задних регионах эмбриона (Meyer and Gruss, 1993: Gamer and Wright, 1993: Beck et al., 1995), указывая тем самым, что их активность по контролю характеристик позвонков может обеспечиваться с помощью др. факторов. Сходство аксиальных фенотипов Cdx мутантных мышей с таковыми мутантов по нескольким Hox генам. указывает на функциональные взаимодействия между двумя семействами генов. Домены экспрессии определенных Hox генов обнаруживают задние сдвиги у Cdx мутантов, которые наиболее подчеркиваются, когда Cdx мутации скомбинированы (Subramanian et al.. 1995: van den Akker et al., 2002), представляя подтверждение этой гипотезе и помещая Hox гены иерархически ниже Cdx. В согласии с этой идеей, консенсусы чувствительных элементов для Cdx белков были идентифицированы в промоторах ДНК последовательностей ряда Hox локусов (Subramanian et al.. 1995; Knittel et al., 1995; Pownall et al., 1996: Charite et al., 1998; Isaacs et аl, 1998; Gaunt et al.. 2004; Tabaries et al., 2005). Интересно, что некоторые из этих консенсусов к Cdx чувствительных элементов, как было установлено, способны трансдуцировать позиционную информацию, чтобы регулировать экспрессию Hox генов в мезодерме и нейроэктодерме дозово-зависимым способом. И, поскольку Cdx гены, как полагают, являются позитивными регуляторами экспрессии Hox генов, то недавно было установлено, что эти гены могут также участвовать в блокировании экспрессии Hox генов. В частности, Cdx-чувствительный энхансер был идентифицирован в enhancer was identified in the Hoxa5 локусе, который необходим для собственно позиционирования каудальной границы экспрессии этого гена с помощью репрессивного механизма (Tabaries et al., 2005). Итак. эти данные показывают, что Cdx гены могут контролировать качественные особенности позвонков косвенно посредством своих эффектов на экспрессию Hox генов. Необходимо отметить, однако, альтерации экспрессии Hox генов у Cdx1 мутантных эмбрионов довольно слабые, указывающие на то, что Cdx гены могут также обладать Hox-независимой ролью в формировании паттерна скелета.
Др. группа генов, которая также важна для собственно контроля спецификации позвонков это гомологи Drosophila Trithorax (TrxG) и Polycomb (PcG) групп. Общепризнано, что члены этой большой группы генов участвуют в эпигенетических процессах, чтобы стабилизировать транскрипционное состояние различных онтогенетически важных генов (Pirrotta 1998), включая Hox гены, хотя недавнее сообщение показало, что эти белки могут играть более непосредственную роль в транскрипционных процессах (Breiling et al,, 2001; Saurin et al., 2001; Milne et al., 2002; de Graff et al., 2003; Wang et al., 2004; Napoles et al., 2004). В то время как TrxG гены, как полагают, поддерживают активность Hox генов в соотв. доменах, гены PcG, по-видимому, участвуют в удерживании их репрессированными в комплементарных регионах (Pirrotta, 1998). Соотв. роль этих генов в контроле региональных характеристик в параксиальной мезодерме, как полагают, непрямая, обеспечиваемая с помощью их эффектов на экспрессию Hox генов. В согласии с этой идеей то, что инактивация Trx гомолога Mll вызывает гомеозисные трансформации в осевом скелете, ассоциированные с подавлением специфических Нох генов после их, по-видимому, нормальной индукции (Hanson et al.. 1999; Yu et al., 1998). Напротив мыши, несущие мутации в элементах PcG генов, подобных Mei18. Вmi1, M33, Mph1, Ring1A или Eed обнаруживают дерепрессию некоторых Hox генов вне их обычных доменов, ассоциированную с гомеозисными трансформациями осевого скелета (Akasaka et al., 1996; van der Lugt et al.. 1994; Schumacher et al., 1996; Core et al.. 1997; Takihara et al., 19?97; del Mar Lorente et al., 2000; Wang et al, 2002). PcG гены, по-видимому, действуют синергично в своей активности, поскольку компаундные мутации по некоторым из этих генов обнаруживают усиление фенотипов, ассоциированных с индивидуальными генами (Bel et al., 1998; Akasaka al., 2001). Однако необходимо отметить, что постоянной характеристикой таких мутантных мышей являются их гомеотические фенотипы довольно легкие и не всегда коррелирующие с ожидаемым типом трансформации. Напр., Ring1A мутанты обнаруживают комбинацию задних (т.е. T12 в L1) с передними (т.е.., C2 в С1 типами трансформаций, которые противоречат заднему типу или трансформациям, ожидаемым для этого типа гена (del Mar Lorente et al., 2000).
Интересно, что TrxG и PcG гены, по-видимому, действуют антагонистически, т.к. трансформации позвонков и измененные паттерны экспрессии Нох у Mll-дефицитных и and Bmi1-дефицитных мышей мы нормализовали, когда и Mll и Bmi1 были делетированы (Bel et al., 199 Akasaka et al., 2001).
Недавняя работа нескольких лаб. предоставила базу для начала понимания молекулярных механизмов активности TrxG и PcG генов. Подробное описание таких механизмов лежит вне рамок нашего обзора, а заинтересованных читателей отсылаем к недавним обзорам (напр., Cernilogar and Orlando, 2005; Grimaud et al., 2006)
Signalling molecules
Помимо "классических" детерминантов позиционных характеристик осевого скелета, рассмотренных выше, генетические и тератогенные исследования открыли необходимость в молекулах, принадлежащих к разным сигнальным системам для развития нормальной аксиальной формулы.
Gdf11 (также наз. Bmp11), член семейства TGFβ сигнальных молекул (Nakashima et al., 1999), как было установлено, играет важную роль в формировании паттерна осевого скелета. Инактивация этого гена у мыши дает строгие отклонения от нормальной формулы позвонков (McPherron et al., 1999). Gdf11 мутантные мыши имеют несколько добавочных торакальных и поясничных сегментов за счет каудальных позвонков. Интересно, что мутанты имеют нормальное число сомитов, это указывает на то, что Gdf11 не влияет на скорость формирования сомитов, а скорее на их позиционные качественные характеристики (McPherron et al.,1999). В целом мутантный фенотип интерпретируется как общая передняя гомеотическая трансформация задних сегментов. Молекулярный анализ этих мутантов показал аномальную экспрессию избранных Hox генов, включая заднюю экспансию Нохс6 и Hoxc8 в развивающихся позвонках 2 или 3-х сегментов и задний сдвиг ростральной границы доменов экспрессии Нохс11 и Hoxc10, последний сопровождается каудальным смещением задних конечностей, также наблюдаемым у этих эмбрионов.
Серия генетических экспериментов также идентифицировала рецепторы, которые, по-видимому, обеспечивают активность Gdf11 в контроле сегментных качественных характеристик осевого скелета. Activin receptor IIB (AcvrIIB) мутантные мыши обнаруживают множественные дефекты формирования паттерна, включая трансформации позвонков, которые напоминают Gdf11-/- фенотип, хотя и менее тяжелый (Oh et al., 1997). Более слабые фенотипические отклонения у AcvrIIB-/- мышей по сравнению с Gdf1-/- мутантами указывает на то, что др. типа II рецептор(ы) для Tgfβ семейства д. компенсировать отсутствие AcvrIIB. В частности, Activin receptor-IIА (AcvrllA), по-видимому, участвует в этом. В то время как нарушение AcvrllA не дает фенотипических отклонений в осевом скелете (Matzuk, 995; Song et al., 1999), снижение дозы AcvrllAв контексте AcvrIIB мутантного фона увеличивает тяжесть осевых фенотипов, указывая, что эти два рецептора кооперативно обеспечивают активность Gdf11 в контексте спецификации позвонков (Oh et ai. 2002). Биохимические исследования показали соединение Gdf11 с этими рецепторами, подтверждая тем самым это заключение (Oh et al., 2002). Недавно type I Tgfβ рецептор, который д. функционально взаимодействовать с type II рецепторами и Gdf11? был идентифицирован как ALK5 (Andersson et al., 2006). Этого типа I рецептор, как было показано биохимически взаимодействует с Gdf11 зависимым от AcvrllB способом. Кроме того, тяжесть фенотипа AcvrllB-/- увеличивалась, когда один аллель ALK5 был инактивирован, указывая на функциональную роль ALK5 в формировании передне-заднего паттерна скелета посредством передачи сигналов Gdf11 signalling in vivo (Andersson et at., 2006).
Др. сигнальные пути, включая FGFs, WNTs и ретиноевую кислоту (RA), также участвуют в контроле аксиальных характеристик в параксиальной мезодерме. Т.к. эти факторы также играют важную роль на ранних стадиях мезодермального развития, то иногда трудно оценить степень их вовлечения в процессы региональной спецификации. Однако для всех этих сигнальных путей существует достаточно данных, достаточных, чтобы говорить с уверенностью, что они также играют роль в контроле сегментных характеристик в параксиальной мезодерме.
Давно известно, что дисбаланс витамина А может приводить к тяжелым тератогенным эффектам (Weston et al, 2003). RA является главным активным метаболитом витамина А и находится среди первых сигнальных молекул, экспериментально ассоциированных с процессами формирования A-P паттерна в параксиальной мезодерме. Как уже обсуждалось выше, было показано. что применение высоких доз RA ведет к ряду скелетных дефектов, включая гомеотические трансформации в осевом скелете (Kessel and Gruss, 1991; Kessel, 1992). Сюда входят как переднего, так и заднего типа трансформации и затрагиваются позвонки всех осевых уровней, а специфические типы трансформаций зависят от стадии и дозы (Kessel and Gruss, 1991; Kessel. 1992). RA является не только тератогеном, затрагивающим осевой скелет; она также играет физиологическую роль в детерминации региональных характеристик в параксиальной мезодерме, как показывают фенотипы компаундных мутантов для retinoic acid receptors (RAR) (Lohnes et at., 1994). Мыши, несущие специфические комбинации мутантных аллелей для RARs имеют аномальные скелетные фенотипы, которые также включают уродства позвонков, оцениваемые как гомеотические трансформации. Интересно, что эти трансформации затрагивают почти исключительно шейную область, указывая тем самым, что или RA не участвует в физиологическом контроле характеристик позвонков в более каудальных областях или что эти эффекты обеспечиваются др. наборами рецепторов. Экспрессия доминантно-негативной формы RAR в хондрогенных клетках также продуцирует альтерации шейных позвонков ( Yamaguchi et ai. 1998). Эти данные были интерпретированы как указывающие на то, что активность RA в развитии скелета необходима в дифференцирующейся мезенхиме.
Манипуляции с метаболизмом RA у эмбрионов предоставили дальнейшее подтверждение потребности собственно пространственного контроля активности RA во время эмбрионального развития в целом и во время формирования осевого паттерна, в частности. Ингибирование продукции RA посредством инактивации Raidh2 подтверждает необходимость этого сигнального пути для мезодермального развития (Niederreither et ai, 1999). Однако эти мутанты были неинформативными в отношении вовлечения RA в контроль пространственных характеристик в осевом скелете, поскольку эмбрионы погибали в середине беременности. Напротив, инактивация Cyp26, энзима, участвующего в катаболизме RA, продуцирует фенотипы позвонков, очень сходные с теми, что возникают в результате экзогенного применения RA (Sakai et al., 2001: Abu-Abed et al., 2001). Интересно, что анализ активности RA у таких мутантов с использованием RA репортерного трансгена, RARE-hsp-lacZ, показал, что Cyp26-обусловленная инактивация передачи сигналов RA происходит локально в PSM, указывая, что эффекты избыточной передачи сигналов RA на осевой скелет обеспечиваются её активностью в этой несегментированной области параксиальной мезодермы (Sakai et ai, 2001).
Сходство скелетных фенотипов компаундных RAR мутантов, Cyp2-/- животных и RA-обработанных эмбрионов с фенотипами Cdx1 и Wnt3a мутантов (see later) подтверждает взаимодействие между этими факторами. В самом деле, молекулярный анализ показал. что экспрессия Wnt3a негативно модулируется усилением передачи сигналов RA (Sakai et ai., 2001; Abu-Abed et al. 2001), а Cdx1 промотор содержит RA responsive elements (RARE) (Houle et al, 2000). Кроме того, стало известно, уже в самых ранних исследованиях Hox генов, что передача сигналов RA оказывает сильное влияние на экспрессию генов Hox (Simeone et ai., 1990), и RAREs были обнаружены в Hox комплексах (Lanston et al., 1997; Zhang et аl, 1997). В согласии с этим аномальная экспрессия Hox генов была найдена у эмбрионов с измененной передачей сигналов RA (изменненая с помощью генетических или фармакологических процедур) и , учитывая роль Hox генов в контроле сегментных характеристик в параксиальной мезодерме, было предположено, что существует аномальная экспрессия этих генов, которые детерминируют осевые феноипы в результате неправильной регуляции передачи сигналов RA. Однако четкие экспериментальные доказательства, подтверждающие эту гипотезу отсутствуют.
Fgfr1-обеспечиваемая передача сигналов FGF также участвует в контроле позиционной информации в параксиальной мезодерме. Инактивация Fgfr1 ведет к тяжелым аномалиям гаструляции и к ранней эмбриональной летальности (Deng eta!., 1994; Yamaguchi et al., 1994), это осложняет анализ роли Fgfr1 в формировании скелетного паттерна. Тем не менее, генетический анализ серии гипоморфных и активированных Fgfr1 аллелей показал, что Fgfr1-зависимая передача сигналов FGF необходима для собственно формирования A-P паттерна параксиальной мезодермы (Partanen et al., 1998). В этом исследовании было установлено, что мыши, несущие гипоморфные аллели гена Fgfr1 , имеют гомеотические трансформации своего осевого скелета, преимущественно с передними характеристиками. Эти скелетные аномалии были ассоциированы с каудальными укорочениями с варьирующей тяжестью в зависимости от специфического Fgfr1 генотипа. Напротив, активирующая мутация, которая превращает сайт аутофосфорилирования tyrosine (Y766) в phenylalanine, ведет исключительно к задним трансформациям (Partanen et al., 1998). Ассоциированные с этими скелетными отклонениями, авт. нашли легкие альтерации в экспрессии Hox генов. Это привело их к предположению, что роль передачи сигналов FGF в контроле позиционной информации в параксиальной мезодерме заключается в установлении соотв. экспрессии Hox генов. Т.о., передача сигналов FGF д. детерминировать качественные особенности позвонков косвенно посредством активности Hox генов (Partanen et al., 1998). Участие FGFs в формировании мезодермального паттерна было также подтверждено в исследованиях на Xenopus, которые выявлена корреляция избыточной экспрессии FGF с усилением активности Hox генов, хотя влияние на характеристики позвонков не было оценено непосредственно (Pownall et al.. 1996).
Генетический анализ Wnt3a также указывает на его участие в установлении сегментных характеристик в параксиальной мезодерме. Полная инактивация этого гена ведет к тяжелому укорочению оси тела кзади от уровня передних конечностей (Takada et al., 1994; Ikeya and Takada. 2001). Однако даже у этих сильно укороченных эмбрионов анализ шейного скелета выявил присутствие передних трансформаций позвонков (Ikeya and Takada. 2001). Анализ гетерозиготных по
Wnt3a гетерозиготных мышей и
vestigia! tail (vt) мутантов, которые несли гипоморфную мутацию гена
Wnt3a (Greco et at.. 1996), подтвердил участие этого фактора в формировании A-P паттерна осевого скелета, распространяясь вдоль всей длины передне-задней оси (Ikeya and Takada, 2001). Эффекты Wnt3a на формирование паттерна параксиальной мезодермы, по-видимому, по крайней мере, частично обусловлены контролем гена
Cdx1, который, как было установлено, строго подавляется в ответ на общее или частичное снижение активности Wnt3a (Ikeya and Takada. 2001). В соответствии с этим скелетные фенотипы
Wnt3a и Cdx1 мутантов очень сходны. Кроме того, исследования
Cdx1 промотора выявили присутствие функциональных β-catenin чувствительных элементов (Lickert et al., 2000). Однако поскольку
Cdx1 мутантный фенотип не включает трансформации кзади от шейного и верхнего грудного отделов (Subramanian et al., 1995), активность Wnt3a в этих наиболее задних регионах д. обеспечиваться посредством Cdx1-независимого механизма. Экспрессия Hox генов также анализировалась у
Wnt3a мутантов и найдены очень незначительные или отсутствие отклонений по сравнению с дикого типа сибсами (Ikeya and Takada, 2001), это говорит против обширной роли этих генов, стоящих ниже
Wnt3a в формировании паттерна параксиальной мезодермы.
Where is segmental identity determined?
Трансплантационные эксперименты, проведенные более 30 лет назад, показали, что сомиты уже содержат свою позиционную информацию, т.к. они всё ещё формируются в передней пресомитной мезодерме (Kieny et at., 1972). В тех экспериментах пресомитная мезодерма с данной стадии трансплантации в эквивалентное положение эмбриона на более ранних стадиях развития дифференцировались в соответствии с проспективной позицией сомитов в ткани донора. Однако несколько лет спустя, когда стали оценивать генетические детерминанты сегментных осевых характеристик и Hox гены заняли центральное положение, их специфические и удивительные паттерны экспрессии в сомитах привели к предположению, что это их сомитная экспрессия, связана с их функцией по контролю качественных особенностей сегментов в параксиальной мезодерме. Это действительно одно из основных предположений "Hox code" и модели "posterior prevalence". Сходным образом трансплантационные эксперименты Kieny et al. (1972) были позднее объяснены с помощью экспрессии специфических Hox генов в происходящих из трансплантатов сомитах, которые соответствовали паттернам, присущим донорской ткани (Nowicki and Burke, 2000).
Ntv не менее, вплоть до недавнего времени, функциональное значение генной активности в сомитах не тестировалось непосредственно и имеются описания Hox-ассоциированных фенотипов позвонков, которые точно не согласуются в активностью Hox генов, необходимых для сомитов. Напр., осевые фенотипы, обнаруживаемые у эмбрионов, которые восстанавливали соотв. сомитные домены экспрессии Hox генов после задержки активации в пресомитной мезодерме (Zakany et al,1997). Сходным образом, специфические генетические манипуляции в Hox комплексах приводили к временной преждевременной экспрессии некоторых Hox генов в параксиальной мезодерме, которая не затрагивала их финальной соматической экспрессии, но тем не менее вызывала аномальные фенотипы в осевом скелете (Kondo and Duboule, 1999). Поскольку эти результаты четко подчеркивают важность времени функционирования Hox генов, они также показывают, что собственно сомитная экспрессия Hox генов недостаточна для формирования нормального паттерна осевого скелета. Фенотипы некоторых Hox мутантных мышей также не согласуются с активностью Hox генов, необходимой в дифференцирующихся сомитах, напр., аномалии в верхних грудных позвонках, обнаруживаемые у Hoxb9 мутантных эмбрионов, усиливались, когда один или оба аллеля гена Hoxa9 , которые не экспрессируются на соответствующем сомитном уровне, были также инактивированы (Fromental-Ramain etai.. 1996). Ещё круче случай с группой Hox 10 паралогов. Как упоминалось раньше генетические данные четко показывают, что гены этой группы паралогов существенны для формирования паттерна поясничной области и что три члена этой группы выполняю эквивалентные функции в этом процессе (Wellik and Capecchi. 2003). Однако экспрессия этих генов не только неспособна достигать соответствующего сомитного уровня, но также обнаруживает сильную изменчивость среди членов группы (Carapug aL 2005).
Прямая оценка пространственной потребности в активности Hox генов показала, что, по крайней мере, в некоторых случаях Hox гены способны импринтировать специфические сегментные характеристики в сомитах, если они действуют во время их формирования в PSM, и что сомитная экспрессия только Hox генов недостаточна (Carapucjo et at., 2005). Это, по-видимому, такой случай для Hox10 группы, т.к.
Hoxa10 может расширять свою доминантную активность, чтобы блокировать образование ребер кпереди от поясничной области, когда эктопически экспрессируется
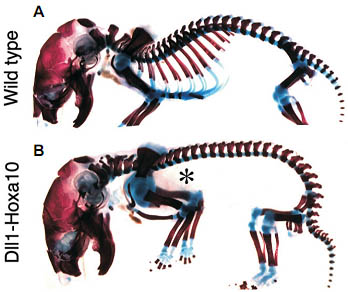 Fig. 2. Effect of expression of Hoxa10 in the presomitic mesoderm of transgenic embryos. (A) Skeleton of a newborn wild type mouse. (B) Skeleton of a newborn transgenic mouse in which the Hoxa10 gene was expressed in the presomitic mesoderm using an enhancer of the the Dll1 promoter. Note the complete absence of ribs (asterisk). The skeletons were stained using the alcian blue-alizarin red method.
Fig. 2. Effect of expression of Hoxa10 in the presomitic mesoderm of transgenic embryos. (A) Skeleton of a newborn wild type mouse. (B) Skeleton of a newborn transgenic mouse in which the Hoxa10 gene was expressed in the presomitic mesoderm using an enhancer of the the Dll1 promoter. Note the complete absence of ribs (asterisk). The skeletons were stained using the alcian blue-alizarin red method.
в проспективной торакальной PSM (Fig. 2), но не в соотв. сомитах (Carapugo taL, 2005). В др. случаях экспрессия Hox генов в PSM или в сомитах, по-видимому, необходима для альтернативной функциональной активности. Это очевидно для группы Hox11, которая, как обсуждалось выше, необходима для продукции как крестцовых, так и каудальных типов позвонков (Wellik and Capecchi, 2003). В этом случае экспрессия в PSM необходима для образования крестца, а экспрессия в сомитах ответственна за данную каудальную сигнатуру позвонков (Carapugo etal.. 2005). Степень, в которой функция др. Hox генов необходима в сомитах, в PSM или даже на более ранних стадиях развития параксиальной мезодермы, ещё предстоит определить. Интересно, что недавно сообщалось, что экспрессия генов Hox в эпибласте действует как доминантно, чтобы детерминировать специфическое клеточное поведение во время гаструляции и возможно на более поздних стадиях дифференцировки параксиальной мезодермы (limura and Pourquie, 2006).
Важным аспектом обсуждаемой выше идеи является обнаружение механизма, который соответствует принципу предсуществующего набора в PSM и он только транслируется позднее во время дифференцировки сомитов. Среди возможных подходов к этой проблеме идентификация системы, которая транслирует информацию д формировании паттерна в морфогенетическую программу. Хотя наше знание об этих системах в целом ограничены , некоторая информация доступна для считывания при формировании ребер, это д. повлиять на понимание глобального механизма образования грудной и поясничной областей, последняя, поскольку, она, по-видимому, необходима для ингибирования ребер (Wellik and Capecchi, 2003).
Всё увеличивающиеся доказательства подтверждают идею, что сигналы, предоставляемые миотомами являются критическими для собственно развития ребер. Мутации в миогенных регуляторных факторах, таких как Myf-5 или myogenin. ведут к отсутствию основной дистальной части ребер (Braun etal.. 1992; Wang etal., 1996). Экспрессия этих генов ограничивается миотомом без очевидного вклада в склеротом (Bober et al., 1991: Hopwood 1991; Ott et al., 1991; Hinterberger et al., 1991; Pownall et al., 1992), указывая на необходимость инструкций между компартментами сомитов при развитии ребер. Среди наиболее вероятных кандидатов по обеспечению этих взаимодействий находятсяFgf4, Fgf6 и Pdgfα . Эти факторы экспрессируются в миотоме (Goldfarb, 1990: Orr-Urtreger and Lonai, 1992: deLapeyriere et al., 1993) и подавлены в сомитах Myf5-дефицитных мышей (Grass et al., 1996; Tailquist et al., 2000). Кроме того, т.к. потребность в Fgf4 и Fgf6 для формирования ребер до сих пор не протестирована генетически, но нарушение передачи сигналов посредством PDGFs также ведет к уродствам позвонков, ребер и грудины (Soriano. 1997). Кроме того функциональные Myf5-связывающие сайты были найдены в Pdgfα промоторе мышей и людей, а knocking-in Pdgfα в Myf5 локус частично нормализует дефекты образования ребер, типичные для Myf5-дефицитных мышей, указывая тем самым, что Pdgfα является bona fide нижестоящим эффектором Myf5 (Tailquist et al., 2000).
На базе этой информации можно предположить, что паттерн формирующие активности, предоставляемые в пресомитной мезодерме (Kieny et al., 1972; Carapuco et al., 2005), Hox-зависимы или нет, по крайней мере, относительно развития ребер, могут быть эффективно перенесены на более поздние стадии в отношении модуляции миотом-склеротом взаимодействий, или за счет контроля продукции миотомных сигналов или модуляции склеротомных реакций на эти сигналы. Однако, независимо от механизма, это каким-то образом специфически кодируется в PSM , а не в уже сформированных сомитах, указывая на то, что кодирующая система может быть связана со специфическими свойствами PSM.
Are Hoxgenes functionally connected to the signalling systems operating in the patterning of the paraxia mesoderm?
Как обсуждалось выше, становится ясным, что как сигнальные молекулы, так и гомеодоменового типа транскрипционные факторы участвуют в контроле спецификации сегментов в параксиальной мезодерме. Однако функциональная связь между этими двумя группами молекул, если таковая есть, неясна. Как указывалось выше, классическая точка зрения заключается в том, что различные сигнальные пути модулируют экспрессию Hox генов, которые ответственны за спецификацию качественных особенностей различных позвонковых сегментов. Это д. уладить кажущиеся расхождения, наблюдаемые у мутантов по некоторым из этих сигнальных систем, в которых фенотипы обычно связаны с дифференцировкой сомитов, но экспрессия или активность в основном ограничена наиболее каудальными частями параксиальной мезодермы (Takada et al., 1994 McPherron et al.. 1999: Sakai et al., 2001: Corson et al., 2003). Поэтому постоянно делались попытки найти модификации в экспрессии Hox генов у любых мутантов с отклонениями в осевом скелете. В некоторых случаях наблюдаемые отклонения в паттернах экспрессии Hox чётки и до некоторой степени обширные (напр., у Gdf11 мутантов), но у др. они незначительные, чтобы можно было утверждать, что эти модификации могут быть причинно связаны с наблюдаемыми фенотипами (напр., у Wnt3a мутантов).
Альтернативные гипотезы, которые не обязательно взаимоисключающие с теми. что представлены в предыдущем параграфе, базируются на находке, что активность Hox генов необходима в PSM (Cагарuсо et aL 2005). В согласии с этой гипотезой Hox гены l/ модулировать активность сигнальных процессов, которые участвуют в установлении осевых качественных особенностей в параксиальной мезодерме. Сюда необходимо включить те сигнальные пути, что описаны выше (т.e. RA, FGF, WNT) и др., которые мы пока не рассматривали в данном обзоре, напр., участие членов суперсемейства Notch. Хотя наши знания не обладают данными, доступными с той же подробностью, чтобы доказать или отказаться от этой гипотезы, существуют доказательства, указывающие на то, что Hox гены в самом деле могут модифицировать активность сигнальных путей. Напр., мы показали, что Hoxa2 модулирует реакцию мезенхимных клеток второй бранхиальной дуги на Fgf8 (Bobola etal., 2003). А компоненты некоторых сигнальных путей, как сообщалось, выступают в качестве нижестоящих мишеней для Hox генов в некоторых биологических контекстах (Mallo and Magli, 2006). Также соблазнительной является недавняя находка, что экспрессия Hox в эпибласте модулирует гатруляционные движения затрагиваемых клеток (limura and Pourquie, 2006), поскольку роль в этом процессе была также описана для передач сигналов FGF и BMP (Miura et al., 2006). Поэтому вполне возможно, что Hox гены могут модулировать активность этих сигнальных путей. В биологических системах экспрессия генов и морфогенетические механизмы часто поддерживаются с помощью петель обратной связи после их инициальной индукции. Если этот принцип также приложим к Hox генам и сигнальным процессам, то изменение передачи сигналов также должно касаться их сигнатур при аномальной экспрессии Hox генов, это обнаруживается у многих сигнальных мутантов, which is what is found in many of the signalling lutants.
Are segmentation and segmental identity functionally connected?
В последние годы достигнуты существенные успехи в направлении понимания молекулярных основ сомитогенеза. Ведущая модель для объяснения этого процесса известна как "clock and wavefront", первоначально была предложена Cooke and Zeeman (1976). Эта модель предполагает существование осциллирующего сигнала в PSM (the сlock), который задает темп для формирования сомитов и "determiation front", который закладывает позиции вдоль AP, где клетки отвечают на осцилляторный сигнал, чтобы создавать сегментационные домены. Накопилось много доказательств, подтверждающих эту модель, которые также предоставляют ключевую информацию для понимания процесса сомитогенежа в молекулярных терминах. Опубликовано множество недавних обзоров относительно различных аспектов этого процесса (Aulehla and Herrmann, 2004; Duboulle and Pourquie, 2004; Giudicelli and Lewis, 2004; Gridley, 2006), поэтому мы опишем очень кратко, чтобы помочь понять возможную связь между сегментацией и позиционной информацией в параксиальной мезодерме. Первым экспериментальным подтверждением циклической молекулярной активности в PSM стала динамическая экспрессия гена Hairy1 (Palmeirim etal., 1997). Экспрессия этого гена была обнаружена в виде волны, бегущей через PSM в направлении сзади кпереди с периодичностью, которая согласуется с ритмом образования сомитов. Затем многие др. гены были обнаружены с эквивалентной осцилляторной экспрессией у мышей, кур, рвбок данио и Xenopus, указывая, что этот механизм законсервирован среди позвоночных (rev. Aulehla and Herrmann, 2004: Duboulle and Pourquie, 2004; Giudicelli and Lewis, 2004; Gridley, 2006). В целом эти циклически работающие гены являются компонентами сигнальных систем Notch и WNT. Известно, что все члены пути Notch работают циклически в основном в одной фазе, указывая тем самым, что они функционально связаны. Напротив, осцилляция этих генов в основном не совпадает по фазе с циклом членов пути WNT . Кроме того, циклическая активность обоих путей, по-видимому, функционально связана, WNT находится, по-видимому, выше Notch (Aulehla et al., 2003). Молекулярная природа фронта волны, по-видимому, включает противоположные градиенты внутри PSM: Fgf8/Wnt3a в направлении сзади кпереди и RA в направлении спереди назад. Fgf8, как полагают, удерживает клетки PSM в недифференцированном состоянии. Т.к. мезодермальные клетки перемещаются кпереди через PSM, то они д. подвергаться действию всё уменьшающихся уровней Fgf8, пока они не достигнут уровня передачи сигналов FGF достаточно низкого, которые позволит им активировать программу сегментации. Эта область и д. быть "determination front". Передне-задний градиент RA, по-видимому, функционально антагонистичен таковому FGFs и поэтому было предположено, что он действует противоположно активности FGF и/или непосредственно, активируя гены, участвующие в процессе сегментации (Diez del Corral and Storey, 2004). Сигнальный путь WNT, действуя посредством Wnt3a, как полагают, интегрирует часы и градиенты в глобальный механизм, контролирующий процесс сегментации (Aulehla and Herrmann 2004).
Связь, если таковая существует, между формированием сомитов и спецификацией типа позвонков, которые они продуцируют, неясна. Эксперименты, в которых градиент Fgf8 в PSM эмбрионов кур был искусственно изменен, приводили к аномальной активации экспрессии Hox генов (Dubrulle et al., 2001). В частности, экзогенное воздействие Fgf8 на зднюю чать PSM давало более мелкие сомиты кпереди от кусочка, которые компенсировались более крупными сомитами после него. Ассоциированная с этим эффектом активация HoxB9 и HoxA10 , по-видимому, сдвигалась кпереди на оперированной стороне. Авт. интерпретировали эту преждевременную активацию экспрессии Hox генов как возникающую в результате из клеток в сомитах, кпереди от кусочка с Fgf8, как результат экспозиции вне осцилляторного цикла, т.о., предполагается связь между "часами" сегментации и спецификацией осевых качественных характеристик, как это определяется по экспрессии Hox генов (Dubrulle et at., 2001). В этих экспериментах, однако, не было проанализировано, была ли активация Hox генов прямым эффектом Fgf8 [как это было показано в др. биологических контекстах (Johnson et al., 1994: Pownall etal., 1998: Bei-Vialar e. al.. 2002)] и приводила ли измененная экспрессия Hox генов действительно к трансформации качественных характеристик в осевом скелете.
Связь между сегментационными таймером (clock) и активацией генов Hox также подтверждается находкой, что некоторые Hox гены, включая Hoxd1 и Hoxd3, обнаруживают профили динамичной экспрессии в PSM эмбрионов мыши, чем-то напоминающие экспрессию генов, описанных для сегментационных таймеров (clock) (Zakany etal, 2001). Экспрессия Hoxd1 в этой области, как было показано, зависит от передачи сигналов Notch, одного из главных компонентов таймера сегментации, это дельнейшее подтверждение связи между сегментацией и позиционной информацией. Инактивация Hoxd1 ведет к слиянию первых двух шейных позвонков, но этого невозможно достигнуть, если этот фенотип возникает в результате отсутствия активации этого гена в PSM за счет передачи сигналов Notch, поскольку ранняя летальность, ассоциирована с глобальной инактивацией этого сигнального пути (Oka et al., 1995). Частичный ответ на этот вопрос получен в независимом сообщении с использованием трансгенного подхода, чтобы модулировать передачу сигналов Notch в PSM. Экспрессия доминантно негативной формы Notch лиганда DII1, с использованием двух разных промоторов, приводило к альтерациям осевого скелета, которые были оценены как изменения спецификации (Cordes et al., 2004). Эти анатомические фенотипы были ассоциированы с незначительными изменениями в экспрессии некоторых Hox генов, но причинные взаимоотношения между морфологическим и молекулярным фенотипами ещё предстоит определить. Гомеотические трансформации были также описаны для др. мутаций членов сигнального пути Notch (Cordes et al., 2004), хотя собственно характеристика изменений спецификации и оценка их степени были осложнены из-за сильно выраженных сегментационных фенотипических отклонений, также наблюдаемых у этих мышей (Zhang and Gridley, 1998; Evrard et al.. 1998).
Др. косвенным указанием на возможную функциональную связь между сегментацией и процессами спецификации сегментных характеристик в параксиальной мезодерме является выявление интересной ассоциации трансформаций позвонков, оцениваемых как гомеотические трансформации, с альтерациями сигнальных путей, которые создают градиенты в PSM (FGF, RA, WNT). Поскольку различные объяснения выдвигаются для этих фенотипов, то вполне также возможно, что они связаны с отклонениями от собственно функционирования сегментных часов (clock). Если это и в самом деле имеет место, то это д. свидетельствовать в пользу гипотетической связи между сомитогенезом и позиционной информацией в параксиальной мезодерме. Тем не менее, такая гипотеза далека от прямой экспериментальной оценки.
Concluding remarks
Years of intense research have resulted in the identification of many of the genetic determinants of positional information in the paraxial mesoderm. However, suprisingly little is known about how these genes work to produce a properly patterned axial skeleton. Very recent data suggest, although in part quite indirectly, that the patterning of the axial skeleton is programmed by interactions between Hox genes and several signalling systems. It is even possible that the generation of the patterning information is linked to the processes leading to formation of somites, a potential connection worth exploring using direct experimental approaches.
The potential connection between Hox and signalling systems also suggests how Hox genes could be modulating specific morphogenetic processes. Earlier in this review we have discussed that the Hox-mediated modulation of rib formation might be mediated through influencing signalling processes between the myotome and sclerotome. This influence of Hox gene activity on signalling could be part of a mechanism by which they control development of vertebral structures other than the ribs. Accordingly, we speculate that Hox genes might provide positional information by modulating different signalling pathways in specific ways and that it is the global outcome of these signalling activities which dictates the specific morphogenetic programmes. Different combinations of Hox genes would determine different profiles of signalling activities, thus generating different structures. In this context, it is worth noting that most of the known signalling pathways have an effect on skeletogenesis and thus modulation of signalling processes could eventually mean modulation of skeletogenic processes. Obviously, there are still too many unanswered questions regarding how positional information is encoded and decoded in the paraxial mesoderm, which surely will keep us busy for years to come.
Сайт создан в системе
uCoz
 Fig. 2. Effect of expression of Hoxa10 in the presomitic mesoderm of transgenic embryos. (A) Skeleton of a newborn wild type mouse. (B) Skeleton of a newborn transgenic mouse in which the Hoxa10 gene was expressed in the presomitic mesoderm using an enhancer of the the Dll1 promoter. Note the complete absence of ribs (asterisk). The skeletons were stained using the alcian blue-alizarin red method.
Fig. 2. Effect of expression of Hoxa10 in the presomitic mesoderm of transgenic embryos. (A) Skeleton of a newborn wild type mouse. (B) Skeleton of a newborn transgenic mouse in which the Hoxa10 gene was expressed in the presomitic mesoderm using an enhancer of the the Dll1 promoter. Note the complete absence of ribs (asterisk). The skeletons were stained using the alcian blue-alizarin red method.