Hematopoietic stem cells (HSCs) ответственны за продукцию в течение всей жизни кровеносной системы. Поэтому HSCs д. устанавливать баланс между двумя противоположными судьбами клеток путем самообновления - поддержания пула HSC и путем дифференцировки в терминально зрелых предшественников (rev. Giebel and Bruns, 2008). В клинической терапии HSCs обычно получают из взрослых тканей [bone marrow (BM), umbilical cord blood (UCB) или из mobilized peripheral blood (MPB)] и успешно используют для лечения различных приобретенных и генетических нарушений и озлокачествлений. Однако ограниченная польза происходящих от взрослых HSCs и их ограниченный in vivo потенциал после культивирования ex vivo (Attar and Scadden, 2004) затрудняют их использование в клинике; поэтому необходимы легко доступные и возобновляемые источники трансплантируемых клеток. В этом отношении, human embryonic stem cells (hESCs) (Thomson et al., 1998; Reubinoff et al., 2000) и более недавно полученные induced pluripotent stem cells (iPSCs) (Takahashi and Yamanaka, 2006; Park et al., 2008; Yu et al., 2007) представляют собой два альтернативных источника pluripotent stem cells (PSCs), которые демонстрируют как неограниченную способность к пролиферации in vitro (Avery et al., 2006) , так и потенциал плюрипотентной дифференцировки (Yu and Thomson, 2008), включая потенциал формирования кровяных HSCs, являются ценными своей способностью восстанавливать гематопоэтическую систему иммунодефицитных животных, напр., NOD/ SCID мышей (Dick et al., 1997; Mazurier et al., 2003) и вносить равные вклады в функциональное восстановление трансплантационных параметров у человека (Grewal et al., 2003). Поскольку факторы эктопической трансплантации пути Cdx/Hox могут модулировать функциональное поведение взрослых HSCs (rev. Klump et al., 2005) и наделять HSC свойствами ESCs у мышей (Kyba et al., 2002; Wang et al., 2005a), этого не происходит с hESCs, где генерация предполагаемых HSCs, с использованием различных методологий, животных реципиентов и путей введения, дают достоверно более низкие уровни восстановления, как показано в нашей лаб. (Wang et al., 2005b; Ji et al., 2008) и позднее др. (Lu et al., 2007a; Lee et al., 2008; Narayan et al., 2006; Tian et al., 2006; Ledran et al., 2008).
Базируясь на процедурах дифференцировки представленных выше, серия исследований (Chadwick et al., 2003; Cerdan et al., 2004; Chadwick et al., 2003; Wang et al., 2005d; Wang et al., 2004; Ji et al., 2008) нашей лаб. предоставила детальную фенотипическую и временную дорожную карту происходящего из hESC гематопоэтического развития в направлении миэлоидного и эритроидного клонов. Эти работы продемонстрировали, что клетки, развивающиеся внутри EBs, обработанных гематопоэтическими цитокинами (в основном SCF и FLT3L) и индуктором вентральной мезодермы BMP-4, остаются не детерминированными к судьбе гематопоэтических клеток более 10 дней развития, это определяется по отсутствию экспрессии
CD45 и активности colony forming unit (CFU) (Chadwick et al., 2003). Во время этого онтогенетического промежутка развивается субнабор подобных эндотелиальным клеток, экспрессирующих PECAM-1, Flk-1/KDR и VEcadherin, но не CD45 (наз. CD45
negPFV), которые после изоляции клонов и дифференцировки в культуре дают как эндотелиальные, так и гематопоэтические предшественники (Wang et al., 2004); следовательно, представляются эквивалентными из гемангиобластов или гемогенных эндотелиальных предшественников, идентифицируемых у разных видов, и гематопоэтических сайтов (Huber et al., 2004; Choi et al., 1998; Nishikawa et al., 1998; Jaffredo et al., 2000; Zambidis et al., 2005; Kennedy et al., 2007; Lu et al., 2007b). Гематопоэтическая система, как полагают, возникает из общих клеток предшественников мезодермального происхождения и развивается дальше посредством инициальной примитивной стадии и стадии желточного мешка, представленная в основном эритроцитами и макрофагами, сопровождаемая дефинитивным гематопоэзом, дающим полный набор кровяных клеток, встречающихся во взрослом организме, включая и HSCs. Передача сигналов от критических ростовых и морфогенетических факторов, которые общие у позвоночных, оказывают влияние на примитивный и дефинитивный гематопоэз. В противоположность гематопоэтическим цитокинам, таким как FLT3L, SCF и TPO, которые могут способствовать выживанию, но не экспансии HSC (Murdoch et al., 2002), bone morphogenetic proteins (BMP) (Sadlon et al., 2004), Notch (Radtke et al., 2005), Wnt (Wodarz and Nusse, 1998) и Hedgehog (HH) (Baron, 2001) считаются ключевыми сигнальными путями стволовых клеток, участвующими в спецификации судеб, самообновлении и дифференцировке. За исключением BMP одинаковые передачи сигналов необходимы для гематопоэтической дифференцировки мышиных и человеческих ESCs (reviewed in McKinney-Freeman and Daley, 2007), ни один из путей Notch, Wnt и HH используется в отношении их способности регулировать ранний гематопоэз у человека.
The Notch pathway
Путь передачи сигналов Notch регулирует широкий спектр выбора судеб стволовых клеток, таких как нейрогенез, миогенез и гематопоэз (Chiba, 2006). Notch передача сигналов активируется посредством 4-х рецепторов (Notch1-4), которые могут взаимодействовать перекрывающимся способом с 5 лигандами Delta/Jagged семейства (Bray, 2006). Связывание лиганда запускает γ-secretase-зависимое протеолитическое расщепление Notch и высвобождение Notch intracellular domain (NICD) в ядро (De Strooper et al., 1999), который в свою очередь замещает корецепторы, ассоциированные с CSL транскрипционными факторами (CBF1 у человека; RBPJ у мыши). Активированные транскрипционные факторы затем рекрутируют и индуцируют экспрессию генов мишеней, таких как Hairy и Enhancer of Split HES1, HES5 и Deltex1 (Bray, 2006; Davis and Turner, 2001).
Хотя недавно расширенная и на регуляцию megakaryopoiesis (Mercher et al., 2008), роль передачи сигналов Notch лучше всего охарактеризована в спецификации T клеточных клонов (rev. Radtke et al., 2004) , а её дерегуляция обнаружена при лейкемии (в основном T-ALL) у человека (Grabher et al. , 2006). При гематопоэзе у взрослых активация передаче сигналов Notch, как было установлено, способствует экспансии и самообновлению HSC у мыши и человека (Karanu et al., 2000; Karanu et al., 2001; Karanu et al., 2003; Varnum-Finney et al., 1998; Ohishi et al., 2002; Carlesso et al., 1999; Dando et al., 2005); однако исследования потери функции у мышей не подтвердили чётко это заключение (Radtke et al., 1999; Saito et al., 2003; Mancini et al., 2005; Maillard et al., 2008). В частности, инактивация Notch рецепторов (Notch1, Notch2), лигандов (Jagged-1) или нижестоящих эффекторов (CSL/RBPJ, Mastermind-like1) не нарушала функции HSC. В эмбриональном гематопоэзе мыши стратегия удаления гена выявила не перекрывающиеся роли Notch1 и Notch2 в дифинитивном гематопоэзе и в развитии B клеток, соотв. (Hadland et al., 2004; Robert-Moreno et al., 2008; Huppert et al., 2000; Krebs et al., 2004; Kumano et al., 2003; Xue et al., 1999). Однако поскольку Notch, по-видимому, существенен для установления дефинитивных HSCs у эмбрионов, то он ингибирует генерацию мезодермальных и последующих гематопоэтических и эндотелиальных клонов из мышиных ESCs (Schroeder et al., 2006), делая роль(и) передачи сигналов Notch неясной во время более ранних стадий гематопоэтического развития.
В подтверждение отсутствия убедительных доказательств, что путь Notch участвует в поддержании недифференцированных мышиных ESCs (Nemir et al., 2006), несколько лаб. (Noggle et al., 2006; Fox et al., 2008; Yu et al., 2008), включая нашу (Lee, 2008), подтвердили отсутствие или минимальный вклад передачи сигналов Notch в недифференцированное состояние hESCs. Активация передачи сигналов Notch с помощью экзогенного Jagged-1 способствуeт hESC гематопоэзу на более значительных уровнях, чем индукция гематопоэза какой-либо цитокинами- или морфогенами-обусловленной стимуляцией, тем самым предоставляется непосредственный доступ к большим количествам гематопоэтических клеток. Интересно, что нокдаун HES1 в CD45neg PFV субнаборе вызывает редукцию выхода гематопоэтических, но усиление выхода эндотелиальных клеток, указывая тем самым, что детерминация бипотентных предшественников может контролироваться за счёт регуляции HES1 (Lee, 2008)). Эти предварительные находки подтверждают, что передача сигналов Notch может действовать аналогичным образом в модели латерального ингибирования клеточного контроля, впервые наблюдаемого у
Drosophila (rev. Radtke et al., 2005). Эта роль Notch может иметь большее значение для управления спецификацией PSC человека исключительно в гематопоэтическую или эндотелиальную судьбу. В этом отношении наши наблюдения подобной Notch-зависимой регуляции гематопоэтического развития iPSCs человека указывают на то, что два типа клеток сходны в отношении их способности отвечать на сигналы Notch. Поскольку биологические эффекты активации Notch сильно зависят от контекста, очень важно установить, полагается ли Notch-зависимое содействие гематопоэзу в PSCs человека на присутствии BMP-4, использованного в нашей системе дифференцировки, которая скорее всего осуществляет важный контроль над биологическими функциями Notch и BMP в эндотелиальном и гематопоэтическом компартментах. Хотя роль Notch в генерации настоящих (
bona fide) HSCs из PSCs человека остается ещё оценить, наши находки (Lee, 2008)) могут иметь важное значение, т.к. они указывают на возможность, что активация Notch пути может оказывать поддержку в стимуляции продукции гематопоэтических стволовых клеток и клеток предшественников или эндотелиальных клеток как для экспериментального, так и клинического применения.
The Hedgehog pathway
Законсервированный от Drosophila до человека путь Hedgehog (HH) играет центральную роль в эмбриональном развитии и в гомеостазе взрослых тканей путем контроля спецификации клеточных судеб и формирования паттерна (reviewed in McMahon et al., 2003). Функциональное значение этого пути иллюстрируется с помощью множественных врожденных дефектов и озлокачествлений (notably leukemia) (Bai et al., 2008), ассоциированных с мутациями и/или путем аберрантной активации (Villavicencio et al., 2000). Три HH лиганда Sonic (SHH), Indian (IHH) and Desert (DHH) были идентифицированы у млекопитающих, которые могут связываться взаимозаменяемо с двумя родственными 12 раз пронизывающими мембрану Patched (Ptc) рецепторами (rev. Ingham and McMahon, 2001). В отсутствие лиганда, Ptc противодействует пути, предупреждая активность др. трансмембранного белка Smoothened (Smo) (Lum and Beachy, 2004; Alcedo and Noll, 1997; Taipale et al., 2002). Соединение HH лигандов с Ptc ослабляет это ингибирование, это активирует транскрипцию генов мишеней посредством регуляции Glioblastoma (Gli) семейства транскрипционных факторов (Gli1, Gli-2, Gli-3) (rev. Koebernick and Pieler, 2002; AzaBlanc and Kornberg, 1999). Разные Gli белки обладают активирующей или репрессирующей активностями в зависимости от протеолитического процессинга белков полной длины. Gli-1 и Gli-2 в основном действуют как транскрипционные активаторы, тогда как Gli-3 генерирует форму репрессора (Gli3R) в отсутствие или при ингибировании передачи сигналов HH (Dai et al., 1999; Wang et al., 2000; Ingham and McMahon, 2001). Хотя функциональное значение Gli-3 было продемонстрировано с помощью генетической инактивации (Litingtung et al., 2002), молекулярные механизмы, которые контролируют Gli-3 взаимодействия и мишени, в основном не установлены, тогда как динамическое взаимодействие между передачей сигналов Gli-1 и Gli2 хорошо известно. Активация и репрессия HH пути путём вмешательства в активность Smo, может быть достигнута синтетическими агонистами (purmorphamine) (Sinha and Chen, 2006) и антагонистами (cyclopamine) (Taipale et al., 2000), соотв.
Исследования с использованием эмбрионов мышей и ESCs выявили участие HH пути (IHH) в раннем гемато-сосудистом развитии (Dyer et al. , 2001; Byrd et al., 2002; Baron, 2003). Однако, in vivo генетические исследования были ограничены исследованиями в выявлении роли пути или в эмбриональной летальности, индуцированной с помощью целенаправленных компонентов (Chiang et al., 1996) или участие в др. путях (напр., Wnt или BMP).
У людей в нашей лаб. впервые была установлена роль HH пути (SHH) в регуляции HSCs у взрослых (Bhardwaj et al. , 2001). После исследования роли этого пути в гематопоэзе из hESC, мы установили, что hESCs, активированные с помощью экзогенного SHH или purmorphamine, отвечают снижением размеров детерминированного гематопоэтического, но не гемогенного эндотелиального компартмента. Напротив, антагонизм передачи сигналов HH с cyclopamine или siRNA против Smo увеличивал развитие крови и был ассоциирован с процессингом Gli-3 в репрессорную форму (Ramos-Mejia, 2008). Этот эффект, как было установлено зависит от BMP-4, это согласуется с установленной связью между путями HH и BMP в биологии HSC у взрослых (revi. Baron, 2003). Более важно то, что cyclopamine благоприятсвует развитию дефинитивного эритропоэза из hESCs судя по экспрессии β globin у взрослых, предоставляя дополнительные доказательства потенциала генерировать дефинитивные гематопоэтические клоны. Хотя роль передачи сигналов HH в hESCs может показаться противоречивой априорным доказательствам у др. видов, где HH, как было установлено, является позитивным регулятром примитивного и дефинитивного гематопоэза (Maye et al., 2000; Dyer et al., 2001; Byrd et al., 2002; Gering and Patient, 2005), это согласуется с нашим предыдущим сообщением, указывающим на активацию передачи сигналов HH при истощении HSCs у взрослых мышей (Trowbridge et al., 2006a).
Все вместе наши находки показывают, что ингибирование передачи сигналов HH в hESCs может быть важным для индукции дефинитивного гематопоэза, при этом возникает возможность генерации настоящих HSCs из hESCs. Оценка этой возможности
in vivo является ключом, т.к. было предположено, что восстановление нарушенной способности HSCs, происходящих из ESCs, может быть объяснено их подобием с клетками, происходящими из желточного мешка (reviewed in Palis and Yoder, 2001).
The Wnt pathway
Эволюционно законсервированный Wnt путь подразделяется на две основные ветви, каноническую (зависимуд от β-catenin) и неканоническую (независимую от β-catenin) которые играют критические роли в спецификации клеточных судеб и перемещениях, соотв., во время как эмбрионального развития, так и регенерации взрослых тканей (rev. Logan and Nusse, 2004; Reya and Clevers, 2005; Uusitalo et al. , 1999). Wnt лиганды передают сигналы посредством соединения с 7 трансмембранными Frizzled (Fzd) рецепторами и с одним из трансмембранным lipoprotein receptor-related protein (LRP) 5 или 6 корецепторов (Wu and Nusse, 2002). Каноническая передача сигналов обеспечивается с помощью лигандов, таких как Wnt3a, ингибирует деградацию мультибелкового комплекса, состоящего минимум из axin, adenomatous polyposis coli (APC) и glycogen synthase kinase 3 beta (GSK3β). Кульминация этого ингибирования заключается в транслокации в ядро β-catenin, это позволяет ему взаимодействовать с T-cell factor (TCF)/lymphoid enhancer factor (LEF) транскрипционными факторами, чтобы регулировать экспрессию генов (Khon and Moon, 2005). Неканоническая передача сигналов, которая менее определена, обеспечивается лигандами, такими как Wnt11, которые используют те же самые Fzd рецепторы но в качестве корецепторов ROR2/RYK (Nusse, 2008; Lu et al., 2004). Этот путь стимулирует Jun NH2-terminal kinase (JNK), Ca2+/CaMKII и PKC пути (rev. Kohn and Moon, 2005). Оба пути взаимодействуют др. с др., а в некоторых случаях, неканоническая передача сигналов противодействует канонической (Kuhl, 2002).
Хотя роль передачи канонических сигналов в регуляции гематопоэза у взрослых была изучена в деталях, противоречия остаются, возможно связанные с различиями в силе и продолжительности передач сигналов Wnt или перекрываемостью с др. путями (Reya et al., 2003; Willert et al., 2003; Trowbridge et al., 2006b; Kirstetter et al., 2006; Scheller et al., 2006; Qian et al., 2008; Koch et al., 2008). В контексте развития генетические исследования продемонстрировали потребность в канонической передаче сигналов для формирования мезодермы (Liu et al., 1999; Lako et al., 2001; Kelly et al., 2004; Huelsken et al., 2000; Gadue et al., 2006). Однако исследования с использованием мышиных ESCs оказались неспособными оценить специфические роли этого пути во время детерминации из мезодермы гематопоэтического клона (Naito et al., 2006; Wang et al., 2007; Nostro et al., 2008), это предотвратило существенные экстраполяции с мыши на человека. Роль неканонической передачи сигналов на гематопоэз у человека охарактеризована ещё в меньшей степени, так только одно исследование в нашей лаб. исследовало путь в регуляции HSCs in vivo у взрослых (Murdoch et al., 2003).
В hESCs, роль пути Wnt, как полагали, не имеет отношения к гематопоэзу пока не было продемонстрировано, что каноническая, но не non-canonical передача сигналов поддерживает развитие бипотентных гемогенных клеток (Woll et al., 2008). С момента этого исследования, недавние успехи нашей лаб. предоставили однозначную информацию о биологических функциях двух путей. Мы установили, что неканонический (Wnt11) и канонический (Wnt3A) Wnts затрагивают разные популяции мишени и стадии гематопоэтического развития (Vijayaragavan et al., 2009). В согласии с ранее определенной ролью во взрослых клетках человеческих (Van Den Berg et al., 1998) и мышиных ESCs (Lako et al., 2001; Lengerke et al., 2008), каноническая передача сигналов усиливает пролиферацию детерминированных давать кровь предшественников, если дей2ствует во время соответствующего временного промежутка во время развития EB (Vijayaragavan et al., 2009). Однако мы не наблюдали какого-либо позитивного влияния канонической передачи сигналов Wnt на спецификацию в мезодерме hESCs, на что указывают работы с мышиными ESCs (Lako et al., 2001; Wang et al., 2007). Короткое пульсовое воздействие некононической передачи сигналов необходимо и достаточно для контроля выхода hESCs из плюрипотентного состояния и последующего вступления в мезэндодермальный и мезодермальный клоны, как показывает экспрессия соотв. маркёров и индукция уникальной клеточной популяции, ко-экспрессирующей Brachyury, Fzd7 и E-cadherin (Brachyury+/Fzd7+/E-cadherin+). SiRNA-обусловленный нокдаун Fzd7 уменьшает размер популяции Brachyury+/ Fzd7+/E-cadherin+ и последующих гематопоэтических компартментов (Vijayaragavan et al., 2009). Кроме того, генерация этой популяции зависела от формирования EB , а потеря в монослойных культурах hESCs, иллюстрирует тем самым важность трехмерной структуры, которая наиболее полно воспроизводит организацию гаструлы.
Все эти находки (Vijayaragavan et al., 2009) предоставляют первые доказательства уникальной роли неканонической передачи сигналов в ранней спецификации гематопоэза из hESCs, тогда как каноническая передача сигналов влияет на пролиферацию клеток, уже детерминированных в клетки крови. Это исследование предлагает ценную модельную систему для проверки возможности хронологической активации и взаимодействий между канонической и неканонической передачей сигналов при переходе клеток из мезодермальных в кровяные. Более того, индуцированная неканонической передачей сигналов популяция клеток Brachyury
+/Fzd7
+/E-cadherin
+ также предоставляет возможность выяснения взаимоотношения между этим субнабором т предполагаемыми мезоэнтодермальными предшественниками, описанными у рыбок данио и
Xenopus (Kimelman and Griffin, 2000; Rodaway and Patient, 2001), но такие доказательства отсутствуют у человека. Как недавно установлено на мышиных ESCs (Lengerke et al., 2008), специфические функции обоих Wnt путей д. быть пересмотрены в контексте их взаимодействия с известными регуляторами гематопоэза, такими как BMP и Cdx/Hox. Дискуссионная функция канонической передачи сигналов на восстановление способности взрослых HSCs (Reya et al., 2003; Kirstetter et al., 2006; Scheller et al., 2006; Koch et al., 2008), в комбинации с нашими находками относительно hESCs, подчеркивают важность тонкой настройки силы и продолжительности передачи сигналов Wnt в отношении терапевтического использования баланса между самообновлением и клональным детерминированием HSCs.
Towards an integrated view of HH, Wnt and Notch signaling in hematopoiesis
Множественные исследования подтвердили, что пути Notch, Wnt и HH могут образовывать между собой сеть и с др. сигнальными путями для установления или регуляции биологических процессов во время эмбриогенеза и в течение всей взрослой жизни (Hing et al., 1994; Maloof et al., 1999; Hooper, 1994). Несмотря на установление связей между BMP и Notch, Wnt и HH путями (Dahlqvist et al., 2003; Itoh et al., 2004; Nobta et al., 2005; Takizawa et al., 2003; Sumi et al., 2008; Lengerke et al., 2008; Baron, 2003), остаётся неясным, могут ли эти пути оперировать в непосредственной связи один с др. в контексте гематопоэтической системы. Однако важность сочетанной регуляции гематопоэза с помощью разных сигнальных путей в основном была продемонстрирована на мышах (Pearson et al., 2008). Напр., взаимодействие между Notch и активируемыми цитокинами путями, такими как FGF, PDGF, TGFβ, VEGF, G-CSF bkb GM-CSF, как было установлено, модулирует экспрессию компонентов Notch пути (Bigas et al., 1998; Reya et al., 2003). Передача сигналов Notch и Wnt действует совместно, чтобы поддержать пул HSC и мультипотентных предшественников, это скорее всего осуществляется посредством регуляции экспрессии генов мишеней для Notch и Notch-зависимого ингибирования дифференцировки HSC с помощью передачи сигналов Wnt (Duncan et al., 2005; Trowbridge et al., 2006b). Каноническая передача сигналов Wnt и Notch, которые независимо способствуют примитивному эритропоэзу и кардиогенезу в мышиных ESCs, соотв., завязывают связи посредством реципрокной регуляции ингибиторов Notch (Numb) и Wnt (Sfrp1, Sfrp5, Dkk1, Wnt5a) путей, чтобы управлять клеточной дифференцировкой специфически в направлении эритропоэза (Cheng et al., 2008). В дополнение к кооперации с передачей сигналов Notch, передача сигналов Wnt , как было установлено, Напр., индукция мезэнтодермальных предшественников, по-видимому, нуждается в кооперативных взаимодействиях между канонической передачей сигналов Wnt и передачей сигналов TGFβ в ESCs мыши и человека (Gadue et al., 2006; Sumi et al., 2008; Nostro et al., 2008), баланс между этими путями играет критическую роль в окончательных решениях по спецификации клонов. Кроме того, связь HH пути с Notch и Wnt, а также с пролиферативными и антиапоптическими сигнальными путями (FGF, IGF) регулирует гематопоэз. Однако эти связи лучше всего описаны применительно к злокачественному гематопоэзу (Sengupta et al., 2007) и плохо исследованы в нормальном развитии.
Помимо сигнальных воздействий внутренне присущие детерминанты, как известно, участвуют в гематопоэзе привлекаемые вместе с передачей сигналов Notch и HH. Представляют интерес гематопоэтические транскрипционные факторы (SCL/TAL-1, RUNX1, HOXB4) (Orkin and Zon, 2002; Hochman et al., 2006) и регуляторы хроматина (Palaparti et al., 1997), подтверждая тем самым участие этих путей в регуляции сложных регуляторных сетей. Несомненно необходимы дальнейшие исследования для выяснения интеграции основных внешних путей в транскрипционные и эпигенетическое регуляторные сети. Недавние исследования недифференцированного состояния мышиных ESCs в отношении LIF и BMP путей (Chen et al., 2008), выявление интеграции HH, Notch и Wnt сигналов с основными генетическими и эпигенетическими сетями во время гематопоэтического развития человеческих PSCs д. составить устойчивый фундамент для более контролируемых манипуляций с этими путями.
Concluding remarks
Итак, мышиные ESCs, и что более важно получаемые от взрослых людей HSCs, позволяют начать понимать новые и отличающиеся роли путей Notch, Wnt и HH в регуляции гематопоэза, возникающего из hESC (see Fig. 1). Необходимы дальнейшие исследования, чтобы установить, увеличивается ли количество гематопоэтических клеток, происходящих из hESCs, которое наблюдается в ответ на манипуляции с путями Notch, Wnt и HH, это может повысить качество клеток, которые обладают bona fide HSC функцией.
Эти исследования иллюстрируют значение (i) систем клеточных культур (EBs) и растворимых ростовых и морфогенетических факторов как средства регуляции последовательных событий и клеточных популяций, развивающихся после выхода из плюрипотентного состояния путем детерминации и дифференцировки в клетки крови, (ii) Notch, Wnt и HH как важных путей кандидататов в регуляции различных и критических аспектов этого развития , (iii) время- и стадио-специфические манипуляций с этими путями. Эти последние вмешательства, которые демонстрируют неоценимый вклад концептуального понимания биологии развития, только начинают исследоваться в области hESC. Уже можно предполагать, что hESCs будут вести себя очень похоже с mESCs, т.к. обе системы обладают общими критическими транскрипционными путями и обнаруживают одинаковые затруднения в генерации настоящих HSCs, наша работа подчеркивает существование различий между видами в отношении их несопоставимой чувствительности к HH пути или стратегии восстановления одиночного гена (HOXB4). В свете этих наблюдений, по-видимому, важно исследовать ситуацию на др. модельных системах, таких как не человекообразные приматы, в свете расходящихся мнений о происхождении дефинитивного гематопоэза человека из производной эпибласта спланхноплевральной мезодермы (Tavian et al., 2001) и гипобласта (Bianchi et al., 1993).
Т.к. индивидуальные вклады путей Notch, Wnt и HH в гематопоэтическое развитие hESCs только в начале исследований, влияние их коллективного вклада д. помочь определить, могут ли комбинаторные манипуляции с этими путями оказаться более мощными, чем стратегии одиночных манипуляций в отношении влияния на развитие гематопоэтических клонов. Однако механистическая сложность, с помощью которой эти пути передают межклеточные и/или внутриклеточные сигналы, осложняет ситуацию и возникает критический вопрос об избирательности. Так, (i) растет
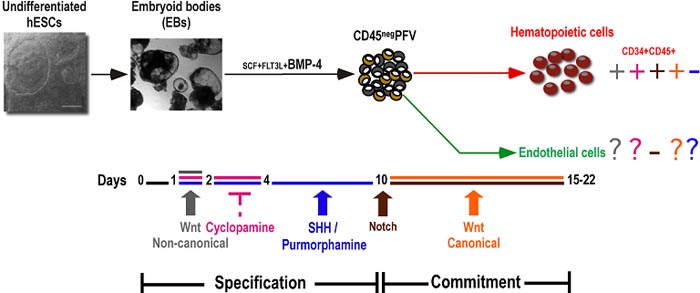 Fig. 1. Cellular and temporal roadmap of hematopoietic development of human embryonic stem cells (hESCs). Undifferentiated hESC colonies were differentiated into embryoid bodies (EBs) in differentiation medium supplemented with SCF, FLT3L and BMP-4 for the duration (days 1 - 1522) of EB development. Based on our previous studies (Wang et al., 2004), this developmental scheme can be divided in two phases. Days 0-10 delineate the specification phase that is characterized by the emergence of the CD45negPFV hemogenic endothelial precursor and the lack of committed hematopoietic (CD34+CD45+) and endothelial cells. These latter populations emerge during the commitment phase from day 10 onwards. Different colors refer to activation of the different pathways as well as inhibition of the hedgehog (HH) pathway (cyclopamine). + and - signs indicate enhanced and decreased hematopoietic (or endothelial) output, respectively, as determined at days 15-22 of EB differentiation in response to manipulation of each pathway for the indicated time window. Question marks refer to unknown data.
Fig. 1. Cellular and temporal roadmap of hematopoietic development of human embryonic stem cells (hESCs). Undifferentiated hESC colonies were differentiated into embryoid bodies (EBs) in differentiation medium supplemented with SCF, FLT3L and BMP-4 for the duration (days 1 - 1522) of EB development. Based on our previous studies (Wang et al., 2004), this developmental scheme can be divided in two phases. Days 0-10 delineate the specification phase that is characterized by the emergence of the CD45negPFV hemogenic endothelial precursor and the lack of committed hematopoietic (CD34+CD45+) and endothelial cells. These latter populations emerge during the commitment phase from day 10 onwards. Different colors refer to activation of the different pathways as well as inhibition of the hedgehog (HH) pathway (cyclopamine). + and - signs indicate enhanced and decreased hematopoietic (or endothelial) output, respectively, as determined at days 15-22 of EB differentiation in response to manipulation of each pathway for the indicated time window. Question marks refer to unknown data.
количество негативных или позитивных регуляторных петель внути этих путей, (ii) важны взаимоотношения с гематопоэтическими нишами и (iii) мешают разнородные рецептор/лиганд взаимодействия вместе с пост-транляционными модификациями функционального значения. Кроме того, гетерогенная природа культур ESC, как это продемонстрировано для самообновления ESC человека (Stewart et al., 2006; Bendall et al., 2007) и мыши (Hayashi et al., 2008), д. приниматься во внимание при оценке функциональных последствий такой гетерогенности, что выходит за пределы нашей способности понимать и контролировать спецификацию клонов человеческих PSCs. Несмотря на эту сложность культур PSC и передач сигналов Notch, Wnt и HH, эти вопросы являются важными для лучшего понимания в контексте гематопоэтического развития в отношении достижения специфичности сигнала и неограниченного потенциала этих путей.
Стратегии манипуляций со стволовыми клетками с использованием синтетических регуляторов, могут иметь большее значение для специфичности targeting активации или ингибирования этих путей. Однако возникают затруднения относительно терапевтического использования, учитывая значение этих путей в гематопоэтическом озлокачествлении (Grabher et al., 2006; Sengupta et al., 2007; Aster et al., 2008; Deshpande and Buske, 2007; Petropoulos et al., 2008), и истощение потенциала HSC после длительной активации (Trowbridge et al., 2006b). Хотя использование синтетических регуляторов передачи сигналов HH является обнадеживающим во многих системах (Stecca and Ruiz i Altaba, 2002), это довольно затруднительно для Wnt из-за прирожденного взаимодействие обоих путей и участия GSK3 в множественных путях, таких как HH (Jia et al., 2002). iPSC технологии открывают привлекательную возможность инициации ступенчатообразной дедифференцировки зрелых клеток крови из соматических источников в мультипотентные HSCs без первоначального прохождения через плюрипотентное клеточное состояние. Если это так, то манипуляции со специфическими наборами внешних и внутренних гематопоэтических регуляторов могут быть облегчены с помощью более подходящих эпигенетических состояний клеток крови взрослых по сравнению с PSCs, это может вести к генерации in vitro кровяных клеток, представляющих множественные ветви гематопоэтической иерархии. Более того, экспериментальные модельные системы iPSCs предоставляют более подходящие платформы для проверки in vitro моделей гематопоэтических аномалий, которые скорее всего вносят вклад в лучшее понимание того, как дерегуляция этих путей может приводить к злокачественному гематопоэзу.
Сайт создан в системе
uCoz Fig. 1. Cellular and temporal roadmap of hematopoietic development of human embryonic stem cells (hESCs). Undifferentiated hESC colonies were differentiated into embryoid bodies (EBs) in differentiation medium supplemented with SCF, FLT3L and BMP-4 for the duration (days 1 - 1522) of EB development. Based on our previous studies (Wang et al., 2004), this developmental scheme can be divided in two phases. Days 0-10 delineate the specification phase that is characterized by the emergence of the CD45negPFV hemogenic endothelial precursor and the lack of committed hematopoietic (CD34+CD45+) and endothelial cells. These latter populations emerge during the commitment phase from day 10 onwards. Different colors refer to activation of the different pathways as well as inhibition of the hedgehog (HH) pathway (cyclopamine). + and - signs indicate enhanced and decreased hematopoietic (or endothelial) output, respectively, as determined at days 15-22 of EB differentiation in response to manipulation of each pathway for the indicated time window. Question marks refer to unknown data.
Fig. 1. Cellular and temporal roadmap of hematopoietic development of human embryonic stem cells (hESCs). Undifferentiated hESC colonies were differentiated into embryoid bodies (EBs) in differentiation medium supplemented with SCF, FLT3L and BMP-4 for the duration (days 1 - 1522) of EB development. Based on our previous studies (Wang et al., 2004), this developmental scheme can be divided in two phases. Days 0-10 delineate the specification phase that is characterized by the emergence of the CD45negPFV hemogenic endothelial precursor and the lack of committed hematopoietic (CD34+CD45+) and endothelial cells. These latter populations emerge during the commitment phase from day 10 onwards. Different colors refer to activation of the different pathways as well as inhibition of the hedgehog (HH) pathway (cyclopamine). + and - signs indicate enhanced and decreased hematopoietic (or endothelial) output, respectively, as determined at days 15-22 of EB differentiation in response to manipulation of each pathway for the indicated time window. Question marks refer to unknown data.