Клетки сердечных клапанов возникают из множественных источников развивающегося эмбриона. Эндотелиальные клетки, которые окружают створки клапанов образуют непрерывный с эндокардом слой эпителиальных клеток (2). В OFT, как эндокардиальные, так и миокардиальные предшественники возникают из вторичного поля сердца (26). Во время ранних стадий образования эндокардиальных подушек мезенхимные клетки AV и OFT подушек происходят из эндотелиальных клеток, как установлено с помощью отслеживания клонов Tie2-Cre;ROSA26R репортера у мышей (27). В зрелых AV клапанах VICs также происходят прежде всего, если не целиком, из экспрессирующих
эндотелиальных клеток (20, 21). У мышей, имеется незначительны, если вообще имеется, вклад в VICs AV клапанов клеток, происходящих из эпикарда, как показано с помощью Wilms Tumor 1 (WT1)-Cre клонального анализа (28). Однако, изучение куринно-перепелинных химер у эмбрионов птиц выявило существенный вклад клеток. происходящих из эпикарда, в развивающиеся AV клапаны (27, 29). В развивающихся OFT подушках имеются значительные количества клеток, происходящих из нервного гребня, как демонстрирует исследование клонов с помощью
у мышей (27). В зрелых SL клапанах, клетки, происходящие из нервного гребня персистируют и концентрируются в индивидуальных карманах (cusps) легочного ствола и аортальных клапанов (30; T. Mead & K.E. Yutzey, unpublished). В целом. исследования по отслеживанию клонов у мышей продемонстрировали, что большинство VICs возникает из предшественников, возникающих из эндотелия. в эндокардиальных подушках. Однако растут доказательства, что специфические субпопуляции в индивидуальных створках клапанов возникают из разных эмбриональных источников. Неизвестно, представляют ли эти клетки из разных эмбриональных источников собой разные субпопуляции VICs со специфическими вкладами в структуру и функцию зрелых клапанов.
Несколько онтогенетически важных сигнальных путей выполняют критические функции в индукции эндокардиальных подушек и EMT. Передача сигналов Bone morphogenetic protein 2 (BMP2) от миокарда в эндокард в OFT и AV канале необходима для инициальной индукции EMT (31). Каноническая передача сигналов Wnt, а также передача сигналов transforming growth factor-β (TGF-β) необходимы для EMT и пролиферации мезенхимных клеток эндокардиальных подушек (19, 32, 33). Передача сигналов Notch в эндокарде регулирует репрессию экспрессии генов эндотелиальных клеток и также необходима для EMT (34). Мезенхимные клетки эндокардиальных подушек высоко пролиферативные и экспрессируют транскрипционные факторы Twist1 и Msx, характерные для популяции мезенхимных предшественников во многих системах органов (18, 35). Twist1, вместе с Tbx20, способствует пролиферации клеток, миграции и экспрессии генов первичного ECM в эндокардиальных подушках и затем он подавляется во время ремоделирования клапанов (36, 37). Итак, клетки предшественники клапанов из эндокардиальных подушек экспрессируют многие из генов и клеточные признаки мезенхимных типов клеток, участвующих в развитии и регенерации, а также в метастазировании опухолей. Генерация компартментов ECM для стратифицированных створок клапанов контролируется с помощью взаимодействий, родственных таковым в типах соединительных тканей (Figure 2) (12, 18). Переход от эндокардиальных подушек к ремоделированию в клапаны нуждается в транскрипционном факторе NFATc1, который способствует экспрессии ECM-ремоделирующего гена
cathepsinK в эндотелиальных клетках клапанов, а также в остеокластах, ремоделирующих кость (38-40). Исследования последних лет продемонстрировали четкие параллели
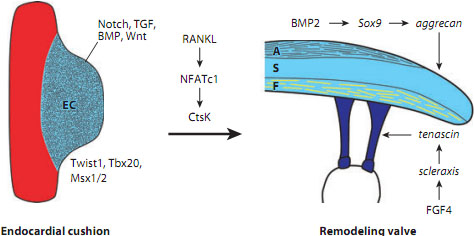 Figure 2
Figure 2
Regulatory interactions of signaling pathways and transcription factors in heart valve development. Various signaling mechanisms, such as Notch, transforming growth factor (TGF), bone morphogenetic protein (BMP), and Wnt pathways, and transcription factors, including Twist1, Tbx20, and Msx1/2, are involved in endocardial cushion (EC) formation during early valvulogenesis. RANKL activation of NFATc1 contributes to elongation and remodeling of the EC through expression of CtsK. During valve maturation, BMP signaling induces cartilage-associated genes Sox9 and aggrecan. Fibroblast growth factor (FGF) signaling promotes expression of scleraxis and tenascin, which are characteristic of tendon cell lineages. These genes and pathways involved in valve development are also active in adult valve disease. A, atrialis; S, spongiosa; F, fibrosa.
во взаимодействиях между сигнальными молекулами, транскрипционными факторами и структурными белками, которые контролируют дифференцировку соединительной ткани, такой как хрящи, сухожилия и кости,и которые также регулируют компартментализованную экспрессию генов ECM в развивающихся клапанах (12). Напр., передача сигналов BMP2 активирует транскрипцию транскрипционного фактора Sox9 и экспрессию гена aggrecan в предшественниках хряща, а также в предшественниках клапанов (41, 42). Кроме того, передача сигналов fibroblast growth factor 4 (FGF4) активирует scleraxis и tenascin в развивающихся сухожилиях, а также в ремоделируемых клапанах (41, 42). Передача сигналов Wnt, активная в развивающихся клапанах и критическая для образования ранних костей, способствует экспрессии генов, характерных для богатого коллагеном фиброзного слоя в культивируемых VICs (43). Инициация и поддержание стратификации створок клапанов скорее всего зависит от гемодинамических и биомеханических сил, действующих на клапаны во время сократительного цикла сердца (44). Однако молекулярные основы интеграции функции клапанов и сердечно-сосудистой физиологии с компартментализацией ECM во время развития и позднее в жизни всё ещё не выяснены.
VALVE COMPOSITION AND FUNCTION
Extracellular Matrix Composition and Organization in the Developing
and Mature Valves
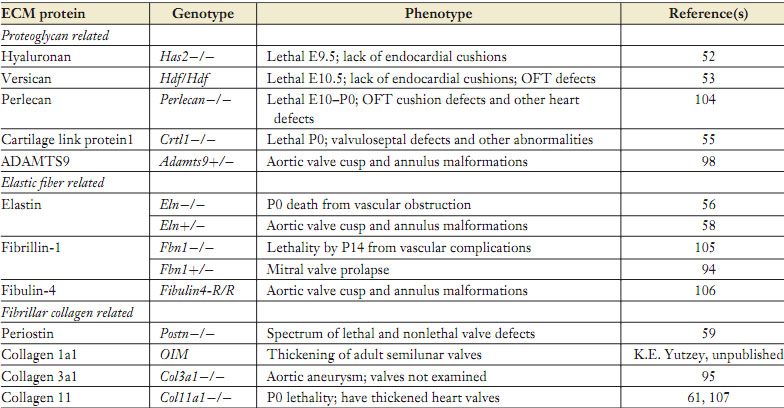
Нормальная функция клапанов нуждается в скоординированной активности сложных структур. Gross & Kugel (45) методично описали гистологию клапанов сердца человека в 1931, и предложили номенклатуру для тканевой организации клапанов, сегодня признанную. Структура зрелых клапанов состоит из высоко организованного ECM, который компартментализован в три слоя, фиброзный, губчатый (spongiosa) и или вентрикулярный для SL клапанов или атриальный для AV клапанов (Figure 1). Фиброзный слой, который расположен с вентрикулярной стороны AV клапанов и с атриальной стороны SL клапанов, состоит преимущественно из фибриллярных коллагенов (types I и III), которые ориентированы по окружности (circumferentially) и обеспечивает жесткость прочности на разрыв (46-49). Атриальный слой AV клапанов и вентрикулярный слой SL клапанов состоит преимущественно из радиально ориентированных волокнистых эластических волокон, которые облегчают тканевые движения (50, 51). Эластические волокна идут от шарнира клапана к закрывающему или подогнанному (coapting) краю и, следовательно, не проходят через всю длину клапана. Атриальный и вентрикулярные слои облегчают тканевое движение, делая возможным расширение и отскок клапана во время сердечного цикла. Губчатый слой (spongiosa) составляет среднюю область и состоит преимущественно из протеогликанов с вкраплениями коллагеновых волокон. Протеогликаны присутствуют на всю толщину клапанов, но являются превалирующим компонентом матрикса среднего слоя и служат в качестве границы между ортогонально расположенными фиброзным и атриальным и вентрикулярным слоями, чтобы обеспечить ткани сжимаемость и целостность. Кольцо (annulus), состоящее преимущественно из фиброзного коллагена, создающее подпорку для распределения сил и закрепления свободных краев карманов и створок, необходимо для стабилизации ткани. В AV клапанах створки соединены с миокардом желудочков с помощью сухожильных хорд, тогда как карманы SL клапанов закреплены непосредственно на артериальных корнях. Имеется избыточность ткани на кончиках как AV, так и SL клапанов, которые обеспечивают функциональное закрытие клапанов или сопоставление (coaptation) створок клапанов и карманов (cusps) и в конечном итоге дееспособность закрытых клапанов. Существует точный баланс между жесткостью и гибкостью. Следовательно, стоихометрия и распределение ECM компонентов являются критическими для собственно функции клапанов. Мыши, лишенные специфических ECM белков, обнаруживают дефекты развития, качающиеся образования и функции клапанов (Table 1). В противоположность высоко структуированным и стратифицированным ECM слоям зрелых клапанов, ECM из эндокардиальных подушек первоначально состоит преимущественно из hyaluronan, а мезенхимные клетки генерируют рыхло организованную коллагеновую сеть, не препятствующей миграции клеток (22). Мыши, лишенные hyaluronan синтезирующего энзима Has2, обнаруживают разбухание эндокардиальных подушек и отсутствие EMT (52). Потеря протеогликанов perlecan или versican также ведет к аномалиям подушек OFT и эмбриональной гибели (53, 54). Сходным образом, потеря cartilage link protein1 (Crtl1), который взаимодействует с hyaluronan и versican, также ведет к дефектам перегородок и клапанов(55). Экспрессия гена elastin инициируется в ремоделируемых клапанах во время поздней эмбриональной и неонатальной стадии (24). Мыши, лишенные elastin, не живут после рождения из-за обструкции сосудов, а гетерозиготные по elastin (eln+/-) мыши обнаруживают аномалии аортальных клапанов как структуры, так и функции у взрослых (56-58). Periostin регулирует фибриллогенез коллагена в разных соединительных тканях, а потеря periostin у мышей ведет к аномальному морфогенезу клапанов и организации коллагена (59, 60). Сходным образом, потеря поперечно-связывающих коллагенов 5a1 и 11a1 ведет к утолщению SL и AV клапанов с измененным соотношением фибриллярных коллагенов 1 и 3, это указывает на дефекты ремоделирования (61).
Итак, эти исследования демонстрируют, что экспрессия и организация разных компонентов ECM существенна для морфогенеза и структурной целостности клапанов во время развития и впоследствии после рождения. Состав ECM зрелых клапанов зависит от синтетической активности VICs. Во время ремоделирования клапанов VICs экспрессируют гены, которые кодируют фибриллярные коллагены, chondroitin sulfate proteoglycans и elastin, ассоциированные со стратифицированным ECM створок клапанов (24, 25). Локализация экспрессии специфических для ECM белков, характерных для разных типов клеток соединительной ткани, указывает на разные субпопуляции VICs в стратифицированных клапанах, но это не было продемонстрировано со всей очевидностью. Дополнительные ремоделирующие ECM энзимы, такие как matrix metalloproteases (MMPs), tissue inhibitors of matrix metalloproteases (TIMPs) и cathepsins, также экспрессируются во время созревания клапанов (17, 25).
VICs из ремоделируемых клапанов обнаруживают высокую синтетическую активность, а клеточная пролиферация редуцирована по сравнению с клетками эндокардиальных подушек (21, 24). В нормальных клапанах взрослых VICs в основном молчащие с незначительной или с отсутствием клеточной пролиферации и с исходными уровнями экспрессии ECM генов, необходимыми для гомеостаза клапанов (25).
Biomechanics and Hemodynamics
Структурно-функциональные взаимоотношения клапанов предоставляют важную для понимания информацию
 a Abbreviations used: E, embryonic day; OFT, outfiow tract; P, postnatal day.
a Abbreviations used: E, embryonic day; OFT, outfiow tract; P, postnatal day.
о механизмах гомеостаза клапанов, а также о процессах развития и болезнях. Сердечные клапаны обеспечивают беспрепятственный однонаправленный ток крови. Гемодинамика нормального зрелого сердца хорошо известна (62). Кровоток от предсердий с низким давлением в желудочки с высоким давлением, который в свою очередь поступает в магистральные артерии. Левая сторона сердца поддерживает достоверно более высокое давление, чем правая сторона. Как результат, воздействие разных физиологических сил зависит от положения и гемодинамических условий клапанов. Состав клапанов и биомеханика отражают лежащую в основе гемодинамику. Три основные составляющие нагрузки-искривление (flexure), сдирание (shear) и растягивающее напряжение (tension)-влияют на ткань клапанов во время цикла сокращения сердца. искривление происходит, когда клапаны активно открываются или закрываются, сдирающее действие происходит, когда кровь проходит через открытый клапан, а напряжение происходит, когда клапан закрыт (4, 63). Сдирающие, сдавливающие и продольные стрессы вносят вклад в деформацию клапанов или смещение ткани клапанов во время постоянного движения при сердечных циклах (64). Ткань клапанов обладает исключительно высокой растяжимостью (strain) из-за тканевых циклов к полностью ненагруженному состоянию при каждом сердцебиении (49). Эти деформирующие силы приводят к скомпенсированному балансу состава клеточного матрикса. Напр., сравнение аортальных и пульмональных клапанов демонстрирует, что аортальные клапаны левой стороны толще, преимущественно в результате увеличения экспрессии коллагена и увеличения толщины фиброзного слоя (C. Alfieri, C. Carruthers, K.E. Yutzey &M. Sacks, unpublished data). Сердцебиения свыше 100,000 раз в день, перекачивают приблизительно 5 л. крови в минуту. В среднем в течение жизни происходит более трех биллионов сердцебиений или кардиальных циклов. Неспособность клапанов может быть результатом лежащей в основе предрасположенности генотипа и порока клапанов, которые меняют реакцию на физиологические нагрузки. При длительной оценке связанная с возрастом дегенерация (износ) и латентные болезни клапанов могут фактически оказаться связанными с легкими дефектами поддержания ткани клапанов, регулируемого онтогенетическими путями.
VALVE MALFORMATION AND DISEASE
Valve Disease Is a Public Health Problem
Болезни клапанов вызывают приблизительно 20,000 смертей ежегодно (65). Превалирование болезней аортальных клапанов составляет 2.5% в США, скорректированных по возрасту (66). Склероз аортальных клапанов, является маркером болезни клапанов и сердечно-сосудистого риска, он присутствует у более чем 25% пожилых людей (67). Действительные прямые затраты на лечение болезней клапанов составляют только в США биллион долларов в год (68). Влияние на здоровье населения болезней клапанов и груза на общество недооценено. Болезни клапанов могут проявляться как стеноз, обструкция тракта оттока или как обратный заброс крови, дефекты закрытия клапанов, ведущие к обратному току крови. Болезни клапанов стремятся к прогрессированию и в конечном итоге могут поставить под угрозу функцию желудочков. Стеноз аортальных клапанов наиболее частая форма болезни клапанов и классически проявляется как стенокардия, обмороки и сердечная недостаточность. Диагноз может быть поставлен клинически и подтвержден эхокардиографией, которая дает количественную оценку тяжести и со временем отражает прогрессирование болезни (62). Большинство болезней клапанов в любом возрасте имеет в основе порок клапанов, указывая на генетическую основу (8).
Врожденные пороки клапанов сердца встречаются приблизительно у 2% живорожденных и, как полагают, показатель существенно выше, поскольку во многих случаях остается субклиническим и поэтому не установленным. Два наиболее распространенных типа пороков клапанов являются bicuspid aortic valve (BAV), аортальный клапан с двумя скорее, чем с тремя карманами (cusps) и mitral valve prolapse (MVP), митральный клапан с чрезмерными или деформированными створками, которые выпадают в левое предсердие. Подсчитано, что BAV встречается более чем в 2%, а MVP более чем в 5% генеральной популяции (5). Кроме того, дефекты клапанов наблюдаются приблизительно в 30% случаев cardiovascular malformations (CVMs), включая сложные дефекты, при которых болезни клапанов являются одним из компонентов диагноза; напр., стеноз аортальных клапанов является частью синдрома гипоплазии левого сердца, а стеноз легочного ствола является частью тетрады Фалло (69). Имеются существенные доказательства, что врожденные пороки клапанов имеют генетическую основу и поэтому являются аномалиями развития (69). BAV и MVP являются широко распространенными находками у пациентов с генными мутациями, которые воздействуют на гомеостаз соединительной ткани (Table 2). Несиндромные семейные мутации в NOTCH1 были идентифицированы при BAV и болезни кальцификации аортальных клапанов (70). Исследования основанных на семейном родстве сцеплений идентифицировали локусы болезней на хромосомах 18q, 13q и 5q для BAV и на хромосомах 16p,
11p и 13q для MVP; однако не были идентифицированы гены (71-74). Важно, что эти исследования сцеплений представили существенную пропорцию случаев и , следовательно, скорее всего, служат причиной

Table 2 Human mutations in ECM genes associated with heart valve abnormalities
пороков и болезней. Анализ родословных согласуется со сложным наследованием и в контексте пониженной пенетрантности и варьирующей экспрессивности, пороки клапанов могут быть результатом множественных генотипов предрасположенности. Итак, пороки клапанов являются легкими и не нарушающими жизнеспособность генетическими дефектами, которые обычно проявляются как серьезная болезнь позднее в жизни.
Valve Malformation Underlies Valve Disease
Хотя болезнь клапанов распознается как важная причина, взывающая болезненность и смертность, вплоть до 1950s изолированная болезнь аортальных клапанов не была оценена по достоинству в контексте пороков клапанов. Поэтому возникла идея, что латентная болезнь имеет своим источником легкую аномалию развития (75, 76). Впоследствии крупномасштабные исследования показали, что во всех возрастах, включая пожилой возраст, причиной большинства болезней клапанов является порок клапанов (8, 77-80), указывая на то, что болезнь клапанов объясняется аномальными механизмами развития (81). В этом контесте болезнь клапанов может развиться как результат предрасполагающих генотипов в комбинации с неадекватным поддержанием ткани клапанов, которое со временем приводит к болезни клапанов. Помимо ассоциации между болезнью клапанов и более тяжелыми врожденными ВПС (CVMs), болезни клапанов могут быть также ассоциированы с др. благоприобретенными CVMs. Напр., приблизительно 20% пациентов с пороками аортальных клапанов также обнаруживают аортопатию (aortopathy), возникают фундаментальные вопросы как об этиологии, так и о терапии. Помимо аномалий аорты de Sa et al. (82) продемонстрировали, что пациенты с пороками аортальных клапанов имеют гистологические аномалии в артерии легочного ствола, подтверждать идею, что аномалии развития имеют множественные проявления, которые могут иметь клиническое значение. Когда окажется более ясным патогенез ассоциированных болезней, то возникнет и молекулярная таксономия для облегчения клинических вмешательств.
Valve Histopathology Identifies Two Basic Disease Processes
Гистопатология клапанов обнаруживает тенденцию подтверждать один из двух паттернов, myxomatous или фиброзные изменения. Слизистая дистрофия соединительной ткани (myxomatous degeneration) характеризуется накоплением протеогликана, деградацией коллагена и фрагментацией эластических волокон. Эти изменения приводят к свободно висящим клапанам, которые склонны к пролапсу и обратному забросу крови. Напротив, фиброз характеризуется накоплением коллагена, деградацией протеогликана и фрагментацией эластических волокон. Эти изменения приводят к жесткости клапанов, которые склонны к ограничению движений и стенозу. Стеноз аортальных клапанов обычно характеризуется склерозом (уплотнением) и прогрессивным фиброзом, далеко зашедшая болезнь характеризуется кальцификацией. Кальцификация обычно обнаруживается поздно. Этиология кальцификации плохо изучена; однако этот аспект болезни клапанов вызывает существенный интерес в качестве потенциального пути разработки новых терапевтических подходов. Одним из преимуществ изучения болезни клапанов у детей является то, что идентифицируемая гистопатология не затемняется распространенными сочетаемыми заболеваниями взрослых, а именно, болезнью коронарных артерий и гипертензией. Поскольку болезнь аортальных клапанов часто протекает на фоне болезни коронарных артерий, то существует значительный интерес к использованию примеров лечения болезни коронарных артерий на фоне болезни клапанов. Напр., лечение статинами гипотетически привлекательно и обнаружены ранние доказательства in vitro позитивного влияния. К сожалению, крупные клинические испытания продемонстрировали, что терапия статинами не влияет на прогрессирование болезни аортальных клапанов и не позволяет отказаться от замещения аортальных клапанов (83). Выяснение генетических и молекулярных основ пороков клапанов сможет открыть возможности для разработки новых терапевтических подходов.
На клеточном уровне болезнь клапанов сердца характеризуется активацией VIC, а также усилением ECM и экспрессии генов ремоделирующих энзимов (Figure 3) (24, 84, 85). VIC активация безусловно увеличивает клеточную пролиферацию и индукцию миофибробластных маркеров, таких как vimentin, MMP13, smooth muscle α-actin (SMA) и эмбриональную тяжелую цепь не мышечного миозина
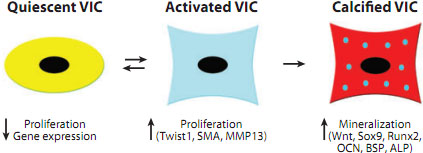 Figure 3
Valve interstitial cell (VIC) phenotype relates to maladaptive and pathological
signaling pathways. Quiescent VICs (left) show little proliferation or gene
expression, whereas activated VICs (middle) demonstrate increased
proliferation and increased myofibroblast-associated gene expression. VIC
activation may be adaptive or maladaptive, and patterns of signaling pathway
gene expression may distinguish these features. Some maladaptive VIC
activation and induction of genes associated with bone formation are apparent
in valve tissue calcification (right). Abbreviations used: ALP, alkaline
phosphatase; BSP, bone sialoprotein; MMP, matrix metalloprotease; OCN,
osteocalcin; SMA, smooth muscle α-actin.
Figure 3
Valve interstitial cell (VIC) phenotype relates to maladaptive and pathological
signaling pathways. Quiescent VICs (left) show little proliferation or gene
expression, whereas activated VICs (middle) demonstrate increased
proliferation and increased myofibroblast-associated gene expression. VIC
activation may be adaptive or maladaptive, and patterns of signaling pathway
gene expression may distinguish these features. Some maladaptive VIC
activation and induction of genes associated with bone formation are apparent
in valve tissue calcification (right). Abbreviations used: ALP, alkaline
phosphatase; BSP, bone sialoprotein; MMP, matrix metalloprotease; OCN,
osteocalcin; SMA, smooth muscle α-actin.
(SMemb) (84). Эти маркеры также экспрессируются в клетках предшественников клапанов, подтверждая идею, что активированные VICs в больных клапанах отражают онтогенетический фенотип. Это подтверждается наблюдением, что транскрипционный фактор Twist1, критический для мезенхимы эндокардиальных подушек, также экспрессируется в больных клапанах сердца человека (85a). Во время кальцификации аортальных клапанов человека экспрессия некоторых генов, ассоциированных с остеогенезом, включая
Sox9, Runx2, osteocalcin, osteopontin, alkaline phosphatase и
bone sialoprotein, индуцируется (86,87). Растут доказательства, что болезнь кальцифицированных клапанов воспроизводит характеристики ген-регуляторных взаимодействий остеогенеза.
Источники и индуктивные механизмы активированных VICs при болезни клапанов не идентифицированы. Имеются инициальные доказательства на базе первичных клеточных культур, что взаимодействие VICs с окружающим ECM вносит вклад в активацию VIC и индукцию остеогенных генов (88). Некоторые VICs динамичны и играют активную роль в поддержании ECM (85, 89). Активированные
VICs могут возникать из молчащих VICs, находящихся в створках клапанов. Альтернативно, незрелые предшественники клапанов возникают во время развития и могут оставаться во взрослых клапанах в качестве потенциальных эффекторов регенерации и репарации. Сообщения о производных гемопоэтических стволовых клеток в сердечных клапанах взрослых подтверждают присутствие популяции экзогенных стволовых клеток, которые привлекаются во время болезни клапанов (90, 91). Дальнейшие исследования необходимы, чтобы выявить регенеративный потенциал или патологические механизмы, ассоциированные с активацией VIC при болезни клапанов.
Genetic Syndromes and Animal Models of Valve Disease
Нормальная функция клапанов сердца зависит от биомеханических свойств стратифицированного ECM, а мутации в разнообразных ECM генах ассоциируют с болезнью клапанов сердца человека (Table 2). Некоторые генетические синдромы охарактеризованы относительно нарушений соединительной ткани. включая пороки клапанов и прогрессивную дисфункцию клапанов. Синдром Марфана вызывается мутациями в FIBRILLIN-1 (FBN1), характеризуется утолщением митрального и аортальных клапанов в дополнение к характерным аномалиям корня аорты и скелета (92). Сходным образом, синдром Williams ассоциирует с гетерозиготными мутациями ELASTIN (ELN), включая артериопатию, проявляющуюся как надклапанный аортальный стеноз, а также болезнь аортальных клапанов (93). Большинство фенотипических отклонений клапанов при генетических синдромах у человека воспроизводятся с помощью целенаправленного мутагенеза на животных моделях (Table 1). fbn-недостаточные мыши характеризуются MVP, сходным с таковым у человека (94). Сходным образом, eln-недостаточные мыши обнаруживают прогрессирующий порок аортальных клапанов и латентную болезнь аортальных клапанов, сходную с дегенеративной болезнью аортальных клапанов у человека (56-58). Интересно, что эти мыши имеют как болезнь клапанов, так и аортопатию с областью annulus, вовлекаемой в проявления болезни. Эти находки ставят фундаментальные вопросы относительно как происхождения, так и функциональной возможности аортальных клапанов и аортального корня.
Синдром Ehlers-Danlos вызывается разнообразными мутациями генов collagen и tenascin, которые затрагивают структуру и функцию соединительной ткани во многих органах, включая клапаны сердца (rev. 12). Сегодня нет мышиной модели для аномалий клапанов, связанных с синдромом Ehlers-Danlos, но мыши, лишенные коллагена 3a1 воспроизводят фенотип аортопатии (95). В будущем было бы интересно определить, имеют ли такие мыши также аномалии и дисфункции клапанов, ассоциированные с синдромом Ehlers-Danlos у человека. Мутации в COL1A1 , ассоциированные с болезнью костей человека osteogenesis imperfecta, могут вызывать в этой популяции пациентов пролапс аортального и митрального клапанов (96). Исследователи создали мышиную модель с целенаправленной Col1a1 oim мутацией и эти животные давали прогрессивно утолщающиеся SL клапаны с повышенным отложением протеогликана у взрослых (97; E. Wirrig, J. Cheek & K.E. Yutzey, unpublished). Болезнь клапанов человека, связанная с генными мутациями протеогликана, ещё не описана. Однако мыши, гетерозиготные по гену деградирующей версикан протеазе Adamts9 имеют утолщенные SL клапаны и хондрогенные узелки в области annulus (98). Мутации в дополнительных изолированных из ECM генов были ассоциированы с пороками аортального и митрального клапанов человека и болезнями с дерегуляцией в створках клапанов организации и отложения ECM, что является общим признаком болезней клапанов независимо от этиологии.
Растут доказательства, что нарушение ECM клапанов индуцирует сигнальные пути, которые ведут к неадекватному ремоделированию ECM и в конечном итоге к болезни клапанов. Фенотипы аортального и митрального клапанов при синдроме Марфана ассоциированы с усилением передачи сигналов TGF-β, это вносит вклад в общую дерегуляцию коллагенов и потерю целостности матрикса этих структур, наблюдаемые на животных моделях (94). Поразительно, ингибирование передачи сигналов TGF-β посредством воздействия losartan редуцирует патологию у мышиных моделей синдрома Марфана и у людей его эффективность также была продемонстрирована (99, 100). Сходным образом у взрослых мышей, с гетерозиготной потерей elastin или гомозиготной потерей periostin, затрагивается передача сигналов TGF-β, ассоциированная с дегенерацией и дисфункцией аортальных клапанов (Table 1) (58, 59). Передача сигналов Notch и Wnt также изменяется у животных моделей болезни аортальных клапанов, а также у пациентов, но механизмы индукции ещё не определены (70, 101). Сигнальные пути
TGF-β, Notch и Wnt необходимы для нормального развития клапанов во время эмбриогенеза и растут доказательства того, что эти пути в ассоциации с дисфункцией ECM, вносят вклад в патогенез прогрессирующих клапанов, приводящий к разнообразным болезненным фенотипам позднее в жизни.
Valve Disease Treatment
Лечение болезней клапанов остается в основном хирургическим. Любой из 4-х клапанов сердца может быть затронут; однако аортальные клапаны наиболее частое место болезни (7). Показания к замещению клапанов включают клинические симптомы, вентрикулярную дисфункцию или неспособность к нагрузкам у пациентов с отсутствием симптомов. Замещение аортальных клапанов является второй по распространенности кардио-торакальной процедурой и потребность в повторном вмешательстве обычна. Почти 100,000 процедур по замещению клапанов осуществляется ежегодно в США и большинство из них это замещение аортального клапана (6). Замещение клапана на биопротез становится чрезвычайно популярным, но продолжает страдать от проблем долговечности. Имеются захватывающие успехи в принудительной катеризации сердца, включая подкожное введение клапанов легочного ствола (102). В январе 2010 Food and Drug Administration одобрила этот подход в рамках программы Humanitarian Device Exemption (http://www.fda.gov/NewsEvents/ucm198597.htm). Этот подход снижает нужду в хирургии на открытом сердце и может также оказаться привлекательной альтернативой в случаях высокого риска. Кроме того, находится в разработке метод имплантации посредством катетра аортальных клапанов с использованием или ретроградного подхода через бедренную артерию или трансапикального антероградного подхода пока в Европе на людях и кажется многообещающим (103). Т.к. осуществимость установлена, то д. быть организованы клинические испытания.
Чтобы улучшить уход за пациентами с болезнью клапанов, необходимо идентифицировать маркеры будущей болезни и прогрессирования болезни. Ранняя идентификация болезни сможет позволить раннее вмешательство и в принципе использовать превентивные подходы к болезни клапанов. Современное медицинское лечение болезни клапанов лечит симптомы сердечно-сосудистой болезни. Напр., некоторые медикаменты направлены на важные симптомы, которые возникают в результате застойной сердечной недостаточности, но не влияют на лежащую в основе причину или первичную проблему болезни клапанов. Т.к. генетические и онтогенетические основы пороков и болезней клапанов выясняются, то будут возникать возможности нового медицинского лечения и будут в принципе предотвращать или задерживать нужду в хирургическом вмешательстве. Определение регуляции поддержания и гомеостаза ткани клапанов позволит создать удивительные возможности для клеточной и молекулярной терапии болезней клапанов.
CONCLUSIONS
The mature valve structure, consisting of highly organized ECM and dynamic VICs, maintains valve function. Together, the stratified ECM and VIC homeostatic mechanisms underlie valve structure and function and coordinate maintenance of valve tissue throughout a lifetime. Heart valve disease is characterized by dysregulation of ECM organization and VIC activation with induction of regulatory pathways active in valve development. Valve disease pathogenesis is being elucidated through study of animal models, and a better understanding of these mechanisms will allow for the development
of novel therapeutics.
SUMMARY POINTS
1. Valve structure is dynamic and composed of interacting cells and stratified extracellular
matrix (ECM).
2. Valve malformation underlies valve disease, suggesting a developmental origin.
3. Valve disease is a common problem that often requires surgery.
4. Valve disease has a genetic basis characterized by aberrant developmental programs and maladaptive ECM remodeling.
5. Developmental pathways modulate valve tissue maintenance.
6. Translational efforts combining basic and clinical research may identify ways to manipulate faulty valve tissue maintenance.
FUTURE ISSUES
1. Links between cell plasticity and disease processes should be identified.
2. Researchers need to determine whether a subset of VICs can regenerate, and if so repair mechanisms need to be defined.
3. Novel pharmacological therapeutics using developmental pathways to elucidate valve
disease pathogenesis should be identified.
4. Durable valve bioprostheses using a combination of clinical, molecular, and engineering approaches should be developed.
5. Markers of disease to allow early intervention or preventive strategies need identification.
Сайт создан в системе
uCoz 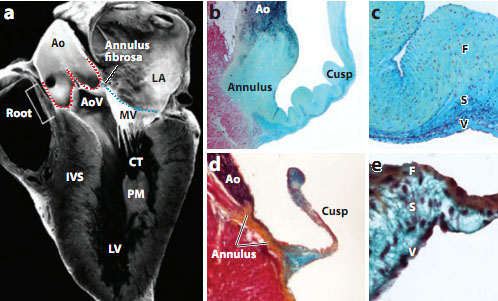 Figure 1
Figure 1  Figure 2
Figure 2  a Abbreviations used: E, embryonic day; OFT, outfiow tract; P, postnatal day.
a Abbreviations used: E, embryonic day; OFT, outfiow tract; P, postnatal day. 
 Figure 3
Valve interstitial cell (VIC) phenotype relates to maladaptive and pathological
signaling pathways. Quiescent VICs (left) show little proliferation or gene
expression, whereas activated VICs (middle) demonstrate increased
proliferation and increased myofibroblast-associated gene expression. VIC
activation may be adaptive or maladaptive, and patterns of signaling pathway
gene expression may distinguish these features. Some maladaptive VIC
activation and induction of genes associated with bone formation are apparent
in valve tissue calcification (right). Abbreviations used: ALP, alkaline
phosphatase; BSP, bone sialoprotein; MMP, matrix metalloprotease; OCN,
osteocalcin; SMA, smooth muscle α-actin.
Figure 3
Valve interstitial cell (VIC) phenotype relates to maladaptive and pathological
signaling pathways. Quiescent VICs (left) show little proliferation or gene
expression, whereas activated VICs (middle) demonstrate increased
proliferation and increased myofibroblast-associated gene expression. VIC
activation may be adaptive or maladaptive, and patterns of signaling pathway
gene expression may distinguish these features. Some maladaptive VIC
activation and induction of genes associated with bone formation are apparent
in valve tissue calcification (right). Abbreviations used: ALP, alkaline
phosphatase; BSP, bone sialoprotein; MMP, matrix metalloprotease; OCN,
osteocalcin; SMA, smooth muscle α-actin.