Интересно, что наша система дифференцировки hEB, по-видимому, воссоздает гематопоэтические события
, которые обычно происходят во время первой недели эмбрионального развития человека и которые, скорее всего, инициируются детерминацией мезодермы в YS гемангиобласты (Fig. 1). У эмбрионов кур, гемангиобласты впервые появляются в заднем регионе первичной полоски (Huber et al., 2004), а при
дифференцировке mEB обычно рассматриваются как экспериментальный заменитель этих пост-имплантационных онтогенетических событий. Сходным образом онтогенетическая кинетика наших происходящих из hEB mesodermal hemato-endothelial (MHE) кластеров и ACE
BL-CFC отражает появление гемангиобластов, которые, по-видимому, возникают после образования первичной полоски у человека на 12-13 день с удивительно подходящим временным графиком (FIGURE 1D, E). Сходным образом, генерация нормальных YS кровяных островков на 14-16 день беременности воспроизводится с помощью происходящей из hEB волны примитивного гематопоэза, сопровождаемой дефинитивной волной эритромиэлопоэза, которая обычно возникает на 18-20 день беременности (перед началом плодного кровообращения на 21 день). Эти результаты указывают на то, что наша базирующаяся на hEB система дифференцировки служит в качестве модели
The renin-angiotensin system may dictate embryonic hemangioblast lineage differentiation
Открытие, что angiotensin converting enzyme (ACE/ CD143) маркирует примитивные эмбриональные гемангиобласты, открывает возможность, что разносторонняя renin-angiotensin система играет критическую роль в регуляции самых ранних стадий гемато-эндотелиальной дифференцировки у человека, также как и у эмбрионов птиц (Savary et al. , 2005). У взрослых, renin-angiotensin ось регулирует кровяное давление и баланс воды посредством гормональной секреции пептида angiotensin II (Ang II) . Ang II является протеолитическим продуктом серии ферментативных процессов, которые начинаются с расщепления angiotensinogen с помощью renin, чтобы предоставить каталитический субстрат для ACE, angiotensin I (Ang I), который в конечном счете превращается в Ang II (Paul et al., 2006). Renin-angiotensin сигнальная система затем обеспечивается с помощью angiotensin II type 1 и 2 receptors (AGTR1/AGTR2), которые локально экспрессируются во всех важных сайтах возникновения ангио-гематопоэза, включая YS, печень, почки, эмбриональную аорту и retinal/choroid регионы (Schutz et al. , 1996). Отметим, поскольку AGTR1 экспрессируется постоянно от развития до взрослого, где он функционирует как ключевой регулятор
сердечно-сосудистой системы посредством купированных с G-protein взаимодействий. AGTR2 редко экспрессируется во взрослых тканях (Grady et al., 1991; Akishita et al., 1999), указывая тем самым на ключевую роль во время раннего развития (Zambidis et al., 2008), мы продемонстрировали драматическую активацию AGTR2 во время экспансии производных EB ACE+ гемангиобластов, это указывает на уникальную роль renin-angiotensin оси в управлении инициальной онтогенетической фазой ангио-гематопоэза у человека (Hubert et al., 2006; Heffelfinger, 2007). В самом деле, мы установили, что hEB-производные BL-CFC могут управляться, чтобы осуществлять дифференцировку или в гематопоэтическое или эндотелиальное потомство за счет манипулирования с сигнальными путями, обычно обеспечиваемыми с помощью renin-angiotensin оси. Во-первых, ферментативная активность ACE необходима для экспансии hEB-производных гемангиобластов, поскольку специфический ингибитор ACE, Captopril, драматически блокирует формирование BL-CFC, подтверждая тем самым потребность в синтезе Ang II пептида, и/или в нижестоящей передаче сигналов AGTR. Более того, манипуляции с передачей сигналов angiotensin II с помощью AGTR1- или AGTR2-специфических ингибиторов вызывают выраженные отклонения в дифференцировке hEB в направлении или эндотелия или мультипотентных гематопоэтических предшественников. Напр., специфическая блокада передачи сигналов AGTR1 с помощью Losartan достоверно усиливает формирование hEB-производных гематопоэтических colonyforming cells (CFC), особенно продукцию мультипотентных смешанных CFC. Чтобы определить, могут ли ингибиторы AGTR действовать или непосредственно на экспансию гемангиобластов или или за счет опосредованной амплификации более детерминированных предшественников, мы включали эти блокаторы в клоногенный BL-CFC метод. Во-вторых, повторный посев AGTR1 ингибированных (Losartan) бластных колоний продуцирует преимущественно гематопоэтические клоны клеток с ограниченной эндотелиальной дифференцировкой. Напротив, повторный посев бластных колоний, обработанных AGTR2-специфическим ингибитором (PD123-319) вызывает образование преимущественно эндотелиального потомства с ограниченной гематопоэтической дифференцировкой. Т.о., функция AGTR2 необходима для экспансии колоний гемангиобластов в мультипотентные гематопоэтические предшественники, а его ингибирование с помощью PD123-319 полностью устраняет гематопоэтическую дифференцировку, поскольку приобретается почти исключительно эндотелиальная судьба гемангиобластными колониями.
Поскольку передача сигналов AGTR2, как известно, непосредственно противодействует передаче сигналов AGTR1 (Hubert et al., 2006), то наши данные приложимы к общему механизму, с помощью которого возникающие гемангиобласты в YS или AGM могут быть нацелены на дифференцировку с помощью ниши гематопоэтических стволовых клеток. Одна из гипотез утверждает, что антагонистическая конкуренция между AGTR2 и AGTR1 за связывание Ang II на возникающих гемангиобластах управляет из развитием или в сторону гематопоэтических предшественников или в сторону сосудисто-эндотелиальных сетей. Наконец, эти исследования указывает на то, что манипуляции с передачей сигналов AGTR2 могут быть важной стратегией для экспансии мультипотентных гематопоэтических предшественников из примитивных HSC. Мы полагаем, что пролиферация AGTR1/ AGTR2-регулируемых стволовых клеток может быть общим феноменом, поскольку ингибирование AGTR1 с помощью Losartan, как было установлено, усиливает регенерацию скелетных мышц у пациентов с первичной мышечной дистрофией (Cohn et al., 2007), а renin-angiotensin ось критически влияет на нормальное развитие плодов, т.к. блокаторы как ACE, так и AGTR1 рецепторов являются тератогенами. Передача сигналов GTR2, в частности, как известно, регулирует, клеточный рост и апоптоз во время развития сосудов и нервов (Grammatopoulos et al., 2005; Savary et al., 2005). Интересно, что мутации AGTR2 были описаны у пациентов с тяжелой умственной отсталостью и аутизмом (Vervoort et al., 2002), это подтверждает роль renin-angiotensin системы в управлении собственно развития нервной системы.
Generation of engraftable definitive adult-type HSC may require developmental maturation of mesodermal precursors in specific mesenchymal stromal niches
Хотя мы первоначально продемонстрировали, что hESC, подобно mESC, прежде всего моделируют онтогенетические ступени, связанные с примитивным YS внеэмбриональным гематопоэзом, но всё ещё неясно, может ли дифференцировка hESC моделировать дефинитивный , AGM-подобный лимфо-гематопоэз, который обычно возникает из внутриэмбрионального AGM. EB или базирующиеся на строме протоколы дифференцировки описывают т.о. что и mESC и hESC-производные гематопоэтические предшественники обладают YS молекулярным и клеточным фенотипом с ограниченным потенциалом долговременного приживления у взрослых реципиентов (Potocnik et al., 1997; Matsuoka et al., 2001; Miyagi et al., 2002), это характерный признак только для AGM-производных HSC. Поскольку YS предшественники могут быть подготовлены к приживлению, то дефинитивные HSC после ко-культивирования в соотв. стромальных нишах (Matsuoka et al., 2001), становятся гематопоэтическими предшественниками, которые могут быть наследственно дефицитными по определенной HSC инструктивной программе, которая может обеспечиваться только in vivo мезенхимным AGM, печенью плода или нишей костного мозга. Недавно мы продемонстрировали, что hESC-производные CD34 клетки детерминируются в культуре в предшественники гемато-эпителиальных клеток и могут в дальнейшем развиваться в зрелую кровь и в сосудистые клетки после трансплантации в желточный мешок эмбрионов кур (Park et al., 2009). Эти наблюдения не только демонстрируют пригодность эмбрионов птиц в качестве удобного и надежного хозяина для моделирование ангиопоэтического развития из hESC, но они также подчеркивают важность оценки, как in vivo ниши помогают созревать примитивным предшественникам при гематопоэзе у взрослых.
Обширные экспериментальные доказательства указывают на то, что мезенхимные стромальные ниши что являются регуляторами нативных взрослых ниш HSC. Чувствительные к bone morphogenetic protein (BMP) mesenchymal stromal cells (MSC), напр., обнаруживаются в гематопоэтических сайтах во время онтогенеза и являются ключевыми компонентами HSC поддерживающих микро-средовых ниш путем активации или дифференцировки в поддерживающие клетки ( напр., osteoblasts). Остеобласты, в свою очередь, экспрессируют Notch лиганды ( напр. Jagged1) и могут увеличивать количества HSC благодаря передаче нишей обеспечиваемых Notch сигналов (Noort et al., 2002; Angelopoulou et al., 2003; Arai et al., 2004; Bensidhoum et al., 2004; Sammons et al., 2004; Koch et al., 2005; Martin and Bhatia, 2005; Mendes et al., 2005; Adams et al., 2006; Francois et al., 2006; Friedman et al., 2006; Muguruma et al., 2006; Suzuki et al., 2006). Передача сигналов Notch может быть критической для детерминации созревания и экспансии дефинитивных HSC и обеспечивает выбор множественных ключевых клеточных судеб посредством латеральной ингибиции механизма выбора клеточных судеб или индуктивной передачи сигналов . NOTCH1 и NOTCH2 экспрессируются во взрослых CD34+ HSC человека, а их лиганд JAGGED1 экспрессируется на остеобластах костного мозга, указывая тем самым на прямое вовлечение в регуляцию HSC с помощью микросреды стромы (Calvi et al., 2003; Zhang et al., 2003; Taichman, 2005; Wilson and Trumpp, 2006). Хотя путь Notch играет главную роль в принятии решения стать лимфопоэтическим клоном, его роль в генезе и поддержании HSCs только начинает проявляться. Эмбрионально нокаутированные Notch1-/- мыши имеют тяжело нарушенный гематопоэз (Kumano et al., 2003), обусловленный неспособностью гемангиобластов в области AGM дифференцироваться в дефинитивные + HSC. Напротив, базирующиеся на mEB исследования показали, что Notch фенотип не влияет на гематопоэз в YS, тогда как AGM-типа дефинитивная генерация HSC пресекается (Hadland et al., 2004; Robert-Moreno et al., 2005), и, скорее всего, зависит от Notch-Runx1 взаимодействия.
В самом деле, передача сигналов Notch-Runx1 может быть центральной для инициального исполнительного принимающего решения процесса, который генерирует дефинитивные мышиные HSC в эмбриональном AGM источнике. Имеются многочисленные доказательства, что Runx1 является ключевым регулятором возникновения дефинитивных HSC в AGM, еоторый обязателен для образования долговременных приживающихся CD45+ c-kit+ HSC (North et al., 1999; North et al., 2002). Runx1 соединяется с ДНК как гетеродимер с CBFβ и ни Runx1-/-, ни CBFβ-/- мутантные эмбрионы не могут давать дефинитивные HSCs (Okuda et al., 1996; Wang et al., 1996). Напротив, целенаправленная делеция Runx1 у взрослых мышей ведет к гематопоэтическим аномалиям, но к сохранению HSC (North et al., 1999; Nakagawa et al., 2006). Поскольку др. факторы, связанные с возникновением гематопоэза, такие как bHLH фактор SCL (Robb et al., 1995; Shivdasani et al., 1995), играют критические роли как в примитивном, так и дефинитивном гематопоэзе, то только Runx1 является уникальным, необходимым для возникновения дефинитивных, приживающихся на долгий срок HSCs. У эмбрионов человека, контроль NOTCH-RUNX1 оси может просто обеспечиваться регуляцией экспрессии белков Notch per se. NOTCH- 1, 2, 4 и лиганды DELTA1-4 и JAGGED1, напр., не экспрессируются в YS сайтах человека, но экспрессия появляется позже в печени плода, куда сначала проникают плодные дефинитивные HSCs (Dando et al., 2005).
Многие линии доказательств сегодня поддерживают концепцию, что примитивные гематопоэтические предшественники, такие как те, что получены из ESC, могут развиваться во взрослый дефинитивный фенотип при соотв. контакте со стромой. Напр., ко-культивирование hESC на первичных стромальных клетках, полученных от мышиных линий стромальных клеток из E10.5 AGM или E12.5 плодной печени существенно увеличивает активность дефинитивных CFC (Krassowska et al., 2006; Ledran et al., 2008). AGM линии стромальных клеток, в частности усиливают дифференцировку гематопоэтической мезодермы с последующим усилением образования клеток гематопоэтических предшественников. Непосредственный межклеточный контакт и передача паракринных сигналов со стромой необходимы для созревания hESC в дефинитивные гематопоэтические клеточные линии, поскольку кондиционированная среда и внеклеточный матрикс от этих стромальных клеточных линий устраняют или существенно снижают активность дефинитивных CFC. Эти результаты подтверждают роль TGFβ1 b TGFβ3 в индукции дефинитивного гематопоэза. Тем не менее доказательства генерации настоящих взрослых AGM-типа дефинитивных HSC ещё не были продемонстрированы убедительно (Tian et al. , 2006; Ledran et al., 2008). Подобно предыдущим сообщениям (Wang et al., 2005a), эритропоэз, генерируемый из трансплантированных клеток в этих последних исследованиях, всё ещё остается на эмбриональной/плодной стадии. Более того, первичные трансплантации иммунодефицитными реципиентам мышам вызывали низкий, кратковременный (менее 3 мес.), ограниченный лимфопоэз и обнаруживали в последующем низкие частоты приживления. Эти характеристики слабого приживления лимфо-гематопоэза согласуются с производными hESC предшественниками, обладающими эмбриональным YS, а не взрослого типа дефинитивным фенотипом.
Др. исследование с использованием преиммунных реципиентов плодов овец из hEB происходящих CD34+ CD38- Lin38- клеток продемонстрировало низкие уровни потенциала приживления для человеческих гематопоэтических клеток продолжительных первичных и вторичных трансплантатов (0.05%-0.2%; оценка спустя 10-39 мес. после инъекций) (Narayan et al., 2006). Т.к. костный мозг этих плодов реципиентов не был conditioned ( напр., с помощью облучения или busulfan) перед трансплантацией клеток, то неясно является ли наблюдаемая низкая частота приживлений достаточной для обеспечения экспансии или гарантии их постнатального выживания. Для выяснение роли мезенхимных стромальных ниш в генерации дефинитивных HSC, наша группа начала сходные эксперименты, описанные выше. Мы совместно культивировали FACS-очищенные ACE+ CD34+-производные гемангиобластов из дифференцированных 910 hEB на строме их E12.5-E14.5 печени плода мыши (FL) (Fig. 3 BD) или человеческих MSC (hMSC), и добавляли к этим культурам человеческие гематопоэтические факторы. В этих условиях очищенные YS-подобные ACE+ CD34+ гемангиобласты дифференцировались в булыжник-подобные CD34+ CD45+ CD38- клетки, которые продуцировали многочисленные дефинитивного типа CFU (GM-CFC, G-CFC, M-CFC, GEMM-CFC, BFU-e, CFU-e) в methylcellulose assays. Эти гематопоэтические колонии были неотличимы от контрольных колоний CD34+ из крови пупочного канатика (Fig. 3 B,C). hEB-производные эритроидные CFU-e, напр., были неотличимы от CB CFU-e как в отношении морфологии, так и паттернов экспрессии взрослого гемоглобина с низким внутрицитоплазматическим эмбриональным глобином (epsilon) и высокими количествами экспрессии неонатального/взрослого gamma и beta глобина в сравнении с происходящими из hEB CFU-e, которые сохраняли экспрессию эмбриональных глобинов (Fig. 3C). Значительно важнее, что эти дифференцирующиеся на строме hEB клетки оказывались способными только в течение короткого времени (evaluated at 12 weeks), приживляться в виде многоклональных лимфо-эритромиэлоидных трансплантатов после инъекции в печень новорожденных высоко иммунодефицитных, облученных NOD/SCID/IL2Rg нулевых (NOG) мышей (Fig. 3C). Эти пилотные эксперименты строго подтвердили, что собственно микроусловия гематопоэза (напр., как показано с помощью hMSC, остеобластных или FL-типа стромальных), могут, в самом деле, давать паттерн YS-подобных hEB предшественников , по крайней мере, в течение короткого времени (12 weeks) способных к трансплантациям, взрослого типа предшественников.
Итак, хотя неясно пока, но генерация
in vitroспособных к трансплантации дефинитивных HSC может нуждаться в воссоздании их
in vivo среды ниш для стволовых клеток. Как проиллюстрировано выше, необходимо лучше понять имеющие к делу отношение ростовые факторы и сигнальные молекулы, которые активируют специфические для дефинитивных HSC гены из примитивных предшественников. Эксперименты, которые выясняют критические компоненты ниш для дефинитивных HSC д., по-видимому, базироваться на дополнительных методах для усиления приживления этих
ex vivo-генерированных HSC после трансплантации и приживления в conditioned реципиентах.
The role of homeobox (HOX)-regulating factors (CDX, MLL) in determining definitive HSC genesis and selfrenewal
Хотя множественные факторы, такие как BMP4, activin A, VEGF, FGF2, Hedgehog, TPO и Wnt, участвуют в регенерации и нижестоящем самообновлении HSC из мезодермы (Johansson and Wiles, 1995; Bhatia et al., 1999; Faloon et al., 2000; Baron, 2001; Dyer et al., 2001; Lako et al., 2001; Li et al., 2001a; Adelman et al., 2002; Byrd et al., 2002; Murdoch et al., 2002; Perlingeiro et al., 2003; Reya et al., 2003; Willert et al., 2003), вышестоящее молекулярное переключение в формировании паттерна гематопоэтической мезодермы в HSC всё ещё остается неясным, однако это важно для понимания тоо, как дифференцируются hESC в направлении взрослого типа дефинитивных HSC . Множественные исследования показали, что регулируемые контрольные HOX гены может быть эффекторами этого вышестоящего переключения на генез дефинитивных HSC. Т.о., помимо формирования паттерна hESC-производных клеток в дефинитивные HSC путем рекапитулирования ниш гематопоэтических стволовых клеток, манипуляции с экспрессией HOX генов могут также выполнять роль по генерации способных к долговременному приживлению трансплантируемых HSC из плюрипотентных стволовых клеток.
HOX белки являются высоко консервативной группой транскрипционных факторов, характеризующихся в 60-аминокислот ДНК-связывающим мотивом, называемым гомеодоменом. HOX гены организованы в 4 основных геномных кластера (A, B, C, D) и выполняют критические роли в эмбриональном органогенезе. Кластеры A-C экспрессируются на высоких уровнях в нормальных HSC и широко участвуют в самообновлении и регуляции HSC. Так, HOXB4 используется благодаря его способности увеличивать способные к трансплантациям HSC человека (Antonchuk et al., 2002). Кроме того, множественные HOX участвуют в качестве партнеров leukemic транслокации или оказываются разрегулированными при лейкемиях с нормальным кариотипом (Antonchuk et al., 2002; Owens and Hawley, 2002; Grier et al., 2005), это ещё больше подчеркивает их роль в самообновлении HSC.
Исследования потери функции показали, что большинство HOX генов обладают перекрывающимися функциями, тогда как генетическое нарушение вышестоящих HOX-регуляторов, таких как MEIS1, PBX1, MLL и CDX гены, приводят к тяжелым гематопоэтическим фенотипам (Yu et al., 1995; Antonchuk et al., 2002; Owens and Hawley, 2002; Davidson et al., 2003; Krosl et al., 2003; Abramovich and Humphries, 2005; Davidson and Zon, 2006), указывая тем самым, что эти гены непосредственно регулируют генез или экспансию HSC. HOX регуляция осуществляется с помощью высоко консервативного семейства генов CAUDAL (CDX1, CDX2 и CDX4) (Chawengsaksophak et al., 2004; Shimizu et al., 2006). CDX гены кодируют семейство гомеодоменовых транскрипционных факторов, которые регулируют формирование передне-заднего эмбрионального паттерна благодаря регуляции специфической экспрессии HOX генов во время эктодермального и мезодермального развития (Epstein et al., 1997; Charite et al., 1998; Reece-Hoyes et al., 2005). Нормальный паттерн эмбриональной экспрессии cdx4, напр., по-видимому, тонко регулируется в развитии у Xenopus (Reece-Hoyes et al., 2005), рыбок данио (Rawat et al., 2004) и мышей (Gamer and Wright, 1993; Horn and Ashworth, 1995; Epstein et al., 1997; Charite et al. , 1998; Rawat et al., 2004). Cdx4 впервые обнаруживается в задней части эмбриона во время гаструляции и сомитогенеза и домены его экспрессии в латеральной пластинке мезодермы включают ткани, инициирующие гематопоэз, из клеток аллантоиса и стенки раннего YS (которые также ко-экспрессируют scl).
Функция Cdx2 и cdx4 скорее всего перекрывается, она является критической для формирования паттерна мезодермы в примитивный гематопоэтический клон. У рыбок данио kugelig cdx4-мутанты (Davidson et al., 2003), показывают, что cdx4 делает заднюю часть мезодермы компетентной для последующей гематопоэтической детерминации (возможно на стадии гемангиобластов) путем активации Hox генов мишеней HoxA6, HoxB3, HoxB4, HoxB8 и HoxC6. Кроме того, cdx1a и cdx4 (перекрываясь) регулируют генез нижестоящих runx1a+ дефинитивных HSC, происходящих из региона AGM (Davidson and Zon, 2006), демонстрируя тем самым роль генов cdx как в примитивном, так и дефинитивном гематопоэзе. Эти исследования на рыбках данио выявили новую ось cdx-hox у позвоночных, которая может действовать как давно желанный инструктивный сигнал для генеза HSC из гемангиобластов. В самом деле, группа Daleys подкрепила эту гипотезу, создав способные к трансплантации, многоклональные HSC посредством вирусной ко-экспрессии Cdx4 и Hoxb4 в mEB прародителях (Wang et al., 2005). Напротив, дерегуляция экспрессии Cdx генов приводит к различным озлокачествлениям (Chawengsaksophak et al., 1997; Rawat et al., 2004). Так, избыточная экспрессия Cdx2/Cdx4 вызывает лейкемию или сама по себе (Bansal et al. , 2006), или с партнерами по слиянию (Rawat et al., 2004), или более мощно при совместной ко-экспрессии с HOX кофакторами (Bansal et al., 2006). Хотя наша группа описала экспрессию CDX4 в примитивных hEB-производных гематопоэтических предшественниках (Zambidis et al., 2005), функция CDX у человека остается технически трудной для изучения, поскольку экспрессия CDX ограничена эмбриональным развитием. Недавно описана избыточная экспрессия CDX4 у людей с острой лейкемией при нормальном кариотипе или при t(9;11) MLL fusions (Bansal et al., 2006). Прото-онкоген mixed lineage leukemia (MLL) является хорошо охарактеризованным HOX-регулятором скорее, чем CDX. MLL, связанный с histone methyltransferase при повторяющихся (11q23) транслокациях, обнаруживается ~80% детских и 10% взрослых лейкемий (Tkachuk et al., 1992; Corral et al., 1993; Yu et al., 1998; Hess, 2004; Eguchi et al., 2005). Эти агрессивные лейкемии часто имеют бифенотипические миэлоид-лимфоидные маркеры и имеют плохой прогноз (Poirel et al., 1996; Pui et al., 2002). N-терминальная часть протоонкогена MLL, как известно, слита in-frame с более чем 40 известными (кажущимися несопоставимыми), вызывающими лейкемию, fusion партнёрами, все они имеют тщательно изученный общий патологический мотив: аберрантная активация HOX генов посредством прямой активации транскрипции (Joh et al., 1996; Dobson et al., 1999; Joh et al., 1999; Ayton and Cleary, 2003; Cozzio et al., 2003; Ferrando et al., 2003; Forster et al., 2003; Johnson et al., 2003; Martin et al., 2003; Rozovskaia et al., 2003; Zeisig et al., 2004; Milne et al., 2005a; Milne et al., 2005b; Chen et al., 2006; Kong et al., 2006; Krivtsov et al., 2006; Meyer et al., 2006; Somervaille and Cleary, 2006). Нормальный дикого типа ген MLL кодирует Trithorax-группы регулятор хроматина, существенный для Hox-обусловленной спецификации тела (Yu et al., 1995), он также специфически необходим для генеза дефинитивных лимфо-гематопоэтических стволовых клеток (Fidanza et al., 1996; Hess et al., 1997). Mll мышиные эмбрионы и mEB выявили критическую роль Mll в развитии дефинитивных HSC в AGM (Ernst et al., 2004a; Ernst et al., 2004b). Хотя развитие примитивных гемангиобластов, по-видимому, интактно в дифференцирующихся Mll-/- mEB, нижестоящие дефинитивного типа предшественники из mEB или AGM регионов дефицитны и это коррелирует с недостаточностью активации Hox генов. Способные к трансплантации AGM-производные HSC, напр., не могут продуцироаться в Mll мышиных эмбрионах, хотя эктопическая экспрессия Cdx4 в Mll mEB частично устраняет их неспособность к гематопоэзу, указывая тем самым на участие потенциала Cdx-Mll-Hox оси. Лучшее понимание CDX4-MLL-HOX оси у человека может выявить эффективные стратегии для увеличения выхода дефинитивных HSC из примитивных, происходящих из hEB предшественников.
Манипуляции с экспрессией HOX генов для получения способных к трансплантации, происходящих из hESC гематопоэтических предшественников уже были описаны, но имели ограниченный успех по сравнению с системой ESC мышей. Генерация приживающихся на длительное время гематопоэтических клеток из мышиных ESC клеток с использованием эктопической экспрессии
Hoxb4/Cdx4 (Kyba et al., 2002; Wang et al., 2005a), напр., открывает возможность, что сходные исследования могут привести к получению дефинитивных HSC из hESC (Wang et al., 2005b). Пока HOXB4 вектором-трансдуцированные hEB-производные предшественники генерировали ~2.5 кратное увеличение экспансии гематопоэтических клеток, которое не приводило к созреванию hESC-производных гематопоэтических клеток в способные к длительному приживлению после трансплантации HSC , как это происходит у мышей. Это расхождение между mESC и hESC системами остается неразрешенным, хотя остается возможность, что др. HOX-регулирующие факторы, такие как MLL или CDX окажутся более мощными, чем HOXB4 для созревания hESC-производных клеток в дефинитивные HSC. Более того, имеются, по-видимому, и многие др. ещё не открытые связанные с HOX факторы, которые могут играть важные роли в формировании паттерна дефинитивных HSC из примитивных гемангиобластов, хотя поиск этих факторов д.быть умеренным из-за сопутствующей онкогенности, которую неизбежно вызывает экспрессия эктопических HOX факторов. Фактически, анализ экспрессии др. генов, важных для физиологии, поведения, самообновления и поддержания HSC
in vivo уже выявил основные различия между происходящими из hESC и взрослыми гематопоэтическими предшественниками. hESC-производные гематопоэтические предшественники, напр., экспрессируют высокие уровни белков клеточного цикла и снижают уровни экспрессии генов, важных для самообновления стволовых клеток. Напротив, взрослые соматические HSC обнаруживают активацию множественных генов, участвующих в восстановлении молчания HSC, таких как cyclin G2, p53 binding protein, p21 и p57 (Wang et al., 2005b).
Definitive, long-term engraftable HSC may arise from distinct mesodermal precursors of a different origin than the YS hemangioblast
Хотя первоначально было предположено, что одна и та же популяция HSC, обнаруживаемая в эмбриональном YS, также доставляется плодам и взрослым (Weissman et al., 1978), на сегодня общепринято, что большинство взрослого типа, формирующих кровь стволовых клеток возникает независимо из ассоциированных с эндотелием кластеров клеток, расположенных в вентральном аспекте дорсальной аорты и vitelline артерии в AGM ( напр., между днями 27-40 развития человека; (Tavian et al., 1999a)). Эти CD34+ CD31+ CD45+ CD38- прилипшие к эндотелию клетки дают долговременные гематопоэтические, миэлоидные и лимфоидные клетки, тогда как их аналоги в YS продуцируют только эритро-миэлоидные клоны (Tavian et al., 1996; Tavian et al., 1999b; Tavian et al., 2001).
Несмотря на это онтогенетические источники HSC, которые возникают из AGM, сегодня остаются неуловимыми. Большинство YS гематопоэтических предшественников скорее всего выживают достаточно долго, чтобы поддержать органогенез в быстро развивающихся эмбрионах. Напротив, HSC генерируемые в дне аорты ( напр., гемогенным эндотелием), или из мезенхимных клеток внутри субаортальных участков или вообще непосредственно из происходящих из не-мезенхимной латеральной пластинки мезодермы гемангиобластных предшественников (Fig. 1A), скорее всего, являются долговременным источником взрослого гематопоэза (Jaffredo et al., 2005). Хотя мышиные, происходящие из AGM предшественники обнаруживают свойства долговременного приживания после трансплантации и воспроизведения всей кровеносной системы взрослых, будучи инъецированными в костный мозг летально облученных взрослых мышей (Medvinsky and Dzierzak, 1996; Cumano et al., 2001), нельзя исключить, что примитивные гемангиобласты (происходящие из внеэмбриональной мезодермы и которые диктуют эфемерный YS гематопоэз) могут также вность до некоторой степени вклад в популяцию дефинитивных HSC, обнаруживаемую у взрослых. Некоторые исследования подтвердили возможность того, что кровь-формирующие кластеры стволовых клеток, возникающие в YS затем созревают, когда они путешествуют по эмбриону в AGM, где они инициируют формообразование дефинитивных HSC. Недавние исследования, напр., используя индуцибельную lacZ метящую клетки систему, которая генетически маркирует YS-производные Runx1+/ Aml1+ клетки, предположили, что взрослые HSC в костном мозге мышей возникают из комбинации предшественников, происходящих из родоначальных, происходящих из внеэмбриональной мезодермы YS кровяных островков, и из кластеров кровяных стволовых клеток, происходящих из AGM, возникающего из латеральной пластинки мезодермы (Samokhvalov et al., 2007; Ueno and Weissman, 2007). На ст. E7.5 развития мыши экспрессия Runx1 (который является критическим для возникновения гематопоэза) ограничена экспрессией только в клетках, обнаруживаемых в YS, тогда как соединения для переноса сосудистых клеток между YS и эмбрионом пока не установлены. Интересно, что генетическое отслеживание этих Runx1+ клеток более года у взрослых, продемонстрировало, что эти производные YS клетки могут вносить вклад в популяцию взрослых HSC в костном мозге (хотя и в ограниченных количествах (~1-10%)). Эти результаты показали, что YS кровяные предшественники могут , в самом деле, вносить вклад в пул взрослых, длительно воспроизводящих лимфо-гематопоэтических стволовых клеток.
Итак, пространственное разделение внеэмбриональной мезодермы и латеральной пластинки мезодермы, которые формируют примитивный и дефинитивный гематопоэз, соотв., открывает возможность, что два типа мезодермы могут продуцировать качественно отличающиеся гемангиобласты с разным потенциалами клеточного клонирования, паттерна и экспрессии генов и вообще эпигенетическими изменениями(Fig. 1 A,B). Необходимо посмотреть, могут ли производные hESC YS-подобные гемангиобласты, описанные нами, далее созревать в дефинитивные HSC посредством воссоздания их естественных микроусловий
in vivo . Альтернативным подходом являются изобретение стратегий дифференцировки hESC, которые генерируют мезодерму типа латеральной пластинки и AGM скорее, чем внеэмбриональную мезодерму YS-типа. В этом направлении мышиные модели предоставили многочисленную информацию о методах для улучшения дифференцировки мезодермы латеральной пластинки, базирующихся на сложных сигнальных сетях, которые управляют формированием паттерна эпибласта и образованием первичной полоски (Tam and Beddington, 1987; Ang and Constam, 2004). В частности, ключевые регуляторы индукции мезодермы
in vivo, которые мы рассмотрим ниже, могут воспроизводить индукцию
in vitro.
Targeted use of mesodermal morphogens may enhance the efficiency of hemangioblast and HSC generation from human pluripotent stem cells
Лучшее понимание сигнальных путей и ростовых факторов окружающей среды, которая воздействует на дифференцирующиеся hESC, могут приводить к улучшению мезодермальной дифференцировки и последующей генерации гемангиобластов-HSC. В частности, детальное картирование мезодермального транскрипционного контроля может приводить к формированию
in vitro системы, которая будет специфически управлять клеточной дифференцировкой или во внеклеточную (YS) или латеральной пластинки (AGM) мезодерму и тем самым давать разные типы гематопоэтических предшественников. Напр., продолжительность, локализация и концентрация ключевых избранных сигнальных путей ( напр., NODAL, TGFβ, WNT и FGF), как полагают, играют критические роли в развитии отличающихся мезодермальных популяций во время образования первичной полоски (Ben-Haim et al., 2006).
NODAL establishes the proximal-distal axis and mesoendoderm specification of the embryo
NODAL экспрессия впервые выявляется во внутренней клеточной массе и примитивной энтодерме мыши на ст. E4.5 (Varlet et al.,1997), его экспрессию поддерживают маркеры плюрипотентности Pou5f1(Oct4) и Nanog в эпибласте (Mesnard et al., 2006). Помимо ег роли в плюрипотентности, NODAL также необходим для образования первичной полоски (Conlon et al., 1994). Около ст. E5.0, субнабор висцеральной энтодермы на дистальном кончике эмбриона отвечает на передачу сигналов NODAL, экспрессируя специфический репертуар генов (Brennan et al., 2001), включая NODAL антагонистов, Lefty1 (Perea-Gomez et al., 1999) и Cer1(Belo et al., 1997). Комбинация проксимально расположенного источника NODAL и дистально расположенного источника NODAL антагонистов создает градиент передачи сигналов NODAL с наивысшим уровнем экспрессии на границе между эпибластом и внеэмбриональными тканями (Lu et al., 2004). Примерно на ст. E5.5 Cer1 и Lefty1-экспрессирующие клетки мигрируют кпереди, ротируя область ингибирования NODAL, в результате наивысший уровень передачи сигналов NODAL оказывается в задней части эмбриона (Kimura et al., 2000; Perea-Gomez et al., 2002; Yamamoto et al., 2004). Потеря передачи сигналов NODAL ведет к отсутствию производных мезодермы передней части первичной полоски и дефинитивной энтодермы (Beck et al., 2002; Yamamoto et al., 2004). Напротив подъем передачи сигналов NODAL в результате потери транскрипции корепрессоров или экспрессии NODAL антагонистов, ведет к избыточной экспрессии мезодермальных маркеров (Meno et al., 1999; Perea-Gomez et al., 2002). В hESCs роль NODAL в поддержании плюрипотентности и ингибировании нейроэктодермальной дифференцировки (Vallier et al., 2004; Smith et al., 2008; Wu et al., 2008) была описана, но её роль в дифференцировке мезоэнтодермы ещё предстоит расшифровать, но это, скорее всего, будет зависеть от продолжительности и величины передачи сигналов NODAL (Vincent et al., 2003).
Activin A, хотя и несущественен для гаструляции мыши (Matzuk, et al., 1995), соединяется с теми же самыми рецепторами, что и NODAL и, как полагают, воспроизводит некорые из его активностей. У
Xenopus, экзогенный активин А хорошо охарактеризован как индуктор мезодермы (Ariizumi et al. , 1991). В самом деле, activin A используется для улучшения дифференцировки hESC в мезодермальные клоны (Schuldiner et al., 2000; Burridge et al., 2007; Yang et al., 2008), хотя его добавление к hESCs также напротив индуцирует энтодермальные скорее, чем мезодермальные клоны (Levenberg et al., 2003; DAmour et al., 2005; Hay et al., 2008; Ishii et al., 2008), это нуждается в супрессии передачи сигналов PI3K посредством ингибирования insulin/IGF (McLean et al., 2007). Этот кажущийся парадокс в активности activin A может быть скорее всего, объяснен эффектом. зависимым от дозы, как это наблюдается в анимальной шапочке
Xenopus, где более низкие концентрации способствуют образованию мезодермальных клоноа, а более высокие концентрации способствуют появлению энтодермальных клонов (Okabayashi and Asashima, 2003). Как и в случае NODAL, использование activin A для поддержания плюрипотентности hESC , также было описано (Beattie et al., 2005; James et al., 2005; Xiao et al., 2006).
BMP4 signals from the extraembryonic ectoderm induce mesoderm formation
Высокие уровни экспрессии NODAL в проксимальной части эпибласта на ст. E5.0 также поддерживают экспрессию BMP4 во внеэмбриональной эктодерме по соседству с эпибластом (Brennan et al., 2001; Ben-Haim et al. , 2006). BMP4 необходим для формирования мезодермы и формирования паттерна (Winnier et al., 1995) и действует путем индукции экспрессии WNT3 в проксимальной части эпибласта (Liu et al., 1999). Дистальная часть висцеральной энтодермы, которая экспрессирует NODAL ингибиторы, также экспрессирует WNT3 ингибиторы, такие как DKK1, которые сходным образом вызывают перемещение экспрессии WNT3 в направлении задней части эпибласта (Glinka et al., 1998; Kemp et al., 2005). Это происходит на предгаструляционной стадии, на которой выявляется экспрессия мезэнтодермальных маркеров, таких как T (Wilkinson et al. , 1990), Mixl1 ((Pearce and Evans, 1999), Eomes (Ciruna and Rossant, 1999) и Gsc (Blum et al., 1992).
Fibroblast Growth Factors (FGFs) control mesoderm pattering and maintenance
В противоположность NODAL, FGFs контролируют спецификацию и поддержание мезодермы скорее, чем индукцию первичной мезодермы (Burdsal et al., 1998; Ciruna and Rossant, 1999). Мутационный анализ известных Fgf генов продемонстрировал, что только Fgf4 и Fgf8 необходимы для раннего эмбрионального развития (Niswander and Martin, 1992; Crossley and Martin, 1995; Ciruna and Rossant, 1999; Sun et al., 1999). Хотя роль FGF2 в поддержании плюрипотентности hESC хорошо известна, когда hESC дифференцируются и передача сигналов FGF рецептора ингибируется с помощью SU5402, то hEBs демонстрируют существенную редукцию экспансии на 4 день и менее 1% клеток выживает к 8 дню (Vallier et al., 2005). Кроме того, доминантно негативный FGFR2 устраняет образование слоя примитивной эктодермы в mEBs, повреждая образование базальной мембраны и mEBs становится некротическими на 6-8 день (Li et al., 2001b). Эти результаты указывают на то, что передача сигналов FGF2 существенна для роста и развития EB.
Мезодерма, не испытавшая формирования паттерна, экспрессирует KDR/flk-1 (VEGFR2) (Ema et al., 2006) и PDGFRA, alpha рецептор фактора роста, происходящего из тромбоцитов (Takakura et al., 1997). Латеральная пластинка мезодермы, которая формирует гаматопоэтические клоны, постепенно подавляет PDGFRA, тогда как параксиальная мезодерма подавляет KDR (Sakurai et al., 2006). Кроме того, экспрессия KDR/flk-1 поддерживается в гемангиобластах и HSC (Ziegler et al., 1999). Более того, добавление VEGFA во время гематопоэтической дифференцировки mESC, как было установлено, усиливает эффекты BMP4 (Nakayama et al., 2000; Park et al., 2004). Сходным образом, обильная экспрессия insulin growth factor 2 (IGF2) в мезодерме гаструлирующего эмбриона мыши и нарушенная дифференцировка мезодермы in vitro Igf2-/- mESC, указывает на то. что IGF2 играет важную роль в индукции мезодермы во время развития. Добавление экзогенного IGF2 к культуре in vitro Igf2-/- дифференцирующихся mESC восстанавливает образование мезодермы и экспрессию мезодермальных маркеров (Morali et al., 2000).
Наша группа уже начала тестировать эффекты этих критических морфогенов на генерацию hEB гематопоэтических клонов, используя нашу новую бессывороточную систему дифференцировки hEB. Мы недавно описали, что в отсутствие сыворотки минимальная комбинация из VEGFA, BMP4 и FGF2/heparan (VBF2) необходима и достаточна для эффективной индукции гематопоэза в дифференцирующихся hESC (Zambidis et al., 2008). Дальнейшее добавление мезодермальных морфогенов, таких как NODAL, WNT3A, IGF2 или activin A к развивающимся hEB, по-видимому, воспроизводит некоторые из
in vivo эффекты по усилению мезодермы, описанные выше (Fig. 4). В частности, добавление NODAL к минимальной VBF2 комбинации ведет к достоверному увеличению тотальных гематопоэтических CFC, мультипотентных CFC и примитивных и дефинитивных эритроцитов по сравнению лишь с одной VBF2 комбинацией. Добавление WNT3A, нижестоящего эффектора NODAL,к VBF2 также слегка увеличивает те же самые популяции гематопоэтических клеток за исключением дефинитивных эритроцитов, указывая тем самым, что этот фактор прежде всего усиливает образование примитивных YS клеток. Сходным образом добавление IGF2 к VBF2 усиливает лишь в легкой степени образование гематопоэтических CFC, мультипотентных CFC и примитивных и дефинитивных эритроидных CFC, хотя эта комбинация, по-видимому, сильнее усиливает дифференцировку миэлоидного ростка. Наши сегодняшние усилия концентрируются на выделении разных мезодермальных предшественников из этой оптимизированной и подвергнутой действию морфогенов культуры hEB и на оценке их примитивного и дефинитивного гематопоэтического потенциала.
Role of microRNAs in pluripotency and directed differentiation of hESC into hemangioblasts and HSC
MicroRNAs (miRNAs) , как недавно было установлено, играет критические роли в эмбриональной дифференцировке и предопределении времени клеточной дифференцировки, включая спецификацию гематопоэтических клонов. MiRNAs пост-транскрипционно регулируют генную экспрессию (Lee et al., 1993; Lagos-Quintana et al., 2001; Lau et al., 2001; Lee and Ambros, 2001; Ruvkun, 2001). MiRNAs транскрибируются с помощью POL II в виде петлеобразной структуры pre-miRNAs, подвергающейся процессингу с помощью ядерного белка Drosha, и экспортируемой в цитоплазму с помощью exportin V, и расщепляемой в её зрелые формы с помощью Dicer/Argonaute комплекса (Chang and Mendell, 2007). Комплекс Dicer позволяет miRNA распознавать мРНК мишень путем спаривания оснований с последовательностями в 3' нетранслируемых регионах мРНК. Комплементарное спаривание оснований ведет к деградации мРНК мишеней, тогда как неполное спаривание оснований ведет к репрессии трансляции мРНК путем физического ингибирования трансляционного аппарата мРНК рибосомального белка (Kloosterman and Plasterk, 2006). Одиночная miRNA может взаимодействовать с и влиять на трансляцию сотер мРНК мишеней, тем самым вызывая драматические эффекты на клеточную
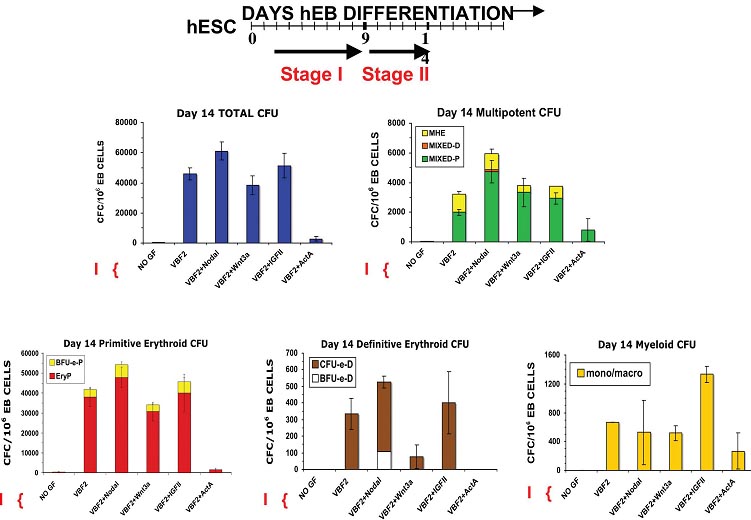 Fig. 4. Mesodermal morphogens and hematopoietic growth factors mediate agonistic and antagonistic effects on hEB hematopoietic differentiation potential. Line 1 (WA01) hEB were cultured in non-adherent serum-free (SF) suspension cultures in the presence of absence of VEGF, BMP4, and FGF2 (VBF2) starting on day 2 until day 9 (Stage I). On day 9, hEB were recultured as single cells onto gelatinized tissue culture plates in SF medium and supplemented with 50 ng/ml of the inductive or inhibitory hematopoietic growth factors Nodal, Wnt3a, IGFII, or Activin A (ActA) for 5 days (Stage II). Single cell suspensions of Day 14 hEB were evaluated for Colony-Forming-Cell (CFC) potential in serumfree H4436 SF methylcellulose containing hematopoietic growth factors. Total CFU, mutipotent CFU (MHE, Mixed-P, and Mixed-D), primitive erythroid (BFU-e-P, EryP), definitive erythroid (CFU-e-D, BFu-e-D), and myeloid (macrophage/monocyte) CFU formation was recorded. In comparison to basal VBF2, further addition of Nodal, a mesoderm inducer, enhanced the generation of all CFC except monocyte/ macrophage CFU. Wnt3a, a downstream effector of Nodal, acted as a moderate agonist during mutlipotent CFU formation, but drastically reduced definitive erythropoiesis. IGFII, another key player in mesodermal differentiation, moderately augmented multipotent CFU and primitive and definitive erythropoiesis. On the other hand, Activin A (ActA) dramacially abolished hematopoietic CFU.
Fig. 4. Mesodermal morphogens and hematopoietic growth factors mediate agonistic and antagonistic effects on hEB hematopoietic differentiation potential. Line 1 (WA01) hEB were cultured in non-adherent serum-free (SF) suspension cultures in the presence of absence of VEGF, BMP4, and FGF2 (VBF2) starting on day 2 until day 9 (Stage I). On day 9, hEB were recultured as single cells onto gelatinized tissue culture plates in SF medium and supplemented with 50 ng/ml of the inductive or inhibitory hematopoietic growth factors Nodal, Wnt3a, IGFII, or Activin A (ActA) for 5 days (Stage II). Single cell suspensions of Day 14 hEB were evaluated for Colony-Forming-Cell (CFC) potential in serumfree H4436 SF methylcellulose containing hematopoietic growth factors. Total CFU, mutipotent CFU (MHE, Mixed-P, and Mixed-D), primitive erythroid (BFU-e-P, EryP), definitive erythroid (CFU-e-D, BFu-e-D), and myeloid (macrophage/monocyte) CFU formation was recorded. In comparison to basal VBF2, further addition of Nodal, a mesoderm inducer, enhanced the generation of all CFC except monocyte/ macrophage CFU. Wnt3a, a downstream effector of Nodal, acted as a moderate agonist during mutlipotent CFU formation, but drastically reduced definitive erythropoiesis. IGFII, another key player in mesodermal differentiation, moderately augmented multipotent CFU and primitive and definitive erythropoiesis. On the other hand, Activin A (ActA) dramacially abolished hematopoietic CFU.
экспрессию ткане-специфическим образом (Lim et al., 2005; Chang and Mendell, 2007; Landgraf et al., 2007).
MiRNAs, как было установлено, играют критическую роль в репрограммировании ядер (Lin et al., 2008), в самообновлении и дифференцировке нормальных ESC (Houbaviy et al., 2003; Suh et al., 2004; Wang et al., 2007). В частности, ключевые ассоциированные с плюрипотентностью транскрипционные факторы соединяются с промоторами и усиливают транскрипцию miRNA, преимущественно экспрессирующихся в ESC, тогда как замалчиваемые гены miRNA активируются в дифференцирующихся клетках (Marson et al. , 2008). Более того, miRNAs, как полагают, оркестрирует время развития клеточной дифференцировки (Giraldez et al., 2005; Brown et al., 2007; Chang and Mendell, 2007; Martello et al. , 2007; Neilson et al., 2007), включая спецификацию гематопоэтических клонов (Chen et al., 2004; Felli et al., 2005; Costinean et al., 2006; Garzon et al., 2006; Ramkissoon et al., 2006; Bruchova et al. , 2007; Choong et al., 2007; Fontana et al., 2007; Georgantas et al., 2007; Thai et al., 2007; Xiao et al., 2007; Zhan et al., 2007). Напр., регуляция HOX генов с помощью некоторых miRNAs (Yekta et al., 2004). Аберрантная экспрессия miRNA , как было установлено, также важный путь туморогенеза, включая озлокачествление гематопоэтических и зародышевых клеток (Eis et al., 2005; Voorhoeve et al., 2006). У мышей описаны некоторые специфичные для гематопоэза miRNAs, включая mir-223, mir-142 и mir-181 (Chen et al., 2004). Кроме того, эктопическая экспрессия mir-155 во взрослых гематопоэтических предшественниках мыши вызывает выраженные эффекты на лимфопоэтическую функцию (Thai et al., 2007). У человека в CD34+ клетках подавление miRNA 221 и 222 происходит во время эритропоэтической дифференцировки (Felli et al., 2005).
Несколько групп показало, что miRNAs могут играть инструктивную роль в детерминации мезодермы эмбриона путем непосредственного контроля экспрессии Nodal (Martello et al., 2007), это играет жизненно важную роль в индукции и формировании паттерна мезодермы, как отмечалось выше. MiRNA регуляция эпителиально-мезенхимного перехода, который является ключевым в гаструляции, также была идентифицирована (Gregory et al., 2008). В hESCs, две miRNAs, miR-1 и miR133, как было установлено, способствуют формированию мезодермы путем репрессии не-мышечных генов, но обладающих противоположными функциями в последующей дифференцировке кардиальных предшественников (Ivey et al., 2008).
Хотя miRNAs четко регулируют онтогенетические решения, регуляторную роль miRNAs во время нормального эмбрионального развития человека из HSC сегодня невозможно изучать, а система дифференцировки hESC представляет собой ценную систему для понимания их функции. Список miRNA в человеческих гемангиобластах и HSC пока не описан. Четкая роль miRNAs в развитии и дифференцировке гемангиобластов д. пролить свет на онтогенетическую роль miRNAs в спецификации гематопоэтического клона. Далее, эктопическая экспрессия miRNAs воспроизводит (Voorhoeve et al., 2006) или antagomirs (антисмысловые miRNA олигонуклеотиды) (Krutzfeldt et al., 2005) может усиливать или эффективно направлять дифференцировку hESC на мезодермально-гематопоэтические клоны.
The utility of hESC-derived hemangioblasts for generating therapeutically-useful hematopoietic lineages
Понимание и воспроизведение in vivo ниш стволовых клеток, которые генерируют гемангиобласты во время развития, могут в конечном итоге позволить разработать мощные методологии для получения терапевтически пригодных, пациент-специфических гемангиобластов из hESC/ iPSC. In vitro дифференцировка гемангиобластов может создать уникальные возможности для регенеративной медицины путем создания пригодных для трансплантаций эндтелиальных клеток, HSC, мегакариоцитов, лимфоцитов и пригодных для переливаний гранулоцитов и эритроцитов (Olsen et al., 2006). Endothelial progenitor cells (EPCs), в частности, привлекают повышенное внимание в последнее время, т.к. количество взрослых с седечно-сосудистыми заболеваниями постоянно растет (Rosamond et al., 2008). Исследователи и клиницисты надеются использовать EPCs для репарации ишемических тканей, увеличения кровеносных сосудов и сердечных клапанов, что может заместить необходимую коронарную ангиопластику или установку коронарных шунтов, которые сегодня используются для репарации сосудов поврежденных тканей (Niklason, 1999; Liew et al., 2006). Получение пацент-специфичных способных к трансплантации эритроцитов, лимфоцитов и предшественников тромбоцитов (megakaryocytes) из плюрипотентных стволовых клеток, будет иметь высокий спрос. Однако получение всех этих терапевтически важных клонов из плюрипотентных стволовых клеток человека сегодня это уникальный технический вызов.
Эффективная генерация hESC-производных B- и T-лимфоцитов. напр., может играть роль в пополнении иммунной системы пациентов, страдающих от тяжелого комбинированного иммунодефицита или AIDS. Хотя они происходят из общего предшественника, B- и T-лимфоциты развиваются в разных местах in vivo и ставят уникальную задачу получения их из hESC. Путем воспроизведения их развития in vivo в костном мозе, напр., достигнут рост CD45R+ CD19+ зрелых функциональных B клеток как из mESCs, так и hESCs (Cho et al., 1999; Cho and Zuniga-Pflucker, 2003) путем ко-культивирования на линии стромальных клеток из костного мозга, таких как S17, MS5 и OP9 (Collins and Dorshkind, 1987; Landreth and Dorshkind, 1988; Itoh et al., 1989; Cumano et al., 1990). Добавление FLT3L и IL7 является критическим для этих систем эффективной продукции B лимфоцитов, хотя др. цитокины, такие как IL-4, как было установлено, также усиливают этот процесс. Клетки крови из пуповины (CB), печени плода, костного мозга (BM) и клетки периферической крови CD34+как было установлено, способны генерировать T клетки in vitro. Описаны различные методологии, включая использование стромы тимуса, ведущие к этому (Hare et al., 1999; Plum et al., 2000; LA MOTTE-MOHS et al., 2007). Формирование кластеров человеческих CD34+ CB клеток с мышиными эпителиальными клетками из тимуса плода в reaggregated thymic organ cultures (RTOC), имплантированных в NOD/SCID мышей давали CD4+ CD8+ незрелые double positive (DP), а также некоторые функционально зрелые CD4 single positive (SP) T-клетки (Saito et al., 2002). Стромальные клети тимуса мыши были использованы, чтобы засеять матрицы в подходе для продукции T клеток из гематопоэтических предшественников, произошедших из костного мозга человека (Poznansky et al., 2000). Культура стромы тимуса от макак резус была использована для ко-культивирования с человеческими CD34+, происходящими из клеток предшественников BM (Rosenzweig et al., 1996). Fetal thymic organ culture (FTOC), в которой человеческие HPC ко-культивировались с долями плодного тимуса из NOD-SCID мышей, благоприятствовало подходу, который, подобно всем этим системам, используется, но продуцирует лишь ограниченные количества T клеток (Jenkinson and Anderson, 1994; Tavian et al., 2001).
In vitro продукция T клеток из ESC, однако, более затруднена из-за трудностей в воссоздании уникальных микроусловий тимуса (которые играют центральную роль в последовательном, временном и пространственном развитии in vivo этих клеток) и CD8+ , которые заставляют примитивные HSC дифференцироваться в направлении T клеток. Открытие ключевой роли передачи сигналов Notch-Delta в стромальной среде тимуса в развитии T привело к появлению системы ко-культивирования OP9-DL1 ESC. Способность системы OP9-DL1 увеличиваться и поддерживать предшественники Т клеток позволяет использовать ее уникально для крупномасштабной генерации Т клеток человека из различных источников. OP9-DL1 клетки поддерживают генерацию из DP незрелых Т клеток, а также некоторых CD8+ SP (но не столько, как CD4+) клеток из мышиных HSC или дифференцирующихся mESC (из популяций KDR/flk-1, которые содержат мышиные гемангиобласты). Эта система была также успешно использована с человеческими CD34+ CB и из костного мозга HSC (Schmitt and Zuniga-Pflucker, 2002; Schmitt et al., 2004; La Motte-Mohs et al., 2005). Недавние попытки генерировать лимфоциты из hESC-производных клеток гематопоэтических предшественников, используя как систему ко-культивирования OP9-DL1, так и FTOC, привели к ограниченному успеху (Martin et al., 2008). Поскольку дефинитивные HSC с лимфоидным потенциалом были выявлены только в AGM, но не в YS эмбриональных тканях человека (Tavian et al., 2001), то эти результаты не явились столь неожиданными. Тем не менее они пролили свет на необходимость в методах, которые могли бы генерировать взрослого типа дефинитивные HSC из hESC прежде, чем удастся крупномасштабная продукция Т клеток для терапии.
Одним из наиболее обещающих подходов к технологии гематопоэтической дифференцировки из hESC является эффективная крупномасштабная продукция red blood cells (RBC) для клинических переливаний (Olivier et al., 2006). Происходящие из hESC эритроидные предшественники, которые, как было установлено, могут возникать непосредственно из hESC-производных гемангиобластов, могут представить клинически пригодный и стандартизованный источник способных к трансплантации RBC для неотложной хирургии или для лечения гемоглобинопатий, таких как серповидно-клеточная болезнь и alpha/beta талассемии. В целом простые переливания нуждаются в ~1- 2.5x10 эритроцитов (500 ml из цельной крови с 5x10
9 эритроцитов на мл) (Ma et al. , 2008b). Т.к. поставки крови часто недостаточны, банки крови с hESC-производными клетками эритроидных предшественников (напр.,
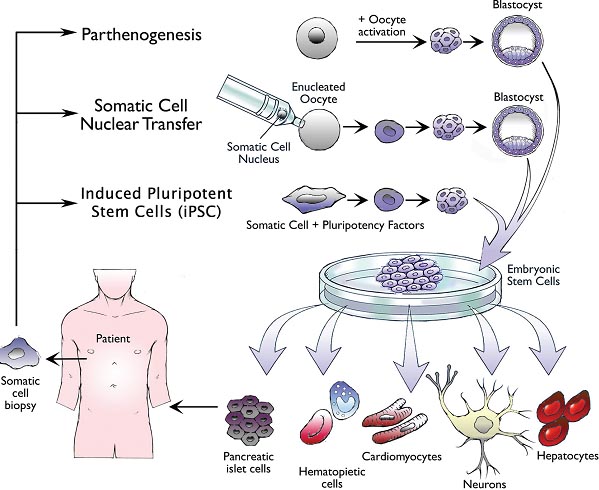 Fig. 5. Methods for generating autologous, patient-specific pluripotent stem cells for therapeutic cell transplantation. Parthenogenesis (PG), somatic cell nuclear transfer (SCNT), and induced pluripotent stem cells (iPSC) have been proposed as the three technologies by which patient-specific pluripotent stem cells could be generated for the generation of transplantable patient-specific progenitors, including hemangioblasts. The process of PG requires chemical activation of a patient's isolated oocyte to proceed to the blastocyst stage, at which point embryonic stem cells can be isolated for subsequent therapeutic generation of somatic cells. Comparatively, SCNT also requires the use of an oocyte, but in an enucleated state. Transfer of a patient's somatic cell nucleus into the cytoplasm of the nucleus, resets the engineered cell to a pluripotent state. Induced pluripotency reprograms a somatic cell into a pluripotent state in the absence of an oocyte or a blastocyst intermediate by genetically transmitting defined pluripotency factors that can reprogram somatic cells to an embryonic stem cell-like state. Pluripotent stem cells generated by any of these methods can be differentiated into all cell types of the body. Progenitor cells from various lineages (e.g. blood, pancreas, heart, neurons, and liver) generated from patient-specific pluripotent stem cells can be transplanted back into the donor as autologous cell grafts without fear of immune rejection.
Fig. 5. Methods for generating autologous, patient-specific pluripotent stem cells for therapeutic cell transplantation. Parthenogenesis (PG), somatic cell nuclear transfer (SCNT), and induced pluripotent stem cells (iPSC) have been proposed as the three technologies by which patient-specific pluripotent stem cells could be generated for the generation of transplantable patient-specific progenitors, including hemangioblasts. The process of PG requires chemical activation of a patient's isolated oocyte to proceed to the blastocyst stage, at which point embryonic stem cells can be isolated for subsequent therapeutic generation of somatic cells. Comparatively, SCNT also requires the use of an oocyte, but in an enucleated state. Transfer of a patient's somatic cell nucleus into the cytoplasm of the nucleus, resets the engineered cell to a pluripotent state. Induced pluripotency reprograms a somatic cell into a pluripotent state in the absence of an oocyte or a blastocyst intermediate by genetically transmitting defined pluripotency factors that can reprogram somatic cells to an embryonic stem cell-like state. Pluripotent stem cells generated by any of these methods can be differentiated into all cell types of the body. Progenitor cells from various lineages (e.g. blood, pancreas, heart, neurons, and liver) generated from patient-specific pluripotent stem cells can be transplanted back into the donor as autologous cell grafts without fear of immune rejection.
из плюрипотентной линии, экспрессирующей универсальный тип крови с O антигеном) мог бы предоставить неограниченный источник способных к переливанию эритроцитов. Достижение этой цели нуждается в hESC дифференцировке и последующей массовой продукции эритроидных клеток, экспрессирующих дефинитивного типа плодные или взрослые beta globin-экспрессирующие RBC, о которых пока не сообщалось. Системы эритропоэтической дифференцировки у мышей оказываются более успешными в отношении массовой продукции дефинитивных, способных к переливанию RBC. mESC-производные erythroid progenitors (ES-EPs) с клеточной морфологией, ростом и характеристиками терминальной дифференцировки сходны с таковыми из незрелых эритроидных предшественников, обнаруживаемых во время стрессового
in vivo эритропоэза, когда они эффективно генерируются в присутствии Epo, SCF и глюкокортикоидов (Carotta et al., 2004). ES-EPs (Ter119
+ cKit
+ CD71
+ эритробласты) могут сохраняться до 70 дней, и терминально дифференцироваться в энуклеированные эритроциты. В сходном исследовании, ES-EPs смогли улучшить острую анемию после инъекции в затронутых мышей, указывая тем самым, что EP из hESC могут сходным образом функционировать при анемических нарушениях (Hiroyama et al., 2008). Недавние сообщения подтвердили осуществимость массивной дифференцировки энуклеированных, человеческих RBC из hESC в суспензиях жидких культур ( напр. ~10
9-10
11 эритроцитов из one six-well стартующих пластинок с ~3x10
6 hESC клетками) (Lu et al., 2008). В этих исследованиях, hEB-производные гемангиобласты дифференцировались в зрелые, энуклеированные эритроциты с реакциями на кислородное равновесие, pH и истощение 1,3-diphosphoglycerate, аналогичными тем, что из пригодных к переливанию RBC. Хотя эти эритроидные клетки экспрессируют низкие уровни взрослого beta-globin (~16%), и высокие уровни эмбриональных/фетальных гемоглобинов (указывая тем самым, что они всё ещё в YS-подобной фазе развития), но их крупномасштабная продукция может быть потенциально оптимизирована для получения и увеличения линий эритроидных предшественников со способностью к долговременной пролиферации. Хотя энуклеированные плодного типа дефинитивные эритроидные клетки, экспрессирующие универсальную группу крови O и были генерированы в этих исследованиях, но прежде чем такие методологии смогут быть использованы для практики переливаний в клинике или в медицинских эффективных протоколах для получения более зрелых взрослого типа , beta-globin-экспрессирующих RBC, необходимо получать (как это было сделано для CB CD34
+ клеток (NeildezNguyen et al., 2002; Giarratana et al., 2005; Miharada et al., 2006). Генерация таких взрослого типа RBC из ESC в целом зависит от воспроизведения
in vivo микроусловий, обнаруживаемых в FL и BM с использованием цитокинов, ростовых факторов и стромальных клеток. Напр., жидкая культура из hESC-производных CD34 клеток в присутствии IL-3, BMP4, FLT3L, SCF и EPO стадио-специфическим способом во время гематопоэтической дифференцировки и последующее ко-культивирование на MS-5 feeder слоях приводит к формированию мегалобластических, ядерных эритроидных клеток (Olivier et al., 2006). Эти культуры первоначально формируют про- и базофильные эритробласты, экспрессирующие эмбриональный Gower I ( ξ
2ε
2
) и Gower II (α
2µ:
2 ). В др. системе ко-культивирование hESC-производных CD34
+ клеток на иммортализованной строме плодной печени ведет к генерации сходных эритробластов с экспрессией эмбриональных гемоглобинов (Qiu et al., 2008). Растяжение культивирования до 35 дней ведет к продукции энуклеированных эритроцитов с переключением гемоглобинов на плодные гемоглобины (α
2 ε
2
), и к минимальной (~2%) экспрессии взрослых β-гемоглобинов. Напротив, формирование дефинитивных эритроидных колоний взывает и перемешивает колонии из hESC, как недавно было описано, с использованием системы ко-культивирования со стромальными клетками плодной печени (Ma et al., 2008a). CFC метод в разные временные точки развития из этих совместных культур выявил эритроциты с быстро увеличивающейся экспрессией beta-глобина (от 26% до ~100%), и снижением экспрессии epsilon-глобина (со 100% до 50%). Сравнение hESC-производных эритроидных клеток с дефинитивными CB эритроидными клетками подтвердило сходство их кривых G6PD диссоциации кислорода. Эти исследования в целом продемонстрировали, что пригодные для трансплантации взрослого типа RBC, экспрессирующие взрослые гемоглобины, могут в конечном итоге продуцироваться в крупном масштабе из плюрипотентных стволовых клеток человека.
Массовая продукция тромбоцитов с использованием hESC, происходящими из мегакариоцитов (тромбоциты продуцирующие клетки тела человека) д. облегчить нужду в донорах и сделать возможной продукцию неограниченных количеств для лечения тромбоцитопении при хронической химиотерапии или при болезнях образования кровяного сгустка ( напр., Bernard-Soulir синдром и Glanzmann thrombasthenia). OP9 стромальная система может быть пригодной для генерации hESC-производных, функциональных мегакариоцитов. Несколько групп уже показали, что ESC могут быть легко индуцированы к дифференцировке в такие предшественники мегакариоцитов с использованием TPO и OP9 стромы, чтобы получить функциональные клетки, секретирующие proplatelets и fibrinogen после воздействия на них агонистов тромбоцитов (Era et al., 2000; Eto et al., 2002; Eto et al., 2003; Fujimoto et al., 2003) Более того, массовая продукция способных к переливанию гранулоцитов также может быть добавлена при дефиците продукции нейтрофилов у хозяина, при врожденном дефиците функции лейкоцитов или при индуцированной химиотерапией миэлосупрессии (Saeki et al., 2008). 75% эффективная продукция нейтрофилов из mESC сначала сопровождалась использованием трехступенчатого протокола дифференцировки. В этой системе формирование из mEBs (8 days) сопровождалось последовательным ко-культивированием mEBs на OP9 строме в среде, содержащей широкий коктейль из гематопоэтических ростовых факторов, давало в результате10
7 нейтрофилов из 80,000 mESC (Lieber et al., 2003; Lieber et al., 2004). Дифференцировка из hESC в нейтрофилы сходным образом сопровождалась с использованием двухступенчатого метода hEB-базирующейся дифференцировки в отсутствие питающего слоя с добавлением гематопоэтических ростовых факторов (Saeki et al., 2008), хотя и со значительно меньшей эффективностью (4x10
6 нейтрофилов из ~4x10
6 hESC). Эти нейтрофилы экспрессируют CD66b, CD16b и GPI-80, обладают морфологическими и цитохимическими (myeloperoxidase и neutrophil alkaline phosphatase) характеристиками зрелых нейтрофилов. Происходящие из hESC гранулоциты также обнаруживают характеристики нейтрофилов из хемотактической активности, стимуляции хемоаттрактантов, продукции реактивных видов кислорода после фагоцитоза и
in vivo IL-1b-усиленной миграции.
Patient-specific pluripotent stem cells can be generated via various methods for the ultimate production of autologous hemangioblasts
Критическая ступень, которую предстоит выяснить прежде чем hESC смогут стать клинически пригодными для генерации терапевтических гемангиобластов и HSC, это избегание обусловленного иммунитетом отторжения, которое возникает после переноса аллогенных, происходящих из hESC клеток реципиенту. Наилучшим способом преодоления этого технического и пока критического затруднения является генерация аутологических, пациент-специфически плюрипотентных стволовых клеток, которые могут быть впоследствии использоваться для генерации HSC. Сегодня предложены три методологии по генерации пациент-специфических плюрипотентных клеток: 1) партеногенез (PG), 2) somatic cell nuclear transfer (SCNT), и 3) induced pluripotent stem cells (iPSC) (Fig. 5).
Parthenogenesis (PG) Это альтернативный бесполый механизм репродукции, который имеет место у насекомых и рептилий, и может использоваться экспериментально для продукции диплоидных эмбрионов из неоплодотворенного, искусственно-активированного ооцита (Cibelli et al., 2002; Cibelli et al., 2006). У млекопитающих, PG-производные эмбрионы останавливают свое развитие на стадии почек конечностей из-за отсутствия существенных критических генов отцовского геномного импринтинга, необходимых для собственно развития (Kono et al., 1996). Хотя и ограниченные в своём потенциале завершать органогенез, PG-производные преимплантационные эмбрионы ст. бластоциста представляют собой ценный источник партеногенетических ESC (pgESC) для целей исследования. Эти эмбрионы могут быть использованы для продукции pgESC линий, которые существенно (но не полностью) генетически идентичны донорскому ооциту. Экспериментально ооциты могут сохранять диплоидность благодаря сохранению полярных телец, при использовании ингибиторов цитокинеза и ионофоров кальция (Revazova et al., 2007; Revazova et al., 2008), или реже благодаря спонтанному удвоению гаплоидного генома во время последующего развития. pgESC от мышей, обезьян и людей, как было установлено, сохраняют характеристики ESC, включая способность к самообновлению, вкладу в химерных животных и к закладке всех трех зародышевых листков, включая гематопоэтическую мезодерму (Kaufman et al., 1983; Cibelli et al., 2002; Vrana et al., 2003; Eckardt et al., 2007; Kim et al., 2007).
Поскольку PG эмбрионы врожденно дефектны в отношении развития полного организма, то человеческие PG-производные hESC (pg-hESC) из ооцитов доноров, по-видимому, лишены многих этических и политических барьеров, связанных с с получением новых линий hESC. Поскольку PG эмбрионы, происходящие из искуственно активированных ооцитов в отсутствие спермия, дают эмбрионов и производные pg-hESC линии существенно сходные с донорским ооцитом, за исключением дистальных от центромер локусов, где происходит кроссинговер во время мейоза I. Было показано, что pg-hESC более чем на 90% идентичны, включая все локусы human leukocyte antigens (HLA), тем самым представляют собой аутологичные, пригодные к трансплантации клетки для женщин доноров ооцитов, а также для их потомства. Происхождение pg-hESC как с гетерозиготными, так и гомозиготными HLA аллелями недавно было продемонстрировано (Kim et al., 2007; Lin et al., 2007; Mai et al. , 2007; Revazova et al., 2007; Revazova et al., 2008). Т.о., аутологичные, готовые к трансплантации клетки из pg-hESC становятся потенциальным источником для терапевтических стратегий при ряде болезней, включая нарушения крови.
HLA-гомозиготными геномы, генерируемые с помощью PG, д. быть лишь по трем HLA маркерам для сочетающейся тканевой трансплантации в противоположность шести HLA маркерам в гетерозиготных диплоидных геномах. Это привело к предположению, что для создания универсальных pghESC стволовых клеток, которые могли бы в конце концов удовлетворять нуждам трансплантации, требуются большие популяции. Компьютерные модели предсказывают, что небольшое число таких pg-hESC линий могло бы обеспечить выгодное соответствие для большинства популяций (Taylor et al., 2005). Банк стволовых клеток д. включать HLA-гомозиготные pg-hESC линии, но также HLA-гомозиготные человеческие клетки фибробласты взрослых (для генерации iPSC; see below), происходящие от доноров, ранее протестированных в отношении желаемых гаплотипов с помощью National Marrow Donor Program. Однако такие банки не будут пригодны для большинства популяций, таких как African-Americans (преимущественно затрагиваемых серповидно-клеточной анемией), или др. этнических меньшинств ( напр. затрагиваемых beta-thalassemia) с редкими гаплотипами. Однако из-за скудности человеческих ооцитов получение PG становится технически непрактичным, хотя PG эмбрионы могут потенциально генерироваться из излишков зрелых metaphase II ооцитов, представляемых в редком числе как побочные продукты in vitro fertilization (IVF). Альтернативно, pg-hESC могут также происходить из избытка незрелых зародышевых пузырьков и metaphase I ооцитов, которые непригодны для репродуктивных технологий, таких как внутриплазматические инъекции спермиев или IVF. Замороженные избыточные ооциты, которые добровольно предоставляются парами для рутинного исследования, также могут в принципе использоваться (Polak et al., 2007). В целом др. альтернативные методы в конечном итоге смогут стать более практичными, чем pG для генерации аутологических hESC для пациентов.
Somatic cell nuclear transfer (SCNT) SCNT, который впервые был описан почти 60 лет тому назад Briggs and King в классических исследованиях на лягушках, продемонстрировал соматические клеточные ядра, перенесенные в энуклеированные ооциты могут быть репрограммированы обратно в плюрипотентное состояние, указывая тем самым, что соматическая дифференцировка обратимый процесс (Briggs and King, 1952). Во время процесса SCNT ядра. экстрагируемые из соматических клеток взрослых ( напр., фибробласты) могут реактивировать гены плюрипотентности, которые ранее замалчивались во время клеточной спецификации и дифференцировки, вследствие воздействия на них цитоплазматических факторов ооцта. Последующее культивирование этих искусственно активированных псевдозигот приводило к образованию бластоциста, из которого внутренняя клеточная масса может быть выделена, чтобы генерировать ESC, которые генетически идентичны донорским ядрам из соматических клеток.
SCNT, как было продемонстрировано на ряде млекопитающих, а клонированная овечка (Dolly) была описана первой (Campbell et al., 1996). Хотя SCNT имеет длинную историю, только недавно было продемонстрировано, что SCNT-производные ESC могут быть получены из не человекообразных обезьян с использованием от взрослых самцов макак резус фибробластов в качестве источника донорских ядер (Byrne et al., 2007). Хотя эти исследования открыли путь для генерации пациент-специфичных SCNT-производных hESC для клеточной терапии, цель всё ещё не достигнута, SCNT неэффективность (менее 1% у обезьян по сравнению с 16% при партеногенезе) требует больших количеств ооцитов для этой техники, чтобы быть клинически пригодной. Кроме того, SCNT нуждается в затратах и сложной экипировке для обеспечения терапевтического клонирования посредством, поэтому SCNT маловероятный источник для генерации аутологичных пациент-специфичных hESC в ближайшем будущем.
Induced pluripotent stem cells (iPSC) Технические и этические проблемы, связанные с происхождением hESC, используемых для SCNT и PG стали источником альтернативных усилий по генерации аутологичных плюрипотентных стволовых клеток. Одним из наиболее обещающих подходов стала генетически индуцируемая плюрипотентность. Во время этого процесса соматические клетки могут быть репрограммированы в плюрипотентно-подобное состояние с использованием определенных групп экспрессируемых ретровирусом транскрипционных факторов плюрипотентности ( напр., SOX2, OCT-3/4, KLF4, C-MYC, LIN28, и NANOG; SOKMLN), как это впервые было продемонстрировано Takahashi and Yamanaka с использованием мышиных фибробластов и SOKM (Takahashi and Yamanaka, 2006; Okita et al., 2007; Takahashi et al., 2007a). Эти iPSC легко формируют мультиклональные тератомы в NOD/SCID иммунодефицитных хозяевах и эффективно вносят вклад в развитие плодовитых химерных мышей, демонстрируя тем самым сравнимость с bona fide ESC, произошедшими из бластоцистов. Эта методология быстро была транслирована на человеческие соматические клетки, включая фибробласты, MSC и кератиноциты, что привело к получению первых iPSC человека, хотя со значительно более низкими частотами, чем с мышиными клетками (Takahashi et al., 2007b; Yu et al., 2007; Nakagawa et al., 2008; Park et al., 2008b). Получение iPSC линий от соматических клеток больных пациентов недавно было подтверждено генерацией аутологичных iPSC линий с целью трансплантаций и моделирования болезней. Некоторые болезненные iPSC линии уже были сгенерированы, включая те, что затронуты синдромом Дауна, болезнью Паркинсона, болезнь Гентингтона и синдромом Shwachman-Bodian-Diamond (Park et al., 2008a). Болезненные iPSC получены из фибробластов 82-летней женщины с диагнозом amyotrophic lateral sclerosis. Эти iPSC могли успешно дифференцироваться в двигательные нейроны, которые нарушаются при ALS (Dimos et al., 2008).
Хотя генерация пациент-специфических iPSC, по-видимому, разрешает проблему иммунного отторжения, основное проблемой данной технологии является серьезный потенциал злокачественного превращения этих плюрипотентных клеток. Этот риск существенен при современном использовании ретро- и лентивирусов, поскольку такие вектора склонны к случайному инсерционному мутагенезу. В частности, использование протоонкогенов KLF4 и C-MYC в современном iPSC коктейле является проблематичным, т.к. они обладают известным потенциалом злокачественной трансформации. В самом деле, химерные мыши, полученные с помощью iPSC, которые были сгенерированы с использованием факторов плюрипотентности в качестве трансгенов в конце концов дают злокачественны опухоли (Nakagawa et al., 2008). Онкогенность iPSC может быть снижена с использованием только OCT4, и или KLF4 или C-MYC (Kim et al., 2008), или альтернативно только трансгенов OCT4 и SOX2 , избегая таким образом KLF4 и C-MYC (Huangfu et al., 2008b), но инсерционный мутагенный потенциал, наследуемый при использовании вирусных конструкций всё ещё остается препятствием на пути клинического использования (Hacein-Bey-Abina et al. , 2003; McCormack and Rabbitts, 2004).
Недавно опубликованные исследования уже начали атаковать препятствия, связанные с iPSC, полученными методами первого поколения. Используя CreLoxP поддающийся удалению лентивирусные и транспозоном-вставляемые трансгены, недавние исследования продемонстрировали, что персистентная экспрессия вирусом вставленного трансгена не нужна для репрограммирования соматических клеток и что лишенные вектора iPSC могут быть созданы, хотя и с более низкой эффективностью (Soldner et al., 2009; Woltjen et al., 2009). Кроме того, генерация человеческих iPSC с использованием неинтегрированных конструкций также была недавно описана (напр., использованием рекомбинантных аденовирусов (Stadtfeld et al., 2008), базирующихся на Epstein-Barr вирусах эписомных конструкциях (Yu et al., 2009), SOKM белках, слитых с cell penetrating peptides (CPPs) (Kim et al., 2009; Zhou et al., 2009), или повторными трансфекциями плазмид, обладающими SOKM кДНК (Okita et al., 2008)), подтвердив тем самым, что репрограммирование не связано с геномной интеграцией или инсерционным мутагенезом. Хотя эта область теперь быстро прогрессирует и обладает высоким потенциалом для конечных клинически безопасных iPSC, методологии для дальнейшей оптимизации сегодня всё ещё нуждаются в дальнейшем развитии (Huangfu et al., 2008a).
Future Directions
Although the existence of the hemangioblast was first recognized almost a century ago (Sabin, 1920; Murray, 1932), in vitro strategies for isolating, characterizing, or generating human hemangioblasts, and adult-type, definitive hematopoietic cell lineages from them, has thus far been elusive. The recent isolation and characterization of the human hemangioblast from hESC has created new potential to further evaluate mechanisms by which hemangioblasts and HSC could be generated, maintained, and expanded. It has become apparent that complex in vivo developmental signaling pathways and environments will need to be recapitulated to further mature these hESC-derived primitive progenitors into adult blood cells before they can be practically used in regenerative medicine for a number of hematological diseases.
Moreover, before hESC-derived hemangioblast and HSC can be used for clinical applications, patient-specific pluripotent stem cells will first need to be generated with more efficient, and ethically non-controversial methodologies than the current approaches that PG or SCNT provide. Human iPSC, which solve some of these obstacles, will have to be generated via methods that lack malignant potential, as was recently described using nonintegrating episomal vectors (Okita et al., 2008; Stadtfeld et al. , 2008; Yu et al., 2009) or reprogramming proteins fused with CPPs (Kim et al., 2009; Zhou et al., 2009). Moreover, despite their great similarities to hESC, it remains to be seen whether iPSC will hold comparable, or perhaps even greater differentiating potential than hESC for generating hematopoietic lineages (Choi et al., 2009; Loh et al., 2009). Finally, the differentiation of hemangioblasts and HSC from diseased patient-specific iPSC will shed important biologic insight into the developmental pathways and molecular nature of a number of hematologic disorders.
Сайт создан в системе
uCoz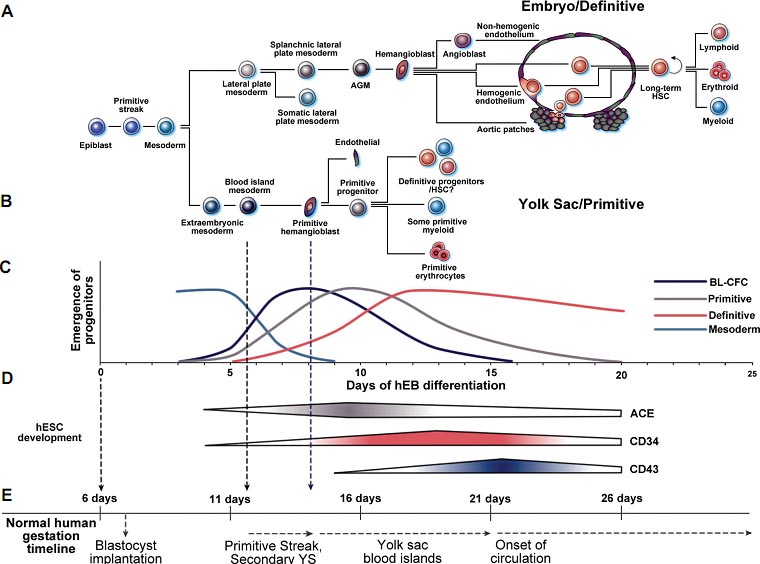 Fig. 1. Comparative schematic of normal human embryonic hematopoiesis and in vitro human embryonic stem cell (hESC) differentiation. (A) Aorta-gonad-mesonephros (AGM) embryonic definitive hematopoiesis originates from the lateral plate mesoderm, and gives rise to adult definitive-type hematopoietic stem cells (HSC) capable of long-term lympho-hematopoietic engraftment in adult recipients. (B) In contrast, primitive yolk sac (YS) hematopoiesis initiates from extra-embryonic mesoderm, and is characterized by the formation of primitive hemangioblasts within YS blood islands that provide ephemeral hematopoiesis for the developing embryo. (C) Human embryoid body (hEB) differentiation recapitulates human YS development and gives rise to mesodermal progenitors, hemangioblasts (BL-CFC), and YS-like primitive and definitive blood cells in two sequential waves. (D) Angiotensin converting enzyme (ACE; CD143), CD34, and CD43 gene expression are upregulated during hemangioblast development, emerging hematopoietic stem cells, and embryonic hematopoietic cells, respectively (Zambidis et al., 2008). (E) Normal human YS development appears to parallel the timeline of our in vitro hEB hematopoietic differentiation system. hESC lines are derived from the inner cell mass of a ~day 6 human blastocyst, and are maintained in an undifferentiated state prior to hematopoietic hEB differentiation. During normal gestation, human YS development directly follows formation of the primitive streak, and the extraembryonic secondary YS layers at gestational days 12-13. The formation of primordial YS blood islands first occurs at days 14-16, with subsequent generation of primitive erythro-myelopoietic cell lines starting after 18-20 days. MHE clusters and ACE+ BL-CFC similarly arise in our system at a corrected gestational timeline of ~12-13 days (6d of blastocyst age + days 6-7 of hEB differentiation), which is when the human primitive streak first develops. Subsequently, primitive erythropoiesis arises at a corrected timeline of ~14-16 days (6d of blastocyst age + 8-10 days of hEB differentiation), which is the milestone for YS blood island generation. Finally, definitive erythro-myelopoiesis arises in our system at a corrected timeline of >18-20 days (6d of blastocyst age + 12-20 days of hEB differentiation), when similar events occur in the human YS, prior to the onset of fetal circulation at about 21 days.
Fig. 1. Comparative schematic of normal human embryonic hematopoiesis and in vitro human embryonic stem cell (hESC) differentiation. (A) Aorta-gonad-mesonephros (AGM) embryonic definitive hematopoiesis originates from the lateral plate mesoderm, and gives rise to adult definitive-type hematopoietic stem cells (HSC) capable of long-term lympho-hematopoietic engraftment in adult recipients. (B) In contrast, primitive yolk sac (YS) hematopoiesis initiates from extra-embryonic mesoderm, and is characterized by the formation of primitive hemangioblasts within YS blood islands that provide ephemeral hematopoiesis for the developing embryo. (C) Human embryoid body (hEB) differentiation recapitulates human YS development and gives rise to mesodermal progenitors, hemangioblasts (BL-CFC), and YS-like primitive and definitive blood cells in two sequential waves. (D) Angiotensin converting enzyme (ACE; CD143), CD34, and CD43 gene expression are upregulated during hemangioblast development, emerging hematopoietic stem cells, and embryonic hematopoietic cells, respectively (Zambidis et al., 2008). (E) Normal human YS development appears to parallel the timeline of our in vitro hEB hematopoietic differentiation system. hESC lines are derived from the inner cell mass of a ~day 6 human blastocyst, and are maintained in an undifferentiated state prior to hematopoietic hEB differentiation. During normal gestation, human YS development directly follows formation of the primitive streak, and the extraembryonic secondary YS layers at gestational days 12-13. The formation of primordial YS blood islands first occurs at days 14-16, with subsequent generation of primitive erythro-myelopoietic cell lines starting after 18-20 days. MHE clusters and ACE+ BL-CFC similarly arise in our system at a corrected gestational timeline of ~12-13 days (6d of blastocyst age + days 6-7 of hEB differentiation), which is when the human primitive streak first develops. Subsequently, primitive erythropoiesis arises at a corrected timeline of ~14-16 days (6d of blastocyst age + 8-10 days of hEB differentiation), which is the milestone for YS blood island generation. Finally, definitive erythro-myelopoiesis arises in our system at a corrected timeline of >18-20 days (6d of blastocyst age + 12-20 days of hEB differentiation), when similar events occur in the human YS, prior to the onset of fetal circulation at about 21 days.  Fig. 4. Mesodermal morphogens and hematopoietic growth factors mediate agonistic and antagonistic effects on hEB hematopoietic differentiation potential. Line 1 (WA01) hEB were cultured in non-adherent serum-free (SF) suspension cultures in the presence of absence of VEGF, BMP4, and FGF2 (VBF2) starting on day 2 until day 9 (Stage I). On day 9, hEB were recultured as single cells onto gelatinized tissue culture plates in SF medium and supplemented with 50 ng/ml of the inductive or inhibitory hematopoietic growth factors Nodal, Wnt3a, IGFII, or Activin A (ActA) for 5 days (Stage II). Single cell suspensions of Day 14 hEB were evaluated for Colony-Forming-Cell (CFC) potential in serumfree H4436 SF methylcellulose containing hematopoietic growth factors. Total CFU, mutipotent CFU (MHE, Mixed-P, and Mixed-D), primitive erythroid (BFU-e-P, EryP), definitive erythroid (CFU-e-D, BFu-e-D), and myeloid (macrophage/monocyte) CFU formation was recorded. In comparison to basal VBF2, further addition of Nodal, a mesoderm inducer, enhanced the generation of all CFC except monocyte/ macrophage CFU. Wnt3a, a downstream effector of Nodal, acted as a moderate agonist during mutlipotent CFU formation, but drastically reduced definitive erythropoiesis. IGFII, another key player in mesodermal differentiation, moderately augmented multipotent CFU and primitive and definitive erythropoiesis. On the other hand, Activin A (ActA) dramacially abolished hematopoietic CFU.
экспрессию ткане-специфическим образом (Lim et al., 2005; Chang and Mendell, 2007; Landgraf et al., 2007).
Fig. 4. Mesodermal morphogens and hematopoietic growth factors mediate agonistic and antagonistic effects on hEB hematopoietic differentiation potential. Line 1 (WA01) hEB were cultured in non-adherent serum-free (SF) suspension cultures in the presence of absence of VEGF, BMP4, and FGF2 (VBF2) starting on day 2 until day 9 (Stage I). On day 9, hEB were recultured as single cells onto gelatinized tissue culture plates in SF medium and supplemented with 50 ng/ml of the inductive or inhibitory hematopoietic growth factors Nodal, Wnt3a, IGFII, or Activin A (ActA) for 5 days (Stage II). Single cell suspensions of Day 14 hEB were evaluated for Colony-Forming-Cell (CFC) potential in serumfree H4436 SF methylcellulose containing hematopoietic growth factors. Total CFU, mutipotent CFU (MHE, Mixed-P, and Mixed-D), primitive erythroid (BFU-e-P, EryP), definitive erythroid (CFU-e-D, BFu-e-D), and myeloid (macrophage/monocyte) CFU formation was recorded. In comparison to basal VBF2, further addition of Nodal, a mesoderm inducer, enhanced the generation of all CFC except monocyte/ macrophage CFU. Wnt3a, a downstream effector of Nodal, acted as a moderate agonist during mutlipotent CFU formation, but drastically reduced definitive erythropoiesis. IGFII, another key player in mesodermal differentiation, moderately augmented multipotent CFU and primitive and definitive erythropoiesis. On the other hand, Activin A (ActA) dramacially abolished hematopoietic CFU.
экспрессию ткане-специфическим образом (Lim et al., 2005; Chang and Mendell, 2007; Landgraf et al., 2007).  Fig. 5. Methods for generating autologous, patient-specific pluripotent stem cells for therapeutic cell transplantation. Parthenogenesis (PG), somatic cell nuclear transfer (SCNT), and induced pluripotent stem cells (iPSC) have been proposed as the three technologies by which patient-specific pluripotent stem cells could be generated for the generation of transplantable patient-specific progenitors, including hemangioblasts. The process of PG requires chemical activation of a patient's isolated oocyte to proceed to the blastocyst stage, at which point embryonic stem cells can be isolated for subsequent therapeutic generation of somatic cells. Comparatively, SCNT also requires the use of an oocyte, but in an enucleated state. Transfer of a patient's somatic cell nucleus into the cytoplasm of the nucleus, resets the engineered cell to a pluripotent state. Induced pluripotency reprograms a somatic cell into a pluripotent state in the absence of an oocyte or a blastocyst intermediate by genetically transmitting defined pluripotency factors that can reprogram somatic cells to an embryonic stem cell-like state. Pluripotent stem cells generated by any of these methods can be differentiated into all cell types of the body. Progenitor cells from various lineages (e.g. blood, pancreas, heart, neurons, and liver) generated from patient-specific pluripotent stem cells can be transplanted back into the donor as autologous cell grafts without fear of immune rejection.
из плюрипотентной линии, экспрессирующей универсальный тип крови с O антигеном) мог бы предоставить неограниченный источник способных к переливанию эритроцитов. Достижение этой цели нуждается в hESC дифференцировке и последующей массовой продукции эритроидных клеток, экспрессирующих дефинитивного типа плодные или взрослые beta globin-экспрессирующие RBC, о которых пока не сообщалось. Системы эритропоэтической дифференцировки у мышей оказываются более успешными в отношении массовой продукции дефинитивных, способных к переливанию RBC. mESC-производные erythroid progenitors (ES-EPs) с клеточной морфологией, ростом и характеристиками терминальной дифференцировки сходны с таковыми из незрелых эритроидных предшественников, обнаруживаемых во время стрессового in vivo эритропоэза, когда они эффективно генерируются в присутствии Epo, SCF и глюкокортикоидов (Carotta et al., 2004). ES-EPs (Ter119+ cKit+ CD71+ эритробласты) могут сохраняться до 70 дней, и терминально дифференцироваться в энуклеированные эритроциты. В сходном исследовании, ES-EPs смогли улучшить острую анемию после инъекции в затронутых мышей, указывая тем самым, что EP из hESC могут сходным образом функционировать при анемических нарушениях (Hiroyama et al., 2008). Недавние сообщения подтвердили осуществимость массивной дифференцировки энуклеированных, человеческих RBC из hESC в суспензиях жидких культур ( напр. ~109-1011 эритроцитов из one six-well стартующих пластинок с ~3x106 hESC клетками) (Lu et al., 2008). В этих исследованиях, hEB-производные гемангиобласты дифференцировались в зрелые, энуклеированные эритроциты с реакциями на кислородное равновесие, pH и истощение 1,3-diphosphoglycerate, аналогичными тем, что из пригодных к переливанию RBC. Хотя эти эритроидные клетки экспрессируют низкие уровни взрослого beta-globin (~16%), и высокие уровни эмбриональных/фетальных гемоглобинов (указывая тем самым, что они всё ещё в YS-подобной фазе развития), но их крупномасштабная продукция может быть потенциально оптимизирована для получения и увеличения линий эритроидных предшественников со способностью к долговременной пролиферации. Хотя энуклеированные плодного типа дефинитивные эритроидные клетки, экспрессирующие универсальную группу крови O и были генерированы в этих исследованиях, но прежде чем такие методологии смогут быть использованы для практики переливаний в клинике или в медицинских эффективных протоколах для получения более зрелых взрослого типа , beta-globin-экспрессирующих RBC, необходимо получать (как это было сделано для CB CD34+ клеток (NeildezNguyen et al., 2002; Giarratana et al., 2005; Miharada et al., 2006). Генерация таких взрослого типа RBC из ESC в целом зависит от воспроизведения in vivo микроусловий, обнаруживаемых в FL и BM с использованием цитокинов, ростовых факторов и стромальных клеток. Напр., жидкая культура из hESC-производных CD34 клеток в присутствии IL-3, BMP4, FLT3L, SCF и EPO стадио-специфическим способом во время гематопоэтической дифференцировки и последующее ко-культивирование на MS-5 feeder слоях приводит к формированию мегалобластических, ядерных эритроидных клеток (Olivier et al., 2006). Эти культуры первоначально формируют про- и базофильные эритробласты, экспрессирующие эмбриональный Gower I ( ξ2ε2
) и Gower II (α2µ:2 ). В др. системе ко-культивирование hESC-производных CD34+ клеток на иммортализованной строме плодной печени ведет к генерации сходных эритробластов с экспрессией эмбриональных гемоглобинов (Qiu et al., 2008). Растяжение культивирования до 35 дней ведет к продукции энуклеированных эритроцитов с переключением гемоглобинов на плодные гемоглобины (α2 ε2
), и к минимальной (~2%) экспрессии взрослых β-гемоглобинов. Напротив, формирование дефинитивных эритроидных колоний взывает и перемешивает колонии из hESC, как недавно было описано, с использованием системы ко-культивирования со стромальными клетками плодной печени (Ma et al., 2008a). CFC метод в разные временные точки развития из этих совместных культур выявил эритроциты с быстро увеличивающейся экспрессией beta-глобина (от 26% до ~100%), и снижением экспрессии epsilon-глобина (со 100% до 50%). Сравнение hESC-производных эритроидных клеток с дефинитивными CB эритроидными клетками подтвердило сходство их кривых G6PD диссоциации кислорода. Эти исследования в целом продемонстрировали, что пригодные для трансплантации взрослого типа RBC, экспрессирующие взрослые гемоглобины, могут в конечном итоге продуцироваться в крупном масштабе из плюрипотентных стволовых клеток человека.
Fig. 5. Methods for generating autologous, patient-specific pluripotent stem cells for therapeutic cell transplantation. Parthenogenesis (PG), somatic cell nuclear transfer (SCNT), and induced pluripotent stem cells (iPSC) have been proposed as the three technologies by which patient-specific pluripotent stem cells could be generated for the generation of transplantable patient-specific progenitors, including hemangioblasts. The process of PG requires chemical activation of a patient's isolated oocyte to proceed to the blastocyst stage, at which point embryonic stem cells can be isolated for subsequent therapeutic generation of somatic cells. Comparatively, SCNT also requires the use of an oocyte, but in an enucleated state. Transfer of a patient's somatic cell nucleus into the cytoplasm of the nucleus, resets the engineered cell to a pluripotent state. Induced pluripotency reprograms a somatic cell into a pluripotent state in the absence of an oocyte or a blastocyst intermediate by genetically transmitting defined pluripotency factors that can reprogram somatic cells to an embryonic stem cell-like state. Pluripotent stem cells generated by any of these methods can be differentiated into all cell types of the body. Progenitor cells from various lineages (e.g. blood, pancreas, heart, neurons, and liver) generated from patient-specific pluripotent stem cells can be transplanted back into the donor as autologous cell grafts without fear of immune rejection.
из плюрипотентной линии, экспрессирующей универсальный тип крови с O антигеном) мог бы предоставить неограниченный источник способных к переливанию эритроцитов. Достижение этой цели нуждается в hESC дифференцировке и последующей массовой продукции эритроидных клеток, экспрессирующих дефинитивного типа плодные или взрослые beta globin-экспрессирующие RBC, о которых пока не сообщалось. Системы эритропоэтической дифференцировки у мышей оказываются более успешными в отношении массовой продукции дефинитивных, способных к переливанию RBC. mESC-производные erythroid progenitors (ES-EPs) с клеточной морфологией, ростом и характеристиками терминальной дифференцировки сходны с таковыми из незрелых эритроидных предшественников, обнаруживаемых во время стрессового in vivo эритропоэза, когда они эффективно генерируются в присутствии Epo, SCF и глюкокортикоидов (Carotta et al., 2004). ES-EPs (Ter119+ cKit+ CD71+ эритробласты) могут сохраняться до 70 дней, и терминально дифференцироваться в энуклеированные эритроциты. В сходном исследовании, ES-EPs смогли улучшить острую анемию после инъекции в затронутых мышей, указывая тем самым, что EP из hESC могут сходным образом функционировать при анемических нарушениях (Hiroyama et al., 2008). Недавние сообщения подтвердили осуществимость массивной дифференцировки энуклеированных, человеческих RBC из hESC в суспензиях жидких культур ( напр. ~109-1011 эритроцитов из one six-well стартующих пластинок с ~3x106 hESC клетками) (Lu et al., 2008). В этих исследованиях, hEB-производные гемангиобласты дифференцировались в зрелые, энуклеированные эритроциты с реакциями на кислородное равновесие, pH и истощение 1,3-diphosphoglycerate, аналогичными тем, что из пригодных к переливанию RBC. Хотя эти эритроидные клетки экспрессируют низкие уровни взрослого beta-globin (~16%), и высокие уровни эмбриональных/фетальных гемоглобинов (указывая тем самым, что они всё ещё в YS-подобной фазе развития), но их крупномасштабная продукция может быть потенциально оптимизирована для получения и увеличения линий эритроидных предшественников со способностью к долговременной пролиферации. Хотя энуклеированные плодного типа дефинитивные эритроидные клетки, экспрессирующие универсальную группу крови O и были генерированы в этих исследованиях, но прежде чем такие методологии смогут быть использованы для практики переливаний в клинике или в медицинских эффективных протоколах для получения более зрелых взрослого типа , beta-globin-экспрессирующих RBC, необходимо получать (как это было сделано для CB CD34+ клеток (NeildezNguyen et al., 2002; Giarratana et al., 2005; Miharada et al., 2006). Генерация таких взрослого типа RBC из ESC в целом зависит от воспроизведения in vivo микроусловий, обнаруживаемых в FL и BM с использованием цитокинов, ростовых факторов и стромальных клеток. Напр., жидкая культура из hESC-производных CD34 клеток в присутствии IL-3, BMP4, FLT3L, SCF и EPO стадио-специфическим способом во время гематопоэтической дифференцировки и последующее ко-культивирование на MS-5 feeder слоях приводит к формированию мегалобластических, ядерных эритроидных клеток (Olivier et al., 2006). Эти культуры первоначально формируют про- и базофильные эритробласты, экспрессирующие эмбриональный Gower I ( ξ2ε2
) и Gower II (α2µ:2 ). В др. системе ко-культивирование hESC-производных CD34+ клеток на иммортализованной строме плодной печени ведет к генерации сходных эритробластов с экспрессией эмбриональных гемоглобинов (Qiu et al., 2008). Растяжение культивирования до 35 дней ведет к продукции энуклеированных эритроцитов с переключением гемоглобинов на плодные гемоглобины (α2 ε2
), и к минимальной (~2%) экспрессии взрослых β-гемоглобинов. Напротив, формирование дефинитивных эритроидных колоний взывает и перемешивает колонии из hESC, как недавно было описано, с использованием системы ко-культивирования со стромальными клетками плодной печени (Ma et al., 2008a). CFC метод в разные временные точки развития из этих совместных культур выявил эритроциты с быстро увеличивающейся экспрессией beta-глобина (от 26% до ~100%), и снижением экспрессии epsilon-глобина (со 100% до 50%). Сравнение hESC-производных эритроидных клеток с дефинитивными CB эритроидными клетками подтвердило сходство их кривых G6PD диссоциации кислорода. Эти исследования в целом продемонстрировали, что пригодные для трансплантации взрослого типа RBC, экспрессирующие взрослые гемоглобины, могут в конечном итоге продуцироваться в крупном масштабе из плюрипотентных стволовых клеток человека.